Как выделить вирус из крови
Обновлено: 26.04.2024
Диагностика инфекционных заболеваний является одной из самых сложных проблем в клинической медицине. Лабораторные методы исследования при ряде нозологических форм играют ведущую, а в целом ряде клинических ситуаций решающую роль не только в диагностике, но и в определении конечного исхода заболевания.
Диагностика инфекционных заболеваний почти всегда предусматривает использование комплекса лабораторных методов.
- бактериологические;
- серологические;
- метод полимеразной цепной реакции (ПЦР) для обнаружения ДНК или РНК возбудителя инфекционного заболевания в исследуемом материале.
У одних пациентов для диагностики этиологии инфекционно-воспалительного процесса достаточно провести бактериологическое исследование, в других клинических ситуациях решающее значение имеют данные серологических исследований, в третьих, предоставить полезную информацию может только метод ПЦР. Однако наиболее часто в клинической практике врачу-клиницисту необходимо использовать данные различных методов лабораторных исследований.
Бактериологические методы исследования
Бактериологические исследования наиболее часто проводят при подозрении на гнойно-воспалительные заболевания (составляют 40-60% в структуре хирургических заболеваний) с целью их диагностики, изучения этиологической структуры, определения чувствительности возбудителей к антибактериальным препаратам. Результаты бактериологических анализов способствуют выбору наиболее эффективного препарата для антибактериальной терапии, своевременному проведению мероприятий для профилактики внутрибольничных инфекций.
Возбудителями гнойно-воспалительных заболеваний являются истинно-патогенные бактерии, но наиболее часто условно-патогенные микроорганизмы, входящие в состав естественной микрофлоры человека или попадающие в организм извне. Истинно-патогенные бактерии в большинстве случаев способствуют развитию инфекционного заболевания у любого здорового человека. Условно-патогенные микроорганизмы вызывают заболевания преимущественно у людей с нарушенным иммунитетом.
Бактериологические исследования при заболеваниях, вызываемых условно-патогенными микроорганизмами, направлены на выделение всех микроорганизмов, находящихся в патологическом материале, что существенно отличает их от аналогичных исследований при заболеваниях, вызванных истинно патогенными микроорганизмами, когда проводится поиск определенного возбудителя.
Для получения адекватных результатов бактериологического исследования при гнойно-воспалительных заболеваниях особенно важно соблюдать ряд требований при взятии биоматериала для анализа, его транспортировки в лабораторию, проведения исследования и оценки его результатов.
- микроскопическое исследование мазка (бактериоскопия) из доставленного биоматериала;
- выращивание культуры микроорганизмов (культивирование);
- идентификацию бактерий;
- определение чувствительности к антимикробным препаратам и оценку результатов исследования.
Доставленный в бактериологическую лабораторию биоматериал первоначально подвергается микроскопическому исследованию.
Микроскопическое исследование мазка (бактериоскопия), окрашенного по Граму или другими красителями, проводят при исследовании мокроты, гноя, отделяемого из ран, слизистых оболочек (мазок из цервикального канала, зева, носа, глаза). Результаты микроскопии позволяют ориентировочно судить о характере микрофлоры, ее количественном содержании и соотношении различных видов микроорганизмов в биологическом материале, а также дают предварительную информации об обнаружении этиологически значимого инфекционного агента в данном биоматериале, что позволяет врачу сразу начать лечение (эмпирическое). Иногда микроскопия позволяет выявить микроорганизмы, плохо растущие на питательных средах. На основании данных микроскопии проводят выбор питательных сред для выращивания микробов, обнаруженных в мазке.
Культивирование микроорганизмов. Посев исследуемого биоматериала на питательные среды производят с целью выделения чистых культур микроорганизмов, установления их вида и определения чувствительности к антибактериальным препаратам. Для этих целей используют различные питательные среды, позволяющие выделить наибольшее количество видов микроорганизмов. Оптимальными являются питательные среды, содержащие кровь животного или человека, а также сахарный бульон, среды для анаэробов. Одновременно производят посев на дифференциально-диагностические и селективные (предназначенные для определенного вида микроорганизмов) среды. Посев осуществляют на стерильные чашки Петри, в которые предварительно заливают питательную среду для роста микроорганизмов.
Микроскопия мазков, окрашенных по Граму
1 - стрептококки; 2 - стафилококки; 3 - диплобактерии Фридленда; 4 - пневмококки
Колонии отсевают на плотные, жидкие, полужидкие питательные среды, оптимальные для культивирования определенного вида бактерий.
Выделенные чистые культуры микроорганизмов подвергают дальнейшему изучению в диагностических тестах, основанных на морфологических, ферментативных, биологических свойствах и антигенных особенностях, характеризующих бактерий соответствующего вида или варианта.
Определение чувствительности к антибактериальным препаратам. Чувствительность к антимикробным препаратам изучают у выделенных чистых культур микроорганизмов, имеющих этиологическое значение для данного заболевания. Поэтому в направлении на бактериологические анализы требуется указать диагноз заболевания у больного. Определение чувствительности бактерий к спектру антибиотиков помогает лечащему врачу правильно выбрать препарат для лечения больного.
Оценка результатов исследования. Принадлежность условно-патогенных микроорганизмов к естественной микрофлоре организма человека создает ряд трудностей при оценке их этиологической роли в развитии гнойно-воспалительных заболеваний. Условно-патогенные микроорганизмы могут представлять нормальную микрофлору исследуемых жидкостей и тканей или контаминировать их из окружающей среды. Поэтому для правильной оценки результатов бактериологических исследований необходимо знать состав естественной микрофлоры изучаемого образца. В тех случаях, когда исследуемый биоматериал в норме стерилен, как, например, спинномозговая жидкость, экссудаты, все выделенные из него микроорганизмы могут считаться возбудителями заболевания. В тех случаях, когда исследуемый материал имеет собственную микрофлору, как, например, отделяемое влагалища, кал, мокрота, нужно учитывать изменения ее качественного и количественного состава, появление несвойственных ему видов бактерий, количественную обсемененность биоматериала. Так, например, при бактериологическом исследовании мочи степень бактериурии (число бактерий в 1 мл мочи), равная и выше 10 5 , свидетельствует об инфекции мочевых путей. Более низкая степень бактериурии встречается у здоровых людей и является следствием загрязнения мочи естественной микрофлорой мочевых путей.
Установить этиологическую роль условно-патогенной микрофлоры помогают также нарастание количества и повторность выделения бактерий одного вида от больного в процессе заболевания.
Врач-клиницист должен знать, что положительный результат бактериологического исследования в отношении биологического материала, полученного из в норме стерильного очага (кровь, плевральная жидкость, спинномозговая жидкость, пунктат органа или ткани), всегда тревожный результат, требующий немедленных действий по оказанию медицинской помощи.
Серологические методы исследования
В основе всех серологических реакций лежит взаимодействие антигена и антитела. Серологические реакции используются в двух направлениях.
2. Установление родовой и видовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Такое исследование требует постановки реакции с заведомо известными иммунными сыворотками.
Серологические исследования не обладают 100%-й чувствительностью и специфичностью в отношении диагностики инфекционных заболеваний, могут давать перекрестные реакции с антителами, направленными к антигенам других возбудителей. В связи с этим оценивать результаты серологических исследований необходимо с большой осторожностью и учетом клинической картины заболевания. Именно этим обусловлено использование для диагностики одной инфекции множества тестов, а также применение метода Western-blot для подтверждения результатов скрининговых методов.
В последние годы прогресс в области серологических исследований связан с разработкой тест-систем для определения авидности специфических антител к возбудителям различных инфекционных заболеваний.
Авидность - характеристика прочности связи специфических антител с соответствующими антигенами. В ходе иммунного ответа организма на проникновение инфекционного агента стимулированный клон лимфоцитов начинает вырабатывать сначала специфические IgM-антитела, а несколько позже и специфические IgG-антитела. IgG-антитела обладают поначалу низкой авидностью, то есть достаточно слабо связывают антиген.
Затем развитие иммунного процесса постепенно (это могут быть недели или месяцы) идет в сторону синтеза лимфоцитами высокоспецифичных (высокоавидных) IgG-антител, более прочно связывающихся с соответствующими антигенами. На основании этих закономерностей иммунного ответа организма в настоящее время разработаны тест-системы для определения авидности специфических IgG-антител при различных инфекционных заболеваниях.
Высокая авидность специфических IgG-антител позволяет исключить недавнее первичное инфицирование и тем самым с помощью серологических методов установить период инфицирования пациента. В клинической практике наиболее широкое распространение нашло определение авидности антител класса IgG при токсоплазмозе и цитомегаловирусной инфекции, что дает дополнительную информацию, полезную в диагностическом и прогностическом плане при подозрении на эти инфекции, в особенности при беременности или планировании беременности.
Метод полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР), являющаяся одним из методов ДНК-диагностики, позволяет увеличить число копий детектируемого участка генома (ДНК) бактерий или вирусов в миллионы раз с использованием фермента ДНК-полимеразы. Тестируемый специфический для данного генома отрезок нуклеиновой кислоты многократно умножается (амплифицируется), что позволяет его идентифицировать.
Сначала молекула ДНК бактерий или вирусов нагреванием разделяется на 2 цепи, затем в присутствии синтезированных ДНК-праймеров (последовательность нуклеотидов специфична для определяемого генома) происходит связывание их с комплементарными участками ДНК, синтезируется вторая цепь нуклеиновой кислоты вслед за каждым праймером в присутствии термостабильной ДНК-полимеразы. Получается две молекулы ДНК. Процесс многократно повторяется. Для диагностики достаточно одной молекулы ДНК, то есть одной бактерии или вирусной частицы.
Введение в реакцию дополнительного этапа - синтеза ДНК на молекуле РНК при помощи фермента обратной транскриптазы - позволило тестировать РНК-вирусы, например, вирус гепатита С. ПЦР - это трехступенчатый процесс, повторяющийся циклично: денатурация, отжиг праймеров, синтез ДНК (полимеризация). Синтезированное количество ДНК идентифицируют методом иммуноферментного анализа или электрофореза.
В ПЦР может быть использован различный биологический материал - сыворотка или плазма крови, соскоб из уретры, биоптат, плевральная или спинномозговая жидкость и т.д. В первую очередь ЦПР применяют для диагностики инфекционных болезней, таких как вирусные гепатиты В, С, D, цитомегаловирусная инфекция, инфекционные заболевания, передающиеся половым путем (гонорея, хламидийная, микоплазменная, уреаплазменная инфекции), туберкулез, ВИЧ-инфекция и т.д.
В заражённых вирусом клетках возможны патологические проявления разностороннего характера.
Морфология патологических эффектов. Зараженные вирусом клетки. Основные реакции зараженных вирусом клеток.
Характерные проявления взаимодействий между вирусом и чувствительными клетками-видимые поражения заражённых клеток вплоть до их гибели, а также присутствие возбудителей в исследуемом материале.
Альтерация и воспаление зараженных вирусом тканей. При вирусных инфекциях на первый план выступает картина повреждения клеток и воспалительных изменений тканей, при различных инфекциях их соотношение и выраженность варьируют. В противоположность бактериальным инфекциям (где доминируют полиморфноядерные лейкоциты), при вирусных поражениях среди клеточных элементов воспалительных реакций доминируют мононуклеары (лимфо- и моноциты). На этапах, предшествующих разрушению клеток, можно визуально наблюдать их дегенеративные и некротические изменения.
Тельца включений зараженных вирусом клеток. Микроскопия заражённых клеток часто позволяет выявить тельца включений — характерный, но не абсолютный признак вирусных поражений. Тельца значительно крупнее, чем отдельные вирионы, и часто окрашиваются кислыми красителями (например, эозином).
• При заражении клеток ДНК-содержащими вирусами тельца включений располагаются в ядре; исключение — тельца включений поксвирусов (тельца Гварнери).
• При заражении клеток РНК-содержашими вирусами тельца включений располагаются в цитоплазме (например, тельца Бабеша-Нёгри, выявляемые в цитоплазме клеток головного мозга при бешенстве).
Причины гибели зараженных вирусом клеток. Размножаясь в клетке, вирусы индуцируют синтез вирусспецифических белков, в той или иной степени подавляющих метаболизм клетки. Нарушение синтеза макромолекул вызвано нарушением трансляции клеточной мРНК. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление макромолекулярных синтезов в клетке вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы. Действие указанных вирусов реализуется на ранних этапах (до появления морфологических признаков цитопатического эффекта). Ингибирование синтеза РНК и ДНК обычно вторично по отношению к воздействию на белки, контролирующие экспрессию генов и пролиферацию клетки. Значительно реже нарушения вызывают вирусные белки, напрямую ингибирующие синтез нуклеиновых кислот. Среди РНК-геномных вирусов наиболее быстрое и глубокое подавление синтезов нуклеиновых кислот вызывают пикорнавирусы, среди ДНК-геномных — покс- и герпесвирусы.
Во время репродукции вируса в клетке накапливаются вирусные компоненты, оказывающие токсическое и повреждающее действие на клеточные структуры. Например, цитотоксические свойства проявляют капсомеры некоторых аденовирусов, гликопротеины парамиксовирусов. В процессе вирусной инфекции также происходит повреждение мембран лизосом, содержимое которых высвобождается и осуществляет аутолиз клетки. Таким образом, гибель клеток наступает в результате сочетания раннего подавления синтеза клеточных компонентов, накопления токсических вирусных продуктов и повреждения лизосом.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Советы хирургам по защите от инфекций передающихся через кровь
1. Какие заболевания, передающиеся с кровью, имеют наибольшее значение для хирурга?
Обычно среди возбудителей, передающихся при контакте с зараженной кровыо, основное внимание уделялось вирусу иммунодефицита человека (ВИЧ), однако рост заболеваемости гепатитом С в Северной Америке привел к тому, что именно гепатит сейчас является наиболее частым среди заболеваний, передающихся таким путем.
В настоящее время инфицирование вирусом гепатита В, который уже почти 50 лет считается профессиональной патологией хирургов, реже приводит к развитию заболевания, что связано с распространением прививок и разработкой сравнительно эффективной схемы лечения в случае контакта с вирусом.
2. Каков сравнительный риск заражения ВИЧ, HBV и HCV?
а) ВИЧ. На данный момент приблизительно 1 миллион жителей США инфицированы ВИЧ. Последние наблюдения показывают, что передача ВИЧ в больничных условиях происходит редко. Медработники составляют только 5% от всех больных СПИДом, и у большинства из них есть другие факторы, помимо профессиональных, вероятно, и вызвавшие заболевание. Наибольший профессиональный риск отмечен у медицинских сестер и работников лабораторий.
С 1 января 1998 года не отмечено ни одного документированного случая передачи ВИЧ от больного к врачу в результате профессионального контакта.
б) HBV. Нет сомнений, что все хирурги за время нормальной трудовой карьеры контактируют с HBV. Считается, что 1,25 миллиона жителей США болеют хроническим гепатитом В. Чрескожная инъекция инфицированной иглой приблизительно в 30% случаев приводит к развитию острого заболевания. В 75% гепатит В протекает клинически скрыто, а 10% инфицированных на всю жизнь остаются носителями вируса.
У многих носителей, потенциально заразных для окружающих, заболевание протекает бессимптомно, с минимальным прогрессированием или без прогрессирования. Примерно в 40% болезнь постоянно прогрессирует, приводя к циррозу, печеночной недостаточности или даже к генатоцеллюлярному раку.
в) HCV. Гепатит С стал для хирургов самой главной проблемой. Считается, что хроническим гепатитом С страдают приблизительно 4 миллиона жителей США. Риск сероконверсии при чрескожной инъекции инфицированной иглой составляет около 10%, однако в 50% острое заболевание приводит к хроническому носительству инфекции. О течении гепатита С до сих пор существуют различные мнения, однако почти у 40% больных хроническая HCV-инфекция приводит к развитию цирроза.
В последнем случае высок риск развития рака печени, вероятность которого достигает 50% в течение 15 лет.
3. Обеспечивает ли вакцинация против гепатита В полную защиту от заболевания?
В настоящее время для всех хирургов и лиц, работающих в операционной, доступна эффективная вакцинация против гепатита В. Вакцину против гепатита В получают с помощью рекомбинантной технологии; она не является разрушенными частицами вируса, полученными от инфицированных людей. Вводят три дозы вакцины, после чего следует определить титр поверхностных антител, чтобы убедиться в успешности вакцинации.
Приблизительно у 5% вакцинированных людей выработки антител не происходит и требуется повторная вакцинация. Некоторые люди остаются рефрактерными к вакцинации, для них сохраняется риск острого гепатита В. Вакцинация не гарантирует иммунизацию.
Согласно некоторым исследованиям, 50% практикующих хирургов не обладают достаточным иммунитетом к HBV из-за различных причин: отсутствия вакинации у старых хирургов, более чем 5-летнего срока после вакцинации, недостаточного количества рекомбинантной вакцины или неправильной вакцинации и, наконец, неспособности выработать соответствующий иммунный ответ.
4. Существует ли риск заражения больных от хирургов, инфицированных HBV?
Передача вируса гепатита В от хирурга к больному документирована. Анализ крови хирургов, которые могут заразить больных, как правило, положителен на е-антиген вируса гепатита В. Е-антиген является продуктом распада вирусного нуклеокапсида и говорит об активной репликации вируса в печени. Обнаружение е-антигена свидетельствует о высоких титрах вируса и сравнительно высокой заразности больного.
Большое количество документированных случаев передачи гепатита В больным от лиц, занятых в хирургии, может вызвать особенные проблемы и ограничение клинической деятельности для клиницистов, передавших эту инфекцию. В одном из последних отчетов из Англии сообщается о передаче вируса гепатита В больному даже от хирурга с отрицательным анализом па е-антиген HBV.
В последнее время одна национальная организация призывает ограничить деятельность е-антиген-положительных хирургов. Вопрос, можно ли хирургу с хроническим гепатитом В продолжать практику, будет обсуждаться в будущем.
5. Какова правильная тактика при чрескожном контакте с кровью больного, у которого есть гепатит В?
Тактика зависит от вакцинированности медработника. Если он вакцинирован и имеет положительный титр антител, то ничего предпринимать не надо. Если медработник не вакцинирован и не имеет антител к HBV, то ему или ей следует ввести дозу анти-HBV иммуноглобулина и начать серию вакцинации против гепатита В.
Медработникам, которые ранее были успешно вакцинированы от гепатита В, однако не имеют или имеют незначительный титр антител, следует ввести дозу анти-HBV иммуноглобулина и повторную дозу вакцины против гепатита В. Поскольку в большинстве случаев таких контактов с больным неизвестно, инфицирован он или нет, то, в общем, хирургам необходимо знать, есть ли у них антитела, и периодически повторять иммунизацию против гепатита В через каждые 7 лет.
6. Чем HCV отличается от HBV? Кто из них опаснее?
а) Заболеваемость в США:
- HBV: примерно 1,25 миллиона больных.
- HCV: примерно 4 миллиона больных.
б) Путь и последствия заражения:
- HBV: ДНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 10% случаев.
- HCV: РНК-вирус, передающийся с кровью; острая форма переходит в хроническую в 50% случаев.
в) Профилактика:
- HBV: эффективная рекомбинантная вакцина.
- HCV: в настоящее время вакцины не существует.
г) Защита после контакта:
- HBV: людям, которые не были вакцинированы и не имеют антител к HBV, целесообразно введение анти-HBV иммуноглобулина.
- HCV: клиническая эффективность анти-HCV иммуноглобулина не доказана. Среди больных, с которыми имеют дело хирурги в США, больше лиц с хроническим гепатитом С, чем с хроническим гепатитом В, а вакцины против HCV-инфекции нет. Риск сероконверсии для гепатита С составляет 10% против 30% для гепатита В, однако HCV-инфекция гораздо чаще переходит в хроническую форму (50% против 10%). Поэтому HCV-инфекция представляет для хирургов гораздо большую угрозу.
7. Насколько высок риск для медработника заразиться ВИЧ?
Передача инфекции подтверждалось, если был зафиксирован контакт медработника с кровью или биологическими жидкостями инфицированного больного, после чего была отмечена сероконверсия ВИЧ. Профессиональный риск безусловно выше у медицинских сестер и работников лабораторий. Общее число заражений несравнимо с большим количеством контактов с вирусом, которые, по всей видимости, имели место с начала эпидемии (начало 1980-х годов).
8. Меньше ли риск заражения ВИЧ при выполнении операций лапароскопическим способом?
В последнее время лапароскопическую хирургию у ВИЧ-инфицированных больных считают хорошей заменой открытым вмешательствам. Данный метод уменьшает вероятность контакта с кровью и острыми инструментами, однако за счет некоторых его особенностей возможно заражение хирургов иными путями, чем при обычной операции. При десуфляции пневмонеритонеума во время лапароскопических вмешательств происходит разбрызгивание капелек ВИЧ-инфицированной крови в операционной. Риск заражения можно уменьшить, направляя воздух в закрытую систему и принимая соответствующие меры предосторожности при смене инструментов.
9. Является ли эффективным методом защиты использование двойных перчаток?
Вследствие возможности контакта поврежденной кожи с кровыо риск заражения людей, работающих в операционной, вирусом гепатита или ВИЧ повышен. Хотя двойные перчатки могут не предотвратить повреждения кожи, показано, что они явно уменьшают вероятность контакта с кровыо. Исследования, посвященные контакту с кровыо в операционной, показали, что в 90% такой контакт происходит па коже рук хирурга дистальнее локтя, включая область, защищенную перчатками. Согласно одному исследованию, если хирург надевает две пары перчаток, то вероятность контакта его кожи с кровыо уменьшается па 70%. Прокол наружной пары перчаток наблюдали в 25% случаев, в то время как прокол внутренней пары — только в 10% (в 8,7% у хирургов и в 3,7% у ассистентов). Прокол внутренней пары перчаток отмечался при операциях, длившихся более 3 часов; он всегда сопровождался проколом наружной пары. Наибольшее повреждение происходило па указательном пальце неведущей руки.
10. Представляет ли большую угрозу для хирургов попадание капелек в глаза?
Исследование эпидемиологических центров показало, что приблизительно в 13% случаев документированной передачи ВИЧ имел место контакт со слизистой и кожей. Попадание капелек в глаза часто недооценивают, хотя этот вид контакта легче всего предотвратить. В недавно проведенном исследовании изучали 160 пар защитных экранов для глаз, используемых хирургами и ассистентами. Все операции длились 30 минут и более. На экранах подсчитывали количество капелек, вначале макроскопических, потом микроскопических. Кровь была обнаружена на 44% из исследуемых экранов. Хирурги замечали брызги всего в 8% случаев. Лишь 16% капелек были видны макроскопически. Риск попадания капелек в глаза был выше для хирурга, чем для ассистента, и увеличивался с увеличением времени операции. Доказано, что важным является также тип вмешательства: риск выше при сосудистых и ортопедических операциях. Защита глаз должна быть обязательной для всех работающих в операционной, особенно для непосредственно оперирующих лиц.
11. Как часто кровь хирурга контактирует с кровью и биологическими жидкостями больного?
Контакт с кровью возможен при повреждениях кожи (уколы, порезы) и соприкосновении с кожей и слизистыми (прокол перчатки, царапины на коже, попадание капелек в глаза). Контакт вследствие повреждения кожи наблюдают в 1,2-5,6% хирургических процедур, а контакт вследствие соприкосновения с кожей и слизистыми — в 6,4-50,4%. Разница в приводимых цифрах обусловлена различиями в сборе данных, выполняемых процедурах, хирургической технике и мерах предосторожности. Например, хирурги в San Francisco General Hospital принимают крайние меры предосторожности, надевая водонепроницаемую форму и две пары перчаток. Случаев передачи инфекции какому-нибудь медработнику при контакте его неповрежденной кожи с инфицированными кровью и биологическими жидкостями не отмечено. Однако сообщалось о заражении ВИЧ медработников, не имеющие других факторов риска, вследствие контакта с их слизистыми и кожей ВИЧ-инфицированной крови. Вероятность передачи инфекции при таком контакте остается неизвестной, поскольку в проспективных исследованиях у медработников после контакта их слизистой и кожи с ВИЧ-инфицированной кровью сероконверсии отмечено не было.
Риск заражения существует для всех работающих в операционной, однако он намного выше для хирургов и первых ассистентов, поскольку 80% случаев загрязнения кожи и 65% случаев повреждений приходится именно на них.
12. Только ли хирургической техникой объясняется загрязнение кожи?
Кожа с царапинами может контактировать с кровью или биологическими жидкостями даже при соблюдении всех мер предосторожности. К сожалению, далеко не вся защитная одежда защищает в равной степени. В одном исследовании отмечены дефекты у 2% стерильных хирургических перчаток сразу после их распаковки.
13. Какова вероятность сероконверсии после контакта крови медработника с кровью больного для ВИЧ и HBV?
Вероятность сероконверсии после укола иглой составляет 0,3% для ВИЧ и 30% для HBV.
14. Какова вероятность для хирурга заразиться ВИЧ на рабочем месте за все время его карьеры?
Риск передачи ВИЧ хирургу можно вычислить, зная частоту обнаружения ВИЧ у хирургических больных (0,32-50%), вероятность повреждения кожи (1,2-6%) и вероятность сероконверсии (0,29-0,50%). Таким образом, риск заразиться ВИЧ от конкретного больного находится в интервале от 0,11 на миллион до 66 на миллион. Если хирург выполняет 350 операций в год в течение 30 лет, то риск заражения на протяжении всей карьеры для него составляет от 0,12% до 50,0%, в зависимости от переменных величии. В этом подсчете допущено несколько предположений:
а) Мы допустили, что заболеваемость ВИЧ является величиной постоянной, однако считается, что в Соединенных Штатах за год она увеличивается на 4,0-8,6%.
б) Учитывается только контакт с зараженной кровью при повреждении кожи; возможность контакта со слизистыми и кожей (без ее повреждения) не принимается во внимание.
в) Риск считается одинаковым для всех операций, однако известно, что он зависит от длительности и срочности операции, а также от объема кровопотери.
Очевидно, что эти предположения не способствуют точности вычислений, поэтому подсчитанная вероятность — всего лишь грубая оценка на основании имеющихся данных.
15. Знают ли хирурги о своем профессиональном риске?
16. Есть ли эффективные методы уменьшить риск заражения хирургов инфекциями, передающимися с кровью?
Профилактике заражения HBV, помимо общих мер предосторожности, способствует высокоэффективная вакцина, которая, однако, не используется так часто, как следовало бы. Большинство хирургов в возрасте 45 лет и старше не вакцинированы. Также отработан протокол лечения после контакта. Наиболее прагматичный подход для профилактики передачи HCV и ВИЧ — уменьшить вероятность повреждения кожи и контакта с кожей и слизистыми за счет применения оптимальных методик и мер предосторожнсти.
Наконец, при попадании крови необходимо быстро ее удалить. При загрязнении кистей или рук следует их немедленно обработать. Если это невыполнимо, то область контакта надо смочить раствором повидон-йода, а когда это будет возможно — обработать.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
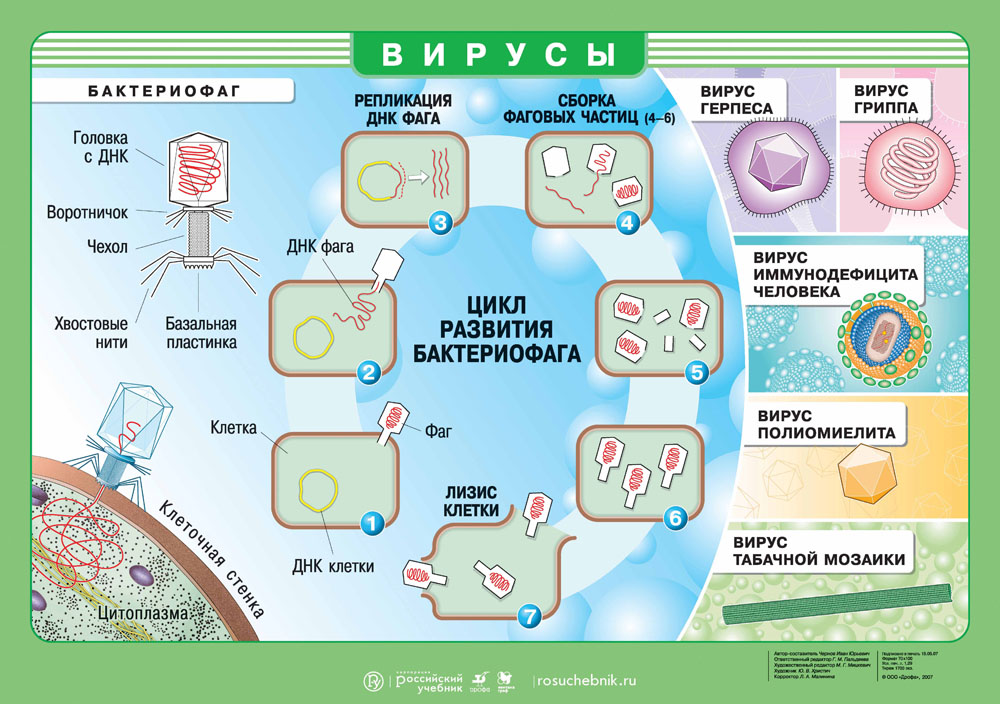
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
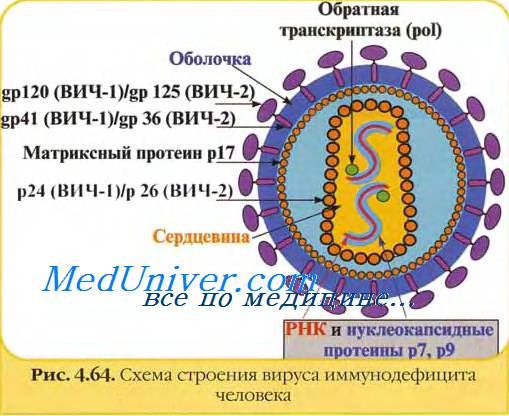
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
Как вирус попадает в организм?
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

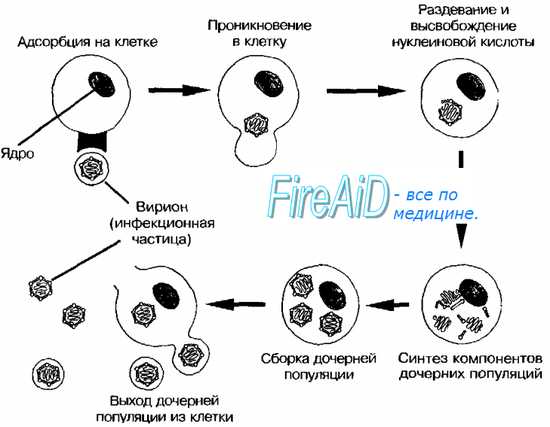
Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Как вирус распространяется?
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.

Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.

Читайте также:

