Какие вирусы относятся к днк содержащим
Обновлено: 12.05.2024
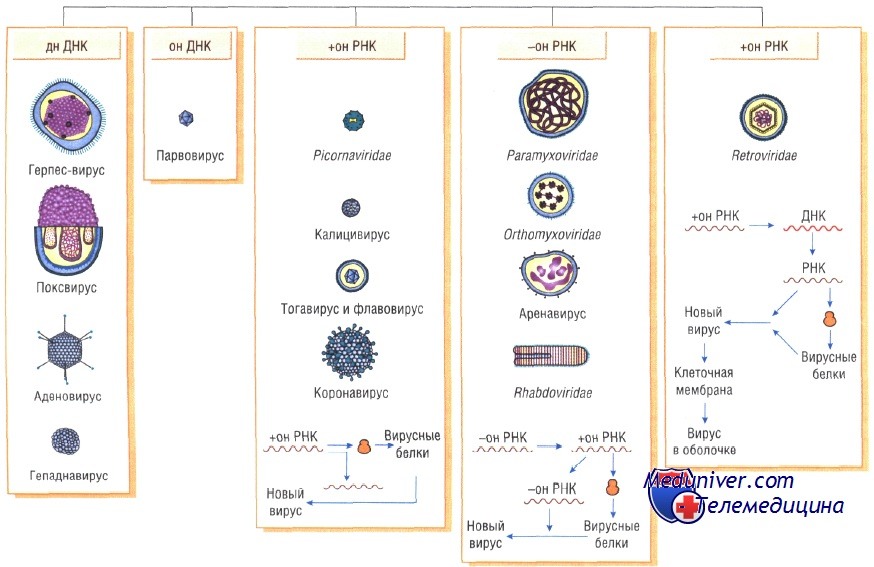
ДНК-вирусы. Этапы репликации вирусов с ДНК геномом.
Оспо-, асфаро- и иридовирусы имеют вирионную транскриптазу (ДНК-зависимую РНК-полимеразу) и размножаются в цитоплазме. Их очень большие геномы кодируют многочисленные ферменты, которые делают их репликацию независимой от клеточного ядра. Моноцистронные мРНК транскрибируются непосредственно на вирусной ДНК.
После разрушения наружной оболочки вириона клеточными ферментами на вирусной ДНК с помощью вирионной ДНК-зависимой РНК-полимеразы синтезируются ранние мРНК. Они транслируются в вирусные белки с помощью которых вирионная ДНК полностью освобождается от белка и реплицируется по полуконсервативному механизму. Вначале синтезируются фрагменты ДНК (фрагменты Оказаки), которые затем соединяются с образованием зрелых вирусных ДНК.
Поздние моно- и полицистронные мРНК транскрибируются после начала репликации вирусной ДНК и кодируют синтез структурных белков вириона. Иридовирусы и асфаровирусы, по-видимому, обладают сходной с вирусами оспы стратегией репликации.
Герпес-, адено-, папиллома и полиомавирусы в одном отношении имеют общую стратегию репликации: вирусная ДНК транскрибируется в ядре клеточной ДНК-зависимой РНК-полимеразой II. В течение определенного промежутка времени проходит два или более циклов транскрипции различных генных единиц (групп генов под контролем одного промотора). Субгеномные полицистронные РНК-транскрипты подвергаются расщеплению и сплайсингу, превращаясь в моноцистронные мРНК.
У папиллома- и полиомавирусов транскрипционная программа состоит по крайней мере из двух циклов (ранние и поздние мРНК), а у герпес- и аденовирусов по крайней мере из трех (сверхранние, ранние и поздние мРНК). В каждом случае вирионные полипептиды синтезируются на мРНК, появляющейся в последнем цикле транскрипции (поздние мРНК). ДНК аденовирусов, папиллома- и полиомавирусов может встраиваться в геном клетки-хозяина, реплицироваться вместе с ним, передаваться дочерним клеткам и транслироваться с образованием вирусных белков.
Парво- и цирковирусы, обладающие оцДНК, реплицируются в ядре. Эти вирусы используют клеточные ДНК-полимеразы для синтеза двуспиральной ДНК, которая затем транскрибируется в ядре клеточной ДНК-зависимой РНК-полимеразой II. Синтезированные транскрипты подвергаются сплайсингу и превращаются в мРНК.
Вирионная ДНК служит матрицей для синтеза (+) и (-)ДНК. Последние включаются в вирионы в качестве генома.
Различают недефектные (автономные) и дефектные парвовирусы. Первые размножаются самостоятельно, тогда как вторые реплицируются только в присутствии вируса-помощника, которым является любой аденовирус или вирус простого герпеса. В связи с этим дефектные парвовирусы называют аденоассоциированными вирусами (ААВ). В вирионах недефектных парвовирусов содержится односпиральная линейная (+)ДНК. Дефектные парвовирусы являются уникальными в мире вирусов, поскольку комплементарные плюс- и минус-ДНК входят в различные вирионы.
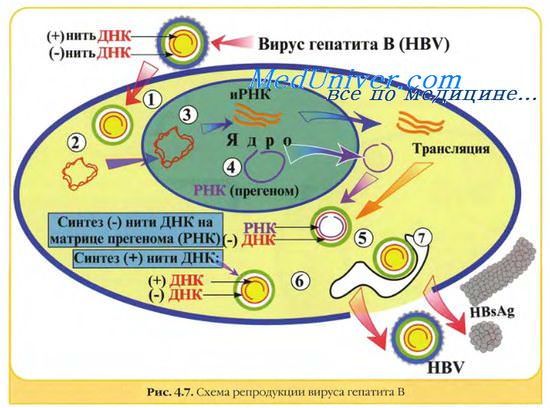
Гепаднавирусы. Частично двуцепочечная ДНК генома гепаднавирусов с помощью вирионной ДНК-полимеразы превращается в суперспирализованную двуцепочечную ДНК. Затем с помощью клеточной РНК-полимеразы II образуются мРНК для вирусных белков, в том числе для обратной транскриптазы, и полноразмерная (+)РНК, которая служит матрицей для обратной вирусной транскрипции с образованием (-)ДНК, на которой в свою очередь синтезируется частично двуцепочечная ДНК. мРНК транскрибируется на двуцепочечной ДНК, стартуя от различных промоторов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
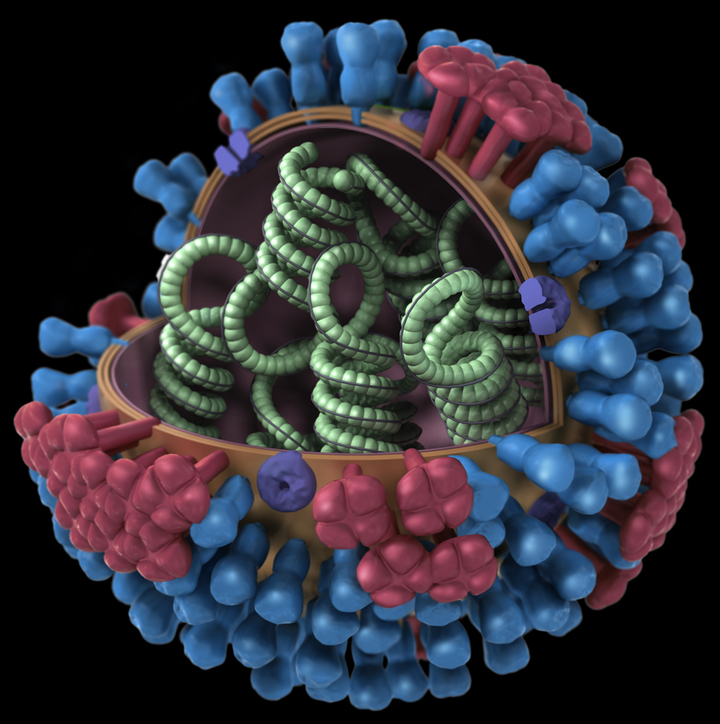
Строение вируса гриппа. Под оболочкой вириома - генетический материал вируса, необходимый для его воспроизводства в клетке.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.

Сравнение жизненных циклов ВИЧ и вируса гриппа. Если первый использует обратную транскрипцию и живет в клетках иммунной стистемы, вирион второго, проникая в эпительные клетки дыхательных путей целиком - а именно там он и обитает - распадается уже внутри клетки, а репликация вирусной РНК происходит в ядре с помощью вирусных полимераз PA, PB1 и PB2 путем комплементарного копирования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.
Строение вирусов. Классификация вирусов
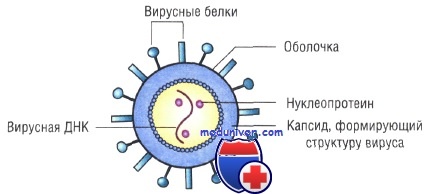
Вирусы классифицируют по типу генетического материала, способам репликации, строению и расположению структурных белков (капсидов), а также наличию или отсутствию оболочки.
Генетическая структура и способы репликации ДНК-вирусы. Могут быть только двунитевыми и одноните-выми. К. первым относят вирус оспы, герпес-вирусы, аденовирусы, паповавирусы и полиомавирусы. Последние два вируса вызывают развитие доброкачественных (бородавки) и злокачественных (рак шейки матки) опухолей. Вирус гепатита В частично дву- и однонитевой. К однонитевым вирусам относят парвовирусы, вызывающие инфекционную эритему.
Репликация ДНК-вирусов обычно происходит в ядре клеток хозяина и сопровождается продукцией полимераз, воспроизводящих вирусную ДНК. При этом последняя не всегда встраивается в хромосомную ДНК хозяина.
РНК-вирусы. Эти вирусы содержат однонитевую РНК, но различаются по стратегии репродукции, (вирусы, содержащие плюс-однонитевую РНК и минус-однонитевую РНК). У плюс-однонитевых вирусов РНК транслируется в структурные белки и служит матрицей (мРНК) для РНК-зависимой РНК-полимеразы.
В состав минус-однонитевых вирусов входит собственная РНК-зависимая РНК-полимераза, продуцируемая на базе генома вируса мРНК. Последняя в свою очередь может быть матрицей для продукции вирусной (минус-однонитевой) РНК.
Строение капсидов вирусов. Вирусная нуклеиновая кислота покрыта белковой оболочкой, состоящей из повторяющихся единиц (капсида) с икосаэдрическим (кубическим) или спиральным типами симметрии. Капсиды вирусов с икосаэдрическим типом симметрии имеют практически сферическую форму. Спиральный тип симметрии свойствен РНК-вирусам, капсиды которых окружают нуклеиновую кислоту, располагающуюся в виде спирали.
Капсид состоит из повторяющихся компонентов (капсомеров), количество генов, кодирующих его, снижено, тем самым облегчён процесс сборки вируса.
Оболочка вирусов. В некоторых случаях нуклеиновая кислота и капсидные белки вируса (нуклеокапсид) окружены липидной оболочкой, состоящей из компонентов клетки хозяина или ядерных мембран. Мембрана клетки хозяина изменяется под действием белков, кодируемых вирусом, или гликопротеинов, выступающих в роли рецепторов для других клеток хозяина. Покрытые оболочкой вирусы чувствительны к действию веществ, растворяющих липидную мембрану (например, эфиров).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ДНК-вирусы как причина развития рака - вирусный канцерогенез
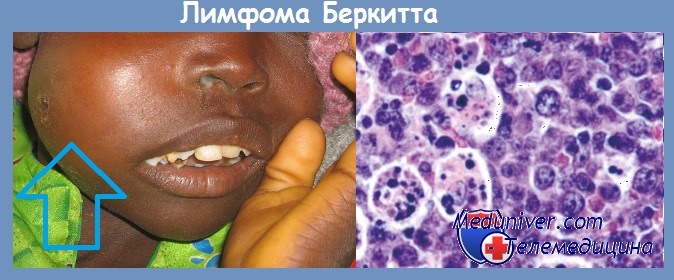
В канцерогенезе также могут участвовать ДНК-содержащие вирусы. Наиболее крупные ДНК-содержащие вирусы принадлежат к группе герпесвирусов. Первым вирусом, выделенным из культуры опухолевых клеток, был вирус Эпштейна-Баррра (ЭБВ).
Вирус был получен из культуры опухолевых клеток больных лимфомой Беркита. В культуре in vitro ЭБВ вызывает бесконечную пролиферацию человеческих В-лимфоцитов. Вирусные гены, встраиваясь в геном этих клеток, инициируют пролиферацию путем активации клеточных генов-регуляторов роста (онкогенов).
В крови больных лимфомой Беркита обнаруживается более высокий, чем у здоровых людей, титр антител к антигенам вирусной оболочки и к мембранным антигенам. В то же время в африканских странах среди множества детей, инфицированных этим вирусом, лимфома развивается только в единичных случаях.
Механизм онкогенеза этого заболевания не может быть объяснен только вирусным заражением. К тому же, за пределами африканского континента регистрируются случаи заболевания лимфомой Беркита, абсолютно не связанные с инфицированием вирусом ЭБВ. По-видимому, ЭБВ также может принимать участие в патогенезе карциномы носоглотки, так как клетки этой опухоли экспрессируют вирусные антигены EBNA-1.
При исследованиях саркомы Капоши, развивающейся у больных СПИДом, в 1994 г. из ее клеток был выделен новый герпесвирус. Первоначально вирус получил название герпес-вируса саркомы Капоши (ГСК), впоследствии он был переименован в герпесвирус человека серотип 8 (ГВЧ 8). Вирус обнаруживается в веретеновидных клетках саркомы Капоши практически при всех случаях заболевания.
ГВЧ 8 был также найден в опухолевых клетках первичной эффузионной лимфомы и в клетках многоочаговой болезни Кастлемана. Данный вирус кодирует синтез циклина, который является промотором клеточного деления, чем и объясняется высокая пролиферативная активность инфицированных клеток.
Человеческие папилломавирусы (ПВЧ) вызывают кожные бородавки и ряд доброкачественных папиллом. Это весьма обширный класс вирусов, и некоторые его представители могут в той или иной степени участвовать в развитии злокачественных опухолей. Большинство вирусов вызывает лишь ограниченную пролиферацию клеток, но ряд серотипов может вызвать и развитие злокачественных новообразований.
Наибольшую опасность с точки зрения онкологии представляют серотипы 16, 18, 31 и 33. Более 90% опухолей карциномы шейки матки in situ обнаруживают в своих клетках генные последовательности вирусов ПВЧ. Эти вирусы также играют значительную роль в возникновении инвазивных и многоочаговых плоскоклеточных раков кожи, которые часто развиваются у больных после долгосрочных курсов иммуносупрессивной терапии.
Механизмы вирусного канцерогенеза в этом случае изучены недостаточно. В исследованиях доказано, что существует вероятность включения вирусной ДНК в клетки базального эпителия. Обычно в клеточную ДНК внедряются восемь ранних и два поздних гена. Ранние гены Е6 и Е7 вызывают пролиферацию клеток.
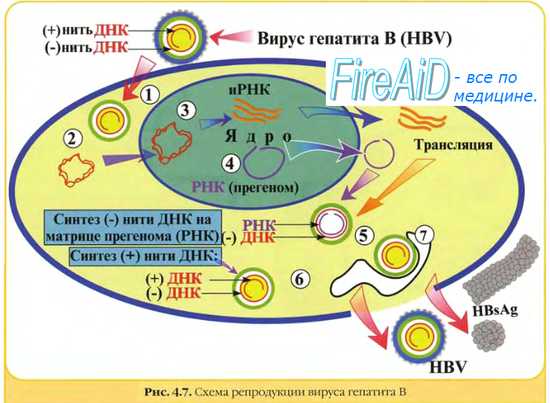
Вирус гепатита В четко связывают с развитием печеночно-клеточного рака. Риск развития этого заболевания у инфицированных вирусом в 200 раз превышает таковой у неинфицированных людей. Механизмы зарождения рака не до конца понятны: считается, что вирус вызывает бесконечную пролиферацию клеток, хотя зараженные вирусом клетки уничтожаются иммунной системой организма. Возможно, что пролиферирующие клетки становятся чувствительными к другим канцерогенам, например к афлатоксину.
Подытоживая вышесказанное, можно заключить, что основным механизмом канцерогенного воздействия является повреждение молекул ДНК и нарушения процессов ее репарации. Если не происходит исправления первичных повреждений ДНК, ошибки со временем начинают накапливаться, что ведет к дестабилизации структуры хромосом и к соматическим мутациям. Большинство таких мутаций летальны для клетки.
Однако, если часть клеток выживает, происходит постепенное накопление клеточной массы с опухолевым фенотипом, что в итоге приводит к клиническим проявлениям. Большой вклад в понимание этого процесса внесли современные исследования механизмов регулировки клеточного цикла и недавнее открытие регуляторных белков, которые запрещают клетке делиться, если ее геном сильно поврежден.
Для развития опухоли может быть недостаточно единичных мутаций в генах-регуляторах деления, но накопление массы ошибок в регуляторных генах может привести к фатальным последствиям. Особенно критичны мутации в генах, регулирующих клеточное деление, так называемых онкогенах. Очень опасны также мутационная инактивация генов, подавляющих клеточное деление — генов-подавителей опухоли, и мутации в генах, кодирующих белки, запрещающие деление при повреждении клеточного генотипа.
Накопление числа жизнеспособных мутаций по одному или нескольким из этих генов приводит к общей клеточной дезорганизации и к потере контроля над клеточным делением. В следующем разделе мы рассмотрим механизмы действия онкогенов и наиболее важные моменты контроля над клеточным циклом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

