Кавасаки вирус у детей отзывы
Обновлено: 25.04.2024
Л.Н. Мазанкова 1 , д-р мед. наук, профессор, И.М. Османов 2 , д-р мед. наук, профессор, Э.Р. Самитова 1, 2 , канд. мед. наук, С.Р. Родионовская 2, 3 , канд. мед. наук, В.Г. Акимкин 4 , д-р мед. наук, профессор, A. А. Плоскирева 4 , д-р мед. наук, М.А. Анцупова 2 , Н.П. Котлукова 5 , д-р мед. наук, профессор, B. В. Попова 2 , А.Ю. Куницына 2 , Л.О. Таранов 5
Ключевые слова: COVID-19, дети, PIMS, MIS-C, PIMS-TS, детский мультисистемный воспалительный синдром, ассоциированный с SARS-CoV-2
Резюме. В статье на клиническом примере описаны особенности течения детского мультисистемного воспалительного синдрома у пациента с сочетанной патологией, что потребовало расширения алгоритма диагностики и применения междисциплинарного подхода к решению проблемы.
Для цитирования: Мазанкова Л.Н., Османов И.М., Самитова Э.Р. и др. Диагностика и лечение детского мультисистемного воспалительного синдрома, ассоциированного с COVID-19: клиническое наблюдение. Практика педиатра 2021;(2):4—9.
Keywords: COVID-19, children, PIMS, MIS-C, PIMS-TS, pediatric inflammatory multisystem syndrome, associated with SARS-CoV-2, multisystem inflammatory syndrome in children
Summary. The article presents the data of observation of the peculiarities of the course of pediatric inflammatory multisystem syndrome, describes a clinical case of this syndrome with comorbid pathology, which requires an extension of the diagnostic algorithm and an interdisciplinary approach to solving the problem.
For citation: Mazankova L.N., Osmanov I.M., Samitova E.R. et al. Diagnosis and treatment of pediatric inflammatory multisystem syndrome associated with COVID-19: clinical case. Pediatrician's Practice 2021;(2):4-9. (In Russ.)
Диагностические критерии PIMS-TS/MIS-C: детский возраст, стойкая лихорадка (≥24 ч по критериям Центров по контролю и профилактике заболеваний США и ≥3 сут по критериям Всемирной организации здравоохранения), полиорганное поражение, выявление лабораторных маркеров воспаления, исключение альтернативных диагнозов и указание на предшествующую перенесенную инфекцию, вызванную SARS-CoV-2. Согласно опубликованным обзорам, в реальной клинической практике наблюдается вариабельность клинических признаков и тяжести заболевания (от легких случаев до случаев с неблагоприятным исходом). Определенные диагностические трудности возникают при проведении дифференциальной диагностики и исключении синдрома Кавасаки, который имеет сходную клиническую картину (стойкая лихорадка и кожно-слизистый синдром). В отличие от синдрома Кавасаки, PIMS-TS чаще возникает у детей более старшего возраста (≥5 лет), чаще характеризуется полиорганной дисфунцией, вовлечением желудочно-кишечного тракта и сердечно-сосудистой системы (миокардит). Средний возраст пациентов варьирует от 7 до 10 лет (диапазон от 7 мес до 20 лет). Вопрос о роли сопутствующих патологических состояний, повышающих риск тяжелого течения PIMS-TS, остается спорным: в серии наблюдений, описанной L.R. Feldstein и соавт., не менее 73% пациентов были ранее здоровы, а наиболее частыми сопутствующими состояниями были избыточный вес и бронхиальная астма [6]; влияние герпесвирусных инфекций, в том числе цитомегаловирусной, на течение заболевания у детей не изучено.
Во всех наблюдениях и обзорах сообщалось о высокой частоте поражения сердца при PIMS-TS/MIS-C -о симптомах дисфункции миокарда, подтвержденных эхокардиографией (эхоКГ) и электрокардиографией (ЭКГ) и свидетельствовавших о снижении систолической функции левого желудочка у 31-100% пациентов [5, 6, 9]. M. Pouletty и соавт. наблюдали миокардит у 44% и перикардит у 25% пациентов [12]. Аналогичные данные (соответственно 53 и 32%) с преобладанием пациентов в возрасте 13-20 лет были получены E.M. Dufort и соавт [5].
Лабораторные маркеры воспаления, дисфункция миокарда и коагуляционные нарушения входят в диагностические критерии PIMS-TS/MIS-C. Согласно критериям уровень С-реактивного белка (СРБ), ферритина, прокальцитонина и сывороточного интерлейкина-6 (ИЛ-6) должен быть значительно повышен. L.R. Feldstein и соавт. выявили, что у 171 из 186 пациентов было отмечено повышение содержания по крайней мере 4 воспалительных биомаркеров, включая тропонин I и пронатрийуретический пептид, D-димер, фибриноген [6]. К лабораторным признакам PIMS-TS/ MIS-С относят также лимфопению, нейтрофилез, гипоальбуминемию, анемию и тромбоцитопению.
Несмотря на потенциально тяжелые клинические проявления, исход PIMS-TS/MIS-C в целом благоприятен. В большинстве случаев в течение первых дней на фоне лечения наблюдается тенденция к улучшению состояния пациентов. Средняя продолжительность пребывания в отделении интенсивной терапии и реанимации (ОРИТ) колеблется от 4 до 7 дней [5, 6]. Летальность относительно низка и составляет, по текущим оценкам, около 2% [5, 6, 9].
Приводим собственное клиническое наблюдение тяжелого течения PIMS-TS/MIS-C на фоне персистирующей цитомегаловирусной инфекции в стадии реактивации.
Клинический пример
Пациент К., 3 лет, поступил 17.11.2020 в инфекционное отделение Детской городской клинической больницы им. З.А. Башляевой по экстренным показаниям на 6-е сутки болезни. Пациент и родители предъявляли жалобы на повышение температуры тела до 39,5°С, боли в животе, рвоту, жидкий стул с примесью зелени, появление высыпаний на коже, задержку мочи в течение 16 ч.
Заболевание началось остро 12.11.2020 со стойкой фебрильной температуры тела (39,5-40°С). На 3-й день болезни (14.11.2020) присоединились боли в животе, была двукратная рвота. На 4-е сутки ребенок осмотрен участковым педиатром, который заподозрил инфекционный мононуклеоз, назначил кларитромицин в возрастной дозе, кипферон. На фоне терапии и применения антипиретиков (ибупрофена, парацетамола) лихорадка сохранялась; к вечеру 4-го дня отмечено снижение диуреза, появилась отечность век, жидкий стул до 3 раз в сутки с примесью зелени.
Из анамнеза жизни: ребенок от 5-й физиологично протекавшей беременности, роды третьи, срочные, самостоятельные. Масса тела при рождении 3150 г, длина 51 см. Вакцинирован по индивидуальному графику, в том числе от пневмококковой инфекции в сентябре 2019 г. Перенесенные заболевания: редкие ОРВИ. В течение последних 2 мес не болел. Эпидемиологический анамнез: в контакте с инфекционными больными не был, дошкольное учреждение не посещает.
Пневматизация легких неравномерная, снижена в задних отделах. В задних отделах S6 и 10 обоих легких - субплевральные уплотнения лентовидной формы толщиной до 6 мм с неровными контурами. В прилежащих отделах легочный рисунок обогащен за счет интерстициального компонента, сгущен и деформирован. Объем поражения легких около 10%.
Результаты лабораторно-инструментального обследования при поступлении представлены ниже.
Клинический анализ крови: уровень гемоглобина - 112 г/л, число лейкоцитов - 12,1 х 109/л, нейтрофилов - 81,6%, лимфоцитов - 12%, тромбоцитов -91 х 109/л (норма от 150 х 109/л до 350 х 109/л), скорость оседания эритроцитов (СОЭ) - 12 мм/ч.
Коагулограмма: D-димер - 3615 нг/мл (норма 0-500 нг/мл).
Серологическое исследование: антитела к SARS-CoV-2 класса IgM - 0,62 ед./мл (норма
Ультразвуковое исследование (УЗИ) органов брюшной полости: эхопризнаки гепатоспленомегалии, инфильтративных и диффузных изменений стенок отдельных петель толстого кишечника, реактивной гиперплазии мезентериальных лимфатических узлов (мезаденита), динамических нарушений моторики кишечника, взвеси в мочевом пузыре.
УЗИ почек: эхопризнаков структурной патологии на момент исследования не выявлено.
ЭхоКГ: небольшое увеличение полостей сердца. Видимые сегменты коронарных артерий интактны. Незначительное снижение систолической функции левого желудочка (фракция выброса 57,09%). Поперечные трабекулы, эктопические хорды в левом желудочке. Клапанный аппарат без видимых изменений. Выпота в полости перикарда нет.
Мультиспиральная компьютерная томография органов грудной клетки: рентгенологическая картина течения двусторонней пневмонии, вероятно вирусной этиологии (КТ-1) (см. рисунок).
Рентгенологическая картина двусторонней пневмонии, вероятно вирусной этиологии (КТ-1)
УЗИ плевральных полостей: эхопризнаки свободной жидкости в плевральной полости справа.
В ОРИТ начато лечение: внутривенные инфузии иммуноглобулина (габриглобин № 3) в дозе 0,3 г/кг в течение 2 дней, терапия системными глюкокортикостероидами (пульс-терапия метилпреднизолоном в дозе 20 мг/кг); гепарином в дозе 10 ЕД/кг/ч, инфузии альбумина, коррекция водно-электролитного дисбаланса, антибактериальная терапия цефтриаксоном в дозе 80 мг/кг/сут, вазопрессорная и кардиотоническая терапия дофамином в дозе 10 мкг/кг/мин, норадреналином в дозе 0,2 мкг/кг/мин. Оксигенотерапия с 18.11.2020, скорость потока О2 максимальная - до 2,0 л/мин.
В связи с отсутствием положительной динамики на фоне трехдневной пульс-терапии метипредом в виде сохраняющейся фебрильной температуры (максимально до 40°G), выраженной пастозности век, миокардиальной дисфункции ребенку с 20.11.2020 была повышена доза иммуноглобулина до 2 г/кг, проведена смена антибактериальной терапии (назначен максик-там из расчета 100 мг/кг/сут, флуконазол 6 мг/кг/сут).
На 5-е сутки госпитализации стабилизировалась сердечно-легочная деятельность, уменьшились симптомы интоксикации, регрессировал кожно-слизистый синдром, снизился уровень СРБ до 10,3 мг/л, D-димера до 582 мкг/л, прокальцитонина до 0,31 нг/мл. Продолжена пероральная терапия преднизолоном в дозе 1,5 мг/кг/сут. В связи с получением результата бактериологического посева крови (Staphylococcus epidermidis) была произведена коррекция антибактериальной терапии с добавлением ванкомицина из расчета 10 мг/кг 4 раза в день.
Для уточнения причины изменений створок аортального клапана ребенок с 09.12.2020 по 15.12.2020 находился в отделении кардиологии, где был исключен инфекционный эндокардит и ввиду положительной динамики коагулограммы (D-димер - 510,0 нг/мл, активированное частичное тромбопластиновое время - 27,8 с) 11.12.2020 завершена гепаринотерапия, 14.12.2020 после нормализации уровня лейкоцитов (9,5 х 10 9 /л) и СОЭ (6 мм/ч) отменены антибиотики. Нормализовались биохимические маркеры системной воспалительной реакции: уровень прокальцитонина - 0,26 нг/мл, СРБ - 10,3 мг/л, ферритина - 117,4 нг/мл. Учитывая низкую вирусную нагрузку ЦМВ (по данным исследования крови методом ПЦР (количественный метод) - 2 х 10 2 копий/мл), ребенок не нуждался в назначении ганцикловира.
Таким образом, при эхоКГ, проведенной перед выпиской мальчика из стационара, не выявлено патологии сердца. Симптомы миокардиальной дисфункции купированы, показатели z-score коронарных артерий находились в пределах нормы, а транзиторное утолщение створок аортального клапана, которое появилось на пике заболевания, было обусловлено течением васкулита (аортальный вальвулит) в рамках основной патологии. В период нахождения в отделении кардиологии у мальчика наблюдалась тахикардия с ЧСС до 160 в минуту, что было обусловлено приемом преднизолона. Курс терапии преднизолоном продолжался 27 дней. После отмены преднизолона ЧСС снизилась до 115-147 в минуту.
Диагноз клинический при выписке:
Основной: U10. Детский воспалительный мультисистемный синдром (PIMS), ассоциированный с COVID-19, тяжелая форма. Двусторонняя вирусная пневмония, КТ-1, более 10%. Вальвулит аортального клапана.
Осложнения: сердечная недостаточность II-III ст. Острое почечное повреждение. Анемия средней степени тяжести.
Сопутствующий: персистирующая ЦМВ-инфекция в стадии реактивации. Астенический синдром. Кариес зубов распространенный.
По месту жительства рекомендовано продолжить терапию ЦМВ-инфекции вифероном, а также дезагрегантную, кардиотрофную терапию и терапию, направленную на восстановление кишечной микрофлоры.
Заключение
Данный клинический случай демонстрирует тяжелое течение детского воспалительного мультисистемного синдрома с полиорганной недостаточностью (дыхательной, сердечной, почечной) у ребенка 3 лет, перенесшего новую коронавирусную инфекцию в бессимптомной форме. К особенностям данного случая следует отнести длительное сохранение умеренной интоксикации и субфебрилитета на фоне адекватной терапии детского мультисистемного воспалительного синдрома (PIMS), ассоциированного с СOVID-19, что обусловлено реактивацией персистирующей ЦМВ-инфекции на фоне иммуносупрессивной терапии основного заболевания, а утолщение на створках аортального клапана носило транзиторный характер аортального вальвулита. Нельзя исключать возможности коморбидной патологии у пациентов с PIMS, требующей расширения алгоритма диагностики и междисциплинарного подхода к лечению.
Литература
Что такое синдром Кавасаки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Похлебкиной А. А., педиатра со стажем в 6 лет.
Над статьей доктора Похлебкиной А. А. работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Болезнь или синдром Кавасаки — это острое воспаление сосудов, которое встречается в основном у младенцев и детей в возрасте до пяти лет. Сопровождается лихорадкой, шелушением кожи и симптомами острого воспаления: гиперемией слизистой оболочки глазного яблока, покраснением слизистой оболочки полости рта, сыпью, увеличением шейных лимфатических узлов, покраснением и отёками кистей и стоп.
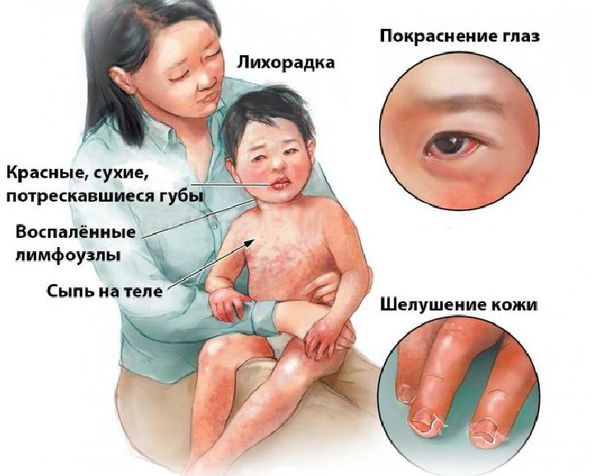
Впервые болезнь описана в Японии в 1967 году доктором Томисаку Кавасаки и впоследствии была признана во всём мире как важнейшее заболевание детского возраста [1] [2] . Синдром Кавасаки является наиболее распространённой причиной болезней сердца у детей в развитых странах.
Причины возникновения болезни Кавасаки до конца не изучены, долгое время к ним относили инфекции. На это указывало увеличение числа заболевших в конце зимы и весны и волнообразное географическое распространение эпидемий. Болезнь Кавасаки редко встречается у детей младше четырёх месяцев. Это позволяет предположить, что материнские антитела могут обеспечивать пассивный иммунитет [3] . Подозреваемыми инфекционными агентами были стафилококки, стрептококки, микоплазмы или хламидии, вирусы, такие как аденовирус, парвовирус или вирус Эпштейна ― Барра. Однако в носоглотке, ротоглотке, на коже или в кале больных возбудители выявлены не были [4] [5] [6] . Также было выдвинуто предположение об аутовоспалительном происхождении болезни Кавасаки [7] .
От болезни Кавасаки страдают все этнические группы, но особенно высок уровень заболеваемости в азиатских странах, среди японцев и корейцев, а также при их миграции в другие страны. Частота встречаемости болезни выше среди братьев, сестёр и близнецов, что предполагает генетический вклад в развитие синдрома [8] [9] . По данным на 2008 год, заболеваемость болезнью Кавасаки в Японии составляет 219 случаев на 100 000 детей, на Тайване — 69, в США — 9–19, в Великобритании — 8 [15] . Исследования выявили несколько генов, повышающих восприимчивость к заболеванию и её последствиям в различных этнических популяциях. К ним относятся FCGR2A, CD40, ITPKC, FAM167A-BLK и CASP3, а также гены, влияющие на ответ после введения внутривенного иммуноглобулина и способствующие образованию аневризмы (выпячиванию стенки артерии). На сегодняшний день вопрос генетического вклада в болезнь Кавасаки интенсивно изучается во всём мире.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Кавасаки
Большинство детей с болезнью Кавасаки нуждаются в медицинской помощи из-за продолжительной лихорадки. Основные симптомы заболевания [3] :
- Изменения со стороны кожи конечностей:
- эритема (покраснение) ладоней и подошв, иногда с болезненными отёками рук или ног, что может препятствовать движениям конечностей;
- чешуйчатое шелушение (отслаивание) эпителия пальцев рук и ног возникает в течение 2–3 недель после начала лихорадки;
- линии Бо (глубокие поперечные "канавки" на ногтях) могут появиться через 1–2 месяца после начала лихорадки.
- Полиморфная сыпь ― на покрасневшей коже появляются красные или фиолетовые бугорки, которые могут принимать различные формы.
- Изменения в ротоглотке:
- эритема, трещины, кровотечение и/или образование корок на губах;
- "клубничный язык" с выпуклыми грибовидными сосочками;
- рассеянное покраснение слизистой оболочки ротоглотки.
- Двусторонний, неэкссудативный (без появления эксудата — отделяемого), безболезненныйконъюнктивит наблюдается более чем у 90 % пациентов.
- Острая односторонняя негнойная шейная лимфаденопатия (увеличение лимфоузлов) с диаметром лимфатического узла не менее 1,5 см.
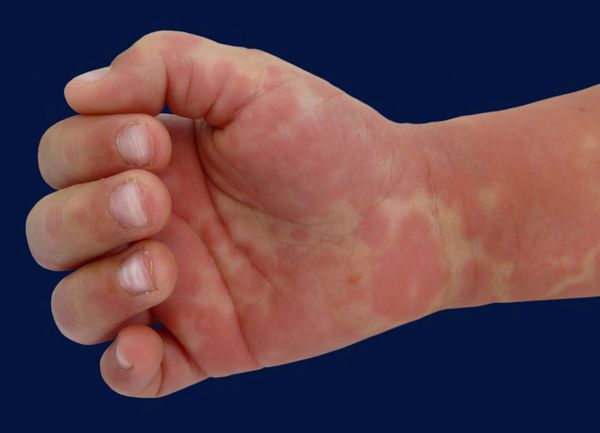
Немаловажный симптом ― высокая температура (часто 40 °C и выше) длительностью более пяти дней. Для постановки диагноза необходимы четыре диагностических критерия из пяти, указанных выше, плюс лихорадка. При аномалии коронарных артерий болезнь Кавасаки может быть диагностирована и при выявлении менее четырёх критериев [8] .
Раздражительность (беспокойство, плаксивость) является важным признаком, который почти всегда присутствует, хотя и не входит в диагностические критерии. Точный механизм раздражительности неясен, но это может быть связано с наличием неинфекционного менингита. Другие относительно распространённые состояния при болезни Кавасаки: артрит, пневмония, увеит, гастроэнтерит (заболевание желудочно-кишечного тракта), дизурия (расстройство мочеиспускания), отит (воспаление среднего уха).
Патогенез синдрома Кавасаки
Болезнь Кавасаки — это генерализованный системный васкулит, вовлекающий кровеносные сосуды по всему организму. Сосудистое воспаление наиболее выражено в коронарных артериях, но также может возникать в венах, капиллярах, мелких артериолах и крупных артериях. На ранних стадиях заболевания наблюдаются отёк эндотелия и субэндотелия сосуда. Отёки возникают из-за выраженной стимуляции цитокинового каскада и активацией эндотелиальных клеток, но внутренняя эластическая мембрана остается неповреждённой.
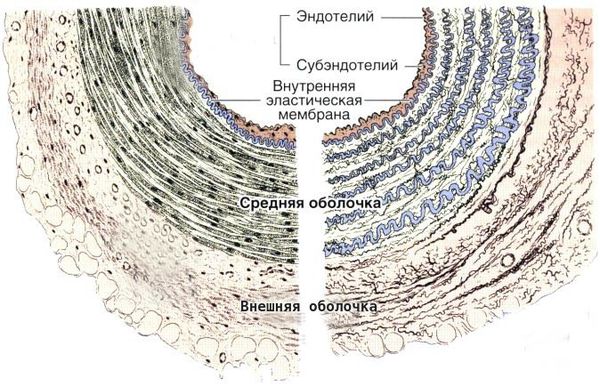
Цитокины — это белковые молекулы, вырабатываемые клетками для регуляции иммунного ответа. Они работают по принципу эстафеты: воздействие цитокина на клетку вызывает образование ею других цитокинов, этот процесс называется цитокиновым каскадом.
Воспалённые клетки вырабатывают различные цитокины и матриксные металлопротеиназы (ферменты, способные разрушать компоненты внеклеточного матрикса соединительных тканей), которые нацелены на эндотелиальные клетки. В результате происходит фрагментация внутренней эластической мембраны и повреждение сосудов.
Активное воспаление в течение нескольких недель или месяцев сменяется прогрессирующим фиброзом (разрастанием соединительной ткани) с образованием рубцов. В результате активного изменения сосудистой стенки и появления новых сосудов развивается стеноз (сужение просвета сосудов).
При повреждении мелких кровеносных сосудов к месту повреждения устремляются тромбоциты и образуют сгусток — тромб, закрывающий место дефекта сосуда.
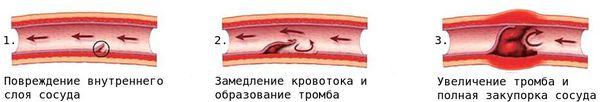
Вследствие стеноза либо тромбоза просвет сосуда со временем сужается или закупоривается, что создаёт риск смерти от сердечно-сосудистых заболеваний, например от инфаркта миокарда.
Классификация и стадии развития синдрома Кавасаки
Существует две формы болезни Кавасаки:
- полная — наличие лихорадки не менее пяти дней и 4-5 клинических признаков, описанных выше;
- неполная ( "атипичная") — типичные клинические признаки заболевания отсутствуют; может наблюдаться, например, почечная недостаточность, которая не характерна для полной формы [3][10] .
Клинические проявления болезни Кавасаки меняются с течением времени. Условно выделяют три стадии заболевания: острую, подострую и выздоровление [3] [7] [10] . Некоторые авторы добавляют четвёртую хроническую стадию.
Острая стадия начинается с внезапного повышения температуры и длится примерно 7–14 дней. Лихорадка обычно сопровождается сильным всплеском и периодическими пиковыми температурами 39-40 °С и выше. Если лихорадка сохраняется, это может быть признаком рецидивирующей болезни Кавасаки. При таком течении заболевания высокая температура не снижается от приёма жаропонижающих препаратов и может сохраняться до 3–4 недель. После введения ВВИГ (внутривенного иммуноглобулина) лихорадка обычно проходит в течение 36 часов.
Подострая стадия начинается, когда лихорадка утихла, и продолжается до 4–6 недель. Отличительные признаки этой стадии: шелушение кожи пальцев, тромбоцитоз (количество тромбоцитов может превышать 1 млн/мкл) и развитие аневризмы. Если лихорадка держится более 2–3 недель возрастает риск сердечных осложнений. На этой стадии наиболее высок риск внезапной смерти.
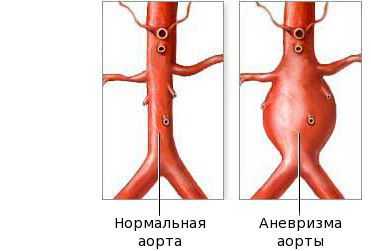
Фаза выздоровления характеризуется полным исчезновением клинических признаков болезни, как правило, в течение трёх месяцев после начала заболевания. Эта стадия начинается с возврата к исходному уровню показателей: снижению количества тромбоцитов, лейкоцитов, СОЭ. На стадии выздоровления сердечные аномалии всё ещё могут быть выражены. Небольшие аневризмы в 60 % случаев разрешаются самостоятельно, но крупные могут расширяться, что создаёт риск инфаркта миокарда.
Хроническая стадия имеет клиническое значение только у тех пациентов, у которых развились сердечные осложнения. Она продолжается всю жизнь. В некоторых случаях недиагностированные разрывы аневризм во взрослом возрасте и эпизоды лихорадок неясного происхождения в детстве могут быть нераспознанными случаями болезни Кавасаки.
Осложнения синдрома Кавасаки
За последние пятьдесят лет болезнь Кавасаки стала одним из самых распространённых приобретённых пороков сердца у детей в мире.
Осложнения заболевания [11] :
- устойчивые формы болезни Кавасаки — постоянная или рецидивирующая лихорадка, невосприимчивая к терапии;
- сердечно-сосудистые патологии — расширение коронарных артерий, аневризмы, инфаркт миокарда;
- рецидивирующие формы болезни Кавасаки;
- другие системные осложнения болезни Кавасаки;
В последнее время появление аневризм коронарных артерий при болезни Кавасаки снизилось, благодаря лечению высокими дозами внутривенных иммуноглобулинов. Тем не менее в настоящее время в Японии около 0,2–0,3 % пациентов с болезнью Кавасаки имеют гигантские аневризмы коронарной артерии [12] . У пациентов с аневризмами более 8 мм в диаметре в течение первого года после начала болезни Кавасаки часто развивается острый инфаркт миокарда, что приводит к дисфункции левого желудочка или внезапной смерти [12] .
После болезни Кавасаки из-за длительного стеноза коронарной артерии может развиться ишемическая болезнь сердца. Тяжёлый локализованный стеноз из-за утолщения коронарной стенки после болезни Кавасаки может вызвать ишемию миокарда. Возникновение гигантской аневризмы часто свидетельствует о многососудистом поражении. Инфаркт миокарда у пациентов с гигантскими двусторонними аневризмами сильно влияет на исходы выживания на ранних и поздних стадиях после начала болезни Кавасаки.
К другим системным осложнениям болезни Кавасаки можно отнести анемию, гипоальбуминемию (снижение албуминов в крови), электролитные нарушения (особенно гипонатриемию — снижение натрия в крови), паралитический илеус (кишечную непроходимость), дисфункцию печени, холецистит, судороги, диарею, рвоту, дегидратацию и сердечную недостаточность, а также ятрогению, вызванную введением внутривенных иммуноглобулинов [11] .
Диагностика синдрома Кавасаки
Болезнь Кавасаки определяют на основании диагностических критериев, поскольку однозначных клинических признаков и специфических тестов не существует. При подозрении на болезнь Кавасаки важно рекомендовать госпитализацию, чтобы провести тщательную оценку и подтвердить диагноз [13] .
Типичная первоначальная лабораторная оценка может включать:
- общий анализ крови (ОАК);
- анализ электролитов;
- тестирование почечной функции;
- анализ ферментов печени, альбумина;
- определение скорости оседания эритроцитов (СОЭ);
- анализ крови на C-реактивный белок (CРБ);
- общий анализ мочи (ОАМ) [3] .
При острой стадии заболевания на ОАК часто выявляется анемия лёгкой и средней степени тяжести.
Во время подострой стадии распространён тромбоцитоз — повышение уровня тромбоцитов. Количество тромбоцитов начинает расти на второй неделе от начала заболевания и продолжает увеличиваться на третьей неделе. Повышение уровня маркеров воспаления, таких как СОЭ и СРБ, ― частое явление, но иногда они лишь незначительно возрастают.
Повышенные или умеренно высокие уровни сывороточных трансаминаз или гамма-глутамилтранспептидаз встречаются у 40–60 % пациентов, а лёгкая гипербилирубинемия (увеличение количества билирубина в крови) ― у 10 %. Гипоальбуминемия связана с более тяжёлым и длительным острым заболеванием. Анализ мочи может показывать пиурию (выделение гноя с мочой) у 80 % детей.
Для острой фазы болезни Кавасаки характерно нарушение липидного обмена, которое в конечном итоге приводит к снижению общего холестерина в сыворотке, особенно ЛПВП (липопротеинов высокой плотности), и увеличению триглицеридов.
При подозрении на болезнь Кавасаки выполняют эхокардиографию (ЭхоКГ). В дальнейшем исследование повторяют через 1–2 недели и через 5–6 недель после начала заболевания.
На электрокардиографии (ЭКГ) может определяться тахикардия, удлинённый интервал PR, изменение волны ST-T и снижение напряжения R-волн, указывающие на миокардит. Изменения волн Q или ST-T могут указывать на инфаркт миокарда.
Отдельной группе пациентов может потребоваться катетеризация сердца и ангиография. Ангиография сосудов позволяет детально исследовать артерии, но это может быть связано с большим риском осложнения во время манипуляции, особенно при выполнении в острой фазе заболевания. Коронарная компьютерная томографическая ангиография и магнитно-резонансная ангиография также будут полезны при оценке состояния и наблюдении за коронарными артериями.
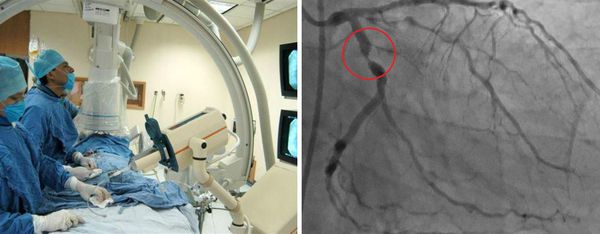
Ультразвуковое исследование показано при дисфункции того или иного органа. Пациентам с клиническими признаками менингита проводят люмбальную пункцию (взятие пробы спинномозговой жидкости).
Лечение синдрома Кавасаки
Основные цели лечения — подавить воспалительную реакцию и минимизировать риски развития аневризм коронарных артерий и других сердечных осложнений.
Все пациенты с болезнью Кавасаки должны быть госпитализированы для введения внутривенных иммуноглобулинов (ВВИГ) и аспирина, проведения эхокардиографии и наблюдения до устранения лихорадки [3] [13] .
В качестве "первой линии" лечения детей с болезнью Кавасаки применяют ВВИГ (внутривенные иммуноглобулины). Препараты наиболее эффективны, если назначены в течение первых 10 дней после начала лихорадки. В современной практике доза составляет 2 г/кг внутривенно в течение 10–12 часов.
Если после введения ВВИГ лихорадка сохраняется или возникает в течение 36 часов и позднее, то во многих из этих случаев рекомендуется повторное лечение ВВИГ в исходной дозе. Некоторые пациенты могут быть резистентными к действию ВВИГ, в таких случаях Американская кардиологическая ассоциация рекомендует пульс-терапию метилпреднизолоном, приём инфликсимаба, циклоспорина А, метотрексата и плазмаферез.
Большинство врачей используют аспирин в средних и высоких дозах в течение всего периода лихорадки, затем лекарство применяется в более низких дозах. Высокие дозировки требуются в острой фазе болезни для достижения противовоспалительного эффекта, в то время как более низкие дозировки препятствуют тромбообразованию в подостром периоде, когда существует риск развития аневризмы.
Прогноз. Профилактика
Без лечения смертность достигает 1 % и, как правило, случается в течение шести недель от начала заболевания. Длительная лихорадка увеличивает риск сердечно-сосудистых осложнений, в результате которых возможна внезапная смерть [14] .
При отсутствии ишемической болезни сердца прогноз для полного выздоровления хороший. Примерно две трети коронарных аневризм подвергаются регрессу в течение первого года. Гигантские аневризмы исчезают реже и требуют более интенсивного наблюдения и лечения.
Специфической профилактики не существует. Важными моментами при диспансеризации являются тромбопрофилактика, тщательное эхокардиографическое наблюдение за стенозами, закупорками коронарных артерий и ишемией миокарда. Каждый шесть месяцев необходимо проходить ЭхоКГ [15] .
Пациентам с тяжёлыми сердечными осложнениями может потребоваться катетеризация, шунтирование коронарной артерии или даже пересадка сердца. Успешное лечение требует эффективной совместной работы педиатров и кардиологов. Частота посещения доктора и приём лекарств зависят от тяжести заболевания. Поскольку дети, перенёсшие болезнь Кавасаки, имеют высокий риск развития осложнений со стороны сердечно-сосудистой системы, им может потребоваться наблюдение в течение жизни.
На сервисе СпросиВрача доступна бесплатная консультация педиатра онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно. Задайте свой вопрос и получите ответ сразу же!


Здравствуйте, фото сыпи пожалуйста.
Сыпь на ладонях и стопах характерна для "коксаки" и энантема во рту.

Похоже, энтеровирус.
Сдайте кровь с лейкоформулой, оам, УЗИ обп.
Мед отвод от вакцинации на 1 месяц, сад или школу не посещать 2 недели.
Екатерина, кровь сказали неплохая, ка и моча. Еще сдали ЭКГ. Не ходим в школу. Подскажите - как быстро это проходит. Сейчас принимаем только изопринозин и супрастин, сыпь медленно уходит.

До 2х месяцев.
Ещё баксет добавьте, вит д, вит с. Белковое - витаминное питание.
Опасные отдалённые последствия очень низкие. Просто режим дня, Закаливание, вакцинация от гриппа, гемофильной инфекции и пневмококка.

По фото сыпи это может быть любая энтеровирусная инфекция. Консультация инфекциониста вам показана, они более избирательно скажут на какую инфекцию сдать.

Здравствуйте. По описанию и фото у ребенка энтеровирусная инфекция, к которой относятся коксаки, есно полиовирусы и другие вирусы. Сыпь может разрешаться в течении 2-3недель. Поправляйтесь?
ГУЛЬНАЗ, спасибо! А где можно подхватить такое? никто не болел из детей ни в школе, ни даже в поликлинике таких случаев нет.

Спасибо за ответ. Все зависит от иммунной системы ребенка. Как правило заражение происходит от вирусоносителя и чаще всего бессимптомно. Вспышки бывают чаще у детей более младшего возраста в организованных коллективах. Не переживайте, теперь у ребенка пожизненный иммунитет?




1) Я ооочень сомневаюсь что это вирус коксаки, не похожа сыпь это раз, во вторых так не лечат Коксаки. Коксаки легкая болезнь, проходящая сама по себе.
2) Вероятно скарлатина у вас была. Необходимы анализ крови, анализ мочи, мазок из зева на флору, не исключен и инфекионный мононуклеоз + ампицилиновая сыпь.
Слишком мало данных.

В конце ноября 2019 года педиатр приехала на вызов в загородный посёлок. Родители вызвали врача, подозревая, что их четырёхлетний ребёнок повторно заболел ветряной оспой.
Жалобы
Родители отмечали у ребёнка повышение температуры до 38 °C , сыпь вокруг рта, ладонях и подошвах, мальчик жаловался на боль в стопах (отказывался наступать на ноги).
После приёма "Нурофена" отмечалось кратковременное снижение температуры, однако боль в стопах не уменьшалась.
Анамнез
Болезнь внезапно началась около суток назад с подъёма температуры и появления болей в ногах. Мальчик настойчиво показывал на подошвы, отказывался наступать на них, просил прикладывать прохладные салфетки. Ночью спал крайне беспокойно. Утром родители заметили мелкие высыпания вокруг рта, на ладонях и подошвах, напоминающие высыпания при ветряной оспе.
Около года назад ребёнок болел ветряной оспой. Тогда отмечались температура и обильная сыпь на теле, пациент был осмотрен педиатром, диагноз подтверждён.
В течение последнего месяца семья не выезжала за пределы своего посёлка. Дома все здоровы. Мальчик посещает частный детский сад. Неделю назад в группу вышел мальчик, недавно приехавший с отдыха из Турции, где легко переболел "неизвестной болезнью с сыпью", со слов его матери. Врача в отеле к нему не вызывали.
Обследование
При осмотре: обильные папуловезикулёзные элементы на подошвах, скудные подобные элементы на ладонях. Вокруг рта около 10 розовых папулёзных элементов. На слизистой нёбных дужек, языка — мелкие пузырьки, вокруг них венчик покраснения. Сыпь во рту не доставляет ребёнку дискомфорта. Пьёт и ест без затруднений.
Со стороны других органов не отмечено никаких изменений. Температура 37,2 °C . К моменту осмотра мальчик уже уверенно наступает на ноги, ходит, не плачет.
Учитывая наличие классических для энтеровирусной инфекции высыпаний на коже кистей, стоп и слизистой рта, дополнительные обследования ребёнку не понадобились.
Диагноз
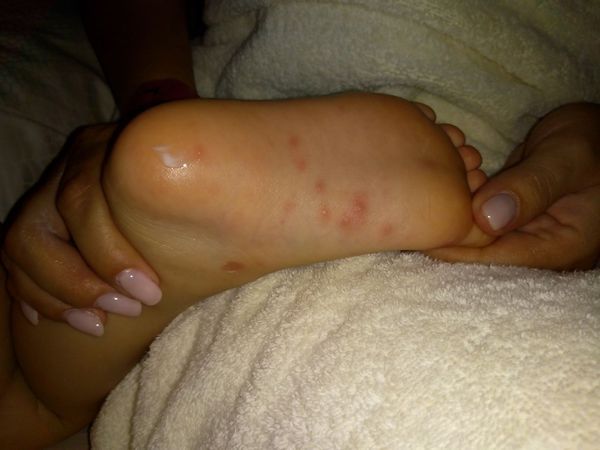
Лечение
Данное заболевание у детей не требует назначения противовирусных или антибактериальных препаратов. Мальчик получал симптоматическую терапию, направленную на облегчение симптомов:
- при жалобах на зуд и боль в месте высыпаний — смазывание элементов болтушкой "Циндол" 3-4 раза в день;
- орошение высыпаний на слизистой рта аэрозолем "Тантум верде" 3 раза в день;
- жаропонижающие средства при повышении температуры выше 38.5-39 °C .
- обильное питьё и диета с ограничением острых, кислых блюд, которые могут раздражать слизистую рта.
Прогулки разрешены, однако важно помнить, что ребёнок заразен для окружающих детей и взрослых. До полного разрешения сыпи мальчик должен быть изолирован. Купать ребёнка можно, но лучше под душем, а не в ванне.
Температура периодически повышалась в течение двух суток, свежие высыпания появлялись до третьего дня заболевания. Болевых ощущений после второго дня болезни больше не отмечалось. Полное разрешение высыпаний на коже и слизистых произошло к 12 дню от появления первых симптомов.
Через 2 недели от начала заболевания ребёнок был полностью здоров и начал вновь посещать детский сад.
Заключение
В нашем регионе случаи энтеровирусной инфекции преимущественно регистрируются с июля по сентябрь. Однако, учитывая широкие возможности для отдыха в тёплых странах в течение всего года, нельзя исключать встречу с этой инфекцией в холодное время года, как это и произошло в данном случае.
Кроме того, инфекция, вызванная вирусом Коксаки, действительно в некоторых случаях может напоминать ветряную оспу. Поэтому осмотр ребёнка педиатром крайне желателен.
Читайте также:

