Мелкоузловой цирроз печени гепатит с
Обновлено: 12.05.2024
Для цитирования: Яковлев А.Б. Дерматологические симптомы цирроза печени: значимость междисциплинарной проблемы. РМЖ. 2014;20:1471.
Печень взрослого человека весит около 1,5 кг. Она покрыта тонкой прочной соединительнотканной оболочкой – глиссоновой капсулой [1]. Большая часть печени располагается в правой стороне туловища. Печень проецируется на переднюю брюшную стенку надчревной области. Верхняя граница печени в норме начинается в 10-м межреберье справа по средней подмышечной линии. Отсюда она круто поднимается кверху и медиально. По правой сосковой линии граница печени может достигать в норме 4-го межреберья. Далее граница печени опускается влево, пересекает грудину несколько выше основания мечевидного отростка, верхняя граница печени доходит до середины расстояния между левой грудинной и левой сосковой линией.
Нижняя граница печени также начинается в 10-м межреберье справа, но идет наискосок и медиально, пересекает 9-й и 10-й реберные хрящи справа, идет по области над чревьем наискосок влево и вверх, пересекает реберную дугу на уровне 7-го левого реберного хряща и в 5-м межреберье соединяется с верхней границей [2]. Расположение нижней границы печени – одна из наиболее важных клинических характеристик ее размера. В норме она определяется ниже края реберной дуги справа, выступ должен быть не более чем 2 см.
Печень состоит из 2-х главных долей, правая доля значительно крупнее левой. Нижняя поверхность печени называется висцеральной и соприкасается с некоторыми частями ЖКТ и правой почкой. Верхняя поверхность печени гладкая, непосредственно прилежит к диафрагме. На нижней поверхности печени имеется короткая глубокая поперечная борозда – ворота печени.
Относительная массовая доля печени неодинакова в различные периоды жизни человека: у новорожденного печень занимает большую часть брюшной полости, а масса составляет 1:20 массы тела; у взрослого масса печени – 1:50 массы тела, а ее скелетотопия соответствует описанной выше [2].
Печень состоит из паренхимы, формируемой гепатоцитами, и соединительнотканной стромы. Гепатоциты – функциональные клетки печени, выполняющие не менее 500 различных функций – от накопительных (гликоген) до детоксицирующих (глюкуронид).
Гипертрофические поражения ногтей, их чрезмерное уплотнение (склеронихия), гиппократовы ногти для цирроза печени не характерны.
Классическим признаком длительно пьющего человека всегда считалась эритема лица – симптом, описанный во многих художественных произведениях. Между тем сама по себе эритема лица, или розацеа, напрямую не коррелирует с тяжестью поражения печени, а лишь выдает факт злоупотребления алкоголем. Именно под действием алкоголя происходит расширение сосудов лица, которое в дальнейшем становится стойким. Однако считается, что крайняя степень розацеа – ринофима все же определенным образом коррелирует с тяжестью поражения печени и может служить ориентировочным симптомом сформировавшегося цирроза, дающим основание для целенаправленного поиска. Такими ориентировочными симптомами являются многие из описанных кожных изменений. Считается, что ринофима представляет собой завершающую инфильтративно-продуктивную стадию развития розацеа. Процесс может локализоваться в области не только носа (ринофима), но и подбородка (гнатофима), на ушах (отофима), веках (блефарофимоз) [15]. Из 4-х видов ринофимы (гландулярная, фиброзная, фиброангиоматозная, актиническая) для цирроза печени в большей степени характерна форма, связанная с инсоляцией, – актиническая. Но могут наблюдаться все перечисленные формы ринофимы.
Крапивница является неспецифическим синдромом и в целом для цирроза не характерна. Но она может быть одним из признаков активного вирусного гепатита. В далеко зашедших случаях цирротического поражения появление крапивницы обусловлено скорее токсическими влияниями [1, 16].
Что такое цирроз печени? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Цирроз печени (ЦП) — это хроническое дегенеративное заболевание печени, связанное с диффузным патологическим процессом, при котором нормальные клетки печени повреждаются, а затем замещаются рубцовой тканью, образуя избыточный фиброз и структурно-анатомические регенераторные узлы.
Этиология
По этиологическим характеристикам можно выделить:
- распространённые формы ЦП;
- редкие формы ЦП.
К распространённым относят вирусные (В, С, D), алкогольные и метаболические формы цирроза печени.
Редкими формами ЦП являются:
- аутоиммунные, лекарственные, токсические, первичные и вторичные билиарные циррозы;
- генетически обусловленные патологии — гемохроматоз (нарушение обмена железа), болезнь Вильсона — Коновалова, дефицит белка альфа-1-антитрипсина, гликогеноз IV типа (недостаток ферментов), галактоземия, наследственная тирозинемия и непереносимость фруктозы;
- нарушение венозного оттока из печени — венокклюзионные формы ЦП (болезнь Бадда — Киари);
- тяжёлая правожелудочковая сердечная недостаточность;
- флебопортальные циррозы (типа Банти).
Пути заражения
Заразиться циррозом печени нельзя. Однако, если он вызван вирусным гепатитом, то возбудитель может передаться через кровь, при половых контактах и от матери к ребёнку.
Основную роль в возникновении и развитии вирусного ЦП играют симптомные, малосимптомные и бессимптомные формы острого вирусного гепатита В, С, а также одновременное заболевание гепатитами В и D с последующим переходом в активный хронический вирусный гепатит. У большинства больных интервал между острым гепатитом С и клинически выраженными проявлениями ЦП превышает 30 лет. Только у мужчин, употребляющих более 50 г спирта в день, выраженные формы ЦП возникают через 13-15 лет.
Наиболее частыми причинами смерти больных ЦП является:
- большая печёночная недостаточность;
- кровотечение из варикозно расширенных вен пищевода;
- первичный рак печени;
- иммунопротективная недостаточность, влекущая за собой активизацию инфекционных (микробных) процессов, в первую очередь спонтанного бактериального перитонита и пневмонии, а также возникновение оксидативного стресса.
У больных в терминальной (заключительной) фазе заболеваний печени в основном наблюдаются декомпенсированные формы цирроза печени: асцит, варикозное расширение вен пищевода и желудка, энцефалопатия и желтуха.
Особенности цирроза печени у детей
Заболевание у детей встречается крайне редко и обычно связано:
- с аутоиммунным поражением печени;
- кардиогенными заболеваниями — лёгочной гипертензией и хронической сердечной недостаточностью;
- болезнью Бадда — Киари;
- врождёнными болезнями накопления — наследственным гемохроматозом, лизосомальными болезнями накопления, болезнью Вильсона — Коновалова;
- флебопортальным циррозом (типа Банти).
Прогноз у таких детей неблагоприятный, чаще всего они погибают, так как не успевают попасть к гепатологу и выяснить диагноз. Также они обычно страдают от множества сопутствующих болезней, в том числе от основного заболевания, ставшего причиной цирроза.
Проявления заболевания у детей и взрослых схожи. Единственный эффективный метод лечения цирроза у детей — это пересадка печени. Поэтому крайне важно вовремя диагностировать заболевание и встать в очередь на пересадку печени.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы цирроза печени
Цирроз печени в течение длительного времени может протекать латентно, т. е. бессимптомно.
Клиническая картина ЦП зависит от его формы и течения, активности основного заболевания, а также наличия или отсутствия печёночно-клеточной недостаточности, синдрома портальной гипертензии, холестаза и внепечёночных проявлений.
Основные общие симптомы, которые чаще всего встречаются при ЦП:
- повышенная утомляемость;
- похудение;
- нарушения сознания и поведения;
- ухудшение аппетита и чувство дискомфорта в животе;
- пожелтение кожи, белковых оболочек глаз и слизистой;
- осветление или обесцвечивание кала;
- потемнение мочи;
- болевые ощущения в животе;
- отёки;
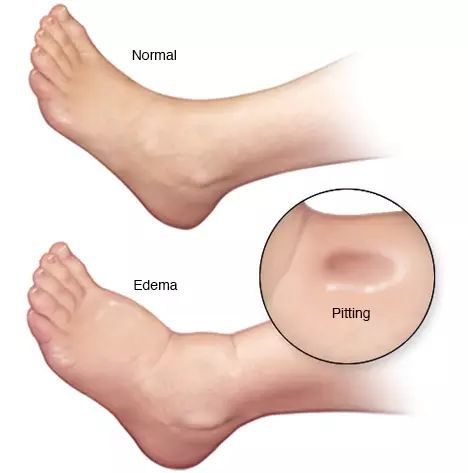
- асцит (скопление жидкости в брюшной полости);
- кровотечения из носа, желудочно-кишечного тракта, дёсен или геморроидальных узлов, а также подкожные кровоизлияния;
- часто возникающие бактериальные инфекции (например, органов дыхания);
- снижение полового влечения;
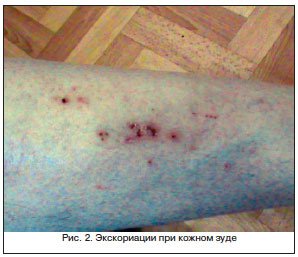
- кожный зуд.
Симптомы распространённых форм ЦП
При высокоактивном ЦП, кроме общей утомляемости, осветления стула и потемнения мочи, может возникать тупая боль в правом подреберье и вздутие живота.
Во время осмотра часто выявляют:
- субиктеричность (желтушность) склер;
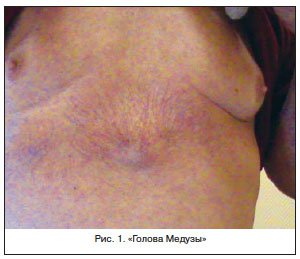
- расширение вен брюшной стенки, напоминающее голову медузы;
- венозный шум при выслушивании в эпигастральной области живота (шум Крювелье — Баумгартена);
- серо-коричневатый цвет шеи;
- гинекомастию (увеличение грудных желёз);
- гипогонадизм (у мужчин);
- контрактуру Дюпюитрена (укорочение сухожилий ладоней).
Три последних признака цирроза печени зачастую наблюдаются при алкогольных ЦП.
В области грудной клетки в 50-80% случаев наблюдаются телеангиэктазии кожи (расширения мелких сосудов), чаще при алкогольных ЦП. Пальпаторно печень отчётлива уплотнена, имеет неровный нижний край. Размеры печени различны — от значительного увеличения до уменьшения.
Часто при пальпации выявляется умеренно увеличенная селезёнка, причём её край может выступать из-под рёберной дуги на 1-3 см.
При развитии ЦП появляются симптомы белково-энергетической недостаточности, асцит, отёки, а также печёночный запах при тяжёлой печёночной недостаточности.
Симптомы при малоактивных и начальных стадиях ЦП
Данные формы ЦП зачастую протекают бессимптомно и выявляются в ходе периодических медицинских осмотров, диспансеризации, а также как случайная находка при обследовании пациента со смежной патологией или внепечёночными проявлениями.
При малоактивном ЦП, как правило, не возникают жалобы, связанные с печенью. Во время активного расспроса можно выявить весеннее снижение работоспособности, частые болезни, после которых возможны кровоточивость дёсен и потемнение мочи. Такие пациенты хуже, чем раньше, переносят длительные физические и нервно-психические нагрузки.
Желтухи и выраженного увеличения билирубина, за исключением периода интеркурентного острого гепатита, нет. Неяркая телеангиоэктазия кожи (сосудистые звёздочки) в области грудной клетки наблюдаются у 40-60% людей с ЦП.
Телеангиоэктазии кожи, плотная печень с фестончатым краем и умеренно увеличенная селезёнка — ценная клинико-диагностическая триада, которая с вероятностью 80-90% свидетельствует о ЦП или далеко зашедшем активном хроническом гепатите.
Патогенез цирроза печени
В основе патофизиологии цирроза лежит повреждение и некроз паренхимы (основной ткани) печени с деструкцией и гибелью гепатоцитов (клеток печени), а также системное поражение интерстициальной ткани.
При всех формах ЦП нарушается иммунологическое равновесие организма, преобладающими становятся аутоиммунные процессы: иммунная система человека принимает собственные клетки печени за чужеродные и повреждает их. В конечном итоге, это приводит к разрушению гепатоцитов и структуры печени в целом. Однако при этом каждая форма ЦП имеет свои патогенетические особенности:
- при вирусных гепатитах повреждающим агентом является сама вирусная частица, которая, размножаясь в клетке, разрушает её, вызывая цитолиз;
- при алкогольном ЦП прямое токсическое воздействие на мембраны гепатоцитов оказывает ацетальдегид с развитием алкогольной жировой болезни печени и алкогольного стеатогепатита;
- при метаболическом ЦП ведущую роль в патогенезе играет ожирение и сахарный диабет через стадию неалкогольного стеатогепатита с инсулинорезистентностью и последующей запрограммированной гибелью клеток печени.
В основе патогенеза более редких причин цирроза печени лежат ещё более частные механизмы развития повреждения и разрушения гепатоцитов и структуры печени:
- нарушение обмена и накопления железа при гемохроматозе;
- накопление меди при болезни Вильсона — Коновалова;
- окклюзия в системе воротной вены при гепатопортальном склерозе.
Цирроз формируется на протяжении многих лет. С течением времени происходят изменения генетического аппарата клеток печени, в результате чего появляются новые патологические клетки. Этот процесс в печени является иммуновоспалительным, он поддерживается чужеродными агентами, в роли которых могут выступать разные субстраты:
- вирус гепатита В;
- алкогольный гиалин;
- денатурированные белки;
- некоторые лекарственные средства;
- медьбелковые и железобелковые комплексы (ферритин).
В итоге повреждения паренхимы печени развивается гепатоцеллюлярная (печёночно-клеточная) недостаточность за счёт диффузного фиброза и трансформации ткани печени в анормальные узлы-регенераты. [3] [4] [5]
Классификация и стадии развития цирроза печени
В 1974 году на съезде гепатологов в Акапулько (Мексика) была принята единая морфологическая классификация, которую позже уточнили и несколько доработали эксперты ВОЗ. В настоящее время она является общепринятой.
Ключевые слова: хронический гепатит С, цирроз печени, гепатоцеллюлярная карцинома.
V.V. Makashova 1,2 , H.G. Omarova 1 , O.N. Hohlova 1 , T.N. Lukashenko 3
1 Central Research Institute of Epidemiology, Moscow
2 Clinical Hospital for the Infectious Diseases, Moscow
3 Outpatient Clinic № 5, Moscow
The article presents a clinical case of a patient with a diagnosis of liver cirrhosis of Child-Pugh class B in the outcome of chronic hepatitis C, treated with interferon and ribavirin for 18 months. In the course of antiviral therapy, RNA of the hepatitis C virus became negative after 8 weeks and remained steadily negative for 2 years. Subsequently, on the background of stress, 3 months after the end of treatment, a relapse of chronic hepatitis C appeared with moderate biochemical and virological activity. 6 months after the relapse, a liver cancer was suspected during an ultrasound examination and histological confirmation was obtained. After a few months, hemorrhage from esophageal varicose veins dilatation (EVVD) occurred in the patient, and after another 1 month, there was repeated hemorrhage from EVVD. The patient was monitored and treated in the intensive care department. Ascites, bilateral pneumonia, fever, leukocytosis appeared. The patient’s condition progressively worsened and with increasing psychomotor agitation, progressive respiratory and cardiovascular insufficiency, biological death was recorded.
There was a divergence of diagnoses, category II. The cause of the fatal outcome was purulent intoxication, as a result of ulcers perforation of the esophagus, purulent mediastinitis with pleural empyema on the left.
Актуальность
Клиническое наблюдение
Пациент Т., 1948 г. р., 22.01.2009 г. обратился в поликлинику к инфекционисту в связи с лейкопенией (до 3,2×10 9 /л), тромбоцитопенией (60–120×10 9 ). Со слов пациента, антитела к HCV впервые выявлены в 1998 г. Не обследовался, не лечился. Впервые обследовался в поликлинике ФСБ № 5 в 2009 г., выявлена РНК HCV+, 1в генотип, вирусная нагрузка — 1,3×10 6 коп/мл.
Жалобы на периодически возникающую слабость и утомляемость.
Перенесенные заболевания: 1972 г. — аппендэктомия, 1992 г. — острый вирусный гепатит А, 1995 г. — оперирован по поводу синдрома Меллори — Вейса. В это же время были гемотрансфузии. 1996 г. — грыжесечение, 1997 г. — повторное грыжесечение, 2004 г. — язвенная болезнь 12-перстной кишки, 2005 г. — правостороннее воспаление легких, хронический бронхит, 2007 г. — повторная пневмония, 2007 г. — сильное кровотечение при удалении зубов, гипертоническая болезнь, сахарный диабет 2-го типа.
Аллергоанамнез — не отягощен.
Наследственность: у отца — цирроз печени алкогольного генеза, у матери — инсульт, у брата — хронический вирусный гепатит В.
Вредные привычки: не курит, алкоголь употреблял часто, но немного (со слов), крепкие напитки (виски, коньяк).
Объективно при осмотре: сосудистые звездочки в области грудной клетки, умеренная пальмарная эритема, иктеричность склер. Печень пальпаторно и перкуторно увеличена — выступает на 4–5 см ниже реберной дуги, селезенка не пальпируется.
Рост — 173 см, вес — 80 кг.
Динамика основных показателей общего и биохимического анализов крови, данные ПЦР-диагностики представлены в таблице 1.
Заключение
Подводя итог всей истории болезни пациента Т., 63 лет, можно констатировать, что имел место ЦП, класс В по Чайлд — Пью в исходе ХГС, пролеченного препаратами интерферона и рибавирина в течение 18 мес. На фоне противовирусной терапии РНК HCV стала отрицательной через 8 нед. и оставалась стойко отрицательной на протяжении 2 лет. В последующем на фоне стресса — через 3 мес. после окончания лечения возник рецидив ХГС с умеренной биохимической и вирусологической активностью. С февраля по май 2012 г. проводилось обследование по поводу подозрения на рак печени. Было получено гистологическое подтверждение в институте им. Герцена — развитие ГЦК в 5–6 сегментах печени. В августе 2012 г., после поездки в Крым у больного возникли острый простатит, уретрит, по поводу чего получал антибактериальную терапию. В конце августа — кровотечение из ВРВП с последующим их лигированием в ГКБ № 57. Повторное кровотечение из ВРВП возникло в октябре с дальнейшей госпитализацией в ЦКВГ, где дважды повторилось, несмотря на проводимую терапию. Пациент наблюдался и лечился в реанимационном отделении. Появились асцит, двусторонняя пневмония, лихорадка, лейкоцитоз. Для исключения острого панкреатита была выполнена диагностическая лапароскопия, при которой патологии выявлено не было. Состояние больного прогрессивно ухудшалось, и при нарастающем психомоторном возбуждении, прогрессирующей дыхательной и сердечно-сосудистой недостаточности 26.10.2012 г. была зафиксирована биологическая смерть.
Имело место расхождение диагнозов, категория II.
Проанализировав историю болезни, считаем справедливым заметить, что пациент по записи в истории болезни поступил в состоянии средней тяжести. Скорее всего, тяжесть состояния была недооценена: не учитывался длительный анамнез заболевания, повторные кровотечения из ВРВП, наличие ГЦР. В госпитале не было проведено лигирование вен пищевода, и мы считаем, что больного в первые же дни после поступления необходимо было переводить в специализированное отделение для проведения этой манипуляции и, возможно, пересадки печени.
Трудно оценить адекватность терапии, т. к. в посмертном эпикризе не указано лечение.
В клиническом посмертном эпикризе даже нет упоминания о наличии ГЦР, только упомянута гемангиома 4 сегмента печени, несмотря на то, что пациент предоставил все выписки предыдущих исследований.
При патологоанатомическом вскрытии отсутствуют данные о послойном исследовании ткани печени и наличии ГЦР, а также гистологическом исследовании на наличие опухоли.
Очень важно и крайне необходимо обсуждать все эти вопросы для исключения дальнейших ошибок в ведении и лечении таких сложных пациентов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цирроз печени: причины появления, симптомы, диагностика и способы лечения.
Определение
Причины возникновения цирроза печени
Основные причины возникновения цирроза печени – вирусные гепатиты B, C, D и алкогольные поражения печени (особенно тяжело протекают сочетанные алкогольно-вирусные циррозы). Кроме того, цирроз может развиваться в результате воздействия промышленных ядов и лекарственных средств, стать исходом неалкогольной жировой болезни печени, возникать при поражении желчных протоков (первичного билиарного цирроза, муковисцидоза), при иммунных нарушениях (аутоиммунном гепатите, первичном склерозирующем холангите), быть следствием наследственных заболеваний (гемохроматоза, болезни Вильсона–Коновалова, недостаточности альфа-1антитрипсина), болезни Банти, застойной сердечной недостаточности. К циррозу могут приводить инфекционные заболевания (например, шистосомоз, сифилис, эхинококкоз).
Их гибель запускает воспалительный процесс, в условиях которого на месте погибших клеток формируется соединительная ткань, что приводит к структурной деформации печени. Из-за разрастания соединительной ткани нарушается внутрипеченочный кровоток, а в ткани печени формируются узлы, что в конечном итоге обуславливает печеночную недостаточность.
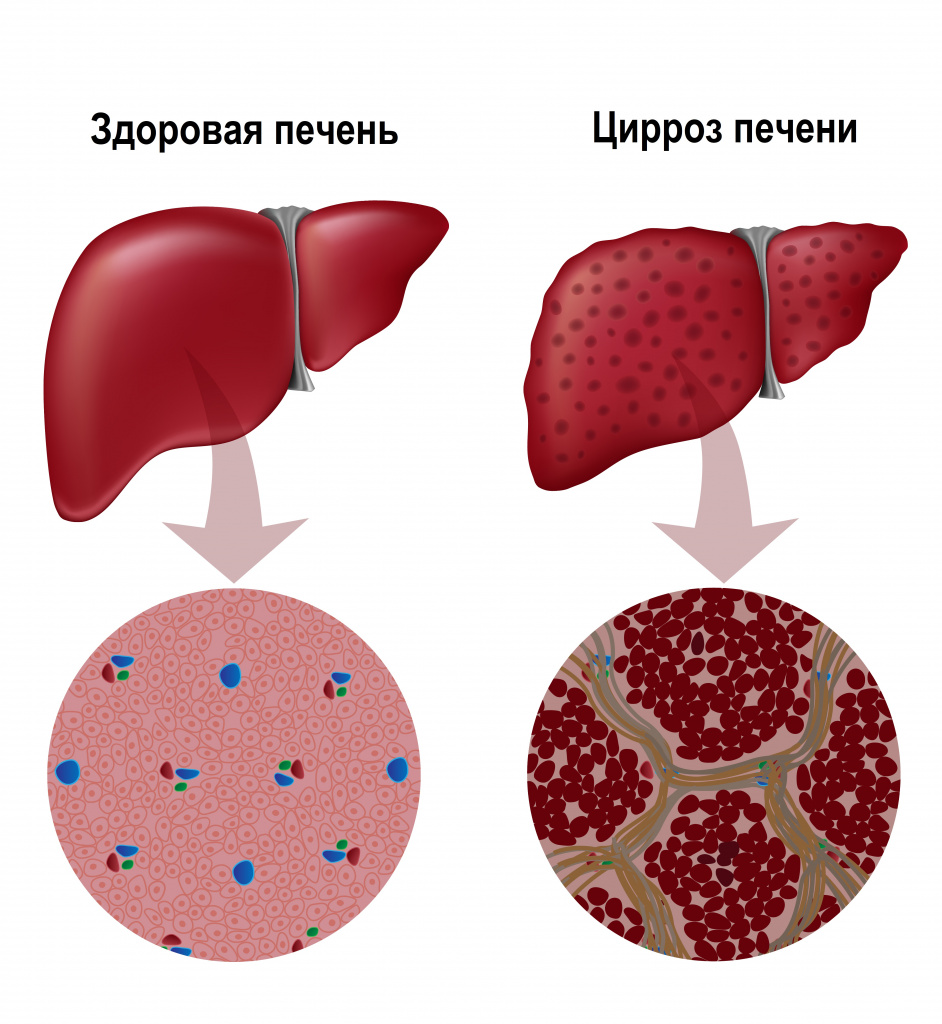
Классификация заболевания
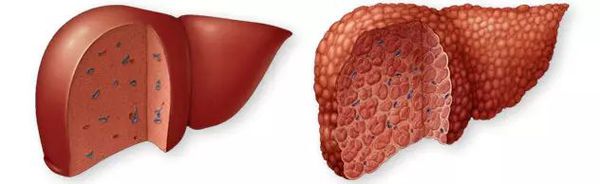
- мелкоузловой цирроз (с узлами диаметром до 3-5 мм) - развивается, например, при алкогольном поражении печени;
- крупноузловой цирроз (с узлами до 2-3 см) – развивается при вирусных гепатитах В и С.;
- смешанный цирроз.
- активный, или прогрессирующий,
- неактивный.
- компенсированный цирроз,
- субкомпенсированный цирроз,
- декомпенсированный цирроз.
- класс А (Child A) — 5–6 баллов,
- класс B (Child B) — 7–9 баллов,
- класс C (Child C) — 10–15 баллов.
Самыми специфичными симптомами при поражениях печени являются: окрашивание кожи и слизистых в желтый цвет (желтуха), портальная гипертензия, асцит, печеночная энцефалопатия.
Желтый оттенок кожи и слизистых возникает, когда в крови накапливается слишком много билирубина – пигмента, входящего в состав желчи. При циррозе желтуха связана с повреждением гепатоцитов - так называемая паренхиматозная желтуха. При такой желтухе поврежденные клетки печени не могу захватывать из крови билирубин, связывать его с глюкуроновой кислотой и выделять в желчные пути, вследствие чего в крови повышается уровень непрямого билирубина. Возможно и обратное всасывание билирубина в кровеносные сосуды из желчных протоков с повышением в крови уровня прямого билирубина. При повышении содержания желчных кислот в крови нервные окончания раздражаются, и больных беспокоит сильный зуд.
Асцит (патологическое накопление жидкости в брюшной полости) - обязательный симптом декомпенсированного цирроза.
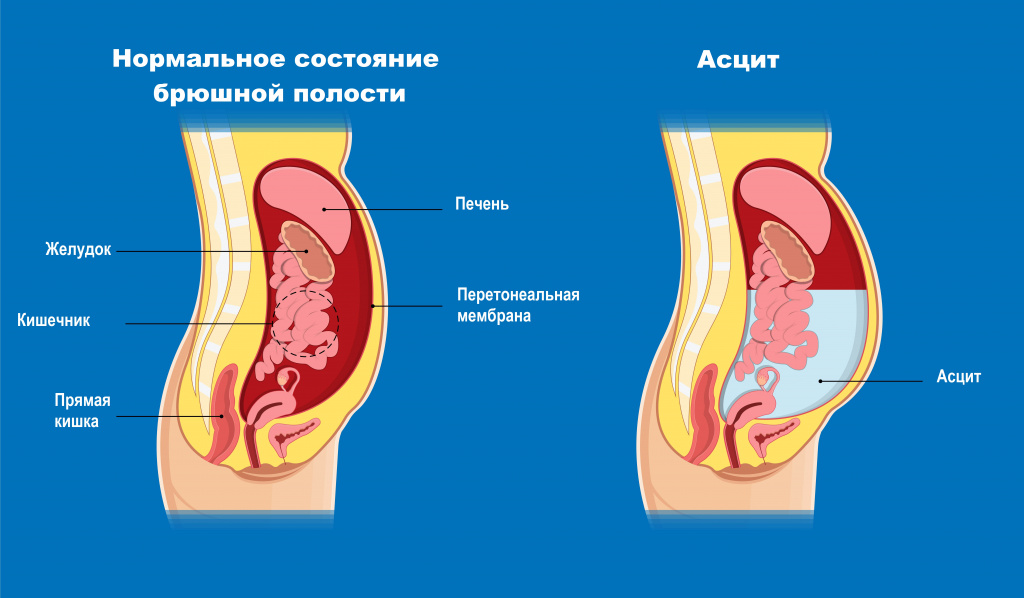
При печеночной недостаточности орган не может выполнять свою дезинтоксикационную функцию, и накапливающиеся токсины начинают оказывать неблагоприятное воздействие на мозг. Кроме того, могут формироваться функциональные или органические шунты между системами портального и общего кровообращения, что ведет к проникновению токсических продуктов кишечного происхождения в головной мозг. В результате возникают различные нервно-психические расстройства - печеночная энцефалопатия.
Развитие печеночной энцефалопатии при циррозе печени - наиболее тяжелое и прогностически неблагоприятное осложнение.
Врачи называют четыре стадии печеночной энцефалопатии:
- на 1-й стадии нарушается сон (появляется сонливость днем и бессонница ночью, кроме того, могут наблюдаться депрессия, раздражительность, эйфория, беспокойство, снижается способность к логическому мышлению, счету);
- на 2-й стадии сонливость нарастает и переходит в летаргию, наблюдается апатия, агрессия;
- на 3-й стадии присоединяется дезориентация во времени и пространстве, нарастает спутанность сознания;
- стадия 4 – кома: характеризуется отсутствием сознания и реакции на болевые раздражители.
Большинство клинических вариантов печеночной энцефалопатии потенциально обратимы – после трансплантации печени признаки энцефалопатии не рецидивируют.
Кроме того, при циррозе могут наблюдаться следующие симптомы:
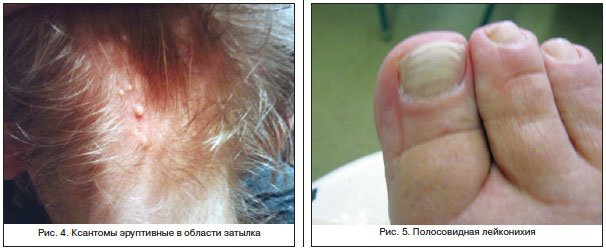
- утолщение дистальных фаланг пальцев;
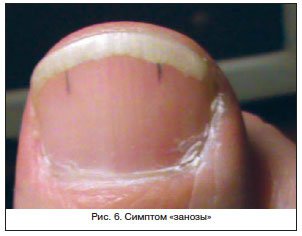
- изменение оттенка ногтевой пластины с ее помутнением;
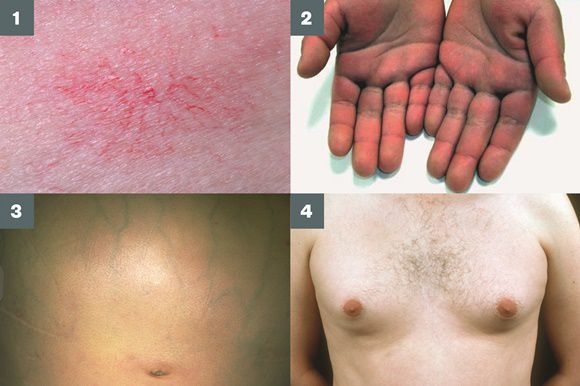
- покраснение ладонной поверхности кистей, реже - стоп;
- расширение капилляров в области лица или тела;
- увеличение размеров молочных желез у лиц мужского пола с одновременным уменьшением яичек.
Лабораторная диагностика цирроза печени может включать:
-
общий анализ крови с определением уровня тромбоцитов;
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.

Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
Литература
Т. Н. Лопаткина, кандидат медицинских наук, доцент
Читайте также:

