Модели вирусов и бактерий
Обновлено: 26.04.2024

Под катом первая часть рассказа о нашем опыте создания научно достверных моделей вирусов.
Мир молекулярных машин и вирусов предлагает массу интересных вызовов CG командам. Проблема в том, что пока не существует универсальной научной методики, которая позволила бы полностью описать строение вирусной частицы. Для того, чтобы описать устройство вируса нужно пользоваться множеством методов, которые дают представление об отдельных кусках финального паззла. Электронная микроскопия позволяет оценить размеры и очертания вирионов, рентгеноструктурный анализ способен описать отдельные белки или их фрагменты, а молекулярно-биологические и биохимические методы дают сведения о том, сколько каких молекул входит в состав вируса и как они между собой взаимодействуют. При этом создается несколько парадоксальная ситуация: многие вирусы изучены очень подробно и в деталях, но не существует изображений, которые давали бы научно достоверное и полное представление о том, как они устроены.
Например, современные электронные микрофотографии вирусных частиц гриппа выглядят так (источник).
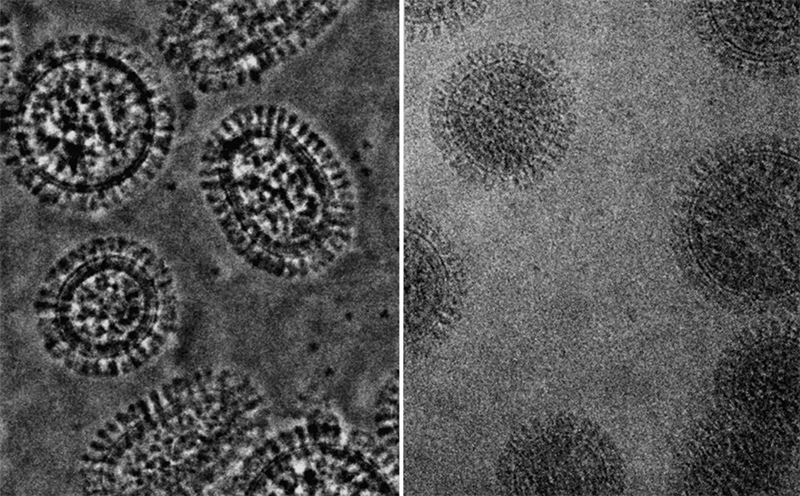
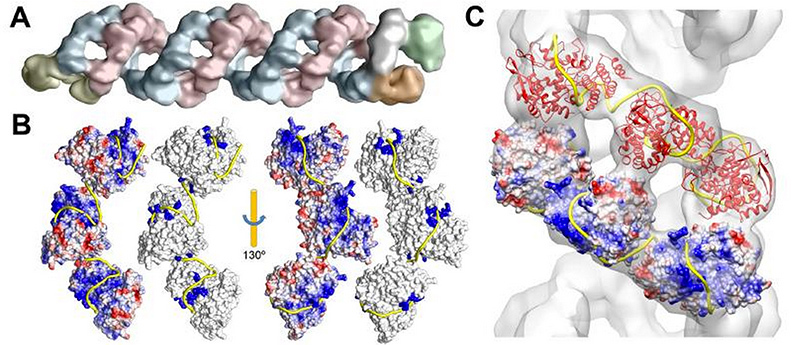
Визуализация данных криоэлектронной микроскопии геномного комплекса вируса гриппа А и реконструкция упаковки РНК (желтая лента) белками В и С. Работу с этими данными опубликовала в конце 2012 года в журнале Science группа вирусологов из Мадрида, которые помогли нам в создании модели вируса гриппа A/H1N1.
Собрать всю доступную информацию технически возможно. Но ее систематизация, обработка и перевод в 3Д модель требует командного подхода. При этом даже компетентный научный консультант не может обладать полным багажом узкоспециальных знаний по теме, поэтому к проекту важно подключить ученых, посвятивших работе с тем или иным вирусом всю свою карьеру. Моделлер без биологического образования не разберется в опубликованных научных данных и структурах белков из Protein Data Bank, а также не сможет корректно достроить модели молекул при помощи молекулярной динамики, где это необходимо (приблизительно 80-90% белков, с которыми мы сталкиваемся, имеют неполное описание пространственной струкутры на 10-90%). Ученый же, даже обладая всеми сведениями в отдельности, не может собрать и визуализировать полную модель в профессиональных пограммах для трехмерного моделирования. По нашему опыту, только тесное взаимодействие этих специалистов может дать аккуратный и информативный результат.
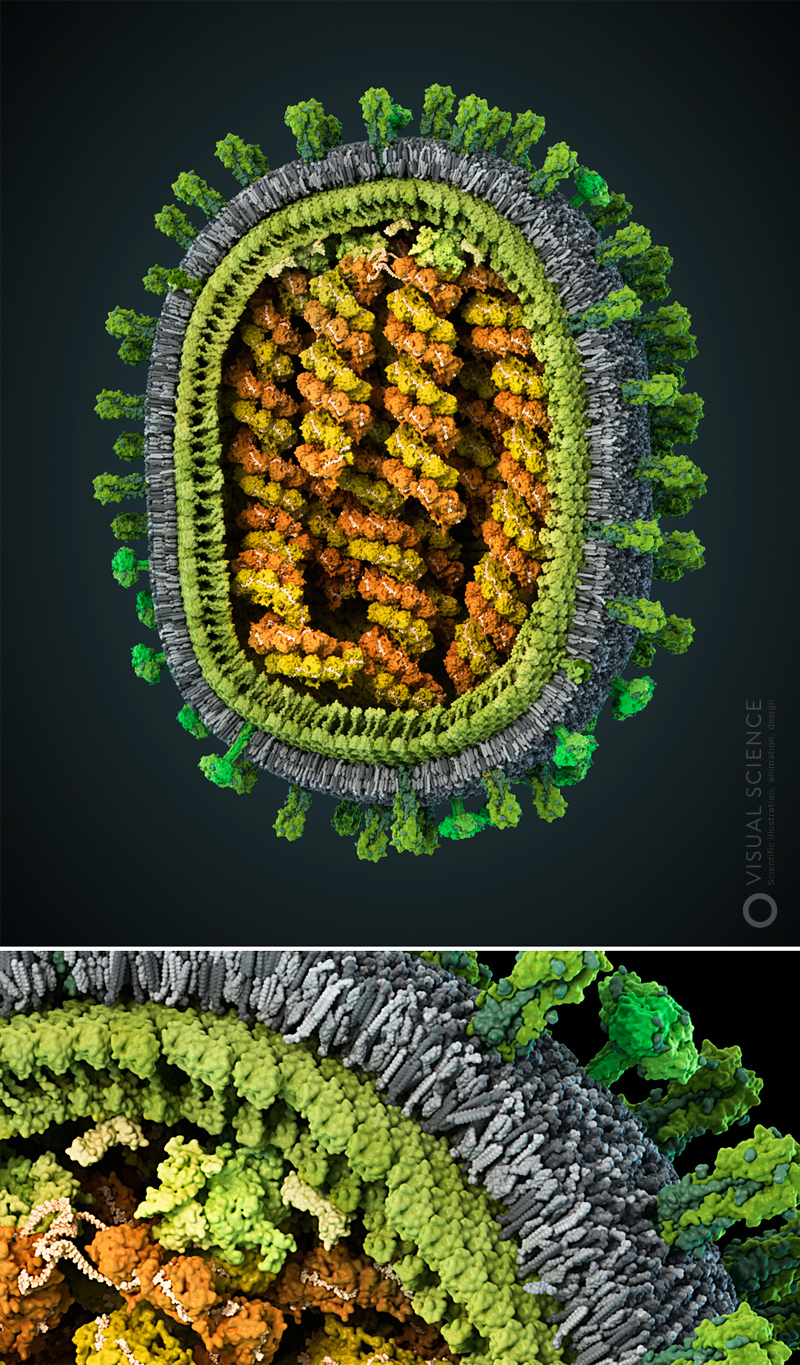
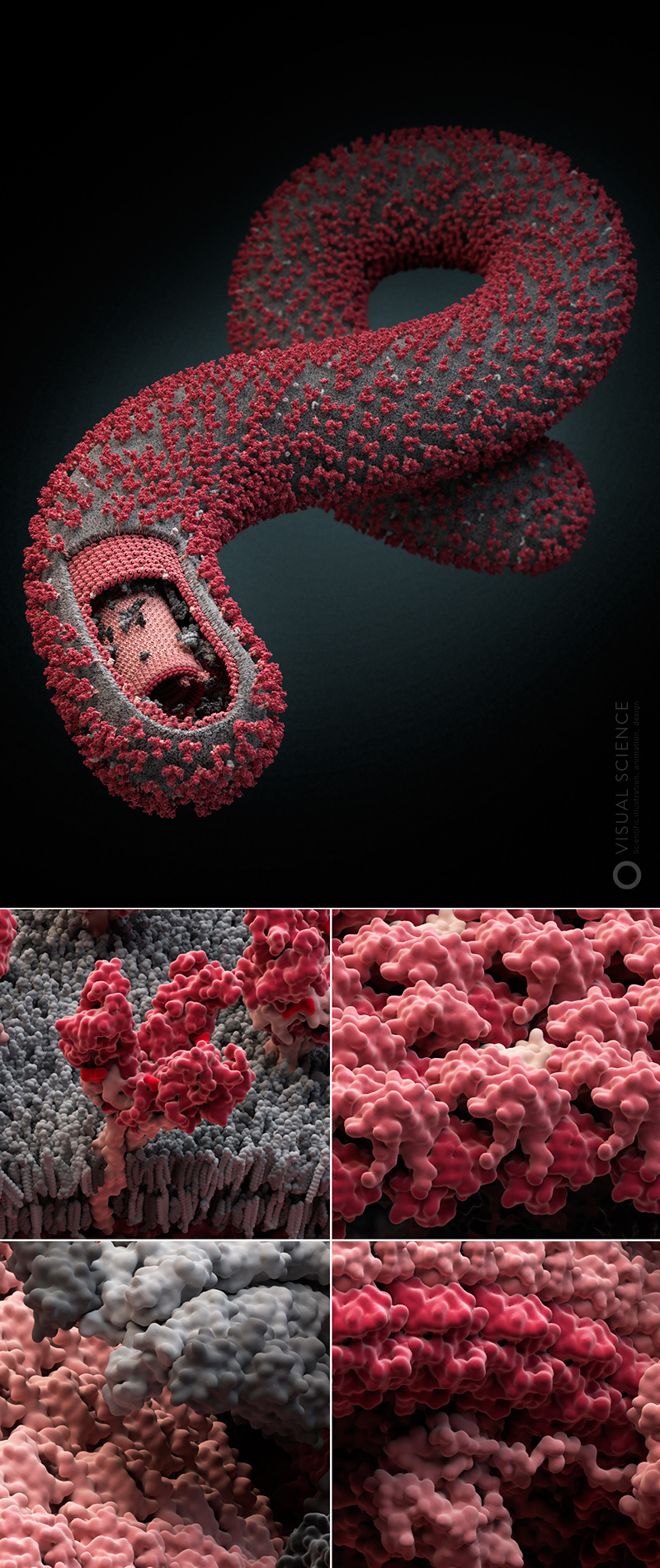
Изображение вируса гриппа с детализацией до атомов. Все белки и белковые комплексы в составе частицы, а также их количественные соотношения и положение соответствуют опубликованным в научной литературе данным (подписи всех компонентов). Модель создана при участии Хайме Мартин-Бенито и коллег (Испанский национальный центр биотехнологий, Мадрид, Испания). 2013 год.
Внутреннее устройство вируса иммунодефицита человека. Виден край мембранной оболочки, белки, присутствующие внутри вириона, капсид и фрагменты РНК вируса, в нем заключенные (подписи всех компонентов). Модель создана при участии Егора Воронина (Global HIV Vaccine Enterprise). Приз за лучшую научную иллюстрацию на конкурсе Science and Engineering Visualization Challenge в 2011 году.

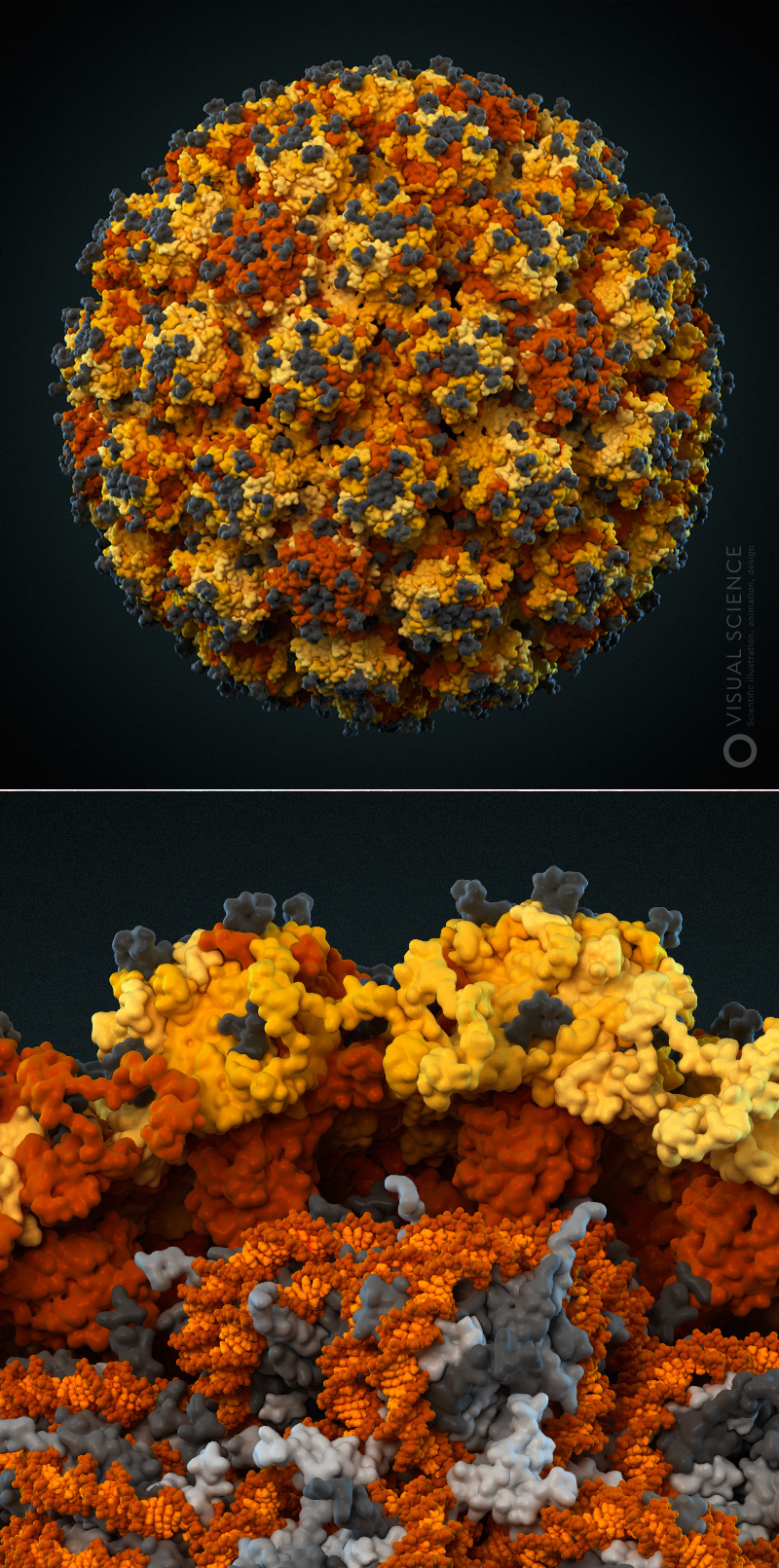
Модель предполагаемой укладки генома вируса папилломы человека. Модель создана при участии Кристофера Бака (Национальный институт рака, США). 2012 год.
Частица и отдельные белки вируса Эбола. Модель создана при участии Рональда Харти (Университет Пеннисльвании, США). Honorable mention конкурса Science and Engineering Visualization Challenge в 2010 году. Экспозиция салона Ассоциации медицинских иллюстраторов в Торонто в 2012 году.
Наша студия несколько лет назад запустила некоммерческий проект, суть которого в моделировании и визуализации наиболее распространенных и опасных вирусов человека. Мы назвали его Viral Park, или “Зоопарк вирусов”. Проект пока включает четыре вирусные модели, еще несколько находятся в разработке, а в планах сделать серию из примерно двадцати вирионов. За время работы над проектом мы успели освоить и наладить процесс, выделив в нем ряд этапов:
- Обзор литературы и систематизация обнаруженных данных
- Молекулярное моделирование и динамика
- Сборка полной модели из отдельных элементов
- 3D визуализация и дизайн
- Создание материалов на основе модели от плакатов до приложений, виджетов и пластиковых моделей.
В этом посте мы немного расскажем о первом этапе нашей работы.
Сбор информации об изучаемой теме — это задача, которую ученые решают постоянно. Невозможно сделать новый проект, не зная того, что опубликовали до тебя. Для этого надо найти и проанализировать сначала обзорные, а потом и исследовательские публикации по интересующему вопросу. Та же схема работает, когда собирается информация о строении вирусов. Благодаря базам естественнонаучных публикаций основных мировых журналов PubMed и Google Scholar этот процесс можно организовать весьма эффективно. Если нужна вводная информация о биологии вируса, можно воспользоваться сайтом Viral Zone а много данных по отдельным белкам доступно в базе данных Uniprot. Структуры белков или их фрагментов, полученные разными коллективами ученых при помощи методов ядерного магнитного резонанса и рентгеноструктурного анализа, доступны в уже упомянутом Protein Data Bank в виде координат всех атомов или, в ряде случаев, только альфа-атомов цепочки белка.
Задачей для ученого в процессе создания модели вируса являются сбор, обработка и подготовка всей информации в том виде, который будет удобен для работы остальных членов команды. Нужно составить полный список всех типов молекул, которые образуют частицу, и всех их взаимодействий. Помимо белков это могут быть липиды мембраны и молекулы вирусного генома, представленные ДНК или РНК. Дальше надо понять, в каких количествах молекулы представлены в частице, и какие места они занимают. Эта наиболее сложная для поиска и часто противоречивая и неполная информация, поскольку разные методы могут давать разные оценки. Для уточнения тех или иных вопросов мы связываемся с авторами статей, в которых они обсуждаются. Это вполне принятая практика в научном сообществе, и ученые часто с удовольствием, а иногда без идут на контакт и порой делятся своими гипотезами и даже неопубликованными данными, как это было при работе над моделью Гриппа в случае с уже упомянутыми испанскими вирусологами.
Результатом исследования литературы должна стать максимально подробная вербальная картина будущей модели. Надо понимать что, в каких количествах и каким образом упаковано в вирусной частице. Это можно свести в описание, таблицу количеств и взаимодействий и план модели в нужном масштабе.
Дальнейшие этапы работы подразумевают получение трехмерных моделей всех нужных компонентов. Одной из проблем тут является то, что не для всех белков и их комплексов могут быть доступны атомные структуры. Существенную часть вирусных белков ученым просто еще не удалось описать. В нашей работе мы используем методы структурной биоинформатики, чтобы заполнить этот пробел. Об этом мы расскажем в следующих постах. Также постараемся раскрыть детали того, как происходит сборка полной модели, ее визуализация и создание образовательных пособий и виджетов на основе полученного результата.
Мы считаем, что у такого детального подхода к моделированию молекулярно-биологических объектов большие перспективы с точки зрения его применения в образовании, популяризации науки и научной коммуникации. В пользу этого говорит и то, что такие модели получают высокие оценки на крупных международных конкурсах научной иллюстрации и дизайна, положительные отзывы известных коллег, а включить такие изображения в свои презентации бывает приятно даже Франсуазе Барре-Синусси, получившей Нобелевскую премию за открытие ВИЧ.
В продолжении темы, помимо моделирования вирусов в рамках Зоопарка вирусов, мы обсудим сферу научной и медицинской иллюстрации в целом, поговорим о том, почему это актуально, чем это отличается от набирающего популярность научного исскуства, или Science Art, и как это поможет сделать мир лучше а науку понятнее.
В нашем первом посте про трехмерное моделирование вирусов мы перечислили основные стадии процесса и рассказали о том, с чего мы начинаем и как собираем исходную информацию. В этой заметке мы расскажем о следующем этапе работы — о создании моделей отдельных молекул, из которых впоследствии будет собрана целая частица.

Компоненты вирусной частицы Гриппа A/H1N1
Вирусная частица — это молекулярный механизм, решающий две принципиальные задачи. Во-первых, частица должна обеспечить упаковку вирусного генома и его защиту от деструктивных факторов среды, пока вирус путешествует из клетки, в которой он собрался, к клетке, которую он сможет заразить. Во-вторых, частица должна быть способна присоединиться к заражаемой клетке, после чего доставить вирусный геном и сопутствующие молекулы внутрь, чтобы запустить новый цикл размножения. Задач не очень много, поэтому вирусы, за редким исключением, могут позволить себе быть довольно экономными в том, что касается структуры.
В частности, геном большинства вирусов невелик и кодирует не очень много белков, нередко это число меньше 10. При этом вирус может заставить клетку синтезировать большое количество однотипных белков, из которых потом соберется вирусная оболочка — капсид. Таким образом, вирусные частицы обычно состоят из большого числа одинаковых элементов, которые связываются друг с другом как детали конструктора, часто образуя регулярные и симметричные структуры. Так, очень многие, хоть и не все вирусные упаковки или их фрагменты имеют спиральную или икосаэдрическую форму.

Примеры вирусных капсидов с икосаэдрической симметрией. Молекула бактриородопсина в правом нижнем углу — для сравнения. (Иллюстрация из обзора).
Для сборки модели вируса принципиально важно знать, как устроены отдельные белки общей структуры и как они друг с другом связываются, эту структуру формируя. Современная наука владеет целым набором методов, которые могут дать ответы на эти вопросы, однако ни один из подходов, к сожалению, не является универсальным и решает только часть задач которые стоят перед нами при создании научно достоверных моделей вирусов с атомной детализацией.
Белки: как получают, хранят и отображают информацию об их структуре?
Напомним, что белки — это полимерные молекулы, состоящие из последоватльно связанных между собой мономеров — аминокислот. В водных растворах белки обычно сворачиваются в сложные трехмерные глобулы (почти как головоломка “Змейка Рубика”), форма которых зависит от аминокислотного состава и некоторых других факторов. Пространственное строение этих глобул определяют в основном методами рентгеноструктурного анализа и ЯМР-спектроскопии. Также в последнее время к этой задаче позволяет подойти электронная микроскопия.
В целом, методы определения пространственной структуры молекул сложны и имеют целый набор ограничений, поэтому далеко не все вирусные белки описаны полностью. Так, рентгеноструктурный анализ предполагает наличие кристалла, через который пропускается рентгеновское излучение. Атомы кристалла провоцируют дифракцию рентгеновских лучей, по картине которой можно оценить распределение электронных плотностей в кристалле, а по этим данным уже восстановить расположения конкретных атомов. Этот метод дает разрешение вплоть до чуть более 1 ангстрема (0,1 нм), однако в случае белков проблема заключается в том, что далеко не все из них можно кристаллизовать. Особенно сложным это оказывается, если белок имеет гибкие подвижные или заякоренные в мембране фрагменты.
ЯМР-спектроскопия основана на явлении ядерного магнитного резонанса и позволяет описывать строение белков в растворе. Этот подход выявляет набор возможных положений атомов в молекуле и, в отличие от предыдущего метода, дает возможность оценить степень гибкости тех или иных ее участков. Но ЯМР-спектроскопия хорошо работает только для сравнительно небольших молекул, поскольку крупные белки дают слишком много шума.
Электронная микроскопия позволяет описать строение крупных молекулярных комплексов, что бывает очень полезно, когда речь идет о вирусах. Для многих симметричных структур можно получить большой набор изображений под разными углами, проанализировав которые можно воссоздать трехмерную картину. Для отдельных объектов разрешение, получаемое в результате применения разных вариантов электронной микроскопии (до 4-5 ангстрем), оказывается не многим хуже разрешения рентгеноструктурного анализа, хотя обычно для получения полной информации приходится совмещать разные подходы и, например, “вписывать” структуры отдельных белков в карты электронных плотностей, получаемые при помощи электронной микроскопии.

Структуры тримера белка оболочки ВИЧ (красные и голубые фрагменты молекул) в комплексе с участком одного из антител к этому белку (зеленые и желтые фрагменты), вписанные в карту электронной плотности, полученную методом крио-электронной микроскопии с разрешением 9 ангстрем. Из статьи Structural Mechanism of Trimeric HIV-1 Envelope Glycoprotein Activation.
Как мы писали в прошлом посте, получаемые структуры систематизируются и хранятся в базе данных Protein Data Bank. При этом в формате *.pdb записываются координаты атомов, и существует целый набор программ, позволяющих эти данные визуализировать и работать с такими структурами. Среди них, например VMD, Chimera, PyMol и десятки других.
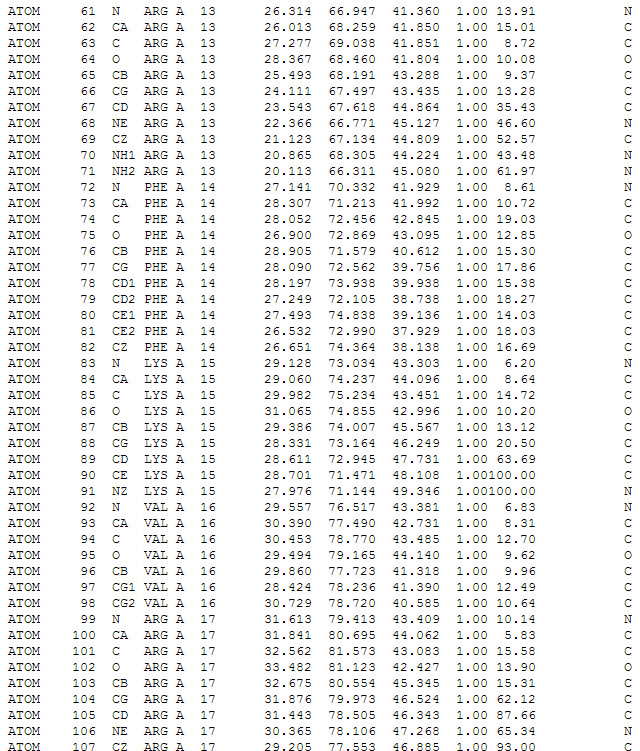
Скриншот текстового отображания файла в формате *.pdb. Описываются координаты отдельных атомов в аминокислотах белка.
Программы могут отображать белки несколькими способами. Помимо простого отображения атомов сферами разного диаметра, соответствующего ван-дер-ваальсовым радиусам атомов, существует возможность показать отдельные связи, поверхность молекулы, а также изгибы аминокислотной цепочки при помощи структур, напоминающих ленты (ribbon diagram), которые наглядно демонстрируют, где в белке аминокислоты образуют альфа-спирали, где бета-слои, а где неструктурированные участки.

Различные варианты визуализации структуры наружней части гемагглютинина вируса гриппа в программе Chimera.
В качестве отступления, надо сказать, что программы, в которых обычно работают ученые, визуализируя отдельные молекулы или белковые комплексы, чаще всего позволяют получить лишь довольно примитивные с эстетической точки зрения результаты (достаточно, например, посмотреть на несколько скриншотов из программы VMD). Принципиально более широкие возможности открываются, если импортировать модели молекул в программы, которые используют профессиональные дизайнеры и специалисты компьютерной трехмерной графики. Эти программы в сочетании с плагинами, улучшающими качество рендера, позволяют получать действительно интересные и привлекательные визуализации. Мы еще расскажем об этом в следующих постах. Пока просто приведем пример:
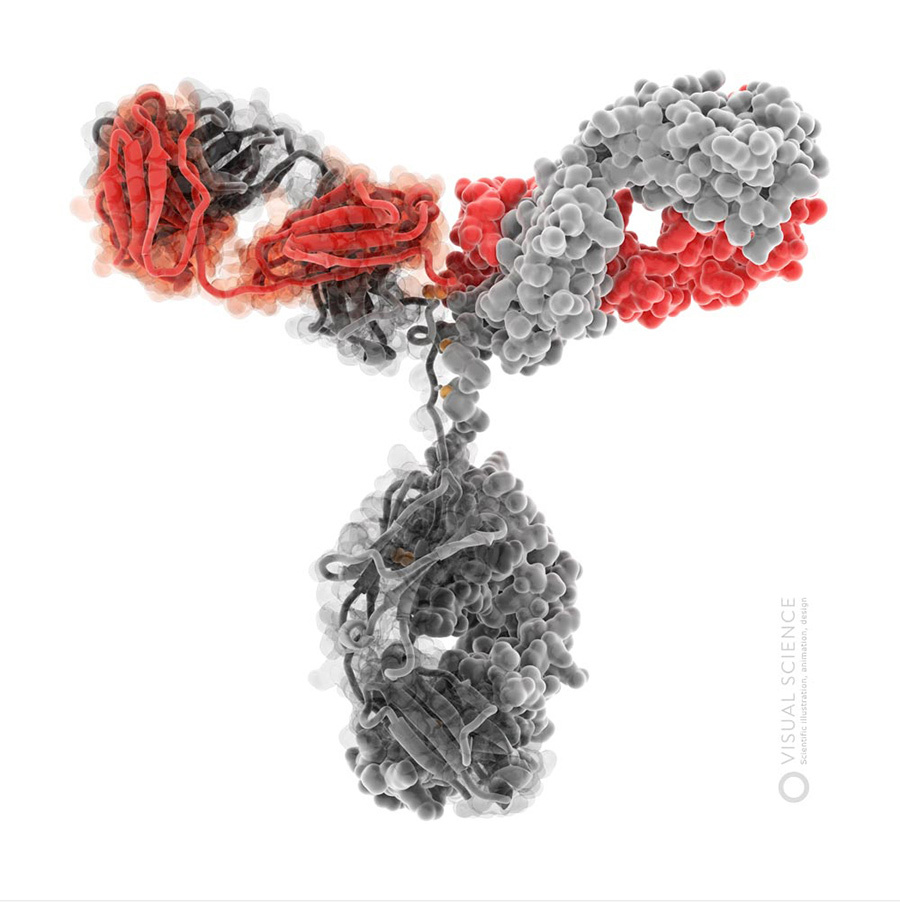

Изображения молекулы иммуноглобулина G.
Молекулярное моделирование

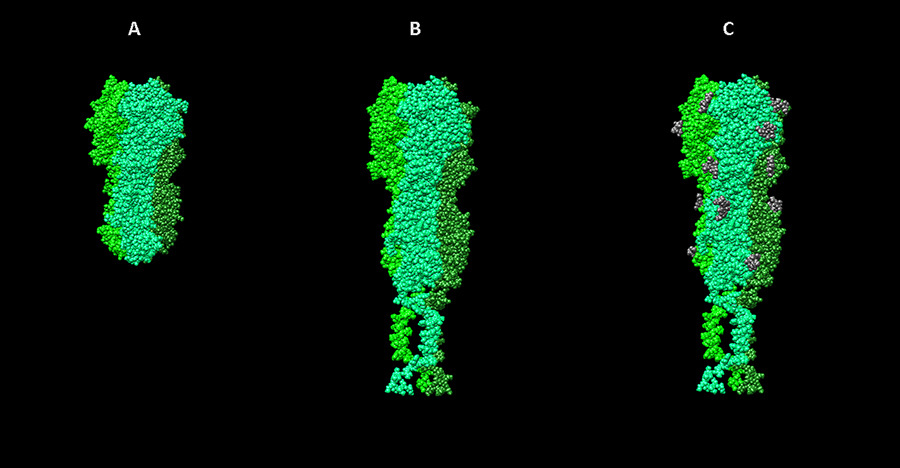
Шаблоны для моделирования нейраминидазного комплекса вируса гриппа. А — фрагмент мономера нейраминидазы N2 из структуры 2AEP в базе данных PDB, B — “стебель” гемагглютинин-нейраминидазы парагриппа (3TSI), С — трансмембранный пептид 2LAT. D — финальная полученная модель.
Окончательная модель белка обычно создается с учетом известных структур его фрагментов, найденных разными методами шаблонов, а также моделей от сервера I-Tasser. Для этого используется программа Modeller. Она позволяет строить модель по гомологии с использованием одного или нескольких шаблонов, а также вносить дополнительные модификации, например, создавать дисульфидные связи в заданных местах.
Докинг
Другим важным аспектом строения вирусов, информация о котором в научной литературе часто оказывается не полна, является взаимодействие между отдельными белками. В нашем случае от этого зависит то, какими поверхностями модели отдельных белков будут контактировать друг с другом и другими компонентами вириона в финальной модели. Информацию о взаимодействиях тоже позволяет уточнить структурная биоинформатика.
Программа докинга не моделирует естественный процесс образования комплекса, это было бы слишком медленно и ресурсоемко, а перебирает варианты взаимного положения двух или более молекул в поисках наилучшей структуры. При докинге обычно большую молекулу в комплексе называют рецептором, а меньшую — лигандом. Для определения качества структуры комплекса лиганда с рецептором используются различные оценочные функции. В идеале в качестве такой функции должна выступать свободная энергия системы, но она слишком сложно вычисляется, поэтому применяют различные эмпирические псевдопотенциалы, учитывающие потенциальную энергию (которая как раз вычисляется просто), площадь контакта лиганда и рецептора, соответствие различным правилам, которые исследователи вывели из анализа большого числа комплексов, и всякие загадочные слагаемые, не имеющие физического смысла, но улучшающие результат программы при испытании на большом количестве известных комплексов. Поиск минимума такого псевдопотенциала в современных программах обычно происходит с помощью различных вариаций метода Монте-Карло и генетических алгоритмов. В настоящее время существует множество программ молекулярного докинга (наиболее известные из них — Dock, Autodock, GOLD, Flexx, Glide), отличающиеся оценочными функциями, методами минимизации и дополнительными возможностями. При этом во время поиска молекулы рецептора и лиганда могут как оставаться неподвижными (такой тип докинга называется жестким), так и несколько менять конформацию (гибкий докинг). Очевидно, что второй вариант более ресурсоемкий, но и результаты такого поиска обычно правдоподобнее. Докинг малых молекул к белкам сейчас является стандартным этапом разработки новых лекарственных препаратов. Можно, например, провести докинги для 10 миллионов лигандов, и выбрать сотню наиболее перспективных соединений для дальнейшей экспериментальной работы — это называется виртуальный скрининг.
Помимо исследований небольших молекул, докинг может быть использован и для построения белок-белковых и белок-нуклеотидных комплексов. Для этих целей также разработано большое количество программ и онлайн-сервисов (ZDOCK, pyDOCK, HEX). Например, в ходе нашей работы над вирусом папилломы человека (ВПЧ) мы столкнулись с тем, что, несмотря на наличие полной структуры внешнего слоя капсида, образованнного белком L1, совершенно не было информации о строении белка L2, который в капсиде расположен ближе к геному, а соответственно, нет данных о том, как пентамеры L1 взаимодействуют с молекулами L2. Мы построили модель белка L2 по гомологии, используя сервер Tasser, после чего провели докинг в программе HeX. В ходе докинга роль рецептора выполнял пентамер L1. Именно на его поверхности проводился поиск оптимального места посадки L2. При этом все структуры оставались неподвижными. Т.е. использовался метод жесткого докинга. В результате была получена правдоподобная структура комплекса пентамера, собранного из L1 и минорного белка L2.
Посттрансляционные модификации
Наконец, биоинформатическими методами можно пытаться восстановить то, какие изменения в структуру вирусных белков вносит сама клетка, в которой они образуются. Большинство белков после синтеза подвергаются дополнительным химическим посттрансляционным модификациям (ПТМ), которые могут серьезно влиять на выполняемые белком функции. Среди таких модификаций фосфорилирование, убиквитинирование, гликозилирование, нитрозилирование, внесние разрывов и другие химические изменения. Многие поверхностные белки вирусов гликозилированы, причем эта модификация имеет непосредственное значение для выполнения основной функции поверхностных белков вируса — связывания с клеточными рецепторами. С другой стороны, белки вирусных матриксов — слоев, которые встречаются непосредственно под липидными оболочками некоторых вирусов, для заякоривания в мембране часто должны быть связаны, например, с миристиловой кислотой — небольшой гидрофобной молекулой, облегчающей взаимодействие белков с липидами. Таким образом, в нашей работе модификации белков тоже требуют внимания.
В настоящее время возможные ПТМ достаточно сложно предсказываются. Основные существующие методы и сервисы основаны на поиске соответствующей экспериментальной информации для сходных белков или поиске в последовательности исследуемого белка небольших участков, характерных для того или иного типа модификации.
В нашей работе при подготовке моделей мы пользуемся экспериментальной информацией, отраженной в соответствующей записи базы данных UNIPROT.
Стадии работы над моделью гемагглютинина вируса гриппа. А — визуализация структуры 3ZTJ из базы данных PDB. B — модель гемагглютинина вируса гриппа H1N1, построенная на основе гомологии с 3ZTJ с достраиванием трансмембранных участков молекулы. С — модель с учетом посттрансляционных модификаций (гликозилирования).
Молекулярная динамика и оптимизация структур
Последнее, о чем хочется упомянуть, — это то, что при подготовке новых моделей белков и, особенно, их комплексов, необходимо проводить оптимизацию структур. Наиболее простым методом оптимизации является минимизация энергии. Она используется для достаточно быстрого “спуска” системы в локальный минимум потенциальной энергии. Эту манипуляцию желательно проводить после каждой модификации структуры молекул. Она позволяет избежать таких неприятностей, как перекрывание атомов или появление неправильных длин связей. Различные методы минимизации энергии предусмотрены практически в любом программном пакете молекулярного моделирования.
Стоит отметить, что данный метод позволяет провести лишь предварительную и очень грубую оптимизацию. Для более точной подготовки пространственных структур используются методы молекулярной динамики или квантовой механики. Последние, например, используются для наилучшей оптимизации структуры небольших молекул лигандов и наиболее точных расчетов энергии межмолекулярных взаимодействий. Но, наибольшая точность, что вполне логично, связана с более ресурсоемкими вычислениями, что делает эти методы практически неподъемными в применении к большим биологическим макромолекулам.
Оценить поведение и стабильность структур достаточно массивных молекул, таких как полипептиды и нуклеиновые кислоты позволяют методы молекулярной динамики.
Метод молекулярной динамики заключается в изучении поведения атомов и молекул и их движений во времени. Расчеты молекулярной динамики позволяют, например, исследовать стабильность как отдельных молекул, так и их комплексов, позволяют оценить значимость возможных конформационных перестроек, влияние точечных мутаций и многое другое. Современные методы анализа результатов симуляций молекулярной динамики позволяют получить самые подробные сведения о поведении во времени как отдельных атомов, так и всей исследуемой системы.
В зависимости от того, насколько хорошо изучены белки того вируса, модель которого мы хотим создать, каждый раз приходится подбирать подходы для достройки и оптимизации моделей всех белков и их взаимодействий. После того, как все структуры получены, можно приступать к сборке полной модели. О том, как это делается, мы расскажем в следующих постах серии о создании научно достверных моделей вирусов человека.
PS:
Ставшая лидером в опросе прошлого поста тема Медицинская анатомическая иллюстрация — история изучения тела человека в работах иллюстраторов 5 столетий будет следующей. С потрясающими гравюрами, восковым моделями прошлого века, пластификатами трупов, атласами выдающся исследователей, 3Д реконструкциями на основе послойных срезов замороженного смертника, интерактивными приложениями и работами современных медицинских иллюстраторов. Скоро.

Проект- групповая работа обучающихся 9 класса , организованная на школьном уровне. Практико-ориентированный, средней продолжительности по теме " Вирусы и бактерии. Геометрическая форма строения. Размножение." представлен в виде презентации, практического приложения к проекту и документа проекта.
| Вложение | Размер |
|---|---|
| проектная разработка по теме"Вирусы, бактерии. Геометрические формы. Размножение. | 782.8 КБ |
| Презентация к проекту"Вирусы, бактерии. Геоиетрические формы. Размножение. | 2.42 МБ |
| Практическая часть к пректу "Вирусы, бактерии. Геоиетрические формы. Размножение. | 24.08 КБ |
| Мониторинг работы над проектом "Вирусы, бактерии. Геоиетрические формы. Размножение. | 35 КБ |
Предварительный просмотр:
учитель биологии Чернышева Е. А.
и учитель математики Макарова О. А.
Эту тему мы выбрали, потому что вирусы занимают важное место в жизни человека, и как правило, оказывают отрицательное влияние на человека.
изучить многообразие форм видов вирусов и бактерий; сравнить их формы с геометрическими фигурами , исследовать процесс размножения вирусов и их влияние на деятельность человека. Человек может предотвратить вредное воздействие микроорганизмов на человека и окружающий животный мир.
Объект исследования: вирусы и бактерии
Виды вирусов и бактерий, геометрические формы вирусов и бактерий, скорость размножения,
Каждый вирус имеет форму многогранников, бактерии-форму поверхностей вращения, скорость размножения вирусов очень велика, но вирусы могут оказывать различное влияние на человека.
Разнообразие жизни на земле с трудом поддается описанию. Полагают, что сейчас на нашей планете обитает свыше миллиона видов животных, 0,5 млн. видов растений, до 10 млн. микроорганизмов, причем эти цифры занижены.
Примитивные организмы быстро размножаются. Размножение организмов идёт в прогрессии. Многие из них опасны для человека.
В нашем мире существует большая группа живых существ, не имеющих клеточного строения. Эти существа носят названия вирусов представляют неклеточные формы жизни.
По этому признаку всё живое в настоящее время делится на две части:
-клеточные (бактерии, грибы, зелёные растения, животные и человек)
Первооткрыватель вирусов Д. И. Ивановский.
Русский физиолог растений и микробиолог, основоположник вирусологии .
С помощью электронного микроскопа ему удалось увидеть мельчайшие вирусы и оценить многообразие их форм.
Каждый вирус обладает формой многогранника.
Вирусы (лат. яд ) – мельчайшие возбудители многочисленных инфекционных заболеваний человека, животных, растений.
Величина вирусов очень мала. Величина вирусов варьирует от 20 до 300 нм (1 нм = 10-9 м).
Вирусы нельзя отнести ни к животным, ни к растениям. Они исключительно малы, поэтому могут быть изучены только с помощью электронного микроскопа.
Формы вирусов и бактерий в системе часто обозначают не звучными латинскими буквами, а сочетаниями букв и цифр.
Многие ученые борются с опасными, смертельными вирусами с того времени, как только они были обнаружены.
С нашей точки зрения, борьба с вирусами будет всегда, пока ученые не найдут средство, которое уничтожит эти опасные для жизни человека организмы имеющие неклеточную форму строения.
Бороться с этими организмами очень тяжело, так как, они имеют свойство изменять состав своего строения при попадании в благоприятные условия.
Практически все вирусы по своим размерам мельче, чем бактерии. Вирусы как и бактерии являются паразитами .То есть размножаются только в живых клетках.
Поэтому отличительными чертами вирусов по сравнению с другими микроскопическими возбудителями инфекций служат не размеры или обязательный паразитизм, а особенности строения и уникальные механизмы репликации т. е. (воспроизведения самих себя).
Вирусы вызывают грипп, полиомиелит, ящур, оспу, СПИД, герпес и многие другие
По форме клеток они могут быть:
C- или O-образными
Форма вирусов определяет такие способности бактерий, как прикрепление к поверхности, подвижность, поглощение питательных веществ.
Вирусы, патогенные для животных, отличаются кубический симметрией
и представляют собой многогранники (тетраэдр, октаэдр, икосаэдр).
Октаэдр- одна из форм организации вирусов
Октаэдр имеет 8 треугольных граней, 12 рёбер, 6 вершин, в каждой его вершине сходится 4 ребра.
Икосаэдр – это правильный многогранник выпуклой формы, который состоит из 12 вершин и 30 рёбер, основой которых являются 20 правильных треугольников - граней
ПРИ ИКОСАЭДРИЧЕСКОМ ТИПЕ СИММЕТРИИ, показанной на схеме строения аденовируса, образуется изометрический белковый чехол, состоящий из 20 правильных треугольников.
Классифицируют четыре типа вирусов: спиральный, икосаэдрический, продолговатый и комплексный.
Примером спирального вируса может служить вирус табачной мозаики.
В СЛУЧАЕ СПИРАЛЬНОЙ СИММЕТРИИ, показанной на схеме строения вируса табачной мозаики, формируется спираль вокруг полой трубчатой сердцевины.
Большинство вирусов животных имеют икосаэдрическую или почти шарообразную форму с икосаэдрической симметрией. Правильный икосаэдр является оптимальной формой Многие вирусы, такие как ротавирус, имеют икосаэдрическую симметрию.
Мы часто видим схематическое изображения разноцветных вирусов с ножками и рожками. Глядя же в микроскоп, созерцаем совсем иное зрелище: в природе бактерии все прозрачны и почти бесцветны.
Английский скульптор Люк Джеррем и группа стеклодувов сделали небольшую коллекцию экспонатов различных вирусов. Получилось очень вдохновенно и изящно.
От них исходит некое величие, ХОЛОДНОЕ величие, как от Снежной Королевы, прекрасной, но в то же время безжалостной .
По законам математики для построения наиболее экономичным способом замкнутой оболочки из одинаковых элементов нужно сложить из них икосаэдр, который мы наблюдаем у вирусов.
Вирусы, мельчайшие из организмов, настолько простые, что до сих пор неясно — относить их к живой или неживой природе, — эти самые вирусы справились с геометрической проблемой, потребовавшей у людей более двух тысячелетий!
как думали раньше.
Бактерии- древняя группа клеточных прокариотов
Антонии ван Левенгук –
голландский естествоиспытатель 17 века,
- впервые создал совершенную лупу-микроскоп, увеличивающую предметы в 160-270 раз
По форме бактерии делят на кокки – бактерии шаровидной формы, Бациллы- бактерии цилиндрической формы, вибрионы- бактерии формы тора, спириллы – бактерии в виде спирали.
Бактерии так же вызывают различные : Нагноение ран, желудочно –кишечные инфекции , заболевание нервной системы Менингит и т. д.заболевания
По подсчетам В.И. Вернадского,
для захвата поверхности Земли бактериям понадобился бы срок: 1,5 дня
Рассмотрим задачи о размножении бактерий
Применение в решении задач.
Колония состояла из n бактерий. В неё попал вирус, который в первую минуту уничтожил одну бактерию, а затем разделился на два новых вируса. Одновременно каждая из оставшихся бактерий тоже разделилась на две новые. В следующую минуту возникшие два вируса уничтожили две бактерии, и затем оба вируса и все выжившие бактерии снова разделились, и так далее. Будет эта колония жить бесконечно долго или вымрет?
Колония вымрет через n поколений.
Предположим, что все бактерии исходной колонии были разных цветов, и все потомки бактерии какого-то цвета - того же цвета. Тогда вирус на первой минуте уничтожил, например, красную бактерию, вирусов стало 2, бактерий - 2(n-1), из них по 2 разных цветов.
На второй минуте вирус уничтожил синих бактерий, все удвоилось, но на каждом шагу вирусов столько, сколько бактерий одного цвета.
Т. о. , на каждой минуте становится на 1 цвет меньше, а всего цветов n, значит, столько минут колония и проживет.
Работая над материалам проекта, мы выяснили, что вирусы и бактерии их свойства тесно взаимосвязаны с геометрическими фигурами.
Закончив проект, мы можем сказать, что достигли своей цели, так как рассказали Вам немного о вирусах и бактериях, о их формах о вреде и пользе, о скорости размножения и профилактике заболеваний.
Работа над проектом показала, что интересно изучать вирусы бактерии и всё то, что невидимо простым глазом.
1. Богданова Т.Л.. Биология. Задания и упражнения. Пособие для поступающих в ВУЗы. - М.,1991;
2. Голубев Д.Б., Солоухин В.З. Размышления и споры о вирусах. - М.: Молодая гвардия, 1989;
3. Майер В., Кенда М. Невидимый мир вирусов. - М.: Мир, 1981;
4. Черкес Ф.К., Богоявленская Л.Б., Бельская Н.А. Микробиология. - М.: Медицина, 1987.
Предварительный просмотр:
Подписи к слайдам:
Цель исследования: изучить многообразие форм вирусов; бактерий. сравнить их формы с геометрическими фигурами , исследовать процесс размножения вирусов и бактерий .
Гипотеза: Каждый вирус имеют форму многогранников, бактерии- форму поверхностей вращения скорость размножения вирусов и бактерий очень велика,
На Земле насчитывается свыше миллиона видов животных, 0,5 млн. видов растений до 10 млн. микроорганизмов
- доклеточные (вирусы) клеточные (бактерии, грибы, зелёные растения, животные и человек)
Русский физиолог растений и микробиолог основоположник вирусологии Открыл вирусы и изучил их на примере вируса табачной мозаики. Д.И.Ивановский
Вирусы (лат. яд ) – мельчайшие возбудители многочисленных инфекционных заболеваний человека, животных, растений. Величина вирусов от 20 до 300 нм (1 нм = 10 м)
Вирусы - внутриклеточные паразиты Вызывают грипп, полиомиелит, ящур, оспу, СПИД, герпес и многие другие Часть вирусов паразитируют на бактериях, уничтожая их. Такие вирусы называются бактериофагами, (пожирающие бактерии) и используются при лечении заболеваний таких как салманеллёз , герпес, ветряная оспа
По форме клеток они могут быть: звездчатыми тетраэдрическими кубическими C- или O-образными
Тетраэдр Форма вирусов - многогранник Тетраэдр Октаэдр Икосаэдр
Четыре типа вирусов: спиральный, икосаэдрический , продолговатый И комплексный
Примером спирального вируса может служить вирус табачной мозаики, изученный Д.И.Ивановским
Вирус аттипичной пневмонии
Вирус паппиломы человека
Свиной грипп (вируса гриппа H1N1)
Бактерии- древняя группа клеточных прокариотов Первооткрыватель мира бактерий Антонии ван Левенгук – голландский естествоиспытатель 17 века, впервые создал совершенную лупу-микроскоп, увеличивающую предметы в 160-270 раз
Бактерии так же вызывают различные : Нагноение ран, желудочно –кишечные инфекции , заболевание нервной системы Менингит и другие заболевания По подсчетам В.И. Вернадского, для захвата поверхности Земли бактериям понадобился бы срок : 1,5 дня
Применение в решении задач Известно, что бактерии размножаются делением: одна бактерия делится на 2, каждая из них так же делится на 2 и т. д. ( скорость геометрической прогрессии). Результат такого деления называют поколением.
Задача Бактерия попала в живой организм. К концу 20-ой минуты она делится на 2, каждая из них к концу следующей 20-ой минуты так же делится на 2 и т.д. Найдите число бактерий к концу суток.
Решение В сутках 1440 минут. Каждые 20 минут появляется новое поколение. За сутки появится 72 поколения. По формуле суммы геометрической прогрессии, где В 1 =1, q=2 , n=72 , находим , что S 72 =869 645 213 695 бактерий в сутки от одной бактерии
Решите задачу. Колония состояла из n бактерий. В неё попал вирус, который в первую минуту уничтожил одну бактерию, а затем разделился на два новых вируса . Одновременно каждая из оставшихся бактерий тоже разделилась на две новые. В следующую минуту возникшие два вируса уничтожили две бактер ии , и затем оба вируса и все выжившие бактерии снова разделились, и так далее. Будет эта колония жить бесконечно долго или вымрет?
ОТВЕТ Колония вымрет через n поколений.
Выводы: Вирусы не имеют клеточного строения, а бактерии клеточные организмы Вирусы и некоторые бактерии - паразиты т. е. живут за счёт других организмов Формы вирусов и бактерий тесно связаны с геометрическими фигурами. Вирусы и бактерии размножаются со скоростью геометрической прогрессии
Спасибо за внимание
Предварительный просмотр:
Приложение математики к микробиологии
Бактерии (расположение в пространстве)
Вирусы (их геометрическая форма)
- Вычислить объем бактерии, имеющей форму шара (на примере сине-зеленой водоросли), если ее диаметр равен 2 мкм.
- Масса одной микробной клетки определяется в 0,00000000157 доли мг, масса же вирусной частички меньше микробной клетки в 1500 раз. Определите массу вирусной клетки.
- Микробы, располагающиеся в пространстве до уборки помещения площадью , 2000000 на , после уборки 100000 на . Сколько всего находилось в помещении микробов до уборки и после? На сколько процентов помещение стало чище?
- Анализ крои показал, что в крови находится 7 тысяч лейкоцитов полулунной формы, 5 миллионов эритроцитов круглой формы и 1000 ромбовидных тел вируса (гепатита В). Определите зараженность крови, зная ее средний объем (6 л).
- В 1 кг почвы содержится 2500 редуцеитов. Сколько редуцеитов будет содержаться в 5 кг почвы?
- На поверхности кожи площадью находится 5000 разнообразных вирусов и микробов. Вычислите сколько вирусов и микробов находится на кожи?
- В воздуха содержится 7500 различных микроорганизмов. В каком объеме воздуха будет содержаться 7500000 микроорганизмов?
Предварительный просмотр:
Этапы работы над проектом
1.Классификация проекта, формулировка проблемы, определение темы.
Проект – групповой (группа обучающихся 9А класса), на школьном уровне, информационный, практико-ориентированный, средней продолжительности (1,5 месяца).
Проблема : знакомство обучающихся 9-10 классов с видами вирусов и бактерий, их геометрической формой строения и размножением .
2. Цели и задачи проекта.
Цель : Воспитание исследовательской активности, инициативы, навыков самостоятельной работы, приобщение обучающихся к творческой деятельности. Изучить многообразие форм видов вирусов и бактерий; сравнить их формы с геометрическими телами, исследовать процесс размножения вирусов и их влияние на деятельность человека.
Задачи : Обучение умению анализировать и систематизировать материал, осуществлять его поиск, делать выводы.
3. Поиск и сбор информации.
Использование различных методов получения информации (литература, СМИ, Интернет)
4. Анализ, обсуждение результатов, коррекция
5. Интерпретация и оформление проекта.
8. Практическая значимость проекта
Приобретение навыков самостоятельной исследовательской работы, приобщение обучающихся к творческой деятельности, приобретение навыков работы в группе. Обнаружение межпредметных связей в процессе работы над различными разделами проекта.

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.
Читайте также:

