Может ли герпес вызывать полинейропатию
Обновлено: 25.04.2024
Проблема диагностики и лечения лицевых болей на сегодняшний является одной из самых распространенных во всем мире. Это связано с оказанием неадекватной медицинской помощи при наличии данной патологии [1—3, 7, 11]. Одной из причин возникновения лицевых болей является нейропатия, которая представляет собой диффузный дистрофический процесс в оболочках периферических нервных волокон, морфологически проявляющийся в виде вакуольной дистрофии или баллонирующей дегенерации.
В формировании иммунитета против вируса герпеса играют роль факторы как клеточного, так и гуморального иммунитета. У лиц с ослабленным иммунитетом латентная инфекция переходит в манифестную, а манифестные формы протекают значительно тяжелее. Таким образом, заболеваемость, течение болезни и персистенция вируса в большей степени зависят от особенностей возбудителя и активности иммунной системы человека. Состояние иммунной системы обусловлено многими факторами: генетическими, экологическими, социально-экономическими, гигиеническими и др. [8—10]. Симптоматически нейропатия тройничного нерва проявляется в виде постоянной ноющей боли различной степени интенсивности, усиливающейся в ночное время. Также может иметь место нарушение чувствительности в зоне иннервации пораженного нерва в виде гипестезии или анестезии.
По данным различных авторов выделяют 2 группы нейропатий.
I. Нейропатии центрального генеза. Они подразделяются на:
- Инфекционные: герпесвирусная инфекция, цитомегаловирус, вирус ветряной оспы, вирус Эпштейн — Барр.
- Опухоли или опухолеподобные процессы головного мозга.
- Сосудистые — изменения в сосудах головного мозга.
II. Периферические нейропатии:
- Травматические — переломы челюстей, иногда проведение проводниковых анестезий.
- Токсические — острый остеомиелит челюстей, вирусная инфекция.
- Выведение пломбировочного материала за верхушку корня зуба, раздражающее действие антисептиков.
Диагностика нейропатии тройничного нерва герпесвирусной этиологии вызывает затруднения. Поэтому врач должен тщательно собрать анамнез, в ходе которого необходимо выяснить, были ли герпетические высыпания на слизистых, с чем пациент связывает появление боли (стрессовые факторы, переохлаждение, переутомление). Уточняется характер болей: постоянная, ноющая, иррадиирует в проекции ветвей тройничного нерва, усиливается в ночное время. Наиболее подвержены постгерпетической нейропатии люди пожилого возраста и с иммунодефицитом, на что также следует обращать внимание при диагностике. При визуальном осмотре можно обнаружить места рубцевания на коже. Также необходимо проверить болевую чувствительность в зонах иннервации всех ветвей тройничного нерва (гипестезия или анестезия) [22]. Одним из методов лабораторной диагностики нейропатиигерпесвирусной этиологии является иммуноферментный анализ, который определяет антигены с помощью антител, меченных ферментом. Чувствительность метода составляет 70—80 %.
На сегодняшний день существует несколько способов лечения нейропатии тройничного нерва герпесвирусной этиологии. Для общего лечения используют прегабалин, габапентин. Американская академия неврологии рекомендует также применять трициклические антидепрессанты (амитриптилин) и опиоиды [13]. В сочетании с общим лечением рекомендуется использовать местную терапию: стимуляция периферических нервных волокон в зоне поражения, аппликации 8%-ного капсаицина и лидокаина, подкожное введение ботулотоксина А [13—19]. Авторами доказано, что дополнительное использование местных процедур уменьшает выраженность болевого синдрома и повышает качество жизни пациента. Также особое внимание уделяется профилактике развития постгерпетической нейропатии. Изучается эффект применения противовирусных препаратов при острой герпетической инфекции (ацикловир, фамцикловир) и развитие в последующем постгерпетической нейропатии. Однако авторы не обнаружили существенной разницы в снижении риска развития постгерпетической нейропатии в группах применения ацикловира, фамцикловира и контрольной группе [20]. Было проведено когортное исследование для изучения эффективности противогерпетической вакцины, которое показало, что вакцинация против вируса простого герпеса ведет к снижению заболеваемости постгерпетической нейропатией [21]. Отсутствие согласованности в действиях врачей смежных специальностей приводит к затруднениям при диагностике и лечении нейропатии герпесвирусной этиологии, а также к формированию в последующем стойких рецидивов с выраженными функциональными нарушениями и болевыми приступами.
Литература
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Городской клинический онкологический диспансер, Санкт-Петербург, Россия, 197044
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Поражение тройничного нерва при герпетической инфекции в оториноларингологии
Журнал: Вестник оториноларингологии. 2016;81(4): 19‑21
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Нейротропизм герпетической инфекции обусловливает разнообразный спектр ее клинических проявлений. Цель - исследование особенностей поражения тройничного нерва при герпетической инфекции. Проведено обследование и этиопатогенетическое лечение 36 больных с невропатией тройничного нерва, обусловленной ВПГ 1-го типа, и 21 больного с невропатией тройничного нерва, обусловленной Herpes zoster oticus. Помимо традиционных клинических методов использованы вирусологическая диагностика для верификации герпетической инфекции и электронейрография. Выздоровление отмечено у 23 больных 1-й группы и у 11 - 2-й группы.
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Городской клинический онкологический диспансер, Санкт-Петербург, Россия, 197044
Кафедра оториноларингологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, Санкт-Петербург, Россия, 197022
Герпетическая инфекция (ГИ) является одной из актуальных медицинских проблем 1. На территории России и стран СНГ различными формами герпетической инфекции ежегодно страдают 20 млн человек [1]. В Санкт-Петербурге регистрируется 23 000-25 000 случаев поражений нервной системы при герпетической инфекции ежегодно [1]. Нейротропизм Г.И. обусловливает разнообразный спектр ее клинических проявлений [1, 4-6]. Например, только при Herpes zoster oticus (ушной герпес) выделяют 12 клинических форм. Возможность поражения герпес-вирусами черепно-мозговых нервов и последующего периневрального распространения приводит к тяжелым функциональным, органическим и косметическим расстройствам. После инфицирования низковирулентные штаммы вируса простого герпеса (ВПГ) в организме человека переходят в латентное состояние и находятся в стадии провируса в чувствительных ганглиях ЦНС: тройничном, пояснично-крестцовом, крестцовом [1, 7-9].
В большинстве случаев распространение ВПГ начинается из самого крупного ганглия - гассерова узла, который расположен между листками твердой мозговой оболочки в одноименной выемке передней грани пирамиды височной кости. Общность строения сенсорных ганглиев, анатомические предпосылки, развитая сосудистая сеть и множественные коллатерали нервных волокон позволяют предполагать возможность распространения ВПГ с поражением вестибулярного, спирального, тройничного и коленчатого ганглиев [4-6, 10].
Цель - исследование особенностей поражения тройничного нерва при герпетической инфекции.
Среди проходивших обследование и лечение в клинике оториноларингологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова за период с 2010 по 2015 г. поражение тройничного нерва было выявлено у 21 больного с Herpes zoster oticus и у 36 - с невралгией тройничного нерва, вызванной ВПГ 1-го типа. Всем пациентам проводились неврологическое обследование и лабораторная вирусологическая диагностика для верификации ВПГ 1-го и вируса герпеса человека (ВГЧ) 3-го типов. В исследование были включены пациенты с высоким (более 1:800) титром специфических IgG. Также проводилось исследование на авидность (определение высокоспециализированных и низкоспециализированных антител). У всех в последующем подтвердилась либо первичная герпетическая инфекция (положительная полимеразная цепная реакция (ПЦР) крови и слюны при показателе авидности <30%), либо рецидив хронической герпетической инфекции (положительная ПЦР крови и слюны при авидности >40%).
Из 36 пациентов с невралгией тройничного нерва (23 женщины и 13 мужчин в возрасте от 21 года до 68 лет) большинство пациентов обращались в начальной стадии заболевания в связи с выраженным болевым синдромом и с подозрением на острый синусит, острый отит. 26 больных связывали появление головных болей с перенесенным ОРВИ или переохлаждением. У 12 больных в этот период имелись признаки Herpes labialis, у 6 - Herpes nasalis. Как известно, при раздражении тройничного нерва возникают интенсивные приступообразные боли в лице. По своей локализации боли совпадают обычно с проекцией одной из трех ветвей нерва. Из 32 больных у 30 пациентов болевой синдром соответствовал поражению n. ophtalmicus и n. maxillaris, у 6 - n. mandibullaris.
Из 21 больного с Herpes zoster oticus было 11 женщин и 10 мужчин в возрасте от 32 до 70 лет. 11 пациентов обратились в течение первой недели от момента заболевания, остальные спустя 7-8 дней, когда появлялись первые симптомы неврита лицевого нерва. 13 больных связывали развитие заболевания с переохлаждением, 8 - со стрессовой ситуацией. Как правило, заболевание начиналось с появления везикулярных высыпаний на ушной раковине, головных болей, недомогания, в последующем появлялись симптомы поражения лицевого, тройничного и слухового нервов. Все пациенты обследовались в острой стадии заболевания и наблюдались до стойкой стабилизации состояния.
Больным проводилось исследование тригеминофациального рефлекса. Как известно, лицевой нерв, являясь преимущественно двигательным нервом, обеспечивающим мимические движения, имеет тесные связи с чувствительными центрами тройничного нерва. Это взаимодействие получило название тригеминофациального рефлекса (ТФР). Впервые, используя методику электронейрографии, данный рефлекс зарегистрировал E. Kugelberg в 1952 г., описав его как рефлекс мигания при раздражении нижнеглазничной ветви тройничного нерва (регистрация осуществлялась с круговой мышцы глаза). Позднее исследования были проведены и для других мимических мышц при электростимуляции ветвей тройничного нерва. В отличии от прямого ответа круговой мышцы глаза, регистрируемого при стимуляции лицевого нерва, ТФР является рефлекторным ответом и состоит из двух компонентов: раннего (R1) и позднего (R2).

Таблица 1. Параметры ТФР в контрольной группе, М±m

Таблица 2. Параметры ТФР у больных с невропатиями тройничного нерва герпетической этиологии, М±m
При сравнении параметров ТФР больных с невропатиями тройничного нерва с показателями в контрольной группе выявлено статистически достоверное увеличение значений латентного периода R1-ответа и ипсилатерального R2 (р<0,001) по сравнению с контрольной группой, что свидетельствует о нарушении проведения возбуждения по системе тройничного нерва. Таким образом, исследование ТФР при поражениях тройничного нерва позволяет выявлять нарушения нервной проводимости.
При лечении герпетических невропатий тройничного нерва была использована следующая схема комплексной терапии:
1. Ацикловир в течение 3 нед по 800 мг 4 раза в сутки или валтрекс по 500 мг 2 раза в день в течение 7 дней.
3. Ибупрофен по 200 мг 4 раза в день или карбамазепин 200 мг 2 раза в день.
4. Мильгамма по 2 мл внутримышечно ежедневно в течение 10 дней, затем мильгамма композитум - внутрь по 1 драже 3 раза в день в течение 6 нед.
Все больные с Herpes zoster oticus получали пролонгированный курс лечения ацикловиром. Пациенты с герпетической невропатией тройничного нерва, обусловленной ВПГ 1-го типа, получали недельный курс валтрекса (валацикловира) гидрохлорида. В организме человека валацикловир быстро и полностью превращается в ацикловир под воздействием валацикловиргидролазы. Ацикловир in vitro обладает специфической ингибирующей активностью в отношении вирусов Herpes simplex типа 1 и 2, Varicella zoster и Эпштейна-Бар, цитомегаловируса и вируса герпеса человека типа 6. У пациентов с сохраненным иммунитетом вирусы Herpes simplex и Varicella zoster с пониженной чувствительностью к валацикловиру встречаются крайне редко. Для лечения заболеваний, вызванных вирусом Herpes simplex, взрослым назначали валтрекс по 500 мг 2 раза в сутки в течение 7 дней.
Основная сложность лечения больных с герпетическими невропатиями тройничного нерва обусловлена недостаточной эффективностью применения обычных анальгетических средств (производные метамизола, ибупрофена), что нередко является показанием к применению препаратов иных групп, в частности - карбамазепина, габапентина или амитриптилина. Для купирования болевого синдрома при невропатиях тройничного нерва, обусловленных ВПГ 1-го типа, в основном назначался нурофен (ибупрофен) по 200 мг 4 раза в день. При невропатиях тройничного нерва, обусловленных Herpes zoster oticus, как правило, назначался карбамазепин. Карбамазепин на протяжении последних нескольких десятилетий остается наиболее эффективным и доступным лекарственным средством при лечении больных с невралгией тройничного нерва. При этом максимальная эффективность карбамазепина (в качестве средства монотерапии) проявляется в начальном периоде заболевания. Основным показанием к назначению карбамазепина является приступообразно возникающая боль, охватывающая область иннервации тройничного нерва. Суточная доза карбамазепина при тригеминальной невропатии обычно составляет 200 мг 2 раза в день. Дозу препарата можно увеличивать до 800 мг в сутки и в последующем переходить на поддерживающие дозы по 200 мг 2 раза в день по мере регресса невропатии. Лечение больных с поражением тройничного нерва включало также применение высоких доз витаминов группы В в форме поликомпонентных препаратов мильгамма и мильгамма композитум.
Результаты лечения больных с невропатией тройничного нерва, обусловленного ВПГ 1-го типа, оказались достаточно оптимистичными: из 36 больных у 23 пациентов на фоне противогерпетической терапии и приема ибупрофена болевой синдром претерпел обратное развитие в течение первых 10 дней. У 8 пациентов явления невропатии сохранялись в течение 11-17 дней, болевой синдром был купирован при переходе на лечение карбамазепином. У 5 больных лечение оказалось малоэффективным.
Из 21 больного с невропатиями тройничного нерва, обусловленными Herpes zoster oticus, полностью купировать болевой синдром удалось только у 11 пациентов, у 6 удалось достичь значительного улучшения, у 4 пациентов существенной динамики от проводимого лечения не было отмечено (пациенты были выписаны с рекомендацией продолжить прием карбамазепина).
Таким образом, несмотря на успехи в лечении герпетических поражений современными противогерпетическими препаратами, проблема постзостерной невропатии тройничного нерва остается актуальной, что, вероятнее всего, связано с демиелинизирующими процессами, которые происходят при Herpes zoster oticus как в стволе тройничного нерва, так и в гассеровом узле.
Для цитирования: Камчатнов П.Р., Евзельман М.А., Чугунов А.В. Постгерпетическая тригеминальная невралгия – возможности предупреждения и лечения. РМЖ. 2014;6:454.
В основе заболевания лежит реактивация вируса Varicella zoster, способного на протяжении длительного периода времени персистировать в ганглиях заднего рога. Соответственно, в отношении тройничного нерва областью их нахождения является гассеров узел. В случае возникновения определенных условий, благоприятных для активации вируса, развивается заболевание. Считается, что факторами риска для его реактивации являются пожилой возраст или, наоборот, инфицирование в детском возрасте (до 18 мес.), состояние иммуносупрессии различного происхождения (приобретенный иммунодефицит, онкологические заболевания, иммуносупрессивная терапия), внутриутробный контакт с вирусом ветряной оспы. Заболевание реализуется в условиях снижения клеточного иммунитета, обусловленного различными причинами.
Вирус герпеса может передаваться от человека к человеку, в частности, в тех случаях, когда индивидуум не переносил ветряной оспы или не был своевременно вакцинирован по поводу данной инфекции. Заболевание не склонно к рецидивированию. Считается, что рецидивы наблюдаются примерно у 6% пациентов, причем период от первого эпизода до рецидива может составлять несколько десятилетий [5]. Клинический опыт свидетельствует о том, что рецидив может быть обусловлен возникшим у пациента заболеванием, наличие которого негативным образом сказывается на состоянии и характере иммунного ответа.
Клинические проявления
Развитию заболевания предшествует продромальный период, который характеризуется лихорадкой, тошнотой, диффузной головной болью, которые, нарастая, могут наблюдаться на протяжении нескольких суток. Характерным является нарастание локальных болей, которые имеют характер нейропатических, а также неприятный жгучий, колющий оттенок зуда, способных сопровождаться аллодинией, гиперестезией и гиперпатией. Как правило, такого рода боли локализованы в области последующих высыпаний и ограничиваются зоной одного или нескольких соответствующих дерматомов. В подавляющем большинстве случаев указанные проявления носят односторонний характер, хотя у отдельных пациентов они могут распространяться и на противоположную половину туловища [8]. Боль может носить исключительно интенсивный характер, что нередко симулирует ряд соматических заболеваний, в частности плеврит, острый инфаркт миокарда, почечную колику. Поражение гассерова узла может вызвать трудности при проведении дифференциальной диагностики со стоматологическими заболеваниями, поражением придаточных пазух носа.
На фоне указанных симптомов появляются гиперемия и множественные макулопапулярные высыпания, которые впоследствии приобретают характер везикулярных. Пузырьки заполнены прозрачным бесцветным серозным содержимым. В случаях благоприятного течения заболевания высыпания могут быль локализованы только в отдельной части дерматома. Появление новых высыпаний возможно на протяжении 5–7 дней. Через несколько суток от момента появления первых высыпаний содержимое их становится мутным (так называемая стадия пустуляции). В последующем, при отсутствии осложнений, на месте имевшихся высыпаний образуются сухие корочки, которые отпадают через 2–3 нед. В этих зонах могут оставаться рубцовые изменения или зоны измененной пигментации. Заболевание, как правило, имеет благоприятный прогноз, характеризуется монофазным течением и в незначительной степени обладает тенденцией к рецидивированию.
Диагностика может быть затруднена до появления характерных высыпаний. После их возникновения правильная постановка диагноза обычно не вызывает трудностей. Подтверждение диагноза возможно при проведении полимеразной цепной реакции, позволяющей выявить ДКН вируса Varicella zoster в содержимом имеющихся высыпаний.
Осложнения
Среди возможных осложнений следует отметить локальные инфекционные поражения, обусловленные инфицированием поврежденных кожных покровов стрептококком или стафилококком, вплоть до развития целлюлита. При вовлечении в патологический процесс офтальмической ветви тройничного нерва возможно развитие кератита, способного привести к тяжелым последствиям в виде поражения роговицы, вплоть до монокулярной слепоты. Редко встречаются поражения герпетической инфекцией ткани головного мозга (с развитием энцефалита) или его оболочек с возникновением серозного менингита.
Одним из наиболее частых и достаточно тяжелых осложнений ганглионита гассерова узла, обусловленного герпетической инфекцией, является постгерпетическая невралгия. Патогенез указанного состояния достаточно сложен и включает в себя по меньшей мере два основных механизма [5]. Во-первых, в его развитии принимает участие повышение возбудимости первичных афферентов вследствие поражения периферических нейронов. В результате этого возникают избыточная возбудимость ноцицепторов и, как следствие, формирование центральной сенситизации. Клинически такая совокупность патофизиологических процессов проявляется возникновением боли и развитием аллодинии. Во-вторых, вследствие дегенерации ноцицептивных нейронов возникает деафферентация вышерасположенных сенсорных систем, обусловливающая их гиперактивность. В результате этого наблюдается формирование боли, которая, однако, не сопровождается аллодинией. По мнению авторов, у одного пациента возможно сочетание обоих механизмов, с чем связано своеобразие болевого синдрома и различий в эффективности проводимой терапии.
Данное патологическое состояние характеризуется всеми типичными для нейропатического болевого синдрома клиническими характеристиками. Установление диагноза возможно в том случае, если боль сохраняется на протяжении не менее 30 сут после наступления полного заживления имеющихся высыпаний.
Факторами риска развития постгерпетической тригеминальной невралгии являются возраст старше 60 лет, женский пол, наличие продромального периода, множественность высыпаний, а также высокая интенсивность болевого синдрома в дебюте заболевания [6]. По мнению авторов исследования, болевой синдром умеренной интенсивности, не сопровождающийся развитием в последующем постгерпетической невралгии, наблюдается у более молодых пациентов и, вероятно, связан с обширным локальным повреждением тканей и воспалительным процессом при наличии множественных высыпаний. Следует подчеркнуть значимость возрастного фактора как важного предиктора развития болевого синдрома – у пациентов, перенесших опоясывающий герпес в возрасте старше 90 лет, постгерпетическая невралгия возникает примерно в половине случаев [5]. Неблагоприятным прогностическим фактором развития болевого синдрома является выявление вируса Varicella zoster в крови.
Как и в отношении подавляющего большинства хронических нейропатических болевых синдромов, исключительно важную роль в развитии постгерпетической невралгии играет совокупность психосоциальных факторов. Наличие предшествующих депрессивных и тревожных расстройств, недостаточная социальная адаптированность пациента, нарушение социальных связей, проживание вне семьи и др. могут повышать вероятность развития болевого синдрома.
Течение постгерпетической невралгии может быть различным. У части пациентов наблюдается значительный регресс или полное исчезновение имеющегося болевого синдрома за период времени около полугода. К сожалению, возможно менее доброкачественное течение, когда болевой синдром приобретает хронический характер и приводит к инвалидизации пациента и резкому снижению качества его жизни [10]. Риск возникновения тяжелого болевого синдрома нарастает с возрастом, так, более чем у 5% пожилых больных интенсивный болевой синдром сохраняется более 12 мес. [5]. Особенности течения заболевания могут быть связаны с различиями патогенеза болевого синдрома, направленностью и интенсивностью компенсаторных реакций организма, а также с эффективностью и адекватностью проводимой терапии, в частности, ее своевременным началом.
Достаточно часто наряду с развитием постгерпетической невралгии у пациентов наблюдаются двигательные нарушения в виде периферических парезов черепных нервов (наиболее часто – лицевого нерва) [1]. Данная форма герпетической инфекции известна в качестве синдрома Рамсея Ханта. Не получено убедительных данных о прогностической значимости моторных нарушений в отношении частоты и длительности болевого синдрома.
Лечение
Вероятно, несоблюдение указанного правила привело к тому, что результаты систематизированного обзора, посвященного изучению результатов противовирусной терапии, не смогли подтвердить ее эффективность в отношении предупреждения развития невралгии через 4 и 6 мес. после появления высыпаний [7]. Эти данные свидетельствуют о необходимости правильного выбора пациентов для достижения желаемого эффекта и своевременного начала лечения.
Для достижения терапевтического эффекта в виде уменьшения риска развития постгерпетической невралгии необходимо применение валацикловира (Вирдел) в суточной дозе 1000 мг 3 раза на протяжении 7 сут. Возможно использование и местных лекарственных форм противовирусных препаратов, но достижение терапевтического эффекта возможно только при их системном введении в адекватных суточных дозировках и достаточном сроке лечения. Препарат Вирдел хорошо переносится, возможно его одновременное применение с другими лекарственными средствами.
В качестве средства, потенцирующего лечебные эффекты валацикловира, предлагается одновременное назначение глюкокортикоидов. Имеются данные о том, что комбинированная терапия способна снизить интенсивность болевого синдрома в острой стадии заболевания [12]. Менее убедительны сведения о способности глюкокортикоидов уменьшить риск формирования постгерпетической невралгии. Авторы проведенных в этом направлении исследований указывают на то, что использование глюкокортикоидов ассоциировано с повышенным риском развития нежелательных побочных эффектов, в частности, обострения язвенной болезни желудка, гипергликемии, присоединения локального инфекционного процесса, причем частота такого рода осложнений повышается с возрастом. Несомненно, что проведение комбинированной терапии требует всестороннего учета возможного положительного ее эффекта и связанного с лечением риска побочных реакций, обусловленного состоянием конкретного пациента.
В том случае, если у больного имеется стойкая постгерпетическая невралгия, наблюдающаяся в отдаленном периоде после заживления высыпаний, лечение больного требует других подходов. В данной ситуации могут быть использованы представители трициклических антидепрессантов (амитриптилин, нортриптилин), которые обладают достаточно высокой эффективностью. Вместе с тем, несмотря на хороший противоболевой эффект, широкое применение этих препаратов ограничивается частым возникновением нежелательных побочных реакций, в особенности при их назначении в высоких дозировках. Достижение противоболевого эффекта при снижении риска побочных эффектов возможно за счет назначения антидепрессантов, обладающих способностью ингибировать обратный захват как серотонина, так и норадреналина. Следует отметить, что противоболевой эффект антидепрессантов при постгерпетической невралгии, как и при других нейропатических болевых синдромах, не связан только с их антидепрессивным эффектом.
Для лечения пациентов с постгерпетической невралгией традиционной широко применяются противоэпилептические препараты, в частности карбамазепин. В настоящее время распространение получили новые лекарственные средства, фармакологические эффекты которых реализуются вследствие взаимодействия с рецепторами гамма-аминомасляной кислоты – основного тормозного медиатора в центральной нервной системе (габапентин, прегабалин). Отмечается их лучшая переносимость по сравнению с противоэпилептическими препаратами предыдущих поколений. В ряде стран при постгерпетической невралгии используются слабые или даже сильные опиоиды.
Интерес представляет возможность применения локальных форм лекарственных препаратов. Так, показано, что местное использование препаратов лидокаина может быть целесообразным при наличии болевого синдрома, сопровождающегося аллодинией. Имеются также сведения о возможной эффективности капсаицина у пациентов с постгерпетической невралгией. Следует отметить, что его широкое применение ограничивается не всегда удовлетворительной переносимостью терапии.
Таким образом, имеющиеся сведения об эффективности использования валацикловира (Вирдел) у пациентов с опоясывающим герпесом позволяют рекомендовать его широкое применение у данного контингента больных. Своевременное начало лечения, правильный отбор больных для назначения препарата способны повысить эффективность проводимой терапии, профилактировать развитие постгерпетической невралгии.
Для цитирования: Курушина О.В., Барулин А.Е. Полинейропатии при соматических заболеваниях: роль невролога в диагностике и лечении. РМЖ. Медицинское обозрение. 2013;21(36):1843.
Полинейропатии, или множественные поражения периферических нервов, являются широко распространенными заболеваниями. Высокая подверженность дистальных участков нервов различным патологическим факторам легко объяснима особенностями строения нервных клеток. Питание и остальные метаболические процессы в отростках периферических нервов осуществляются за счет аксоплазматического тока веществ из тела клетки посредством специальной транспортной системы. А так как длина отростков во много тысяч раз превышает размеры самого тела нейрона, то концевые участки нервов являются чрезвычайно уязвимой зоной. При этом основными патогенетическими процессами чаще всего являются аксонопатия или демиелинизация нервных волокон.
Литература
1. Баранцевич Е.Р., Мельникова Е.В., Скоромец А.А. Патогенетические аспекты неврологических расстройств при сахарном диабете // Ученые записки СПбГМУ им. И.П. Павлова. 1998. Т. 5. № 2. С. 26.
2. Бойко А.Н., Батышева Т.Т., Костенко Е.В., Пивоварчик Е.М., Ганжула П.А., Исмаилов А.М., Лисинкер Л.Н., Хозова А.А., Отческая О.В., Камчатнов П.Р. Нейродикловит: возможность применения у пациентов с болью в спине // Фарматека. 2010. № 7. С. 63–68.
3. Батуева Е.А., Кайгородова Н.Б., Каракулова Ю.В. Влияние нейротрофической терапии не нейропатическую боль и психовегетативный статус больных диабетической нейропатией // Российский журнал боли. 2011. № 2. С. 46.
4. Воробьева О.В. Полинейропатии. Возможности альфа-липоевой кислоты в терапии полинейропатий, ассоциированных с соматическими заболеваниями // Здоровье Украины. 2007. № 6/1. С. 52–53.
5. Курушина О.В., Рыбак В.А., Барулин А.Е., Саранов А.А. Психофизиологические аспекты формирования хронических болевых синдромов // Вестник Волгоградского государственного медицинского университета. 2010. № 02. С. 52–54.
6. Левин О.С. Полинейропатии. М.: МИА, 2005. 496 с.
7. Морозова О.Г. Полинейропатии в соматической практике // Внутренняя медицина. 2007. № 4 (4). С. 37–39.
8. Вгownlee М. Biochemistry and molecular cell biology of diabetic complication // Nature. 2007. Vol. 414 (6865). Р. 613–820.
9. Granados-Soto V., Sanchez-Ramirez G., La-Torre M.R. et al. Effect of diclofenac on the antiallodinic activity of vitamin B12 in a neuropathic pain model in the rat // Proc West Pharmacol Soc. 2004. Vol. 47. P. 92–94.
10. Zambelis T., Karandreas N., Tzavellas E. et al. Large and small fiber neuropathy in chronic alcohol–dependent subject // J Periph Nerv Sys. 2005. Vol. 10. P. 375–338.
Хроническая воспалительная демиелинизирующая полинейропатия (ХВДП) – это болезнь периферических нервов, которая имеет аутоиммунную природу. Специалисты говорят о группе заболеваний, объединенных общим названием, получившим официальное признание только в 80-х годах 20 века. Хроническая воспалительная демиелинизирующая полинейропатия возникает в любых возрастных группах, но максимальная заболеваемость встречается у взрослых, чаще у мужчин среднего возраста. Статистика показывает, что у пациентов старше 50 лет заболевание имеет более тяжелые формы, которые хуже реагируют на лечение. Частота у взрослых – 2 случая на 100 тыс. населения, у детей – 1 на такое же количество.
- Первичная консультация - 4000
- Повторная консультация - 2500
Почему возникает воспалительная демиелинизация?
Причины возникновения ХВДП до сих пор изучаются, многое остается неясным. У более трети взрослых пациентов ХВДП развивается вслед за вирусной инфекцией. У детей прослеживается связь с респираторными инфекциями и возрастными вакцинациями. В группе риска также беременные в третьем триместре. Однако у половины пациентов никакой явной причины найти не удается.
Исследователи считают, что демиелинизирующее воспаление запускается при помощи Т-лимфоцитов, которые начинают разрушение периферического миелина путем выработки антител. При этом на любом участке нерва может возникнуть воспалительный инфильтрат и отек, это касается так же спинномозговых корешков. Поэтому иногда правомочно говорить о полинейрорадикулопатии.
Проявления
Коварство болезни в том, что первые симптомы не имеют никакой специфичности и не вызывают озабоченности ни у пациента, ни у врача – все развивается слишком исподволь. Первые несколько месяцев никаких клинических проявлений может не быть, хотя процесс активно идет.
Иногда провокаторами могут стать болезнь, тяжелые физические нагрузки, изменения гормонального статуса, эмоциональные нагрузки, стрессы.
Основных клинических проявлений два:
- Слабость или нарушение чувствительности в руках и/или ногах, которая сочетается с двигательными нарушениями. Слабость прогрессирует ступенеобразно и неуклонно, но медленно. Длительность прогрессирования симптомов – не менее 2-х месяцев. Возможно сопутствующее вовлечение черепно-мозговых нервов.
- Снижение сухожильных рефлексов с конечностей вплоть до их отсутствия.
Чаще всего слабость начинается со стоп, постепенно поднимается вверх. В дальнейшем могут нарушиться мелкие и точные движения кистей. Атрофии мышц развиваются гораздо позже, или их не бывает совсем. Снижение чувствительности в ногах приводит к неустойчивости при ходьбе, болям.
Типичная форма ХВПД характеризуется симметричностью поражения, постепенным нарастанием симптоматики, хорошим ответом на лечение. Атипичная может быть асимметричной или фокальной, когда первоначально вовлечено только одно сплетение или 1 периферический нерв.
Принципы диагностики
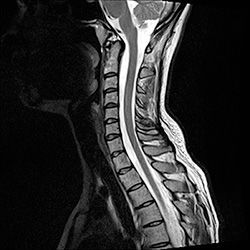
Неврологи клиники ЦЭЛТ знают о том, что начальные проявления ХВДП протекают под маской многих других распространенных болезней, по поводу которых пациенты долго и безуспешно лечатся. Диагностика включает такие исследования:
- Электронейромиография, позволяющая выявить нарушения проведения возбуждения по нервным волокнам, провести дифференциальную диагностику с другими заболеваниями периферической нервной системы.
- Анализ крови на содержание антител. спинного мозга (позвоночника) с контрастным усилением, накопление контраста иногда происходит в области воспаленных корешков нервных сплетений.
Результаты этих исследований, а также ответ на терапию позволяют отличить ХВДП от других видов полинейропатий.
Читайте также:

