Назовите методы культивирования вируса гриппа
Обновлено: 10.05.2024
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.
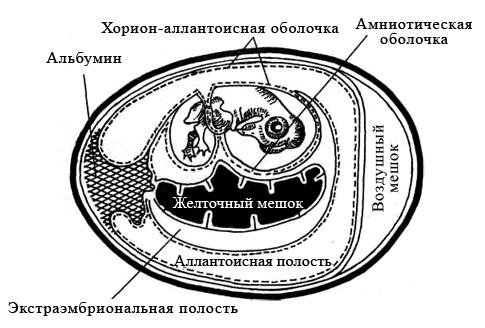
Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.

Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?
Вирусы не способны культивироваться на питательных средах, т.к. являются внутриклеточными паразитами.
1. Метод культивирования в организме чувствительных экспериментальных лабораторных животных.
Ограничения:
1) не все вирусы человека размножаются в организме лабораторных животных;
2) в организме экспериментальных животных есть иммунная система, которая может оказывать влияние на размножение вирусов.
2. Культивирование вирусов в развивающихся куриных эмбрионах.
Куриные эмбрионы имеют двухслойную экто- и энтодермальную хорион-аллантоисную оболочку; желточный мешок построен из мезодермальных клеток. Т.о., куриный эмбрион содержит ткани любого происхождения.
Куриный эмбрион не обладает иммунологической активностью.
Дешевле по сравнению с лабораторными животными. После заражения куриных эмбрионов они погибают вследствие размножения вирусов. На оболочках эмбриона могут образовыватся бляшки – мелкие зернистые образования. Вирус накапливается в жидкости куриного эмбриона.
Но: в куриных эмбрионах размножаются не все вирусы человека.
3. Метод культивирования вирусов в культуре ткани:
– для культивирования вирусов вне организма; используют эмбриональные, опухолевые клетки, которые активно размножаются в питательных средах для культуры тканей.
Типы культур тканей:
1) перевиваемые тканевые культуры – культуры обычно опухолевых клеток. Они стандартные. Их нужно постоянно поддерживать, они одинаковы во всех лабораториях мира;
2) первично-трипсинизированные тканевые культуры - культуры эмбриональных тканей, которые готовятся каждый раз по мере надобности: эмбриональную ткань измельчают, затем подвергают обработке трипсином (чтобы разрушить межклеточные связи), центрифугируют отдельные клетки. Эти культуры ткани обладают хорошими ростовыми качествами, но они не стандартны.
Для поддерживания культур ткани служат специальные синтетические питательные среды.
Культивирование вирусов под агаровым покрытием (однослойные культуры тканей) дает возможность получить потомство отдельных вирионов.
Методы регистрации размножения вирусов
1. Организм животного:
- Изменения в организме животного (болезнь).
2. Куриный эмбрион:
- Бляшки на оболочках;
3. Культура ткани:
При размножении вирусов проявляются изменения, которые не свойственны здоровым клеткам:
- ЦПЭ (цитопатический эффект);
- У культивируемых вирусов есть феномен гемадсорбции (в результате избыточного синтеза гемагглютинин экспрессируется на наружную поверхность клеток культуры ткани и они приобретают способность адсорбировать эритроциты);
- появление в клетках включений – морфологических структур, которые обнаруживаются только в зараженных вирусом клетках культуры ткани.
Виды включений:
1) по локализации:
2) По характеру окраски по Романовскому-Гимза:
Типы включений характерны для определенного вируса.
- Учет размножения вирусов в культуре ткани (метод цветной пробы – ориентировочный тест, который говорит о нарушении клеточного метаболизма):
- если культура ткани не заражена, в клетках протекают процессы метаболизма, продукты метаболизма обнаруживаются в питательной среде, рН изменяется в кислую сторону, изменяется цвет индикатора;
- если культура ткани заражена вирусом, нарушения клеточного метаболизма, продукты метаболизма не обнаруживаются в питательной среде, рН не меняется, индикатор не меняет цвет.
Культуры тканей по чувствительности к вирусам делятся на 3 группы:
1) пермессивные (поддерживает вирусную инфекцию);
2) непермессивные (не способны поддерживать вирусную инфекцию);
3) полупермессивные (вирус поддерживается, но не размножается; такие клетки передают вирусную инфекцию при контакте с другими клетками).
Особенности противовирусного иммунитета
На вирус развивается полноценный иммунный ответ.
Вирус существует в организме в двух формах. В отношении внеклеточного вируса действуют те же механизмы противомикробной резистентности, что и в отношении бактерий.
Неспецифические механизмы:

- клеточная ареактивность – отсутствие специфических рецепторов для вирусов на клетках организма;
- выделительные механизмы: чихание, кашель;
- барьерная функция кожи и слизистых оболочек;
Его особенности: при бактериальных инфекциях – лейкоцитоз, при вирусных – лейкопения. Т.к. нейтрофильные лейкоциты фагоцитируют вирус, он в них размножается и они гибнут. Защитное значение имеет фагоцитоз клеток, пораженных вирусом – на поверхности таких клеток экспрессируются вирусные белки, что делает их объектом макрофагального фагоцитоза, отсюда – моноцитоз, характерный для вирусных инфекций.
- гуморальный иммунитет: система комплемента, пропердина и вирусные ингибиторы – это химические группировки и радикалы, тождественные вирусным рецепторам, и они их блокируют.
Специфические механизмы иммунитета
Роль антител особая. Уровень сывороточных антител и устойчивость к вирусам не идут параллельно. При вирусной инфекции важно не количество антител, а их локализация в организме – на месте входных ворот или на территории пораженных тканей.
Большую роль при вирусной инфекции играет клеточный иммунитет. Это связано с тем, что инфицированные вирусом клетки становятся мишенью для цитолитического действия Т-киллеров.
При заражении двумя разными вирусами одной ткани один подавляет другой. Это явление лежит в основе невосприимчивости к вирусным инфекциям. Это
Интерферон – индуцибельный белок клеток позвоночных, появляется под влиянием интерфероногенов. Один из них – вирусная инфекция. Основная функция интерферона: подавление размножения вирусов.
Виды (в зависимости от продуцирующей клетки):
Интерферон – важнейший фактор, обладающий многогранной биологической активностью: стимулирует фагоцитоз, киллерную функцию Т-лимфоцитов, подавляет синтез комплемента, снижает гемопоэз, снижает развитие реакций гиперчувствительности замедленного и немедленного типов.
Интерферон обладает активностью в отношении внутриклеточных вирусов. Он нарушает трансляцию иРНК на рибосомах, что ведет к прекращению синтеза вирусных белков.
Интерферон появляется в клетке уже через 2 часа после заражения вирусом. Защищает практически от всех видов вирусных агентов.
Особенности интерферона:
- подавляет репродукцию любых видов вирусов (т.е. не обладает специфичностью);
- Обладает видовой специфичностью (защищает только свой вид).
Универсальность интерферона делает его незаменимым в терапии вирусных инфекций.
Интерферон обеспечивает защиту на уровне нуклеиновой кислоты, т.е. поддерживает нуклеиновый гомеостаз, а антитела и Т-лимфоциты – белковый гомеостаз.
Индукторы синтеза эндогенного интерферона:
- естественные (бактерии, вирусы, ЛПС);
- синтетические (крупномолекулярные соединения: полифосфаты, поликарбонаты и т.п.)
Применение интерферона:
- средство антивирусной терапии.
Химиотерапия вирусных инфекций
С помощью химиотерапевтических препаратов воздействуют на различные этапы взаимодействия вируса с клеткой: тормозят адсорбцию вирусов на клетках.
Основные препараты:
– производные ремантадина строго специфичны (ремантадин – при вирусах гриппа А);
– производные марборана (онковирусы, вирус оспы и т.д.);
– структурные аналоги пуриновых и пиримидиновых оснований (фтортимедин, фтордезоксиурацил, азидотимедин и т.п.);
Встраиваются в вирусную нуклеиновую кислоту → вирусы теряют инфекционность.
Специфическая профилактика вирусных инфекций
Вирусные вакцины: живые и убитые.
В настоящее время живые вакцины используется…, т.к. возможна реверсия аттенуированных штаммов.
Средство экстренной профилактики: иммунные сыворотки, интерферон.
Экстренная профилактика кори – коревой γ-глобулин. Чаще используются химические и генно-инженерные вакцины.
Принципы классификации вирусов
По типу нуклеиновой кислоты вирусы делятся на:
По размерам вириона на:
- крупные (более 100 нм);
- средние (50-100 нм);
- мелкие (меньше 50 нм).
По типу симметрии нуклеокапсида на:
По наличию или отсутствию суперкапсидной оболочки.
По антигенной структуре.
По типу репликации нуклеиновой кислоты.
Главную роль в патологии человека играют РНКовые вирусы к ним относятся:
- сем. Пикорновирусы и т.д.
ДНКовые вирусы, патогенные для человека. Это:
- вирус папилломы, полиомы и бородавок;
- Аденовирусы (постоянные обитатели глоточного кольца), могут вызывать ОРВИ, ОРЗ;
- сем. Поксвирусов, включающее вирус натуральной оспы.
Происхождение вирусов
Происхождение вирусов – вопрос, который на протяжении многих лет составлял предмет дискуссий.
Было выдвинуто три гипотезы:
1. Вирусы – потомки бактерий и других одноклеточных организмов, претерпевших дегенеративную (регрессивную) эволюцию.
2. Вирусы – потомки древних доклеточных форм жизни, перешедших к паразитическому способу существования.
3. Вирусы – дериваты (производные) клеточных генетических структур, ставших относительно автономными, но сохранившими зависимость от клеток.
Лабораторные исследованияпри проведении идентификации вирусов и диагностике вирусных инфекций включают следующие этапы: выделение, культивирование, индикация (выявление) и идентификация вирусов.
2.3.1 Культивирование вирусов
Вирусы не растут на искусственных питательных средах, а размножаются только внутриклеточно. Крупным достижением было предложение Р. Гудпасчура в 1932 г. использовать для культивирования вирусов куриные эмбрионы. Окончательное решение проблемы культивирования вирусов оказалось возможным лишь после того, как были разработаны основные способы культивирования клеток вне организма.
Использование куриных эмбрионов. Куриные эмбрионы – практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание).
Для заражения обычно используют куриные эмбрионы 7–12-дневного возраста. Перед заражением определяют жизнеспособность эмбриона путем овоскопирования (просматривают в проходящем свете). Живые эмбрионы при овоскопировании проявляют двигательную активность, хорошо виден сосудистый рисунок. Простым карандашом очерчивают границы воздушной камеры.
Куриные эмбрионы заражают вируссодержащим материалом в асептических условиях стерильными инструментами, предварительно обработав скорлупу над воздушным пространством йодом и спиртом. Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость, либо в желточный мешок (рисунок 29). Выбор метода заражения зависит от биологических свойств вируса.

Рисунок 29 – Схематическое изображение развивающегося куриного эмбриона
Культура клеток. Вначале был использован метод переживающих тканей. Он заключался в том, что в колбу, содержащую питательную среду, вносили кусочек ткани. Клетки некоторых тканей в таких условиях могут переживать (но не размножаться) до 30 дней, а в них могут размножаться вирусы. Однако этот способ давал очень небольшой выход вирусов. Необходимо было разработать условия, при которых клетки ткани могли бы свободно размножаться.
Для получения культур клеток необходимо было решить четыре главных задачи:
– получить в необходимом количестве свободные (т. е. изолированные друг от друга) клетки;
– создать такие питательные среды и условия, в которых клетки могли бы активно размножаться;
– обеспечить условия, при которых в культурах клеток не могли бы размножаться бактерии;
– определить методы, с помощью которых можно было бы распознавать рост вируса в культуре клеток и идентифицировать его.
Для выделения изолированных (разобщенных), но жизнеспособных клеток из разрушенных тканей, стали использовать обработку их слабым раствором трипсина, разрушающего межклеточные мостики. Для культивирования клеток были предложены различные среды, содержащие все необходимые для размножения клеток питательные вещества (аминокислоты, основания, витамины и другие), минеральные соли, имеющие оптимальную рН и т. д. К питательным средам добавляли индикатор, по изменению цвета которого можно было судить о метаболизме клеток и их размножении. Было установлено, что в качестве основы, на которой клетки размножаются и образуют монослой, может быть использовано хорошо обработанное стекло пробирок и колб. Для подавления возможного роста бактерий вируссодержащий материал перед посевом его в культуры клеток стали обрабатывать антибиотиками.
В 1949 г. Дж. Эндерс, Т. Веллер и Ф. Роббинс показали, что вирус полиомиелита хорошо размножается в первично-трипсинизированных культурах клеток, полученных из почек обезьян. Основной недостаток первично-трипсинизированных клеток заключается в том, что после нескольких пересевов они перестают размножаться. Поэтому предпочтением стали пользоваться культуры таких клеток, которые способны размножаться in vitro бесконечно долго. Такие перевиваемые культуры клеток (клеточные линии характеризуются бессмертием и гетероплоидным кариотипом) получают из опухолевых тканей (HeLa получена из карциномы шейки матки, НЕр-2 – из карциномы гортани; Детройт-6 – из метастаза рака легкого в костный мозг; RН – из опухоли почки человека) или из мутантных клеток с полиплоидным набором хромосом. Однако опухолевые клетки нельзя применять для получения вакцин. Для этих целей используют только культуры таких клеток, которые не содержат никаких контаминантных вирусов и не обладают злокачественностью. Лучше всего этим требованиям отвечают культуры диплоидных клеток.

Полуперевиваемые (диплоидные) культуры клеток – клетки одного генотипа, способные in vitro выдерживать 50–100 пассажей, сохраняя при этом свой исходный диплоидный набор хромосом. Диплоидные линии фибробластов эмбриона человека используются как для диагностики вирусных инфекций, так и при производстве вирусных вакцин. Как оказалось, вирусы могут размножаться не только в культурах клеток, образующих монослой на стекле пробирок, но и в суспензиях живых клеток.
Для обеспечения жизнедеятельности культивируемых клеток необходимы питательные среды. По назначению они делятся на ростовые и поддерживающие. В ростовых питательных средах должно содержаться больше питательных веществ, обеспечивающих активное размножение клеток и формирование монослоя. Поддерживающие среды обеспечивают переживание клеток в уже сформированном монослое в период размножения в них вирусов.
2.3.2 Выделение вирусов
Выделение вирусов в культурах клеток. При выделении вирусов из различных инфекционных материалов (кровь, моча, слизистые отделяемые, смывы из органов) применяют культуры клеток, обладающих наибольшей чувствительностью к предполагаемому вирусу. Для заражения используют культуры в пробирках с хорошо развитым монослоем клеток. Перед заражением клеток питательную среду удаляют и в каждую пробирку вносят по 0,1–0,2 мл взвеси исследуемого материала, предварительно обработанного антибиотиками для уничтожения бактерий и грибов. После 30-60 мин контакта вируса с монослоем клеток удаляют избыток материала, в культуру вносят поддерживающую среду и пробы оставляют в термостате до выявления признаков размножения вируса.
Выделение вирусов на лабораторных животных. При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Таким образом, для выделения чистых культур вирусов в лабораторных условиях в настоящее время используются следующие живые объекты (биологические модели): 1) культура клеток (тканей, органов); 2) куриные эмбрионы; 3) лабораторные животные.
2.3.3 Индикация вирусов
Индикация вирусов в культурах клеток. Индикатором наличия вируса в зараженных культурах клеток может служить:
1) развитие специфической дегенерации клеток – цитопатическое действие вируса (ЦПД), имеющее три основных типа: крупно- или мелкоклеточная дегенерация; образование многоядерных гигантских клеток (симпластов); развитие очагов клеточной пролиферации, состоящих из нескольких слоев клеток (гроздевидная дегенерация клеток).
Различают два механизма гибели клеток, вызываемой вирусами, – некроз и апоптоз. Некроз происходит из-за необратимых нарушений целостности клеточных мембран, апоптоз – вследствие фрагментации ядерной ДНК под действием клеточной эндонуклеазы.
Цитопатические эффектыоценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью:
2) обнаружение внутриклеточных включений, располагающихся в цитоплазме и/или в ядрах пораженных клеток;
3) положительная реакция гемагглютинации (РГА) или гемадсорбции (РГАдс). Некоторые вирусы, в частности, вирус гриппа, обладают особыми рецепторами (гемагглютининами), с помощью которых они адсорбируются на эритроцитах и вызывают их склеивание (гемагглютинацию). Такие вирусы легко обнаруживаются с помощью реакции гемагглютинации или гемадсорбции (эритроциты адсорбируются на инфицированных вирусами клетках культуры тканей);
4) феномен бляшкообразования. Широкое распространение получил предложенный в 1952 г. Р. Дюльбекко метод бляшек (негативных колоний), позволяющий производить количественное определение вирусов. Для выделения вирусов монослой клеток после удаления питательной среды заражают вируссодержащим материалом и покрывают слоем агара, содержащего индикатор нейтральный красный. Чашки (флаконы) инкубируют при 37 °С. Через 48–96 ч выявляются пятна – бляшки. Они имеют диаметр 1–3 мм и выглядят неокрашенными на розовом фоне. Пятна возникают за счет цитопатического действия вируса;
5) цветная реакция Солка. О росте вирусов в клетках можно судить с помощью индикатора, добавляемого к питательной среде. Если клетки активно осуществляют метаболизм, рН среды сдвигается в кислую сторону, и среда окрашивается в желтый цвет. В случае размножения вируса клетки погибают, рН среды мало меняется, и она сохраняет первоначальный (малиновый) цвет или (при нейтральной рН) приобретает оранжевый;
6) реакция интерференции (используется при отсутствии ЦПД, гемагглютинации и гемадсорбции): исследуемая культура повторно заражается вирусом, вызывающим ЦПД. В положительном случае ЦПД будет отсутствовать (реакция интерференции положительна). Если в исследуемом материале вируса не было, наблюдается ЦПД.
Кроме того, для обнаружения вируса в культурах клеток могут быть использованы различные серологические реакции.
Индикация вирусов на лабораторных животных. Индикация вируса основана на обнаружении у животных признаков инфекционного заболевания, регистрации их гибели, изучении характера патоморфологических и патогистологических изменений в тканях и органах, выявлении положительной реакции гемагглютинации.
2.3.4 Методы идентификации вирусов
Определение типа вируса (его идентификация) основано на нейтрализации биологической активности вируса с помощью типоспецифических сывороток. Конечный результат ее может быть установлен на основании следующих признаков:
1) нейтрализация цитопатического действия: в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1–2 дня в неё вносят известный цитопатогенный вирус. При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим антителам примененной сыворотки;
2) нейтрализация реакции гемадсорбции;
3) изменение проявления цветной пробы;
4) задержка (торможение) реакции гемагглютинации: смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
5) нейтрализация в опытах на животных.
Таким образом РН (реакция нейтрализации) основана на подавлении соответствующей реакции, феномена, развития инфекционного процесса после внесения в культуру или введения в организм животного смеси вируса со специфичными AT, содержащимися в диагностической сыворотке.
Вопросы для самоконтроля
1 Назовите основные принципы классификации вирусов.
2 Приведите русские и латинские названия основных семейств вирусов человека и животных.
3 Назовите типовых представителей основных семейств вирусов и заболевания, вызываемые ими.
4 Каковы особенности морфологии и ультраструктуры вирусов человека и животных (основных семейств)?
5 Назовите РНК-геномные и ДНК-геномные фитовирусы.
6 Какие этапы включают в себя лабораторные исследования при идентификации вирусов и диагностике вирусных инфекций?
7 Какие биологические модели используются для выделения и культивирования вирусов человека и животных?
8 Как происходит заражение куриных эмбрионов в лабораторных условиях?
9 Какие методы получения культуры клеток вы знаете?
10 Как проводят идентификацию вирусов в курином эмбрионе и на лабораторных животных?
11 Какие существуют методы индикации вирусов на культуре клеток?
12 В чем заключается назначение и сущность реакций нейтрализации вирусов?




Рис. 2. Заражение куриного эмбриона на ХАО через естественную воздушную камеру
(по Николау)
Рис. 3. Заражение куриного эмбриона в аллантоисную полость (по Николау)
Заражение через искусственную воздушную камеру применяют чаще первого, так как оно обеспечивает контакт вируссодержащего материала с большей поверхностью ХАО и, следовательно, ведет к образованию большего количества вируса. Для заражения эмбриона этим методом его помещают в штатив горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое над центром воздушной камеры (предназначено для отсасывания из нее воздуха), а другое диаметром 0,2-0,5 см сбоку, со стороны зародыша. Сложность метода в том, что, делая второе отверстие, необходимо осторожно снять вначале кусочек скорлупы, затем скользящим движением, не повреждая ХАО, сдвинуть подскорлупную оболочку в сторону так, чтобы через образовавшийся дефект мог пройти воздух. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры (рис. 4, а). В результате через боковое отверстие наружный воздух устремляется внутрь, образуя искусственную воздушную камеру, дном которой является ХАО (рис. 4, б).

,
Рис. 4. Заражение куриного эмбриона на ХАО через искусственную воздушную камеру (по Николау и др.)
Через боковое отверстие на поверхность ХАО наносят инфекционную жидкость и отверстие закрывают кусочком лейкопластыря. Закрывать первое отверстие нет необходимости, так как внутренний листок подскорлупной оболочки при этом методе заражения не нарушается и продолжает выполнять роль барьера для микрофлоры окружающей среды.
Дальнейшую инкубацию эмбрионов, зараженных этим методом, проводят в горизонтальном положении боковым отверстием вверх.
Заражение в желточный мешок. Большей частью им пользуются для размножения хламидий, а также вирусов болезни Марека, ринопневмонии лошадей, катаральной лихорадки овец и др. Заражают эмбрионы 5-7-дневного, а иногда и 2-3-дневного возраста (вирус лихорадки долины РИФ). Используют два варианта заражения (рис. 6).


Рис. 5. Заражение куриного эмбриона в амниотическую полость (по Николау и др.)
Рис. 6. Заражение куриного эмбриона в желточный мешок (по Николау и др.)
Первый вариант. Иногда путь заражения осуществляется на горизонтально укрепленном в штативе эмбрионе, при этом зародыш находится внизу, а желток - над ним. Отверстие в скорлупе закрывают каплей расплавленного парафина.
Второй вариант. Эмбрионы помещают в штатив в вертикальном положении. Делают отверстие в скорлупе над центром воздушной камеры и вводят иглу на глубину 3,5-4 см под углом 45° к вертикальной оси в направлении, противоположном месту нахождения зародыша.
Заражение в амниотическую полость. Для этой цели используют эмбрионы 6-10-дневного возраста. Метод используется при культивировании вирусов гриппа, ньюкаслской болезни, ринопневмонии лошадей и др. Есть два способа заражжения (рис. 5).
Закрытый способ. Заражение проводят в затемненном боксе. Яйцо помещают на овоскопе в горизонтальном положении зародышем вверх. Через отверстие в скорлупе над воздушной камерой вводят иглу с затупленным концом по направлению к зародышу. Доказательством того, что игла проникла в амнион, служит движение тела зародыша в направлении передвижения.
Открытый способ. Скорлупу над воздушной камерой срезают так, чтобы образовалось окно диаметром 1,5-2,5 см. Через него пинцетом под контролем глаза снимают подскорлупную оболочку. Затем анатомический (14 см) пинцет с сомкнутыми браншами ведут, продавливая хорионаллантоисную оболочку по направлению к зародышу. Когда пинцет достигнет его, бранши размыкают, захватывают амниотическую оболочку вместе с ХАО и подтягивают к окну. Удерживая левой рукой пинцет с фиксированной в нем оболочкой амниона, вводят вируссодержащий материал (рис. 7). Далее все оболочки опускают, окно закрывают лейкопластырем и эмбрион инкубируют в вертикальном положении.
Заражение в тело зародыша. Для заражения используют эмбрионы 7-12-дневного возраста. Известно два варианта метода.
Первый вариант. Заражают так же, как в амнион закрытым способом, с той лишь разницей, что берут острую иглу и на овоскопе показателем попадания иглы в тело считают подчинение зародыша движениям иглы.
Второй вариант. Заражают так же, как в амнион открытым способом: через окно в скорлупе подтягивают пинцетом тело зародыша. Материал вводят в головной мозг или определенные участки тела. При таких методах заражения бывает значительный процент неспецифической гибели эмбрионов.

Рис. 7. Заражение куриного эмбриона в амнион открытым способом (по Николау и др.)


Рис. 8. Отсасывание аллантоисной жидкости (по Николау)
Рис. 9. Отсасывание амниотической жидкости (по Николау и др.)
Для получения стенки желточного мешка как вируссодержащего материала желток извлекают на чашку Петри, стенку его разрезают ножницами и отполаскивают от содержимого в физиологическом растворе. Тело зародыша извлекают, удерживая его за шею (рис. 10).
При вскрытии куриных эмбрионов ставят бактериологический контроль вируссодержащего материала посевом на МПБ, МПА, МППБ и среду Сабуро. Вируссодержащий материал хранят при минус 25 °С и ниже.
Культивирование с производственными целями на куриных эмбрионах применяется для размножения ряда вирусов (осповакцины, клещевого энцефалита, гриппа, москитной лихорадки и др.). Так, для изготовления гриппозной и оспенной вакцин используют вирусы, размноженные на хорионаллантоисной оболочке, вакцины против москитной лихорадки - в аллантоисной полости, а вирус клещевого энцефалита культивируют в желточном мешке.
Метод размножения вирусов на культурах тканей
Для изготовления живых и инактированных вакцин вирусы размножаются на первичных культурах тканей, а диагностических препаратов также и на перевиваемых культурах.
Для размножения вирусов предложен ряд методов с использованием культур тканей. Такие методы, как Карреля-Берреуза (1910), культивирование кусочков ткани, фиксированных в сгустке плазмы, Меттлендов (1928) - культивирование в переживающих тканях - в настоящее время не используются не только в производстве, но и в исследовательской работе. Эти методы вытеснены культивированием в однослойной культуре клеток.
Работа по культивированию клеток производится в специальных лабораториях при соблюдении высоких требований к стерильности воздуха, посуды, растворов, питательных сред. Используемая посуда должна быть нейтральной, хорошо вымытой и обезжиренной, применяемые реактивы - химически чистыми.

Вирусы не способны культивироваться на питательных средах, т.к. являются внутриклеточными паразитами.
1. Метод культивирования в организме чувствительных экспериментальных лабораторных животных.
Ограничения:
1) не все вирусы человека размножаются в организме лабораторных животных;
2) в организме экспериментальных животных есть иммунная система, которая может оказывать влияние на размножение вирусов.
2. Культивирование вирусов в развивающихся куриных эмбрионах.
Куриные эмбрионы имеют двухслойную экто- и энтодермальную хорион-аллантоисную оболочку; желточный мешок построен из мезодермальных клеток. Т.о., куриный эмбрион содержит ткани любого происхождения.
Куриный эмбрион не обладает иммунологической активностью.
Дешевле по сравнению с лабораторными животными. После заражения куриных эмбрионов они погибают вследствие размножения вирусов. На оболочках эмбриона могут образовыватся бляшки – мелкие зернистые образования. Вирус накапливается в жидкости куриного эмбриона.
Но: в куриных эмбрионах размножаются не все вирусы человека.
3. Метод культивирования вирусов в культуре ткани:
– для культивирования вирусов вне организма; используют эмбриональные, опухолевые клетки, которые активно размножаются в питательных средах для культуры тканей.
Типы культур тканей:
1) перевиваемые тканевые культуры – культуры обычно опухолевых клеток. Они стандартные. Их нужно постоянно поддерживать, они одинаковы во всех лабораториях мира;
2) первично-трипсинизированные тканевые культуры - культуры эмбриональных тканей, которые готовятся каждый раз по мере надобности: эмбриональную ткань измельчают, затем подвергают обработке трипсином (чтобы разрушить межклеточные связи), центрифугируют отдельные клетки. Эти культуры ткани обладают хорошими ростовыми качествами, но они не стандартны.
Для поддерживания культур ткани служат специальные синтетические питательные среды.
Культивирование вирусов под агаровым покрытием (однослойные культуры тканей) дает возможность получить потомство отдельных вирионов.
Методы регистрации размножения вирусов
1. Организм животного:
- Изменения в организме животного (болезнь).
2. Куриный эмбрион:
- Бляшки на оболочках;
3. Культура ткани:
При размножении вирусов проявляются изменения, которые не свойственны здоровым клеткам:
- ЦПЭ (цитопатический эффект);
- У культивируемых вирусов есть феномен гемадсорбции (в результате избыточного синтеза гемагглютинин экспрессируется на наружную поверхность клеток культуры ткани и они приобретают способность адсорбировать эритроциты);
- появление в клетках включений – морфологических структур, которые обнаруживаются только в зараженных вирусом клетках культуры ткани.
Виды включений:
1) по локализации:
2) По характеру окраски по Романовскому-Гимза:
Типы включений характерны для определенного вируса.
- Учет размножения вирусов в культуре ткани (метод цветной пробы – ориентировочный тест, который говорит о нарушении клеточного метаболизма):
- если культура ткани не заражена, в клетках протекают процессы метаболизма, продукты метаболизма обнаруживаются в питательной среде, рН изменяется в кислую сторону, изменяется цвет индикатора;
- если культура ткани заражена вирусом, нарушения клеточного метаболизма, продукты метаболизма не обнаруживаются в питательной среде, рН не меняется, индикатор не меняет цвет.
Культуры тканей по чувствительности к вирусам делятся на 3 группы:
1) пермессивные (поддерживает вирусную инфекцию);
2) непермессивные (не способны поддерживать вирусную инфекцию);
3) полупермессивные (вирус поддерживается, но не размножается; такие клетки передают вирусную инфекцию при контакте с другими клетками).
Особенности противовирусного иммунитета
На вирус развивается полноценный иммунный ответ.
Вирус существует в организме в двух формах. В отношении внеклеточного вируса действуют те же механизмы противомикробной резистентности, что и в отношении бактерий.
Неспецифические механизмы:

- клеточная ареактивность – отсутствие специфических рецепторов для вирусов на клетках организма;
- выделительные механизмы: чихание, кашель;
- барьерная функция кожи и слизистых оболочек;
Его особенности: при бактериальных инфекциях – лейкоцитоз, при вирусных – лейкопения. Т.к. нейтрофильные лейкоциты фагоцитируют вирус, он в них размножается и они гибнут. Защитное значение имеет фагоцитоз клеток, пораженных вирусом – на поверхности таких клеток экспрессируются вирусные белки, что делает их объектом макрофагального фагоцитоза, отсюда – моноцитоз, характерный для вирусных инфекций.
- гуморальный иммунитет: система комплемента, пропердина и вирусные ингибиторы – это химические группировки и радикалы, тождественные вирусным рецепторам, и они их блокируют.
Специфические механизмы иммунитета
Роль антител особая. Уровень сывороточных антител и устойчивость к вирусам не идут параллельно. При вирусной инфекции важно не количество антител, а их локализация в организме – на месте входных ворот или на территории пораженных тканей.
Большую роль при вирусной инфекции играет клеточный иммунитет. Это связано с тем, что инфицированные вирусом клетки становятся мишенью для цитолитического действия Т-киллеров.
При заражении двумя разными вирусами одной ткани один подавляет другой. Это явление лежит в основе невосприимчивости к вирусным инфекциям. Это
Интерферон – индуцибельный белок клеток позвоночных, появляется под влиянием интерфероногенов. Один из них – вирусная инфекция. Основная функция интерферона: подавление размножения вирусов.
Виды (в зависимости от продуцирующей клетки):
Интерферон – важнейший фактор, обладающий многогранной биологической активностью: стимулирует фагоцитоз, киллерную функцию Т-лимфоцитов, подавляет синтез комплемента, снижает гемопоэз, снижает развитие реакций гиперчувствительности замедленного и немедленного типов.
Интерферон обладает активностью в отношении внутриклеточных вирусов. Он нарушает трансляцию иРНК на рибосомах, что ведет к прекращению синтеза вирусных белков.
Интерферон появляется в клетке уже через 2 часа после заражения вирусом. Защищает практически от всех видов вирусных агентов.
Особенности интерферона:
- подавляет репродукцию любых видов вирусов (т.е. не обладает специфичностью);
- Обладает видовой специфичностью (защищает только свой вид).
Универсальность интерферона делает его незаменимым в терапии вирусных инфекций.
Интерферон обеспечивает защиту на уровне нуклеиновой кислоты, т.е. поддерживает нуклеиновый гомеостаз, а антитела и Т-лимфоциты – белковый гомеостаз.
Индукторы синтеза эндогенного интерферона:
- естественные (бактерии, вирусы, ЛПС);
- синтетические (крупномолекулярные соединения: полифосфаты, поликарбонаты и т.п.)
Применение интерферона:
- средство антивирусной терапии.
Химиотерапия вирусных инфекций
С помощью химиотерапевтических препаратов воздействуют на различные этапы взаимодействия вируса с клеткой: тормозят адсорбцию вирусов на клетках.
Основные препараты:
– производные ремантадина строго специфичны (ремантадин – при вирусах гриппа А);
– производные марборана (онковирусы, вирус оспы и т.д.);
– структурные аналоги пуриновых и пиримидиновых оснований (фтортимедин, фтордезоксиурацил, азидотимедин и т.п.);
Встраиваются в вирусную нуклеиновую кислоту → вирусы теряют инфекционность.
Специфическая профилактика вирусных инфекций
Вирусные вакцины: живые и убитые.
В настоящее время живые вакцины используется…, т.к. возможна реверсия аттенуированных штаммов.
Средство экстренной профилактики: иммунные сыворотки, интерферон.
Экстренная профилактика кори – коревой γ-глобулин. Чаще используются химические и генно-инженерные вакцины.
Принципы классификации вирусов
По типу нуклеиновой кислоты вирусы делятся на:
По размерам вириона на:
- крупные (более 100 нм);
- средние (50-100 нм);
- мелкие (меньше 50 нм).
По типу симметрии нуклеокапсида на:
По наличию или отсутствию суперкапсидной оболочки.
По антигенной структуре.
По типу репликации нуклеиновой кислоты.
Главную роль в патологии человека играют РНКовые вирусы к ним относятся:
- сем. Пикорновирусы и т.д.
ДНКовые вирусы, патогенные для человека. Это:
- вирус папилломы, полиомы и бородавок;
- Аденовирусы (постоянные обитатели глоточного кольца), могут вызывать ОРВИ, ОРЗ;
- сем. Поксвирусов, включающее вирус натуральной оспы.
Происхождение вирусов
Происхождение вирусов – вопрос, который на протяжении многих лет составлял предмет дискуссий.
Было выдвинуто три гипотезы:
1. Вирусы – потомки бактерий и других одноклеточных организмов, претерпевших дегенеративную (регрессивную) эволюцию.
2. Вирусы – потомки древних доклеточных форм жизни, перешедших к паразитическому способу существования.
3. Вирусы – дериваты (производные) клеточных генетических структур, ставших относительно автономными, но сохранившими зависимость от клеток.
Читайте также:

