Обморок при кишечном гриппе
Обновлено: 25.04.2024
Острая кишечная инфекция у детей и взрослых занимает второе место по распространённости после респираторных болезней. Этот группа инфекционных заболеваний, протекающих в ЖКТ и сопровождающихся местными и общими симптомами. Особенно остро кишечная инфекция проходит у младенцев. Согласно статистике ВОЗ, каждый год в мире от кишечных инфекций умирает примерно 2 млн детей младше 5 лет. Поэтому очень важно своевременно обращаться за квалифицированной помощью.
Всплески заболевания обычно приходятся на теплое время года, особенно когда влажно. Болезнетворные микроорганизмы живучи и могут существовать до нескольких дней вне тела человека. Это могут быть вирусы и бактерии. Дети раннего возраста наиболее подвержены заражению и сложнее переносят инфекцию. У них велик риск осложнений и серьезного вреда здоровью в целом. Микроорганизмы проходят через рот и желудок, потом закрепляются в кишечнике и размножаются, от этого происходит общая интоксикация.
Разновидности инфекций
Все инфекции делятся на бактериальные и вирусные, которые в свою очередь тоже классифицируются на несколько видов.
Бактериальные виды
- Стафилококковая – на ее фоне появляется рвота, диарея, незначительно повышается температура тела. Может быть насморк, желудочные и кишечные спазмы, покраснение горла.
- Сальмонеллезная – ребенка лихорадит, у него повышается температура, стул становится жидким, но сохраняет нормальный цвет.
- Брюшно-тифозная – возникает лихорадка, ломота в теле, может носом идти кровь, болеть горло, при мочеиспускании ребенку больно.
- Эшерихиоз – рвота, понос, повышение температуры тела, колики в животе. Источник:
А.Н. Сурков
Тактика лечения острых кишечных инфекций у детей
// Вопросы современной педиатрии, 2011, т. 10, №6, с.141-147
Вирусные формы
Причины развития заболевания
Возбудителями острых кишечных инфекций могут выступать патогенные и условно-патогенные бактерии, вирусы.
Основные формы передачи вируса: орально-фекальная, а для вирусной инфекции характерен воздушно-капельный путь. Нередко заражение происходит от грязных, несвежих или недостаточно приготовленных продуктов, сырой воды. Вирус или бактерия проходит через рот и желудок и далее укрепляется в кишечнике, где начинается активное размножение, приводящее к интоксикации организма.
Основные причины заражения:
- контакт с людьми-носителями;
- некачественные или несвежие продукты питания;
- низкое качество и загрязненность воды;
- плохо вымытые овощи и фрукты.
Симптомы кишечной инфекции у детей
Признаки заболевания разделяют на местные и общие. К последним относятся:
- высокая температура;
- недомогание;
- головная боль;
- обезвоживание.
Местные симптомы:
- поражения желудка и кишечника;
- диарея;
- боли в животе;
- рвота.
При тяжёлой форме острой кишечной инфекции у ребёнка могут развиться осложнения с различной симптоматикой:
- Нейротоксикоз: спутанность сознания, нервозность, судороги.
- Нарушение кровообращения: снижение давления, бледность и синюшность кожи, ухудшение работы сердца.
- Почечная недостаточность: снижение выработки мочи, боли в районе поясницы.
- Гиповолемический шок от обезвоживания: резкое похудение, пониженная температура, у младенцев — западение родничка.
- Кровотечения в органах ЖКТ.
Самые распространенные признаки, по которым можно определить инфекцию – это некоторые изменения поведения ребенка. Он становится сонливым, отказывается от еды, у него вялость.
Болезнь может иметь инкубационный период. Первые симптомы могут появляться через 6-48 часов после заражения.
Способы клинической диагностики
Чтобы точно установить диагноз и исключить другие заболевания, проводятся:
- бактериологические посевы кала и рвоты;
- анализ крови (общий, иммуноферментный);
- копрологический анализ кала. Источник:
Д.В. Усенко, А.А. Плоскирева, А.В. Горелов
Острые кишечные инфекции у детей в практике педиатра: возможности диагностики и терапии
// Вопросы современной педиатрии, 2014, т.13, №3, с.12-20
Очень важно отличить инфекцию кишечника от других болезней с похожими симптомами. Например, от небактериального отравления пищей или лекарствами, воспаления аппендикса, пневмонии. Если появились симптомы, нужно обратиться к детскому инфекционисту или гастроэнтерологу. Врач назначит бактериологические исследования и/или дополнительные серологические способы диагностики, чтобы выявить антитела к возбудителям инфекции. При вирусных инфекциях ухудшается общее состояние, поднимается высокая температура, а при бактериальных возникают четкие локальные симптомы.
Лечение острой кишечной инфекции у детей
Первое желание родителей – что-то дать ребенку, как-то начать его лечить еще до консультации с врачом.
До прихода врача нужно оказать первую помощь:
Если соблюдать все рекомендации врача, бороться с обезвоживанием и соблюдать диету, ребенок сможет выздороветь за 4-5 дней.
Рекомендации при острой форме заболевания
Профилактика обезвоживания
Меры против высокой температуры
Антибиотики
ВОЗ дала рекомендации, когда при кишечных инфекциях показана терапия именно противомикробными препаратами:
- диарея на протяжении нескольких дней;
- кровь в рвотных и каловых массах;
- холера в тяжелой форме.
Сорбенты
Это именно то, что можно дать ребенку при кишечной инфекции, чтобы избежать интоксикации. Согласно данным ВОЗ, нет прямых доказательств действенности таким препаратов именно против заболевания. Однако и вреда они не наносят, поэтому педиатры часто их назначают.
Диета при кишечной инфекции у детей
Болезнь будет протекать хуже, если кормить ребенка молочными и мясными продуктами. Почти любая еда может ухудшить состояние. Поэтому в идеале показано голодание на 1-2 дня. Однако далеко не все родители согласны на такое и такие меры не подходят детям с низкой массой тела. ВОЗ предлагает кормить ребенка так же, как и до болезни, но лучше перевести его на вегетарианскую диету с преобладанием жидкой пищи. Полезны овощи, крупы.
Профилактика кишечных инфекций
- соблюдать личную гигиену;
- употреблять в пищу только чистые и свежие продукты;
- подвергать их необходимой термической обработке;
- пить только кипячёную воду;
- избегать контактов с больными.
Источники:
- А.Н. Сурков. Тактика лечения острых кишечных инфекций у детей // Вопросы современной педиатрии, 2011, т.10, №6, с.141-147.
- Д.В. Усенко, А.А. Плоскирева, А.В. Горелов. Острые кишечные инфекции у детей в практике педиатра: возможности диагностики и терапии // Вопросы современной педиатрии, 2014, т.13, №3, с.12-20.
- Х.С. Хаертынов, В.А. Анохин. Современные принципы терапии острых кишечных инфекций // Казанский медицинский журнал, 2010, т.1, №XCI
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Обморок (синкопа) —это кратковременная потеря сознания, при которой резко снижается мышечный тонус, затем — через минуту-две — человек возвращается в сознание без реанимационных мероприятий.
Обмороки бывают разных типов, и в каждом случае прогнозы различаются. Однако всегда суть этого состояния заключается в том, что в мозг не поступает достаточное количество крови, он перестаёт нормально работать, и происходит потеря сознания.

Три основных типа обморока
1. Рефлекторный (нейромедиаторный) обморок возникает из-за сбоя в работе нервной системы и, как следствие, расширения сосудов и снижения частоты сердечных сокращений (брадикардии). Падает системное артериальное давление, и в результате нарушается кровоснабжение головного мозга. Рефлекторные обмороки бывают двух типов:
- Вазовагальный (нейрокардиогенный) обморок возникает, когда нарушается работа вегетативной нервной системы, регулирующей артериальное давление и частоту сердечных сокращений. Это самый распространённый вид обмороков, особенно часто он бывает у спортсменов, молодых и в общем-то здоровых людей. Обычно вазовагальный обморок происходит с человеком, который стоит или сидит. В этом случае часто бывает предобморочное состояние: головокружение, дурнота, прилив тепла, бледность, тошнота, рвота, боль в животе, повышенная потливость. Причин для беспокойства при вазовагальном обмороке обычно нет. Такой обморок может случиться после сильного кашля, чихания, смеха, испуга, сильной боли, при виде крови, а также во время нахождения в людном месте, жарком помещении, на солнце, после физических нагрузок, мочеиспускания, дефекации и т. д.
- Синокаротидный обморок который возникает при давлении на каротидный синус (расширенную часть общей сонной артерии). Это, например, может происходить при движении шеи (в частности, когда мужчина бреется и поворачивает голову), а также если воротник рубашки слишком тугой.
- от обезвоживания (в том числе на фоне сахарного диабета);
- при болезни Паркинсона;
- после приёма антиаритмических или антигипертензивных препаратов (особенно у пожилых людей на жаре), противорвотных средств, антидепрессантов и нейролептиков;
- от злоупотребления наркотическими средствами и алкоголем;
- из-за внутреннего кровотечения в результате нарушения целостности внутренних органов после травмы или в связи с осложнениями различных заболеваний;
- после длительного стояния, особенно в людных, душных местах.
3. Кардиогенный обморок связан с нарушением работы сердца. Он может возникнуть даже когда человек лежит. Обычно никаких предвестников нет — человек резко теряет сознание. Этот вид обморока указывает на серьёзную угрозу жизни и здоровью. Чаще он происходит у людей, в семьях которых были случаи необъяснимой внезапной смерти или ранние сердечно-сосудистые заболевания. Причиной обморока могут стать:
- аритмия;
- ишемия (недостаток кровоснабжения) из-за сильного сужения коронарных сосудов, а также опухоли или тромба, которые нарушают проходимость крупного сосуда;
- структурные изменения (тампонада сердца, расслоение аорты, врождённая аномалия коронарных артерий, гипертрофическая кардиомиопатия и др.).
Иногда обмороки могут быть связаны с гипогликемией (слишком низким уровнем глюкозы в крови) при сахарном диабете, паническим или тревожным расстройством и др.
На обморок также может быть похож бессудорожный эпилептический приступ, однако он длится дольше, чем обычный обморок, и после него человек далеко не сразу приходит в себя. Также во время приступа больной может прикусить язык, иногда случается недержание кала или мочи.
Потеря сознания в некоторых случаях бывает вызвана серьёзными неврологическими нарушениями: инсультом, транзиторной ишемической атакой, синдромом подключичного обкрадывания (ухудшением кровоснабжения из-за сужения или блокировки просвета подключичной артерии), тяжёлой мигренью.
Потерю сознания после черепно-мозговой травмы также нельзя назвать обмороком, в этой ситуации обязательно нужно обратиться к врачу, чтобы он оценил тяжесть повреждений.
В редких случаях потеря сознания может быть вызвана нарколепсией — заболеванием, при котором у человека возникают приступы дневного сна и катаплексия (внезапное расслабление мышц).
Когда при обмороке следует обратиться к врачу?
- обморок длится более 2-х минут;
- обмороки часто повторяются;
- Вы в первый раз упали в обморок после 40 лет;
- Вы получили травму во время обморока;
- у Вас сахарный диабет;
- Вы беременны;
- у Вас были или есть болезни сердца;
- до обморока Вы почувствовали боль в груди, сильное или нерегулярное сердцебиение;
- во время обморока возникло недержание мочи или кала;
- если у Вас началась одышка.
Что сделает врач?
Врач должен понять, в чём причина обморока и есть ли угроза жизни и здоровью. Для этого он расспросит о самом эпизоде, об истории болезни, о болезнях родственников (особенно о ранних проблемах с сердцем), проведёт осмотр и сделает электрокардиограмму. Очень важно рассказать доктору обо всём, что Вы чувствовали до и после обморока, так как дополнительные симптомы могут очень помочь в диагностике. Например, боль в груди в ряде случаев указывает на острый коронарный синдром (инфаркт миокарда или нестабильную стенокардию) или эмболию лёгочной артерии. Учащённое сердцебиение — часто признак аритмии. Одышка может быть проявлением сердечной недостаточности или эмболии лёгочной артерии. Головная боль в ряде случаев указывает на сосудистые нарушения и кровоизлияния.
Нередко пациенту, кроме прочего, проводят анализ кала на скрытую кровь (так проверяется, нет ли кровотечения в желудочно-кишечном тракте), по анализу крови устанавливается, нет ли анемии, также делается анализ крови на мозговой натрийуретический пептид (он может указать на проблемы с сердцем). Женщине, скорее всего, проведут тест на беременность. Врач может посмотреть, насколько сильно меняется давление и пульс при перемене положения тела.
Если врач считает, что, скорее всего, случился синокаротидный обморок, для подтверждения диагноза потребуется массаж каротидного синуса.
Если есть подозрение на субарахноидальное кровоизлияние, может понадобиться компьютерная томография головного мозга и люмбальная пункция.
Если у доктора возникло предположение, что дело в эпилепсии, он назначит электроэнцефалографию.
На высокий риск тяжёлых последствий указывают:
Лечение после обморока
Нужно ли проходить какое-то лечение после обморока, зависит от причины его возникновения.
При рефлекторных обмороках нужно избегать провоцирующие факторы, так как никакое лечение в этом случае не требуется. Если Вы падаете в обморок, когда у Вас берут кровь, предупредите об этом медсестру — она положит вас на кушетку, прежде чем уколоть палец или сделать инъекцию. Если Вы не понимаете, что именно вызывает обмороки, но врач сказал, что угрозы для здоровья нет, можно вести дневник, чтобы установить провоцирующие факторы.
При пониженном давлении рекомендуется избегать обезвоживания, не есть большими порциями, пить кофеиносодержащие напитки. Чтобы давление не падало резко, после того, как Вы встаёте, можно прибегнуть к специальным манёврам: скрестить ноги, напрячь мышцы в нижней части туловища, сжать кулаки или напрячь мышцы рук.
Если обморок спровоцирован приёмом каких-либо лекарственных средств, врач отменит или заменит виновный препарат, поменяет дозу или время приёма.
При некоторых болезнях сердца потребуется хирургическое вмешательство, в том числе установка кардиовертера-дефибриллятора (устройства, контролирующего ритм сердца). В других случаях помогает консервативная терапия, например, противоаритмические средства.
Первая помощь при обмороке
Когда Вы чувствуете, что скоро упадёте в обморок (возникло предобморочное состояние или, например, беспричинная зевота), ложитесь так, чтобы ноги были повыше. Или садитесь, опустив голову между коленями. Так в мозг будет поступать больше крови. Если Вы всё же потеряли сознание, после того, как придёте в себя, не вставайте сразу. Лучше дать себе 10–15 минут на восстановление.
Если человек у Вас на глазах стал терять сознание, следуйте тем же инструкциям: положите его так, чтобы ноги были выше головы или посадите, а голову опустите между коленями. Также лучше расстегнуть воротник, ослабить ремень. Если человек долго не приходит в себя (больше 2 минут), положите его на бок, следите за дыханием и пульсом и вызовите скорую. Использовать нашатырный спирт не рекомендуется: во-первых, неясно, приводит ли он человека в сознание быстрее, во-вторых, он может быть опасен при некоторых заболеваниях, например, при бронхиальной астме.

Почти каждый человек хоть раз прошел испытание ротавирусом и помнит эти изматывающие симптомы заболевания: слабость, рвоту, боли в кишечнике и диарею. И хотя длится это состояние недолго, следует отнестись к нему серьезно, особенно если болен грудничок и маленький ребенок.
Опасное состояние при этом заболевании состоит в том, что организму грозит обезвоживание.
Источники заражения ротавирусной инфекцией
Источником заражения является заболевший человек, при этом даже спустя десять дней после выздоровления вирус продолжает появляться в фекалиях. Поэтому так важно соблюдать бытовую гигиену.
Заражение происходит следующими способами:
- Через пищу или воду
- Пользуясь бытовыми предметами больного: посудой, полотенцем, игрушками
- При контакте с заболевшим человеком
Вирус можно подцепить в транспорте или магазине, поэтому так важно мыть руки после улицы.
Ротавирус обладает высокой устойчивостью. Попадая в организм человека, возбудитель поражает эпителиальные клетки тонкого кишечника. Вместо пораженных клеток на смену приходят незрелые эпителиоциты, которые являются функционально неполноценными, что влечет ферментативную недостаточность кишечника. В условиях недостатка ферментов желудочно-кишечный тракт не в состоянии расщепить углеводы и особенно лактозу. Поэтому больному назначают специальную диету без молочных продуктов и сдобы. Так непереваренные остатки пищи попадают в толстый кишечник, в нем накапливается жидкость из окружающих тканей и больной страдает от диареи. В результате наступает обезвоживание организма.
Болезнь не проходит, пока эпителий не станет зрелым, и кишечник не восстановится.
Симптомы
Инкубационный период составляет от нескольких часов до трех дней. Спустя некоторое время после заражения больной начинает чувствовать слабость, тошноту, повышается температура. Затем начинается рвота, она может быть как однократной, так и множественной. У детей симптомы выражены сильнее, и они переносят заболевание тяжелее. Затем начинаются боли в животе, которые сопровождаются нарушением стула: сначала он становится кашицеобразным, потом перерастает в диарею. Спустя несколько часов больной чувствует сухость во рту – это первый признак обезвоживания. Больной теряет вес, особенно это выражено у детей до года. От обезвоживания сохнут и трескаются губы и западают глаза. Если у больного спустя 6 часов нет мочеиспускания, то это опасный симптом обезвоживания. Если ребенок тяжело переносит болезнь, то лучше всего его госпитализировать. В условиях стационара больше возможностей вывести ребенка из этого состояния: применяют капельницы, чтобы ликвидировать обезвоживание.
Лечение
Основное лечение – это избавление от токсинов и восполнение жидкости в организме. Поэтому больному врач-терапевт прописывает сорбенты: энтеросгель, активированный уголь, полисорб. Для восполнения потери жидкости используют Регидрон – один пакетик на литр воды. Если обезвоживание ярко выражено, то больного госпитализируют и применяют инфузионную терапию растворами Трисоль или Рингера.
Антибиотики при ротавирусной инфекции бесполезны. Назначают их лишь в одном случае, если заболевание осложнилось кишечной инфекцией. Если диарея затянулась и больной спустя несколько дней не чувствует себя лучше, то выписывают энтерофурил или фуразолидон.
Для восстановления пищеварения назначают мезим или фестал и пробиотики.
Обязательно следует соблюдать безмолочную диету. Пищу лучше готовить на пару или отваривать. Рекомендуется кисель, рисовая каша на воде, печеные яблоки, нежирный мясной бульон, рыбу и нежирное мясо, вареный картофель.
Запрещено все овощи и фрукты, бобовые, молочные продукты, сдоба и газированные напитки. Если аппетита нет, то через силу есть не надо, но пить надо обязательно.
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо).
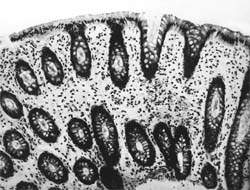 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
Методы диагностики ротавирусной инфекции
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
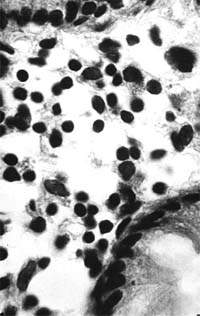 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых кли
В развитии инфекционного заболевания обычно выделяют четыре периода: латентный (инкубационный), продромальный, разгар болезни и исход. Латентный период продолжается от момента воздействия этиологического фактора до появления первых клинических признаков болезни. В этот период происходит мобилизация защитных сил организма, направленных на компенсацию возможных нарушений, на уничтожение болезнетворных агентов и удаление их из организма. Продромальный период представляет собой временной интервал от первых симптомов заболевания до полного проявления. Период выраженных проявлений заболевания характеризуется полным развитием клинической картины. При различных инфекционных заболеваниях может страдать нервная система ребенка, что клинически проявляется синдромом нейротоксикоза. Нейротоксикоз — ответная неспецифическая реакция детского организма на воздействие вирусной, бактериальной или вирусно-бактериальной флоры, характеризующаяся преимущественным поражением центральной (ЦНС) и вегетативной нервной системы. С истощением функциональных возможностей органов и систем в результате перенесенного заболевания, особенно нервной системы при ее перенапряжении, а также вследствие аутоинтоксикации или экзогенного токсикоза связывают возникновение астенического синдрома. Это наиболее частое клиническое проявление периода реконвалесценции. Утомление в течение длительного времени, которое не компенсируется полным восстановлением, вызывает синдром перегрузки, следом за которым развивается состояние истощения. Субъективно ощущаемое чувство утомления — прежде всего сигнал о перегрузке центральных регуляторных систем, неудовлетворительном состоянии энергетических ресурсов организма и аутоинтоксикации продуктами метаболизма. Длительное утомление, приводящее к истощению, по сути своей является результатом стрессорного воздействия на организм, вызывающего нарушение функций регуляторных систем — вегетативной, эндокринной и иммунной. Если стрессорные факторы действуют в течение длительного времени, может развиться реакция организма, при которой возможны функциональные изменения в виде вегетативной дисфункции [1, 6]. Синдром вегетативной дисфункции (СВД) включает в себя проявление всех форм нарушения вегетативной регуляции. Наряду с соматическими проявлениями: головокружением, головными болями, сердцебиением, одышкой, жаждой, булимией, рвотой после еды, непереносимостью отдельных видов пищи, субфебрилитетом неясного происхождения, кожными высыпаниями и др., у пациентов с СВД выявляют эмоциональные расстройства разной степени выраженности в виде тревожности, нарушения сна, беспричинного плача, а также расстройства поведения, в частности, импульсивности, повышенной двигательной активности и возбудимости, дефицита внимания, что клинически определяется как астеновегетативный или психовегетативный синдром [Вейн А. М., 1981].
Интерес и сложность проблемы астеновегетативного синдрома заключается в том, что она является комплексной: медицинской, психологической и педагогической. Однако все специалисты сходятся в том, что такое состояние существует, его необходимо диагностировать и правильно корректировать.
Задачи исследования
Данное исследование посвящено изучению динамики состояния вегетативной нервной системы детей с астеновегетативным синдромом после перенесенных инфекционных заболеваний, а также оценке эффективности препарата Тенотен детский при названной патологии.
Тенотен детский содержит сверхмалые дозы антител к мозгоспецифическому белку S-100, создан по особой технологии специально для детского возраста, оказывает успокаивающее, нормализующее настроение и поведение действие, а также выраженное вегетостабилизирующий эффект [3, 5].
Критерии включения больных в исследование:
Критерии исключения больных из исследования:
Наличие декомпенсированных заболеваний или острых состояний, которые могут влиять на проведение исследования.
Применение вегетотропных и ноотропных препаратов в период исследования и в последние две недели перед исследованием.
Участие в других клинических исследованиях в течение четырех недель перед включением в данное исследование.
Материал исследования
Для исследования методом случайной выборки дети были распределены в две группы. В основной группе (30 человек) дети в периоде реконвалесценции наряду с симптоматической витаминотерапией получали Тенотен детский по 1 таблетке 3 раза в день в течение 4 недель в сочетании со стандартной терапией. В контрольную группу (20 человек) вошли дети, получавшие стандартную витаминотерапию и симптоматическую терапию за исключением препаратов, обладающих вегетотропной активностью.
Достоверных различий по половозрастным показателям между основной и контрольной группами детей не было.
По спектру перенесенных заболеваний, их тяжести, характеру осложнений выделенные группы детей также значительно не отличались. Спектр заболеваний включал вирусные и вирусно-бактериальные инфекции дыхательных путей (этиологически подтвержденные формы гриппа и другие респираторные вирусные инфекции, тяжелые формы бронхитов и пневмоний и др.), острые средние отиты, тяжелые и осложненные формы инфекционного мононуклеоза, висцеральные формы ветряной оспы, протекающие с нейротоксикозом и везикулезными высыпаниями на внутренних органах. Данные о заболеваниях приведены в таблице.
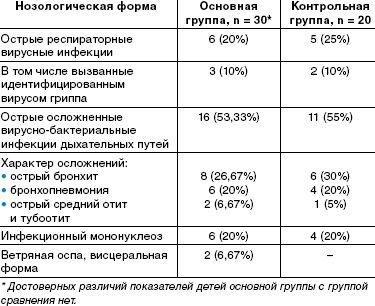
Диагностическое обследование включало в себя клиническую оценку проявлений вегетативной дисфункции, психологическое исследование, неврологическое обследование, электрокардиографию (ЭКГ).
Состояние вегетативной нервной системы определялось по исходному вегетативному тонусу, вегетативной реактивности и вегетативному обеспечению деятельности. Исходный вегетативный тонус, характеризующий направленность функционирования вегетативной нервной системы в состоянии покоя, оценивался по анализу субъективных жалоб и объективных параметров. Оценивалась степень выраженности психопатологических проявлений: утомляемость, тревожность, эмоциональная неустойчивость и др. (модифицированный опросник А. М. Вейна). Определялся внутрисистемный вегетативный тонус по индексу Кердо и межсистемный вегетативный тонус по коэффициенту Хильдебранта. Для оценки вегетативного обеспечения деятельности, отражающего в основном состояние автономной системы регуляции, проводилась клиноортостатическая проба (КОП). Функциональное состояние сердечно-сосудистой системы рассматривалось также на основании данных электрокардиографии.
Уровень внимания оценивался с использованием шкалы SNAP-IV, таблиц Шульте, по результатам модифицированного метода Пьерона–Рузерапо. Выявление расстройств кратковременной и долговременной памяти, косвенно отражающей выраженность астении, проводилось с помощью методики 10 слов и пиктограммы.
Для определения состояния эмоциональной сферы обследуемых (тревоги, депрессии) использовался ахроматический и цветовой тесты Люшера.
После окончания лечения всем детям было проведено повторное комплексное обследование для оценки эффективности терапии. Кроме того, родителям детей предлагалось оценить результаты лечения при помощи десятибалльной аналого-визуальной шкалы, где 0 — это очень плохая оценка, 10 — очень хорошая.
Результаты исследования
Перед началом исследования у всех обследуемых детей (без достоверных различий в обеих группах) с помощью опросника А. М. Вейна определялись умеренно выраженные психопатологические расстройства, в виде неустойчивости эмоционального фона (84%), повышенной тревожности (34%), утомляемости (38%), отвлекаемости (86%), нарушений сна (74%), снижения памяти, а также различные соматические проявления в виде периодических головных болей (52%), головокружения (24%), метеозависимости (12%), снижения аппетита (64%), диспептических нарушений в виде тошноты, рвоты, вздутия живота (44%).
Индекс Кердо позволил определить наличие внутрисистемной дистонии у детей, перенесших тяжелые инфекционные заболевания, он составил в среднем 32,89 ± 0,99 в обеих исследованных группах, что свидетельствовало о превалировании симпатических влияний на организм в покое.
Межсистемный вегетативный тонус, оцениваемый с помощью коэффициента Хильдебранта (средние значения составили 3,98 ± 0,03), имел, в основном, эйтонический характер.
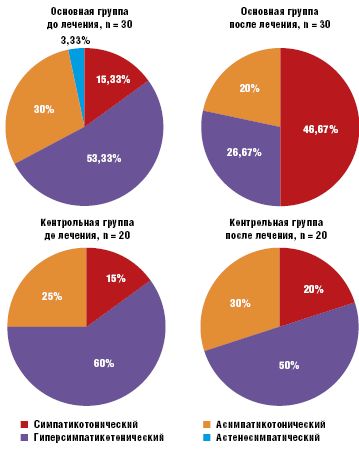
КОП, определяющая вегетативное обеспечение автономной системы регуляции, наряду с нормальным симпатикотоническим вариантом КОП, отражающим устойчивость гемодинамики в ортостазе (14% случаев), выявила и патологические варианты. Гиперсимпатикотонический вариант КОП, характеризующийся резким повышением систолического артериального давления (САД) и диастолического артериального давления (ДАД) и частоты сердечных сокращений (ЧСС) и обусловленный избыточным включением симпатико-адреналовой системы, встречался в преобладающем количестве случаев — у 58% детей. Асимпатикотонический вариант КОП, обусловленный недостаточным подключением симпатического отдела вегетативной нервной системы, при котором САД и ДАД не изменяются или падают, ЧСС остается нормальной или компенсаторно увеличивается, встречался у 28% детей с СВД. Астеносимпатический вариант КОП с падением САД и ДАД и резким увеличением ЧСС в первые минуты ортостаза, с последующей гиперсимпатикотонической реакцией был выявлен в 2% случаев.
Основными психопатологическими проявлениями СВД являлись невнимательность, гиперактивность, импульсивность. Их оценка производилась с помощью шкалы-опросника SNAP-IV (Swanson J., 1992). Показатель невнимательности в двух группах по этой шкале достоверно не отличался и составил в среднем 53,33% (норма (Swanson J., 1992) — 0,40–1,82), средний показатель гиперактивности — 1,96 ± 0,32 (норма (Swanson J., 1992) — 0,27–1,59) и импульсивности 2,13 ± 0,37 (норма (Swanson J., 1992) — 0,26–1,52) (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Выраженность астении косвенно отражается на интеллектуально-мнестических показателях, в частности на оперативной памяти: чем выше утомляемость ребенка в период после перенесенного инфекционного заболевания, тем больше страдает процесс запоминания. Оценка памяти у детей проводилась с помощью методики запоминания десяти слов. Регистрировались следующие показатели: 1) количество повторений, необходимых для воспроизведения 10 слов; 2) количество слов, воспроизведенных через 1 час.
В большинстве случаев обследуемым обеих групп (достоверных различий показателей детей основной группы с группой сравнения нет) для воспроизведения 10 слов требовалось 3 и более повторений, что свидетельствовало о снижении показателей механического запоминания. В то же время количество воспроизводимых слов через час после начала исследования значительно снизилось, что явилось признаком нарушения динамической памяти у детей с вегетативной дистонией.
В качестве методики для исследования опосредованного запоминания использовалась пиктограмма. Регистрировались следующие показатели: 1) количество воспроизведенных понятий; 2) динамика воспроизведенных понятий через 1 час.
Оценка результатов пиктограмм в целом показала, что у детей с СВД дистонией изображаемые образы часто не соответствовали реальным объектам, что впоследствии затрудняло их интерпретацию. Показатели по критерию адекватности (обоснованности связи между предложенным понятием и его пиктограммой) в среднем составили около 50%.
Проведенное по методике Люшера тестирование отразило статистически значимое отклонение преимущественно выбираемой обследуемыми цветовой гаммы от аутогенной нормы. В то же время величина вегетативного показателя не имела столь значимых различий по сравнению с возрастными нормами. Среднестатистические показатели тревожности и напряжения, определенные с помощью теста Люшера, также не имели значительных отклонений от стандартных показателей (p < 0,05 — достоверность различий по сравнению с возрастными нормами).
Таким образом, проведенное клиническое обследование детей, перенесших инфекционные заболевания, выявило наличие у них различной степени выраженности проявлений СВД. Безусловно, такие психовегетативные нарушения отражались на периоде реконвалесценции, ухудшали качество жизни и требовали их адекватной коррекции.
В качестве альтернативного препарата для коррекции проявлений СВД был использован Тенотен детский с успокаивающим и выраженным вегетостабилизирующим действием (Лобов М. А., 2008). Основная группа детей (30 человек) получала Тенотен в дозе 3 таблетки/сутки курсом 1 месяц в сочетании со стандартной витаминотерапией. Контрольная группа детей (20 человек) получала стандартную терапию с применением лекарственных средств, не обладающих психотропной и вегетотропной активностью. По окончании курса лечения были проведены повторные клинические исследования.
Прием препарата Тенотен детский в течение месяца обеспечил достоверное (в сравнении с контрольной группой) улучшение показателей психовегетативного статуса и снижение частоты соматоневрологических расстройств у детей, принимавших Тенотен детский, тогда как в контрольной группе детей эти показатели оставались практически на прежнем уровне (рис. 1, 2).
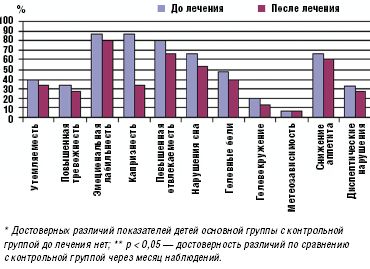
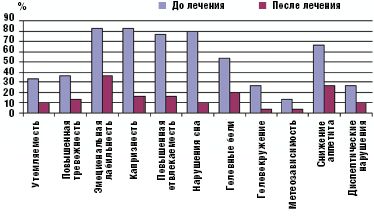
Улучшение показателей вегетативного тонуса отмечалось не только в его психоэмоциональной (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна), но и соматоневрологической (головные боли, головокружение, снижение аппетита, диспептические нарушения) составляющей. Полученные данные отражены на рис. 1.
Качественно изменились результаты КОП. У детей, принимавших Тенотен детский, отмечалась нормализация показателей вегетативного обеспечения (симпатикотонический вариант КОП) с 15,33% детей в начале терапии до 46,67% (p < 0,05), у остальных наметилась четкая тенденция к улучшению. В контрольной группе показатели КОП остались практически на прежнем уровне. Данные отражены на рис. 3.
Была выявлена положительная динамика в отношении патопсихологических проявлений. После курсового применения препарата уменьшение выраженности мнестических и поведенческих симптомов (невнимательность, гиперактивность, импульсивность) отмечалось в среднем у 85% детей. Все показатели шкалы SNAP-IV у детей основной группы после лечения Тенотеном достоверно снизились (p < 0,05). Показатели гиперактивности и невнимательности снизились до нормальных значений, абсолютные показатели импульсивности также значительно уменьшились в наблюдаемой группе.
По данным психометрического исследования у пациентов с СВД основной группы были выявлены достоверные положительные изменения при проведении тестов на память и внимание в сравнении с контрольной группой. Данные тестирования выявили отчетливое улучшение показателей механической и динамической памяти у 30% детей (p < 0,05), а также опосредованной памяти в тестах с пиктограммой — повышение показателя адекватности до 75% (p < 0,05).
Динамическая оценка результатов цветового теста Люшера выявила относительную стабилизацию психоэмоционального состояния у детей основной группы, что отразилось на предпочитаемой цветовой гамме и приближении ее к аутогенной норме (по коэффициенту суммарного отклонения от аутогенной нормы — p < 0,05). У детей контрольной группы определяемые показатели не имели статистически значимых изменений.
По окончании исследования родители оценили результаты лечения при помощи десятибалльной аналого-визуальной шкалы. В среднем успешность лечения в основной группе была оценена на 7–8 баллов, в контрольной — на 4–5 баллов.
Выводы
Проведенное исследование показало, что у детей, перенесших инфекционные заболевания, имеются в различной степени выраженные симптомы астеновегетативного синдрома (СВД) в виде психоэмоциональных (утомляемость, тревожность, эмоциональная неустойчивость, отвлекаемость, нарушение сна) и соматоневрологических (головные боли, головокружение, снижение аппетита, диспепсия) нарушений.
Астеновегетативные нарушения отрицательно влияют на процесс реконвалесценции у детей после перенесенных тяжелых инфекционных заболеваний, удлиняя этот период и ухудшая качество жизни пациентов.
Применение препарата Тенотен детский после перенесенных инфекционных заболеваний в дозе 1 таблетка 3 раза в день приводит к нормализации показателей вегетативного тонуса и обеспечения, уменьшает частоту соматоневрологических проявлений вегетативной дисфункции, что способствует более быстрому завершению периода восстановления.
Тенотен детский устраняет проявления астении, стабилизирует психоэмоциональное состояние детей: улучшает настроение, успокаивает, способствует снижению раздражительности и капризности, облегчает процессы обучения (запоминание, концентрацию внимания, усидчивость).
Препарат Тенотен детский безопасен у пациентов старшего дошкольного и младшего школьного возраста. Побочных эффектов во время применения препарата не было отмечено.
Доказанное успокаивающее, выраженное вегетотропное и антиастеническое действие препарата Тенотен детский позволяет рекомендовать его для применения у детей с различными проявлениями вегетососудистой дисфункции после перенесенных инфекционных заболеваний.
По вопросам литературы обращайтесь в редакцию.
Е. В. Михайлова, доктор медицинских наук, профессор
Т. Ильичева
Cаратовская областная детская инфекционная клиническая больница,
Саратовский государственный медицинский университет, Саратов
Читайте также:

