Острый токсический гепатит у крыс
Обновлено: 25.04.2024
Для профилактики и лечения различных заболеваний печени все шире используются антиоксиданты природного происхождения. Изучен побочный продукт, получаемый при производстве дигидроквертицина, получивший название биофлавоноидный комплекс лиственницы. В состав препарата вошли: олигомер дигидрокверцетина, терпеновые углеводороды, эфиры смоляных кислот, фитостерины, биофлавоноиды (дигидрокемпферол, кемпферол, кверцетин, изорамнетин, листвинидин, спиробиофлавоноиды). На модели острого токсического гепатита белых крыс, вызванного введением четырёххлористого углерода, показаны высокие гепатопротекторные свойства биофлавоноидного комплекса лиственницы. Проведено сравнение фармакологического действия препарата с ларивитолом. Следует отметить более выраженное влияние биофлавоноидного комплекса лиственницы. Установлено, что биофлавоноидный комплекс лиственницы и ларивитол положительно влияют на восстановление функции печени, проявляющееся нормализацией содержания уровня ферментов переаминирования и щелочной фосфатазы в сыворотке крови, повышением уровня альбуминов и восстановлением функции гепатоцитов.

2. Голиков С. Н., Саноцкий И. В., Тиунов Л. А. Общие механизмы токсического действия // АМН СССР. – Л.: Медицина, 1986. – 280 с., ил.
3. Додонов Н. С. Влияние флавоноидов на перекисное окисление липидов и активность антиоксидантных систем при токсическом поражении печени: Дис. . канд. фарм. наук. Самара, 2005. – 188 с.
4. Косарев В. В., Бабанов С. А. Токсические (токсико-аллергические) гепатиты // Consilium medicum. Гастроэнтерология. – 2009. – № 2. – С. 29-30.
5. Кравченко Л. В, Трусов Н. В., Ускова М. А, Аксенов И. B., Авреньева Л. И., Гусева Г. В., Васильева М. А., Селифанов А. В., Тутельян В. А. Характеристика острого токсического действия четырёххлористого углерода как модели окислительного стресса. // Токсикологический вестник. – 2009. – № 1. – С. 12-18.
6. Плохинский Н. А. Биометрия / Н. А. Плохинский. – М.: Изд-во Московского университета, 1987. – 367 с.
7. Сергеева Е. О. Влияние флавоноидов на механизмы развития окислительного стресса при токсических поражениях печени: Дис. . канд. фарм. наук. Пятигорск, 2007. – 202 с.
В патогенезе токсического поражения печени большое значение имеет непосредственное действие метаболизируемого вещества на её микросомальную систему с образованием свободных радикалов, индуцирующих аутокаталитическое перекисное окисление микросомальных липидов, что в дальнейшем приводит к выраженным функциональным и структурным изменениям гепатоцитов [2, 5].
Образование свободных радикалов и реактивных метаболитов является важным механизмом повреждения клеток и развития патологических процессов в организме. Выделяют следующие реактивные молекулы, играющие роль в развитии некротического повреждения гепатоцитов: супероксидный радикал, гипохлорит, хлорамины, синглетный кислород, пероксирадикалы, гидроксильный радикал [4].
Для профилактики и лечения различных заболеваний печени все шире используются антиоксиданты. Они замедляют или полностью ингибируют процессы свободнорадикального окисления, действуют на стадии образования свободных радикалов, их связывания и разрушения, а также утилизации продуктов окисления, из которых образуются новые радикалы. Особое внимание уделяется антиоксидантам природного происхождения [7].
Перспективным источником биологически активных соединений с антиоксидантными и антирадикальными свойствами считается применение биофлавоноидов, обладающих малой токсичностью, широтой терапевтического действия, а также возможностью длительного применения без риска возникновения побочных реакций. Опубликованы многочисленные данные по гепатозащитному действию флавоноидов [3].
Цель исследования - изучить гепатопротекторные свойства биофлавоноидного комплекса лиственницы на модели острого токсического гепатита белых крыс и сравнить его действие с ларивитолом.
Для реализации указанной цели были поставлены следующие задачи:
- вызвать токсический гепатит у белых крыс путём применения четырёххлористого углерода;
- установить лечебные свойства биофлавоноидного комплекса лиственницы и сравнить его действие с ларивитолом.
Материал и методы исследования
Изучение гепатопротекторных свойств препаратов проводили на белых беспородных крысах обоего пола массой 180-200 г [1]. При этом по принципу аналогов было создано 4 группы животных - одна контрольная и три опытных - по 12 крыс в каждой. Условия содержания и кормления были одинаковы для всех групп животных.
Первая группа служила контролем (интактные крысы). Острый токсический гепатит у крыс второй, третьей и четвёртой опытных групп вызывали внутрибрюшинным введением четырёххлористого углерода (ССl4) на вазелиновом масле из расчёта 0,4 мл на 100 г массы тела в течение трех суток однократно. Третьей опытной группе сразу после окончания введения четыреххлористого углерода в течение 14 суток применяли биофлавоноидный комплекс лиственницы из расчёта 1 г/кг массы тела, и четвёртой опытной группе в течение такого же периода времени применяли ларивитол из расчёта 0,5 г/кг массы тела. Схема опыта представлена в табл. 1.
Таблица 1. Схема опыта
Биофлавоноидный комплекс лиственницы
Все манипуляции (взвешивание, введение препаратов, декапитация) осуществляли с 9 00 до 12 00 ч с целью исключения суточных влияний на метаболизм.
Для оценки эффективности действия препаратов проводили клинический осмотр животных, измерение массы и контроль некоторых биохимических показателей сыворотки крови (аланинаминотрансфераза, аспартатаминотрансфераза, креатинин, общий билирубин, щелочная фосфатаза, общий белок и т.д.). Биохимические исследования выполняли по стандартным методикам с использованием биохимического анализатора.
Цифровой материал исследований подвергался математической обработке в описании Н. А. Плохинского [6] с вычислением средних арифметических (М), их среднестатистических ошибок (m) и критерия достоверности (р). Различия считали достоверными при р
Результаты исследований
Во время проведения опыта внешние признаки интоксикации (у животных второй группы) проявлялись на второй - третий день после введения четырёххлористого углерода: отмечались вялость, гиподинамия, нежелание принимать пищу, потеря веса и др. В дальнейшем симптомы интоксикации постепенно нарастали и достигали своего максимума к шестому дню, а затем они постепенно убывали. У животных 3-й опытной группы, которым вводился биофлавоноидный комплекс лиственницы после применения четырёххлористого углерода, явления интоксикации наступали несколько позже (на 4 - 5 сутки) и были менее выраженными.
Действие ларивитола на организм крыс было менее выражено, и масса животных изменялась в меньшей степени за весь период проведения эксперимента. Данные таблицы 2 показывают, что проведение интоксикации крыс четырёххлористым углеродом существенно влияет на их рост и развитие. Следует отметить прирост живой массы крыс первой группы и её снижение в группах, получавших гепатопротекторы. Однако менее выраженное снижение массы с некоторым увеличением её к концу опыта зафиксировано в третьей группе.
Таблица 2. Динамика массы крыс
биофлавноидный комплекс лиственницы
Биохимические исследования сыворотки крови животных представлены в табл. 3.
Таблица 3. Биохимические показатели крови крыс
Щелочная фосфатаза, ед/л
Из представленных в таблице данных видно, что во второй группе под действием четырёххлористого углерода происходило существенное повышение таких показателей как аспартатаминотрансфераза и аланинаминотрансфераза (на 7,9 и 34,3 % по сравнению с контролем). Возрастание активности аланинаминотрансферазы обычно рассматривается в качестве показателя степени токсического поражения печени и повреждения плазматической мембраны.
Следует отметить, что в третьей и четвёртой опытных группах, где после введения четырёххлористого углерода, крысам применяли биофлавоноидный комплекс лиственницы и ларивитол, не было отмечено существенного повышения этих ферментов. Так, после 14-суточного скармливания биофлавноидного комплекса лиственницы, уровень аспартатаминотрансферазы даже немного снизился (на 2,7 %), а аланинаминотрансферазы - возрос (на 0,8 %) по сравнению с интактными животными. Такая же картина наблюдалась и после применения ларивитола. Повышение ферментов переаминирования было незначительным (на 7,2 и 5,3 %), но, ни в одном из случаев разница с контролем не подтвердилась статистически.
Повышение активности щелочной фосфатазы во второй группе после введения четырёххлористого углерода (на 6,4 %) характерно для холестатического синдрома, обусловленного нарушением желчевыделительной функции гепатоцитов и поражением желчных канальцев (внутрипеченочный холестаз). После применения биофлавоноидного комплекса лиственницы уровень щелочной фосфатазы наоборот снизился (на 0,6 % по сравнению с контролем), а после скармливания ларивитола - повысился (на 0,3 %), но, ни в одном из случаев разница с контролем не подтвердилась статистически, что свидетельствует о высокой терапевтической эффективности обоих препаратов.
Изменения остальных показателей сыворотки крови животных не имели статистического подтверждения с контрольными показателями.
При проведении макроскопических исследований установлено токсическое поражение печени после введения CCl4. При этом отмечались жировая дистрофия, изменение окраски и дряблая консистенция. Необходимо отметить, что после применения биофлавоноидного комплекса лиственницы и четырёххлористого углерода, печень животных не имела существенных патологических изменений и мало отличалась от печени интактных крыс из первой группы (таблица 4).
Таблица 4. Морфологическая характеристика печени исследуемых крыс
Характеристика печени крыс
Биофлавноидный комплекс + ССl4
Плотная, гладкая, блестящая
Плотная, диффузно утолщена, блестящая
Плотная, дряблая, блестящая
Плотная, дряблая, блестящая
Без патологических очагов
Небольшое количество очагов некроза
Умеренное количество очагов некроза
Без патологии. Строение печени не нарушено
Портальные тракты склерозированы, пограничные пластинки разрушены. Гепатоциты с явлениями зернистости и жировой дистрофии. Очаговый некроз гепатоцитов
Некротические процессы и жировое перерождение долек печени, более выраженные вокруг центральной вены. На периферии широкая полоса нормальных гепатоцитов
В дольках печени умеренное количество очагов некроза и жирового перерождения. Наиболее интенсивные изменения в центральной части печеночных долек. На периферии узкая полоса нормальных гепатоцитов.
На модели экспериментального токсического гепатита белых крыс нами были изучены гепатопротекторные свойства биофлавоноидного комплекса лиственницы и проведено его сравнение с ларивитолом.
Поступление четырёххлористого углерода в организм крыс приводило к развитию цитолитического (повышение в сыворотке крови содержания аспартатаминотрансферазы и аланинаминотрансферазы), холестатического (повышение активности щелочной фосфатазы и концентрации билирубина), гепатодепрессивного (снижение общего белка и альбуминов) синдромов поражения печени. Всё это свидетельствует об усилении процессов перекисного окисления липидов и ослаблении функционирования антиоксидантной системы организма. Это обусловлено образованием радикала СClз при метаболизме четырёххлористого углерода, что является пусковым звеном в механизме повреждающего действия яда. Образовавшиеся радикалы, взаимодействуя с липидами, стимулируют развитие перекисного окисления липидов и вызывают повреждение биологических мембран.
При острой интоксикации четырёххлористым углеродом в паренхиме печени отмечались некроз, жировая дистрофия гепатоцитов и выраженная воспалительная реакция.
Применение крысам биофлавоноидного комплекса лиственницы в дозе 1,0 г/кг массы тела на фоне экспериментального токсического гепатита оказывало выраженное гепатопротекторное действие, которое проявлялось уменьшением нарушений функционального состояния печени (ферменты переаминирования и щелочная фосфатаза находились в пределах физиологической нормы и их значения незначительно отличались от показателей интактных животных).
Использование ларивитола у подопытных животных четвёртой группы также оказывало гепатопротекторное действие, хотя и менее выраженное, но также приводило к нормализации уровня печёночных ферментов в сыворотке крови и нормализации функции печени.
Таким образом, проведённые нами исследования свидетельствуют о высоком гепатопротекторном действии обоих препаратов с небольшим преимуществом биофлавоноидного комплекса лиственницы.
На основании полученных данных можно сделать вывод, что биофлавоноидный комплекс лиственницы и ларивитол можно рекомендовать в качестве гепатопротекторов при токсическом поражении печени животных.
Рецензенты
Скворцов В. Н., д.в.н., заведующий Белгородским отделом Всероссийского научно-исследовательского института экспериментальной ветеринарии им. Я. Р. Коваленко, г. Белгород.
Булекбаева Л.Э. 1 Ерлан А.Е. 1 Рыспекова Ш.О. 2 Джусипбекова Б.А. 2 Алпысбаева К.К. 2 Артыкбаева У.С. 2
Статья посвящена исследованию морфологических свойств крови и лимфы, реогепатографии и уровень кровоснабжении сосудов у крыс. При экспериментальном токсическом гепатите у крыс лимфатическая система вовлекается в патологический процесс. Возрастает уровень тромбогенных процессов не только в крови, но и в лимфе. Изменение реогепатографии обуславливаются нарушением оттока в паренхиме, изменением эластичности сосудов печени и развитием артериовенозных шунтов.

2. Забродский П.Ф., Германчук В.Т. Влияние тетрахлорметана на показатели иммунной системы // Бюлл. экспер. биол. и мед. – 2004. – № 1. – С. 56–57.
3. Камалов Ю.Р., Северов М.В., Олейникова Е.Б. Значение ультразвукового исследования вен портальной системы для выявления синдрома портальной гипертензии у больных циррозом печени.// Тез.1-го съезда Ассоциации специалистов ультразвуковой диагностики в медицине. – М., 1991. – С. 96.
4. Клишина И.М. Влияние гомогената трутеновых личинок на уровень белка и нуклеиновых кислот в условиях токсической гепатопатии // Матер. 55-ой регион. конф. по фармации, фармакологии и подготовка кадров. – Пятигорск, 2000. – С. 195–196.
5. Копылова Л.Е., Саркова Е.В., Асташов В.В. Лимфатический регион печени матери и потомства при беременности, осложненной действием экотоксикантов.// Бюлл. СО РАМН. – 2008. – № 5. – С. 38–43.
6. Кунцевич Г.И., Скуба Н.Д., Белолапотко Е.А. Роль комплексного ультразвукового исследования в дифференциальной диагностике очаговых образований печени. Методические рекомендации. – М., 1997. – C. 45.
7. Юрова Е.Г., Асташов В.В., Казаков О.В. Структура брыжеечных лимфатических узлов у крыс с хроническим токсическим гепатитом и в условиях его коррекции лазерным излучением и фитосорбционными комплексами // В кн.: Проблемы экспериментальной клинической и профилактической лимфологии. – Новосибирск, 2002. – С. 389–391.
8. Raom R., Kuman K.V et. al. Влияние фруктозы на активность синтезы оксид азота под действием CCl4 // Indian J. Exp. Biol. – 2001. – V. 39, № 1. – P. 68–69.
9. Zhang J., Zong Ch., Li D., Zhan R. Взаимосвязь между локальной ренин-ангиотензин-альдестероновой системой и фиброзом печени крыс // Word. Chin. J. Dig. – 2002. – V. 10, № 4. – P. 397–400.
У крыс после введения внутрибрюшинно CCl4 (100 мкг/кг) через 24 часа развивался выраженный гепатит. Отмечено снижение активности синтеза оксида азота в эндотелиальных и гладкомышечных клетках кровеносных сосудов [8]. Острое отравление тетрахлорметаном per os крыс в дозе 0,75 ЛД50 через 4 суток вызывало снижение основных гуморальных и клеточных иммунных реакций [2].
При хроническом токсическом гепатите крыс, вызванном введением 4-х хлористого углерода, наблюдалось увеличение паракортикальной зоны в брыжеечных лимфатических узлах, что свидетельствует, по мнению авторов, об усилении иммунного ответа по гуморальному типу [7].
После трехкратного введения 50 % масляного раствора CCl4 через день крысам отмечено снижение в печени нуклеиновых кислот на 16 % и общего белка на 18 % по сравнению с показателями интактных животных [4].
Хроническая интоксикация животных тетрахлорметаном вызывала выраженные дистрофические и воспалительные изменения в печени и в регионарных лимфатических узлах. При беременности у самок и у потомства эти изменения сохранялись, но были выражены меньше. Авторы считают, что в этих условиях у животных лучше сохранялась дренажно-детоксикационная функция лимфатической системы [5]. Радиоиммунным методом установлено увеличение содержания ренина, ангиотензина I и II, альдестерона и активности ангиотензин-конвертирующего фермента при токсическом гепатите, вызванным введением CCl4 крысам [9].
В последние годы среди неинвазивных методов диагностики хронического гепатита и портальной гипертензии важное место отводится ультразвуковым исследованиям [7, 1].
Материалы и методы исследования
Эксперименты проведены на 102 половозрелых белых лабораторных крысах-самцах линии Вистар, массой 180-250 гр. Для создания модели токсического гепатита использовали 50 % масляный раствор четыреххлористого углерода (CCl4), который вводился внутрибрюшинно (0,3 мг/кг) один раз в течение 3 суток через день. Наличие токсического гепатита у крыс было подтверждено гистологическими и биохимическими исследованиями.
Острые опыты проводились на 2 группах крыс: 1-я группа крыс – контрольная (24 интактных крыс) и 2-я группа – это крысы с моделью токсического гепатита (78 крыс) с соблюдением основных принципов Хельсинской конвенции о гуманном отношении к лабораторным животным. Через 15 суток после интоксикации крыс 4-х хлористым углеродом под эфирным наркозом прижизненно регистрировали лимфоток из грудного и кишечного лимфатического сосуда.
Морфологический состав крови у крыс с токсическим гепатитом изучали на гематологическом анализаторе SYSMEXKX-219 (Япония). Время свертывания крови и лимфы определяли по Сухареву, вязкость – на вискозиметре ВК-4, рН – на анализаторе OSMETECHOPTITMССА (США).
Определение морфологического состава лимфы проводили в камере Горяева с сеткой Бюркера. Определяли число лейкоцитов, лейкоцитарную формулу – в сухих мазках лимфы, окрашенных по методу С.П. Романовского. Для изучения гистологических препаратов использовали световой микроскоп Leica – DМ-1000.
Полученный материал обработан на компьютере вариационно-статистическим методом с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
Результаты реогепатографического исследование у крыс контрольных группы представляли собой чередующие систолические волны достаточной амплитуды, с закругленной вершиной и диастолическим подъемом. Скорость быстрого кровенаполнения составляла в контроле 1,02 ± 0,06 Ом/с, скорость медленного кровенаполнения 0,15 ± 0,02 Ом/с. На фоне токсического гепатита наблюдали, что форма кривой характеризовалась появлением заостренной и зазубренной, а в некоторых случаях платообразной вершины.
Результаты исследований на крысах с токсическим гепатитом показали противоречивые данные, в одних случаях наблюдали увеличение амплитуды систолической волны на 65 %.Скорость быстрого кровенаполнения составляла 6,06 ± 0,5 Ом/с, а медленного кровенаполнения – 4,05 ± 0,02 Ом/с. В других случаях наблюдали уменьшение амплитуды диастолической и систолической волны на 45 %, с одновременным уменьшением скорости быстрого кровенаполнения до 0,70 ± 0,02 Ом/с, но возрастала скорость медленного кровенаполнения (рисунок).
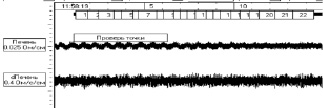
а) реогепатограмма контрольной группыу крыс
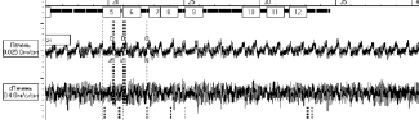
б) реогепатограмма на фоне токсического гепатита у крыс
Кривая реогепатограммы у крыс с контрольной группой и на фоне токсического гепатита
По мнению некоторых авторов, изменение кривой реогепатограммы происходит разнонаправлено, но, в основном, зависит от этиологии заболеваниях [9]. При вирусной этиологии происходит снижение амплитуды систолической волны, при токсическом гепатите происходит обратный эффект т.е. идет увеличение амплитуды систолической волны.
Изучение скорости кровотока методом лазерной ультразвуковой доплерографии у крыс на фоне хронической затравки СCl4 показало, что скорость линейного кровотока в воротной вене снижалась, а в печеночной артерии скорость кровотока повышалась по сравнению с контрольной группой. Пульсационный индекс и индекс периферического сопротивления уменьшались в воротной вене и в печеночной артерии на 25 % .Изменение этих показателей указывает на наличие нарушения гемодинамики печени на фоне токсического гепатита у крыс и начальным формированием проявлений портальной гипертензии (таблица).
Проведенными исследованиями продемонстрировано, что адопция ликвора от интактных крыс, не влияет на показатели иммунного статуса крыс с моделью токсического гепатита, предположительно, за счет угнетения пластических процессов, обусловленного печеночной дисфункцией. Напротив, реципиенты ликвора с моделью токсического гепатита подверглись значительному снижению показателей иммунного статуса, вследствие адопции ликвора от крыс с аналогичной моделью, воспроизведенной за 14 дней до адопции, за счет сбоя центральных механизмов поддержания иммунного гомеостаза. Также, продемонстрировано, что адопция ЦСЖ от доноров с моделью гепатита, стимулирует рост показателей активности иммунной системы у изначально интактных крыс, вероятно, за счет адаптационной интенсификации регуляторных импульсов со стороны центра поддержания иммунного гомеостаза.

Известно, что вирусный гепатит, как и любое другое заболевание, сопровождающееся нарушением синтетической функции печени, является системной патологией, протекающей с поражением многих систем и органов [3] .В этой связи, множество работ посвящено изучению патогенетической картины печеночных патологий и разработке стратегии лечения гепатитов, главным образом вирусных. Для достижения объективных результатов важным является применение адекватной экспериментальной модели гепатопатологического процесса. Имеются указания на то, что модель хронического токсического гепатита является оптимальной для изучения вирусных гепатитов [1]. Моделирование гепатитов способствует познанию их патогенеза, в том числе и с позиции роли центральных иммунорегуляторных влияний на их течение, поскольку статус иммунной системы, безусловно, играет важную роль в исходе заболеваний печени. С другой стороны, нарушение иммунитета при печеночных патологиях представляет интерес ввиду значимости печени в поддержании гомеостаза, в том числе и нейроиммуноэндокринного. Таким образом, перспективными представляются разработки, касающиеся изучения взаимодействия нейроиммунитета и печени.
Цель исследования.
Оценить изменение иммунологических показателей у крыс с хроническим токсическим гепатитом под влиянием адопции аллогенного ликвора, обладающего различной степенью иммунотропной активности.
Материал и методы исследования.
В работе приведены данные, полученные от 32 крыс линии Brown Norway, весом 160-180г. Оперативное вмешательство осуществлялось под гексеналовым наркозом (доза - 70мг./кг., внутрибрюшинно). Для воспроизведения модели хронического токсического гепатита (ХТГ) был использован гелиотрин, вводимый внутрибрюшинно в дозе 50 мг/кг массы тела один раз в неделю в течение 35 дней [2]. Адопция цереброспинальной жидкости (ЦСЖ) в III желудочек мозга проводилась раз в сутки согласно стандартной стереотопографии на аппарате WPI (Berlin, Germany) [6]. Количественное определение показателей иммунного статуса проводили с использованием набора дифференцировочных маркеров (Sandoz Pharma AG, Switzerland). Статистическая обработка результатов проводилась с расчетом критерия Стъюдента, различия считали достоверными при значении p≤0,05.
Полученные результаты и их обсуждение.
В проведенных ранее экспериментах было показано, что крысы Brown Norway (BN) с ХТГ имеют достоверно сниженные показатели иммунного статуса по сравнению с нормальными показателями интактных крыс. Примечательно, что при двукратном (в среднем) снижении количества клеток оцениваемых лейкоцитарных элементов, процентное соотношение показателей иммунограммы не изменялось. Вероятно, число всех типов клеток лейкоцитарного звена уменьшилось за счет генерализованного угнетения метаболической функции печени и последующего подавления центральных звеньев иммунорегуляции, что подтверждается исследованиями отдельных авторов [10]. В этой связи, проведено три серии экспериментов направленных на определение степени вовлеченности иммунокомпетентного микроокружения гипоталамуса в механизмы супрессирования иммунной системы при ХТГ.
Задачей первой экспериментальной группы крыс являлось изучение влияния адопции аллогенного ликвора, полученного от интактных крыс линии Sprague Dawley (SD) на показатели иммунного статуса при ХТГ. Полученные данные свидетельствуют, что ни один из оцениваемых показателей, за исключением общего пула лимфоцитов, каких-либо значимых количественных изменений не претерпел, количество нейтрофилов, мононуклеаров, В-лимфоцитов, Т-лимфоцитов, NK-клеток и лейкоцитов в целом незначительно колебалось в ту или иную сторону. Лишь абсолютное число лимфоцитов в периферической крови животных изучаемой группы достоверно возросло на 9% в сравнении с их количеством в крови контрольной группы крыс с ХТГ, но без манипуляций с составом ЦСЖ. (табл.1).
Таблица 1. Влияние адопции аллогенного ликвора на иммунный статус крыс с ХТГ
показатели иммунитета (×10 6 /L)
крысы с ХТГ (контроль)
ХТГ + адопция интактной ЦСЖ
ХТГ + адопция ЦСЖ от крыс с ХТГ
крысы без ХТГ + адопция ЦСЖ от крыс с ХТГ
Примечания: во всех сравниваемых группах n = 8
a - достоверно по отношению к контрольной группе крыс
b - достоверно по отношению к группе крыс с адопцией аллогенной интактной ЦСЖ
* - достоверно по отношению к группе интактных крыс
Таким образом, исследованиями продемонстрировано, что аллогенная адопция ЦСЖ полученной от интактных крыс, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ. По данным ряда авторов, стимуляция центральных звеньев иммунорегуляции ведет к избирательной модуляции нарушенных звеньев периферической иммунной системы, возвращая супрессированные либо гиперактивированные механизмы реализации иммунных процессов к физиологически нормальным значениям [5]. Казалось бы, внутрижелудочковое введение нормальной ЦСЖ, имеющей физиологичный состав иммунотропных компонентов и обладающей способностью модулировать подавленную активность центра поддержания иммунного гомеостаза, должно ослабить интенсивность иммуносупрессии у крыс с токсическим гепатитом, однако этого не произошло. Отсутствие какого-либо воздействия адопции ЦСЖ на активность иммунитета экспериментальной группы крыс, возможно, обусловлено неспособностью периферической иммунной системы прореагировать на смену вектора центральной эфферентной импульсации (в условиях "искусственной оптимизации" состава ЦСЖ), за счет тотального подавления анаболических (пластических) процессов в организме реципиентов ЦСЖ, имеющих печеночную дисфункцию.
Результаты, полученные во второй серии экспериментов, направленных на изучении роли ликвора полученного от аллогенных крыс-доноров, на которых за 14 дней до забора ЦСЖ была воспроизведена аналогичная модель ХТГ, демонстрируют, что животные изучаемой группы с ХТГ (реципиенты ЦСЖ) подверглись значительному снижению показателей иммунного статуса, вследствие адопции ликвора. Так, количество лейкоцитов в изучаемой группе было достоверно снижено в сравнении с контрольной группой крыс с ХТГ (без адопции ЦСЖ) и в сравнении с группой крыс (первой экспериментальной серии) с ХТГ и с адопцией ЦСЖ от интактных животных линии SD. Аналогичные изменения были характерны и в отношении нейтрофилов и клеток мононуклеарного ряда. Общий пул лимфоцитов, включая Т- и В-популяции и натуральные киллеры, также подвергся значительному снижению числа клеток в периферической крови. Анализ показателей иммунограммы позволяет предполагать, что адопция аллогенной ЦСЖ в гипоталамическое ликворное микроокружение крыс реципиентов ЦСЖ ведет к угнетению активности иммуноцитов периферической крови за счет сбоя центральных механизмов поддержания иммунного гомеостаза. Указанное подавление иммунитета крыс реципиентов ликвора, полученного от особей с моделью патологии усугубленной с течением времени, возможно, обусловлено замещением собственного ликвора, донорским ликвором, с составом биоактивных субстанций (главным образом цитокинов) истощенным моделью токсического гепатита более прогрессировавшего у крыс доноров ЦСЖ. Таким образом, адопция "декомпенсированного" ликвора от крыс с прогрессировавшей с течением времени моделью токсического гепатита индуцирует ускорение повреждения функций периферической иммунной системы реципиентов ЦСЖ, за счет экспериментально спровоцированной дезрегуляции механизмов поддержания иммунного гомеостаза в гипоталамусе, как результат адопции "декомпенсированного" (истощенного) ликвора. С другой стороны, возможен и иной механизм снижения активности периферической иммунной системы. По утверждению ряда авторов, угнетение периферических иммунных процессов может являться результатом компенсаторного действия центральных иммунотропных импульсов, направленных на предотвращение цитокиновой гиперсекреции в условиях патологии [4;9].
В третьей серии экспериментов оценивалось влияние адопции аллогенной ЦСЖ от крыс с моделью ХТГ на состояние иммунной системы изначально интактных крыс. Анализ полученных данных позволяет судить о том, что аллогенная адопция ЦСЖ от крыс с моделью патологии ведет к повышению показателей иммунограммы у крыс реципиентов ЦСЖ. В частности, общее количество лейкоцитов повысилось на 13% в сравнении с тем же показателем у интактных крыс. Число нейтрофилов, клеток мононуклеарного ряда и общий пул лимфоцитов также статистически значимо возросли. Среди клеток лимфоцитарного ряда достоверное увеличение клеточности имело место среди В-популяции лимфоцитов и натуральных киллеров. В то же время, общее число Т-лимфоцитов и, в частности, их хелперная и эффекторная субпопуляции не проявили значимого увеличения, однако тенденция к повышению числа клеток наблюдалась для обеих оцениваемых субпопуляций Т-клеток. Таким образом, показано, что центральное введение ЦСЖ, полученной от доноров с моделью гепатита, стимулирует рост показателей активности периферической иммунной системы. Возможным механизмом действия адоптированной ЦСЖ является адаптационное усиление интенсивности иммунорегуляторных импульсов со стороны центра поддержания иммунного гомеостаза в гипоталамусе. Указанная интенсификация иммуностимулирующих гипоталамических импульсов, возможно, обусловлена составом адоптированной ЦСЖ, свидетельствующим о глубоком подавлении активности периферической иммунной системы, вызванном моделью токсического гепатита в организме донора ЦСЖ. Вероятно, обедненный цитокиновый состав адоптированной ЦСЖ индуцирует компенсаторное повышение концентрации цитокинов в ЦСЖ и, следовательно, периферической крови реципиентов ликвора, т.е. происходит активация иммунной системы экспериментальной группы крыс без ХТГ, обусловленная искусственно спровоцированной ложной афферентной сигнализацией в центр поддержания иммунного гомеостаза. Предложенная гипотетическая схема стимуляции иммунитета изначально интактных крыс реципиентов ЦСЖ согласуется с утверждением отдельных авторов о том, что введение различных иммунологически активных субстанций в ІІІ желудочек мозга позволяет изменять вектор иммунотропных влияний гипоталамуса в желаемом направлении [7;8].
Заключение.
- Адопция аллогенной интактной ЦСЖ в гипоталамическое ликворное микроокружение, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, смоделированным за 14 дней до адопции, ведет к угнетению активности иммуноцитов периферической крови за счет интенсификации сбоя центральных механизмов поддержания иммунного гомеостаза у крыс реципиентов ликвора с аналогичной моделью ХТГ, вызванной позднее.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, индуцирует компенсаторное повышение количества иммуноцитов периферической крови у изначально интактных реципиентов ликвора, т.е. имеет место активация иммунной системы крыс без ХТГ, обусловленная ложной активирующей афферентной сигнализацией в центр поддержания иммунного гомеостаза.
Работа выполнена при поддержке Научного Комитета НАТО (грант FEL.RIG.980765).
Ключевые слова
Об авторах
Трапезникова Елена Геннадьевна, научный сотрудник лаборатории спортивной гигиены
188663, Ленинградская область, Всеволожский район, г.п. Кузьмоловский
Попов Вадим Борисович, доктор биологических наук, ведущий научный сотрудник лаборатории общей токсикологии и гигиенического нормирования
188663, Ленинградская область, Всеволожский район, г.п. Кузьмоловский
Радилов Андрей Станиславович, доктор медицинских наук, профессор, и.о. директора
188663, Ленинградская область, Всеволожский район, г.п. Кузьмоловский
Шилов Виктор Васильевич, доктор медицинских наук, профессор, заведующий кафедрой токсикологии, экстремальной и водолазной медицины
191015, г. СанктПетербург
Список литературы
1. О состоянии санитарно-эпидемио- логического благополучия населения в Российской Федерации в 2019 году: Госу- дарственный доклад. – М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2020; 299.
3. Антоненко О.М. Токсические поражения печени: пути фармакологической коррек- ции. Поликлиника MC. 2013; 6:(2): 45-51.
4. Stravitz R.T., Lee W.M. Acute liver failure. Lancet. 2019; 394: 869-881.
5. Esquer F., Esquer M., Parrau D., Carpio D., Yañez A., Cong P. Systemic administration of multipotent mesenchymal stromal cells reverts hyperglycemia and prevents nephropathy in type I diabetic mice. Biol. Blood Marrow Transplant. 2008; 14: 631-40.
6. Wang J., Wan H. Mesenchymal stromal cells as a therapeutic treatment for ischemic stroke. Neuroscience bull. 2014; 30: 524-35.
8. Айрапетов Г.А., Загородий Н.В., Воротников А.А. Экспериментальный метод замещения костно-хрящевых дефектов суставов (ранние результаты).Медицинский вестник Юга России. 2019; 10(2): 71-76.
9. Ball L.M., Bernardo M.E., Roelofs H., Lankester A., Cometa A., Egeler M.R., et al. Co-transplantation of ex vivo-expanded mesenchymal stem cells accelerates lymphocytes recovery and may reduce the risk of graft failure in haploidentical hematopoietic stem cell transplantation.Blood. 2007; 10: 2764-2767.
10. Le Blanc K., Samuelsson H., Gustafsson B., Remberger M., Sundberg B., Arvidson J., et al. Transplantation of mesenchymal stem cells to enhance engraftment of hematopoietic stem cells. Leukemia. 2007; 21(8): 1733-1738.
11. Wyse R.D. Use of genetically modified mesenchymal stem cells tо treat neurodegeneration diseases. Int. J. Mol. Sci. 2014; 15: 1719-1745.
12. Jo C.H., Lee Y.G., Shin W.H., Kim H.,Chai J.W., Jeong E.C., et al. Intra-articular injection of mesenchymal stem cells for the treatment of osteoarthritis of the knee: a proof-of-concept clinical trial. Stem Cells. 2014; 32: 1254–1266.
14. Golchin A., Tahereh Z. F., Khojasteh A., Soleimanifar F., Ardeshirylajimi A. The Clinical Trials of Mesenchymal Stem Cell Therapy in Skin Diseases: An Update and Concise Review. Current Stem Cell Research & Therapy.2019; 14(1): 22-33.
15. Li M., Ma J., Gao Y., Yang L. Cell sheet technology: a promising strategy in regenerative medicine. Cytotherapy. 2019; 21(1): 3–16.
16. Konno T., Akito K., Kurita K., Ito Y.Formation of embryoid bodies by mouse embryonic stem cells on plastic surfaces.Journal of Bioscience and Bioengineering. 2005; 100(1): 88 - 93.
18. Мужикян А.А., Макарова М.Н., Гущин Я.А. Особенности гистологической об- работки органов и тканей лабораторных животных. СПб: Международный вестник ветеринарии. 2014; 2: 103–9.
19. Kinnaird T., Stabile E., Burnett M.S., Lee C.W., Barr S., Fuchs S., Epstein S.E. Marrow-derived stromal cells express genes encoding a broad spectrum of arteriogenic cytokines and promote in vitro and in vivo arteriogenesis through paracrine mechanisms. Circ Res. 2004; 94: 678–685.
20. Stagg J., Galipeau J. Mechanisms of Immune Modulation by Mesenchymal Stromal Cells and Clinical Translation. Curr.Mol. Med. 2013; 13(5): 856-867.
21. Praveen K.L., Kandoi S., Misra R., Vijayalakshmi S., Rajagopal K., Verma R.S. The mesenchymal stem cell secretome: A new paradigm towards cell-free therapeutic mode in regenerative medicine. Cytokine & Growth Factor Reviews. 2019; 46: 1-9. DOI: 10.1016/j.cytogfr.2019.04.002.

For the prevention and treatment of various liver diseases are increasingly being used antioxidants of natural origin. The preparation consisted of an oligomer of dihydroquercetin, terpene hydrocarbons, esters of resin acids, phytosterols, bioflavonoids (digidrokempferol, kaempferol, quercetin, izoramnetin, listvinidin, spirobioflavonoidy). In the model of acute toxic hepatitis in white rats induced by administration of carbon tetrachloride, show high hepatoprotective properties of bioflavonoid complex of larch. A comparison of the pharmacological action of the drug with larivitol is conducted. A more pronounced effect bioflavonoid complex of larch should be noted. It is established that the bioflavonoid complex of larch l arivitol have positive effect on the recovery of liver function, manifested by normalization of enzyme levels transamination and alkaline phosphatase in serum, by increased levels of albumin and by restoring the function of hepatocytes.
В патогенезе токсического поражения печени большое значение имеет непосредственное действие метаболизируемого вещества на её микросомальную систему с образованием свободных радикалов, индуцирующих аутокаталитическое перекисное окисление микросомальных липидов, что в дальнейшем приводит к выраженным функциональным и структурным изменениям гепатоцитов [2, 5].
Образование свободных радикалов и реактивных метаболитов является важным механизмом повреждения клеток и развития патологических процессов в организме. Выделяют следующие реактивные молекулы, играющие роль в развитии некротического повреждения гепатоцитов: супероксидный радикал, гипохлорит, хлорамины, синглетный кислород, пероксирадикалы, гидроксильный радикал [4].
Для профилактики и лечения различных заболеваний печени все шире используются антиоксиданты. Они замедляют или полностью ингибируют процессы свободнорадикального окисления, действуют на стадии образования свободных радикалов, их связывания и разрушения, а также утилизации продуктов окисления, из которых образуются новые радикалы. Особое внимание уделяется антиоксидантам природного происхождения [7].
Перспективным источником биологически активных соединений с антиоксидантными и антирадикальными свойствами считается применение биофлавоноидов, обладающих малой токсичностью, широтой терапевтического действия, а также возможностью длительного применения без риска возникновения побочных реакций. Опубликованы многочисленные данные по гепатозащитному действию флавоноидов [3].
Цель исследования - изучить гепатопротекторные свойства биофлавоноидного комплекса лиственницы на модели острого токсического гепатита белых крыс и сравнить его действие с ларивитолом.
Для реализации указанной цели были поставлены следующие задачи:
- вызвать токсический гепатит у белых крыс путём применения четырёххлористого углерода;
- установить лечебные свойства биофлавоноидного комплекса лиственницы и сравнить его действие с ларивитолом.
Материал и методы исследования
Изучение гепатопротекторных свойств препаратов проводили на белых беспородных крысах обоего пола массой 180-200 г [1]. При этом по принципу аналогов было создано 4 группы животных - одна контрольная и три опытных - по 12 крыс в каждой. Условия содержания и кормления были одинаковы для всех групп животных.
Первая группа служила контролем (интактные крысы). Острый токсический гепатит у крыс второй, третьей и четвёртой опытных групп вызывали внутрибрюшинным введением четырёххлористого углерода (ССl4) на вазелиновом масле из расчёта 0,4 мл на 100 г массы тела в течение трех суток однократно. Третьей опытной группе сразу после окончания введения четыреххлористого углерода в течение 14 суток применяли биофлавоноидный комплекс лиственницы из расчёта 1 г/кг массы тела, и четвёртой опытной группе в течение такого же периода времени применяли ларивитол из расчёта 0,5 г/кг массы тела. Схема опыта представлена в табл. 1.
Таблица 1. Схема опыта
Биофлавоноидный комплекс лиственницы
Все манипуляции (взвешивание, введение препаратов, декапитация) осуществляли с 9 00 до 12 00 ч с целью исключения суточных влияний на метаболизм.
Для оценки эффективности действия препаратов проводили клинический осмотр животных, измерение массы и контроль некоторых биохимических показателей сыворотки крови (аланинаминотрансфераза, аспартатаминотрансфераза, креатинин, общий билирубин, щелочная фосфатаза, общий белок и т.д.). Биохимические исследования выполняли по стандартным методикам с использованием биохимического анализатора.
Цифровой материал исследований подвергался математической обработке в описании Н. А. Плохинского [6] с вычислением средних арифметических (М), их среднестатистических ошибок (m) и критерия достоверности (р). Различия считали достоверными при р
Результаты исследований
Во время проведения опыта внешние признаки интоксикации (у животных второй группы) проявлялись на второй - третий день после введения четырёххлористого углерода: отмечались вялость, гиподинамия, нежелание принимать пищу, потеря веса и др. В дальнейшем симптомы интоксикации постепенно нарастали и достигали своего максимума к шестому дню, а затем они постепенно убывали. У животных 3-й опытной группы, которым вводился биофлавоноидный комплекс лиственницы после применения четырёххлористого углерода, явления интоксикации наступали несколько позже (на 4 - 5 сутки) и были менее выраженными.
Действие ларивитола на организм крыс было менее выражено, и масса животных изменялась в меньшей степени за весь период проведения эксперимента. Данные таблицы 2 показывают, что проведение интоксикации крыс четырёххлористым углеродом существенно влияет на их рост и развитие. Следует отметить прирост живой массы крыс первой группы и её снижение в группах, получавших гепатопротекторы. Однако менее выраженное снижение массы с некоторым увеличением её к концу опыта зафиксировано в третьей группе.
Таблица 2. Динамика массы крыс
биофлавноидный комплекс лиственницы
Биохимические исследования сыворотки крови животных представлены в табл. 3.
Таблица 3. Биохимические показатели крови крыс
Щелочная фосфатаза, ед/л
Из представленных в таблице данных видно, что во второй группе под действием четырёххлористого углерода происходило существенное повышение таких показателей как аспартатаминотрансфераза и аланинаминотрансфераза (на 7,9 и 34,3 % по сравнению с контролем). Возрастание активности аланинаминотрансферазы обычно рассматривается в качестве показателя степени токсического поражения печени и повреждения плазматической мембраны.
Следует отметить, что в третьей и четвёртой опытных группах, где после введения четырёххлористого углерода, крысам применяли биофлавоноидный комплекс лиственницы и ларивитол, не было отмечено существенного повышения этих ферментов. Так, после 14-суточного скармливания биофлавноидного комплекса лиственницы, уровень аспартатаминотрансферазы даже немного снизился (на 2,7 %), а аланинаминотрансферазы - возрос (на 0,8 %) по сравнению с интактными животными. Такая же картина наблюдалась и после применения ларивитола. Повышение ферментов переаминирования было незначительным (на 7,2 и 5,3 %), но, ни в одном из случаев разница с контролем не подтвердилась статистически.
Повышение активности щелочной фосфатазы во второй группе после введения четырёххлористого углерода (на 6,4 %) характерно для холестатического синдрома, обусловленного нарушением желчевыделительной функции гепатоцитов и поражением желчных канальцев (внутрипеченочный холестаз). После применения биофлавоноидного комплекса лиственницы уровень щелочной фосфатазы наоборот снизился (на 0,6 % по сравнению с контролем), а после скармливания ларивитола - повысился (на 0,3 %), но, ни в одном из случаев разница с контролем не подтвердилась статистически, что свидетельствует о высокой терапевтической эффективности обоих препаратов.
Изменения остальных показателей сыворотки крови животных не имели статистического подтверждения с контрольными показателями.
При проведении макроскопических исследований установлено токсическое поражение печени после введения CCl4. При этом отмечались жировая дистрофия, изменение окраски и дряблая консистенция. Необходимо отметить, что после применения биофлавоноидного комплекса лиственницы и четырёххлористого углерода, печень животных не имела существенных патологических изменений и мало отличалась от печени интактных крыс из первой группы (таблица 4).
Таблица 4. Морфологическая характеристика печени исследуемых крыс
Характеристика печени крыс
Биофлавноидный комплекс + ССl4
Плотная, гладкая, блестящая
Плотная, диффузно утолщена, блестящая
Плотная, дряблая, блестящая
Плотная, дряблая, блестящая
Без патологических очагов
Небольшое количество очагов некроза
Умеренное количество очагов некроза
Без патологии. Строение печени не нарушено
Портальные тракты склерозированы, пограничные пластинки разрушены. Гепатоциты с явлениями зернистости и жировой дистрофии. Очаговый некроз гепатоцитов
Некротические процессы и жировое перерождение долек печени, более выраженные вокруг центральной вены. На периферии широкая полоса нормальных гепатоцитов
В дольках печени умеренное количество очагов некроза и жирового перерождения. Наиболее интенсивные изменения в центральной части печеночных долек. На периферии узкая полоса нормальных гепатоцитов.
На модели экспериментального токсического гепатита белых крыс нами были изучены гепатопротекторные свойства биофлавоноидного комплекса лиственницы и проведено его сравнение с ларивитолом.
Поступление четырёххлористого углерода в организм крыс приводило к развитию цитолитического (повышение в сыворотке крови содержания аспартатаминотрансферазы и аланинаминотрансферазы), холестатического (повышение активности щелочной фосфатазы и концентрации билирубина), гепатодепрессивного (снижение общего белка и альбуминов) синдромов поражения печени. Всё это свидетельствует об усилении процессов перекисного окисления липидов и ослаблении функционирования антиоксидантной системы организма. Это обусловлено образованием радикала СClз при метаболизме четырёххлористого углерода, что является пусковым звеном в механизме повреждающего действия яда. Образовавшиеся радикалы, взаимодействуя с липидами, стимулируют развитие перекисного окисления липидов и вызывают повреждение биологических мембран.
При острой интоксикации четырёххлористым углеродом в паренхиме печени отмечались некроз, жировая дистрофия гепатоцитов и выраженная воспалительная реакция.
Применение крысам биофлавоноидного комплекса лиственницы в дозе 1,0 г/кг массы тела на фоне экспериментального токсического гепатита оказывало выраженное гепатопротекторное действие, которое проявлялось уменьшением нарушений функционального состояния печени (ферменты переаминирования и щелочная фосфатаза находились в пределах физиологической нормы и их значения незначительно отличались от показателей интактных животных).
Использование ларивитола у подопытных животных четвёртой группы также оказывало гепатопротекторное действие, хотя и менее выраженное, но также приводило к нормализации уровня печёночных ферментов в сыворотке крови и нормализации функции печени.
Таким образом, проведённые нами исследования свидетельствуют о высоком гепатопротекторном действии обоих препаратов с небольшим преимуществом биофлавоноидного комплекса лиственницы.
На основании полученных данных можно сделать вывод, что биофлавоноидный комплекс лиственницы и ларивитол можно рекомендовать в качестве гепатопротекторов при токсическом поражении печени животных.
Рецензенты
Скворцов В. Н., д.в.н., заведующий Белгородским отделом Всероссийского научно-исследовательского института экспериментальной ветеринарии им. Я. Р. Коваленко, г. Белгород.
Читайте также:

