Патогенная микрофлора при гепатите с
Обновлено: 04.05.2024
Исследования последних лет существенно изменили стандартные представления о патогенезе многих заболеваний. На сегодняшний день получены однозначные доказательства роли кишечной микробиоты в развитии атеросклероза, ожирения, сахарного диабета (СД), артериальной гипертензии (АГ) и многих других заболеваний. В последнее время активно обсуждается роль кишечной микрофлоры в развитии заболеваний печени. Показано, что длительно существующий дисбиоз кишечника, в особенности синдром избыточного бактериального роста (СИБР), приводит к развитию неалкогольной жировой болезни печени (НАЖБП) (стеатоза и стеатогепатита), внутрипеченочного интралобулярного холестаза, а также функциональных нарушений внепеченочных желчных путей.
Существует целый ряд механизмов, посредством которых кишечная микрофлора участвует в повреждении печени, таких как индукция ожирения, производство эндогенного этанола, активация системной воспалительной реакции, изменение метаболизма холина и др. Современные методы исследования микробиома позволили выявить достоверные различия в составе кишечной микрофлоры у пациентов с наличием заболеваний печени и без таковых.
Появляется все больше работ, демонстрирующих развитие НАЖБП у пациентов, не страдающих ожирением, СД и дислипидемией. Возможно, как раз в этих случаях ведущим патогенетическим фактором поражения печени и являются качественные и количественные нарушения кишечной флоры. В статье рассматриваются вероятные патогенетические механизмы поражения печени при нарушениях нормальной кишечной микробиоты, а также принципы ведения пациентов и перспективные методы комплексной терапии.
Ключевые слова: неалкогольная жировая болезнь печени, стеатогепатит, кишечная микрофлора, микробиом, комплексная терапия.
Для цитирования: Костюкевич О.И., Былова Н.А., Симбирцева А.С. Роль кишечной микробиоты в развитии заболеваний печени и желчевыводящих путей // РМЖ. Гастроэнтерология. 2016. № 11. С. 713–720.
Для цитирования: Костюкевич О.И., Былова Н.А., Симбирцев А.С. Роль кишечной микробиоты в развитии заболеваний печени и желчевыводящих путей. РМЖ. 2016;11:713-720.
The role of gut microbiota in liver and biliary system disorders
Kostyukevich O.I., Bylova N.A., Simbirtseva A.S.
N.I. Pirogov Russian National Research Medical University, Moscow, Russia
Recent studies revolutionized traditional views on the pathogenesis of many disorders. To date, the role of gut microbiota in atherosclerosis, obesity, diabetes, hypertension etc. was clearly demonstrated. In recent years, the role of gut microflora in liver diseases presents a wide field of speculations. It was shown that long-term gut dysbiosis and, in particular, small intenstinal overgrowth syndrome (SIBO) result in nonalcoholic fatty liver disease (NAFLD), i.e., steatosis and steatohepatitis, intrahepatic intralobular cholestasis, and extrahepatic biliary tract dysfunction. Gut microflora is implicated in liver damage by a number of mechanisms, i.e., induction of fatty liver changes, endogenous ethanol production, activation of systemic inflammatory reaction, changes in choline metabolism etc. Modern investigational tools revealed reliable differences in gut microbiota composition in patients with and without liver diseases. There is increasing evidence that NAFLD occurs in patients without obesity, diabetes or dyslipidemia. In these cases, qualitative and quantitative abnormalities of gut microflora are assumed as a key pathogenic factor of liver damage. The paper addresses probable pathogenic mechanisms of liver damage in gut microbiota abnormalities as well as management strategies and perspective complex therapeutic approaches.
Key words: nonalcoholic fatty liver disease, steatohepatitis, gut microflora, microbiome, complex therapy.
For citation: Kostyukevich O.I., Bylova N.A., Simbirtseva A.S. The role of gut microbiota in liver and biliary system disorders // RMJ. Gastroenterology. 2016. № 11. P. 713–720.
В статье освещена роль кишечной микробиоты в развитии заболеваний печени и желчевыводящих путей
Разнообразие кишечной микрофлоры
На сегодняшний день установлено, что в кишечном микробиоме доминируют некультивируемые и ранее не определявшиеся бактерии родов Firmicutes (60–80%) и Bacteroidetes (15–30%) [14]. Каждый человек уникален по составу микробиоты. Состав микробиоты широко варьирует в популяции и зависит как от генетических факторов, так и от особенностей питания [15]. Так, например, при преобладании в рационе мясных продуктов в микробиоме выявляется значительное количество Faecalibacterium prausnitzii [16], а у людей, употребляющих большое количество растительной пищи, – Bacteroidetes, которые содержат множество генов целлюлаз и ксилан-гидролаз [17]. Низкокалорийная диета приводит к значительному снижению численности Firmicutes и росту численности Bacteroidetes [18].
Нарушения нормального состава микробиоты и болезни человека
Появились новые факты, свидетельствующие об однозначной связи кишечного биоценоза с многочисленными заболеваниями, такими как атеросклероз [19], сердечная недостаточность [20], ожирение, СД [21], воспалительные заболевания кишечника [22], злокачественные новообразования [23], аутизм, мочекаменная болезнь, аллергические [24] и аутоиммунные болезни [25].
Показано, что микроорганизмы способны к объединению ДНК с нашей собственной [26], что потенциально ведет к генетическим мутациям, связанным с аутоиммунными болезнями. Вероятно, в этом случае иммунная система синтезирует антитела к фрагментам ДНК, которые сформировались в процессе фагоцитоза или апоптоза инфицированных клеток [27]. Возможно, расшифровка микробиома приведет к новому пониманию патогенеза аутоиммунных болезней [28]. Было показано, что коррекция избыточного бактериального роста в кишке приводит к уменьшению выраженности аутоиммунных процессов. Микроорганизмы также могут блокировать механизм репарации ДНК [29], что, возможно, приводит к раннему старению, апоптозу или раку [30]. Нарушение кишечной микрофлоры встречается у 90% больных ССЗ [31].
Большое внимание сейчас уделяется изучению связи кишечной микрофлоры и патологии печени. Прежде всего речь идет о НАЖБП.
Оценка микрофлоры кишечника у пациентов с НАЖБП
Известно, что культивируется лишь 5–20% видов кишечных бактерий. Для преодоления этой проблемы в практику внедряются новейшие методы идентификации, основанные на разнообразии в последовательности бактериальных 16S рРНК генов (пиросеквенирование), которые предоставляют информацию о количестве, характере и разнообразии видов бактерий [32].
Секвенирование образцов кала пациентов с НАЖБП показало значительное увеличение количества Bacteroidetes и уменьшение – Firmicutes и Actinobacteria. Также у данных пациентов отмечены повышенные уровни этанола, что может свидетельствовать о росте этанол-продуцирующих бактерий (например, Escherichia) [33].
Кишечная микрофлора и оксидативный стресс
Показано, что СИБР и транслокация кишечной флоры приводят к развитию оксидативного стресса и активации системного воспалительного ответа [42]. По результатам водородного дыхательного теста у 50–75% больных НАСГ выявляют избыточную бактериальную пролиферацию в тонкой кишке [43].
Бактериальные липополисахариды (ЛПС) запускают синтез провоспалительных цитокинов клетками Купфера [44]. Доказательствами роли бактериальных ЛПС в поражении печени являются исследования, в которых инфузии низких доз ЛПС мышам с ожирением приводили к повышению уровня провоспалительных цитокинов [45] и развитию стеатогепатита [46]. У пациентов с НАЖБП также отмечены значительно более высокие уровни циркулирующего эндотоксина [47].
Эндогенный этанол
Эндогенный этанол является метаболитом многих видов кишечной флоры. Всасываясь через кишечную стенку, он через воротную вену достигает печени [48], затем под действием алкогольдегидрогеназы этанол окисляется до ацетата и ацетальдегида. Первый является субстратом для синтеза жирных кислот, а второй способствует синтезу активных форм кислорода. Таким образом, метаболизм этанола приводит к накоплению триглицеридов в гепатоцитах [49] и запускает оксидативный стресс.
Повышенные уровни этанола были обнаружены у пациентов с ожирением [50], а также у детей с НАСГ [51], что указывает на его значимую роль в развитии НАЖБП.
Этанол также увеличивает проницаемость слизистой кишечника [52], что усугубляет явления эндотоксемии. Проведение 5-дневной антибактериальной терапии у пациентов с НАСГ привело к значимому снижению уровня этанола, что указывает на тесную связь эндогенного этанола и микрофлоры кишечника [53].
Повышение количества прооксидантов в печени, активация звездчатых клеток приводят к формированию стеатогепатита и запуску фиброгенеза [54].
Кишечная микрофлора и ожирение
Исследования последних лет показали взаимосвязь изменений кишечного биоценоза и ожирения [55]. В результате избыточной микробной ферментации пищевых волокон и некоторых других субстратов в организм хозяина попадает небольшое количество дополнительной энергии, что может с течением времени способствовать увеличению веса. Кроме того, показано, что микрофлора воздействует на гены, регулирующие расход и запасание энергии [56].
Ряд исследователей считает, что кишечная микрофлора каждого человека имеет свою метаболическую активность, и определенные изменения ее состава могут служить предрасполагающим фактором развития ожирения [57].
В серии экспериментов проводилась пересадка кишечной флоры безмикробным мышам, выросшим в стерильной среде. В результате наблюдалось увеличение массы жировой ткани за 2 нед. на 60% без каких-либо изменений в питании, что сопровождалось развитием ИР, гипертрофией адипоцитов, повышением уровней лептина и глюкозы в крови [58].
Еще в одном исследовании проводилась пересадка безмикробным мышам кишечной флоры от худых и тучных мышей. Оказалось, что безмикробные мыши, которым пересадили кишечную флору от тучных мышей, набирали вес гораздо быстрее, чем те, кому пересаживали флору от худых собратьев [59]. Полученные данные позволили предположить, что изменения микрофлоры кишечника могут играть роль в патогенезе ожирения и требуют дальнейшего изучения.
При анализе бактериального генома у мышей, страдающих наследственным ожирением, выявлено резкое снижение в кишечнике доли бактерий группы Bacteroidetes по сравнению с обычными мышами, тогда как доля бактерий группы Firmicutes, напротив, повышена. Схожие изменения были выявлены и у людей [60].
Кишечная микрофлора и сахарный диабет
Интересные данные были получены в работе Brugman, где показано положительное влияние антибиотиков на гликемический профиль крыс с предрасположенностью к СД. У крыс без диабета также обнаружено достоверно более низкое содержание Bacteroidetes [61]. Предположительно прием кишечных антисептиков приводит к снижению активности системного воспаления в ответ на уменьшение антигенной стимуляции, которое может способствовать деструкции β-клеток поджелудочной железы.
Таким образом, нарушения состава микробиоты могут приводить к избыточному поступлению в гепатоцит свободных жирных кислот и синтезу провоспалительных цитокинов, что приводит к формированию стеатоза и стеатогепатита.
Появляется все больше работ, демонстрирующих развитие НАЖБП у пациентов, не страдающих ожирением. Возможно, как раз в этих случаях ведущим патогенетическим фактором поражения печени и являются качественные и количественные нарушения кишечной флоры.
Методы обследования пациентов с поражением печени и кишечным дисбиозом
1. Верификация заболевания печени.
Поводом для обследования пациента часто является случайно выявленная ферментемия или гипербилирубинемия, которая в большинстве случаев не достигает высоких значений (1,5–3 нормы).
Для диагностики НАЖБП прежде всего требуются исключение вирусной, алкогольной, аутоиммунной этиологии, а также выявление специфических УЗИ-критериев и, при необходимости, морфологическое исследование биоптатов печени.
Спектр обследования пациентов должен включать в себя:
– определение маркеров вирусных гепатитов (HCV-AT, HBsAg, Ig M, G-CMV, EBV, HSV-1, 2, 6);
– тщательный сбор лекарственного и алкогольного анамнеза (опросники CAGE, AUDIT, анкета ПАС) [62];
– определение маркеров аутоиммунного поражения печени (общий IgG, ANA, АМА, pANCA, SMA в сыворотке);
– МРТ, КТ или УЗИ печени;
– биопсия печени при необходимости морфологической верификации диагноза;
– диагностика ассоциированных метаболических состояний.
2. Диагностика СИБР и дисбиоза.
Для диагностики СИБР важны следующие моменты:
– выявление характерных клинических симптомов СИБР (постпрандиальный дискомфорт, вздутие, урчание, бурление в животе, неустойчивый стул);
– проведение водородного дыхательного теста;
– посев кала для исключения избыточного роста патогенной и условно-патогенной флоры;
– определение эффективности кишечных антисептиков или антибиотиков;
– выявление и устранение причины, приведшей к развитию СИБР.
Причины нарушений нормального кишечного биоценоза
Со времен внедрения антибактериальных препаратов в широкую клиническую практику произошла радикальная смена микроокружения в человеческой популяции. Созданный в процессе естественного отбора устойчивый бактериальный микробиоценоз исчез, нарушилось микроэкологическое равновесие, достигнутое в ходе эволюции, в пользу вирусного и грибкового микроокружения, на которое антибактериальные средства действия не оказывают [63].
Можно выделить следующие основные причины дисбиозов [64]:
1. Заболевания органов пищеварения, сопровождающиеся очагами воспаления и моторно-секреторными расстройствами.
2. Перенесенные острые кишечные инфекции.
3. Длительный прием лекарственных препаратов, влияющих на секрецию пищеварительных желез, моторику и регенерацию эпителия пищеварительного тракта, а также антибиотиков.
4. Неполноценные диеты, приводящие к развитию гнилостной и бродильной диспепсии и другим расстройствам процессов пищеварения и всасывания.
5. Поражение ЖКТ при других заболеваниях, таких как системные заболевания соединительной ткани, хроническая сердечная недостаточность, болезни крови и др.
6. Нарушения иммунного статуса (не только следствие, но и причина изменения нормального биоценоза кишечника).
Важно помнить, что нарушения кишечной микрофлоры всегда вторичны и не являются самостоятельным диагнозом.
Комплексная терапия
Очевидно, что пациенты с заболеваниями печени и наличием дисбиоза кишечника нуждаются в комплексном подходе, включающем меры, направленные на восстановление и биоценоза кишечника, и структурно-функциональной целостности гепатоцитов. Поэтому актуален поиск препаратов, обладающих комплексным действием, и наиболее оптимальных схем лечения.
В работах И.Л. Ильенко изучались схемы коррекции дисбиозов у детей, включающие пробиотические штаммы в сочетании с комплексными гомеопатическими препаратами в сравнении с монотерапией пробиотиками. После коррекции наиболее выраженные положительные сдвиги в клинико-лабораторных показателях отмечены в группе, получавшей комбинацию пробиотика и комплексного гомеопатического препарата Хепель (р <0,05) [72].
Хепель является комплексным антигомотоксическим средством, в состав которого входят 7 растительных и 1 минеральный компонент. Препарат обладает противовоспалительным, спазмолитическим, желчегонным, гепатопротекторным, дезинтоксикационным, антиоксидантным, антипролиферативным и онкостабилизирующим действием [73, 74]. Есть клинические данные, демонстрирующие влияние Хепеля на реологические свойства желчи, эффективность при внутрипеченочном холестазе, алкогольной болезни печени [75], функциональных гипербилирубинемиях [76]. Важное преимущество препарата заключается в его доказанной безопасности. Ни в одной из экспериментальных работ на культуре клеток НepG2 не было выявлено цитотоксичности [73, 74].
С учетом многогранности патогенетических механизмов повреждения печени у пациентов с нарушениями кишечной микрофлоры применение комплексных препаратов и схем терапии, направленных на коррекцию основных звеньев патогенеза, представляется крайне перспективным и, несомненно, достойным дальнейшего изучения.
Гепатит С. Вирус гепатита С. Диагностика гепатита С. Лечение гепатита С. Профилактика гепатита С.
Гепатит С обычно протекает хронически и характеризуется преимущественным развитием хронических форм гепатита с исходом в цирроз и первичную карциному печени. Вирус гепатита С включён в состав рода семейства Flaviviridae.
Резервуар возбудителя гепатита С — инфицированный человек. Основной путь передачи вируса гепатита С — парентеральный. Основное отличие от эпидемиологии вируса гепатита В — более низкая способность вируса гепатита С к передаче от беременной к плоду и при половых контактах.
Больной выделяет вирус гепатита С за несколько недель до появления клинических признаков и в течение 10 нед после начала проявлений. Заболевание чаще регистрируют в США (до 90% всех трансфузионных гепатитов) и Африке (до 25%).
Для клинической симптоматики вирусного гепатита С характерны изменение консистенции и размеров печени. При активном процессе печень обычно увеличена и болезненна при пальпации, её консистенция умеренно плотная. Другие проявления включают спленомегалию, диспепсический и астенический синдромы, желтуху, артралгии и миалгии, кардиты, васкулиты, лёгочные поражения, анемии и др. Осложнения хронического процесса — цирроз и первичная карцинома печени.

Принципы микробиологической диагностики гепатита С
Маркёры репликации вируса гепатита С — AT [IgM) к Аг вируса гепатита С и вирусная РНК. Маркёры гепатита С выявляют методами ИФА и ПЦР.
Показание для поиска AT или РНК вируса гепатита С — любое воспалительное заболевание печени. Вирусспецифические AT появляются в среднем через 3 мес и указывают на возможное инфицирование вирусом гепатита С или на перенесённую инфекцию. В серонегативный период выявляют РНК вируса гепатита С. Для подтверждения результатов ИФА, а также при обследовании пациентов, не относящихся к основным группам риска, применяют метод рекомбинантного иммуноблотинга, позволяющий эффективно исключить ложноположительные результаты ИФА.
Лечение и профилактика гепатита С
Средства этиотропной терапии гепатита С отсутствуют; при хронических инфекциях можно использовать а-ИФН. На фоне терапии ИФН у 40-70% больных отмечают стихание воспалительного процесса (на что указывает снижение содержания концентрации аминотрансфераз в сыворотке), однако по окончании курса у 40-50% пациентов наблюдают рецидив воспаления.
Средства специфической иммунопрофилактики гепатита С не разработаны.
Высокий риск инфицирования вирусными гепатитами в настоящее время во многом объясняется все более широким применением внутривенного введения наркотических препаратов и их суррогатов. Наркотические вещества оказывают влияние на неспецифическую резистентность организма и состояние микрофлоры кишечника. Рост инфицированности гепатитом С и микст-гепатитом В+С среди молодого населения вызывает серьезную обеспокоенность в медицинской сфере. Формирование множества антигенных вариантов вируса гепатита С исключает ранний иммунологический контроль, что является одной из причин негативных исходов болезни. Нарушения иммунологического статуса, возникающие при гепатите С, являются одной из важных причин развития дисбиоза кишечника. Нарушения состава микрофлоры кишечника выявляются во все периоды парентеральных гепатитов. Возникающие под воздействием бактерий и побочных продуктов их метаболизма воспалительные и дистрофические изменения кишечной слизистой оболочки являются одним из важнейших причин нарушения функции других органов.

2. Благов Н.А., Егорова Е.Н. Особенности клиники вирусных гепатитов В, С, В+С у наркоманов // Инфекционные болезни: диагностика, лечение, профилактика: Тез. докл. 6 Российско-Итальянской науч. конф. (14–16 декабря 2000 г.). – М., 2000. – С.33.
5. Бухарин О.В., Валышев А.В., Челпаченко О.Е. Колициногенная активность кишечной микрофлоры как показатель дисбиотического состояния желудочно-кишечного тракта // Микробиология, эпидемиология и иммунобиология. – 2002. – № 4. – С.55-57.
6. Гранитов В.М., Хорошилова И.А. Классификация кишечного дисбактериоза // Успехи современного естествознания. – 2002. – № 3. – С.6-10.
7. Дубова А.В., Мартова О.В., Алянский С.М. Изучение микробиоценоза толстого кишечника у больных вирусным гепатитом С и др. // Гепатит В, С и Д – проблемы диагностики, лечения и профилактики: Тез. докл. 4 Рос. науч.-практ. конф. – М., 2001. –С.106-108.
8. Кочурко Л.И., Лиходед В.Г., Лобова Е.А. Показатели иммунитета к эндотоксину грамотрицательных бактерий при кишечных дисбактериозах // Эпидемиология и иммунобиология. – 1998. – № 5. – С.25-27.
9. Макось Р.П., Дикий Б.Н., Засуха Г.П. Дисбактериоз у больных вирусным гепатитом // Врачебное дело. – 1988. – № 7. – С.114-116.
10. Шахгильдян И.В. Характеристика групп высокого риска инфицирования вирусом гепатита С // Вирусные гепатиты: достижения и перспективы. – 2000. – № 2. – С.3-4.
Гепатит С (ГС) с момента своего выделения из группы парентеральных гепатитов сразу привлек к себе внимание специалистов. В настоящее время среди хронических заболеваний печени ГС стоит на первом месте – 40 – 60 % больных. Особую тревогу вызывает рост инфицированности вирусом ГС, а также формирование микст-инфекции В+С среди молодежи, что связано с ростом наркомании у этого контингента. При этом преобладает групповой характер их приема, частое использование общих шприцев и игл без достаточной их стерилизации. Наркотические вещества оказывают влияние на специфическую и неспецифическую защиту макроорганизма и на течение инфекционного процесса [2, 10].
Именно глубокие нарушения иммунологического статуса и реактивности макроорганизма, а также нарушение желчевыделения, функциональные расстройства, нарушение свойств пищеварительных соков являются причинами развития дисбиоза у больных вирусными гепатитами [8].
Синдром толстокишечного дисбиоза – это количественные и качественные нарушения состава микрофлоры толстой кишки с формированием дефицита бифидо- и лактофлоры при нарастании содержания различных условно-патогенных микроорганизмов, что сопровождается появлением разнообразных клинических проявлений (хронический запор, неустойчивость стула, метеоризм, спастические боли), а также метаболических, трофических, иммунологических нарушений [1, 3, 4].
При кишечном дисбиозе под действием большого количества микроорганизмов коньюгированные желчные кислоты гидролизуются до свободных желчных кислот. Деконьюгированные желчные кислоты повреждают эпителий слизистой оболочки кишечника вплоть до полного исчезновения микроворсинок, вследствие чего инактивируются гликопротеины апикальной мембраны энтероцитов, снижаются синтез и сорбция ферментов на ее поверхности, что приводит к нарушению мембранного пищеварения [5]. Снижение бактериальной ферментации углеводов и угнетение роста полезной микрофлоры, утилизирующей муцины бокаловидных клеток кишки, приводят к нарушению условий для продукции и усвоения короткоцепочечных жирных кислот (уксусной, пропионовой, масляной). Развитие синдрома интоксикации обусловлено снижением детоксицирующей функции нормальной микрофлоры в результате повреждения полимерами бактериальных клеточных оболочек. При развитии кишечного дисбиоза также происходят нарушения в системе местного и общего иммунитета. Рано возникают сдвиги в фагоцитарной системе защиты, возникают нарушения в Т-клеточном звене иммунитета. В результате уменьшения иммунологической функции нормальной микрофлоры снижается антителообразование, бласттрансформация В-лимфоцитов, возникает дисбаланс гуморального иммунитета, угнетается синтез различных цитокинов: интерферонов, интерлейкина – 1 и фактора некроза опухолей альфа (ФНО - α) [8].
У большинства больных вирусным гепатитом С (91 %) выявлены нарушения микрофлоры кишечника [7, 9].
Цель исследования
Выявить влияние наркотических препаратов на качественный и количественный состав микрофлоры кишечника и изучить ее состояние у больных вирусным гепатитом С и микст-гепатитом В+С в различные периоды болезни.
Материалы и методы исследования
Исследование проводилось у 70 больных хроническим гепатитом С, 60 больных микст-гепатитом В+С. Из этих лиц была отобрана группа пациентов (73 человека), страдающих наркотической зависимостью. Контрольная группа (75 человек), не употребляющих наркотики и ранее не включавшихся в исследуемую группу. Возраст больных колеблется от 16 до 56 лет. Материал собран методом сплошного массива. Подавляющее число больных ВГ (98 %) поступали в стационар при ухудшении самочувствия.
Диагноз вирусного гепатита ставили на основании эпидемиологического анамнеза, клинических данных, результатов лабораторных и иммуносерологических исследований.
Комплекс проведенных исследований включал анализ клинико-эпидемиологических данных, общеклинических показателей крови и мочи, результатов биохимических, серологических исследований, результатов бактериологического исследования кала, инструментальных исследований, статистическую обработку полученных данных.
Лабораторные критерии верификации диагнозов:
- Гепатит С: наличие антител к ВГС, подтвержденное дополнительным тестированием – определение антител к core протеину и неструктурным белкам NS2, NS3, NS4,NS5, определение РНКHCV наличие РНК ВГС.
- Микст-гепатит В+С: включало в себя обследование на вирусный гепатит В и вирусный гепатит С.
Исследование кала на дисбиоз проводили по методике Р.В. Эпштейн-Литвак, Ф.Л. Вильшанской.
Для оценки нарушений эубиотического равновесия кишечника использовались следующие критерии:
- Снижение уровня защитной флоры (то есть концентрации бифидобактерий 10 7 КОЕ/г и меньше, лактобактерий 10 5 КОЕ/г и меньше).
- Изменение количественного содержания кишечной палочки (более 10 8 КОЕ/г или менее 10 6 КОЕ/г).
- Появление кишечной палочки с измененными свойствами в количествах, превышающих 25 % от общей популяции, в том числе более 10–20 % штаммов со сниженными ферментативными свойствами и более 5 %-лактозонегативными.
- Увеличение содержания кокковых форм в общей сумме микробов более чем на 25 %.
- Появление гемолизирующих штаммов энтеробактерий.
- Выявление золотистого стафилококка, протея, грибов рода Candida и других условно-патогенных микроорганизмов в титре 10 2 КОЕ/г и выше.
Выявленные нами изменения микробного состава кишечника у больных ВГ позволило разработать классификацию дисбиоза кишечника у больных вирусными гепатитами. Эта классификация была разработана в 2002 году [6]. Однако, с учетом длительного изучения этой проблемы, мы сочли необходимым в ней провести коррективы. В частности:
1) нормальное количество бифидо- и лактобактерий; незначительное снижение бифидобактерий (10 -7 ) и лактобактерий (10 -5 ), либо незначительное снижение бифидобактерий (10 -7 ), алактобактерии в норме;
2) количественные изменения кишечной палочки (увеличение или уменьшение);
3) условно-патогенная флора в пределах нормы.
1) нормальное количество бифидо- и лактобактерий; либо незначительное снижение бифидобактерий (10 -7 ) и лактобактерий (10 -5 ); либо незначительное снижение бифидобактерий (10 -7 ), а лактобактерии в норме;
2) качественные и/или количественные изменения кишечной палочки;
3) увеличение количества представителей условно-патогенной флоры.
1) незначительное снижение бифидобактерий (10 -7 ), а лактобактерии в норме; либо уменьшение бифидобактерий (10 -7 и меньше) и лактобактерий (10 -5 и меньше);
2) кишечная палочка почти вся представлена атипичными штаммами (85–100 %);
3) резкое возрастание количества условно-патогенной флоры.
1) бифидобактерии отсутствуют;
2) резкое уменьшение количества или отсутствие типичных форм кишечной палочки;
3) условно-патогенная флора растет в ассоциациях.
Полученные результаты обработаны статистически по стандартной компьютерной программе MicrosoftExcel с вычислением достоверности различия по критерию Стьюдента (t). Различия считались значимыми при Р
Результаты исследования и их обсуждение
У больных ГС оптимальное содержание бифидобактерий отмечалось в 95,71±2,42 % случаев, лактобактерий – 97,14±1,99 %. Количество кишечных палочек, соответствующее бактериологической норме, выявлено у 91,42±3,34 % больных. Из представителей условно-патогенных микроорганизмов определялись грибы рода Candida у 11,42±3,8 % больных, клебсиеллы – у 17,14±4,5 %. Гемолитические формы кишечных палочек выявлены у 17,14±4,5 % больных, со сниженными ферментативными и лактозонегативными свойствами у 40±5,85 %. Степени дисбиоза кишечника при ГС следующие: первая степень у 4,28±2,41 % больных, вторая степень – у 38,57±5,81 %, третья степень – у 28, 57±5,39 %.
У всех обследованных больных микст-гепатитом В+С выявлено оптимальное содержание лактобактерий. Оптимальное содержание бифидобактерий отмечено в 98,33±1,65 % случаев. Нормальное количество кишечных палочек отмечено в 80±5,16 % случаев, изменение их количества – в 20±5,16 %. Представители условно-патогенной флоры определялись следующие: клебсиеллы – в 33,33±6,08 % случаев, грибы рода Candida – в 15±4,6 %. Кишечные палочки со сниженными ферментативными и лактозонегативными свойствами определялись у 30±5,91 % больных. На основании предложенной нами классификации у больных микст-гепатитом В+С дисбиоз первой степени определяли в 8,33±3,56 % случаев, второй степени – в 51,66±6,45 %, третьей степени – в 11,66±4,14 %.
У всех больных ГС в начале желтушного периода определялись бифидобактерии и лактобактерии. Количество кишечных палочек, соответствующее норме, выявлялось у 90,32±5,31 % больных. Клебсиеллы встречались в 19,35±7,09 % случаев, грибы рода Candida – в 9,67±5,3 %. Кишечные палочки со сниженными ферментативными и лактозонегативными свойствами определялись у 45,16±8,93 % больных, гемолитические формы – у 16,12±6,6 %. В 32,25±8,39 % случаев выявлялись изменения культуральных свойств кишечных палочек. Первая степень дисбиоза не определялась, вторая – в 38,7±8,74 % случаев, третья – в 29±8,14 %.
В разгар желтушного периода у больных ГС оптимальное содержание бифидобактерий определялось в 94,87±3,53 % случаев, а лактобактерий – у всех больных. Нормальное количество кишечных палочек выявлено у 92,3±4,26 % больных, а кишечные палочки со сниженными ферментативными и лактозонегативными свойствами у 25,64±6,99 %. Гемолитические формы кишечных палочек – у 15,38±5,77 % пациентов. Грибы рода Candida встречались в 12,8±5,34 % случаев, клебсиеллы – в 20,51±6,46 %. Культуральные изменения колоний кишечных палочек определялись в 20,51±6,46 % случаев. Степени тяжести дисбиоза кишечника следующие: первая степень определялась у 2,56±2,52 % больных, вторая степень – у 53,84±7,98 %, третья – у 20,51±6,46 %.
В период ранней реконвалесценции бифидобактерии, лактобактерии определялись в 92,3±7,69 % случаев. Оптимальное содержание кишечных палочек – в 92,3±7,69 % случаев. В 38,46±14 % случаев выявлялись кишечные палочки со сниженными ферментативными и лактозонегативными свойствами, а гемолитические формы – в 15,38±10,4 %. Клебсиеллы определялись у 7,69 % больных, грибы рода Candida – не определялись. Культуральные изменения кишечных палочек выявлены у 23±12 % пациентов. Первая степень дисбиоза не определялась, вторая степень определялась у 38,46±14 % больных, третья – у 30,76±13,32 %.
У 94,44±3,81 % больных микст-гепатитом В+С в начале желтухи в оптимальном количестве определялись бифидобактерии и лактобактерии. Нормальное количество кишечных палочек выявлено у 88,88±5,23 % больных. У 33,33±7,85 % больных – кишечные палочки со сниженными ферментативными и лактозонегативными свойствами, с гемолитическими свойствами – у 5,5±3,8 %. В 27,77±7,46 % случаев отмечены изменения культуральных свойств кишечных палочек. Клебсиеллы определялись у 13,88±5,76 % пациентов, грибы рода Candida – у 19,44±6,59 %. Степени дисбиоза кишечника следующие: первая степень не определялась, вторая степень – у 55,55±8,28 % больных, третья – у 13,88±5,76 %.
В разгар желтушного периода у всех больных определялись бифидобактерии и лактобактерии. У 73±8,87 % обследованных количество кишечных палочек в пределах нормы. Кишечные палочки со сниженными ферментативными и лактозонегативными свойствами встречались в 30,76±9,22 % случаев. Изменения культуральных свойств кишечных палочек выявлены в 11,53±6,38 % случаев. Клебсиеллы определялись у 42,3±9,88 % обследованных, грибы рода Candida – у 15,38±7,21 %. Первая степень дисбиоза определялась у 7,69±6,38 % больных, вторая – у 61,53±9,73 %, третья – у 19,23±7,88 %.
В период ранней реконвалесценции оптимальное содержание бифидобактерий и лактобактерий отмечено у всех пациентов. В 87,5±6,89 % случаев – нормальное количество кишечных палочек. Кишечные палочки со сниженными ферментативными и лактозонегативными свойствами выявлялись у 25±9 % больных. Клебсиеллы определялись у 25±9 % обследованных, грибы рода Candida – у 16,66±7,76 %. Первая степень дисбиоза не выявлена, вторая степень выявлена у 70,83±9,47 % больных, третья степень – у 8,33±5,76 %.
У наблюдаемых нами больных ВГ колонии кишечных палочек значительно отличались от обычных по культуральным свойствам. Если в норме на среде Эндо колонии кишечных палочек темно-красного цвета с металлическим блеском, то у больных ВГ колонии не имеют круглой формы, едва возвышаются над поверхностью агара, размазанные, без четких границ.
Исследования микрофлоры кишечника проведены у 73 больных парентеральными ВГ, страдающих наркотической зависимостью. Длительность приема наркотических препаратов составляла от 1 до 5 лет. Исследование кала на дисбиоз проводили в желтушный период заболевания. Изменения кишечного микробиоценоза в данной группе обследованных выявлены в 82,2±4,48 % случаев. Эти изменения, по сравнению с группой больных ВГ, не употребляющих наркотических веществ (группа сравнения – 75 человек), характеризовались следующим: содержанием грибов рода Candida у 12,32±3,84 % и 9,58±3,44 % больных соответственно, клебсиелл – у 24,65±5,04 и 23,28±4,94. Кишечные палочки со сниженными ферментативными свойствами и лактозонегативными свойствами определяли в 31,5±5,43 % и 30,13±5,37 % случаев. Изменение культуральных свойств кишечных палочек – 36,99±5,65 % и 21,91±4,84 % соответственно (p<0,05). Отмечено в группе больных ВГ, принимающих наркотические препараты, появление стафилококков, синегнойной палочки.
Степени выраженности дисбиоза следующие: первая степень – 5,47±2,66 % только в группе сравнения, вторая степень – 42,46±5,78 % и 49,31±5,85 % соответственно, третья степень – 17,8±4,47 % и 15±4,18 %.
Выводы
Изменения кишечной микрофлоры у больных ГС, микст-гепатитом В+С выявлялись от начала желтушного периода до периода ранней реконвалесценции. В желтушном периоде в обеих группах характерно появление представителей условно-патогенной флоры: грибов рода Candida, стафилококков, синегнойной палочки, протея, энтеробактера. При этом у больных ВГ, страдающих наркотической зависимостью, они встречаются чаще и в большом количестве.
У этой группы больных выявлены кишечные палочки со сниженными ферментативными, лактозонегативными и культуральными свойствами. При этом изменения культуральных свойств кишечной палочки можно рассматривать как предикторы развития дисбиоза.
В обеих группах преобладает вторая и третья степень дисбиоза. Выявленные изменения состояния микрофлоры кишечника должны учитывать при проведении терапии у больных ВГ.
Бактериальные гепатиты - диагностика
Незначительные гистологические изменения и отклонения от нормальных биохимических показателей крови характерны для бактериальной септицемии. Например, при лептоспирозе, особенно если он вызван Leptospira icterohaemorrhagica (болезнь Вейла), могут наблюдаться тяжелые повреждения печени и почек в сочетании с геморрагическими высыпаниями.
Желтуха — частый симптом при данном процессе, хотя гистологические изменения ткани печени обычно легкой степени и неспецифичны.
Туберкулез печени встречается значительно чаще, чем принято считать. При этом наиболее характерный гистологический признак — гранулемы, часто с казеозным некрозом. В отсутствии некроза гранулемы неотличимы от саркоидных.
Наиболее часто подобные образования находят внутри долек, однако в них достаточно сложно обнаружить кислотоустойчивые бактерии. Для бруцеллеза также характерен гранулематозный процесс, при котором выявляют скопление небольшого количества лимфоцитов, плазматических клеток и гистиоцитов.
Гранулемы в печени считают неспецифическим симптомом, поскольку они образуются при широком спектре состояний, включая инфекционные заболевания, лимфому и употребление лекарственных препаратов. Для врожденного сифилиса характерны присутствие в ткани печени спирохет и диффузный фиброз паренхимы, который может прогрессировать с исходом в перицеллюлярный цирроз.
Гранулематозный гепатит — частый признак вторичного сифилиса. Гранулемы также можно встретить и при третичном сифилисе, однако классический симптом данной стадии — сифилитическая гумма — некротический узел, окруженный грануляционной тканью, по мере заживления которого образуются глубокие рубцы (hepar lobatum) и фиброз.
Гистологическая картина печени при туберкулезе: казеозная гранулема (а), окраска гематоксилин-эозином, х 125.
Кислотоустойчивые бактерии (б), окраска по Цилю-Нельсену. Гранулематозный гепатит, обнаруженный при поиске причин лихорадки. Окрашивание PAS (х 180). Гистологическая картина печени при врожденном сифилисе: диффузный перицеллюлярный фиброз (а), окраска гематоксилин-эозином (х 160).
Спирохеты (б), окраска по Левадити, х 600).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Вирусы гепатитов - характеристика, особенности поражения печени
Печень может страдать от различных вирусных инфекций, однако некоторые вирусы выделяют в особую группу гепатотропных из-за их способности избирательно поражать ткань этого органа. В настоящее время в нее входят пять возбудителей (от вируса гепатита А до вируса гепатита Е). Кроме того, растет количество данных в пользу существования других вирусов, вызывающих поражение печени. Большинство форм гепатитов не диагностируют, потому что они протекают субклинически.
Вирус гепатита А содержит РНК и вызывает острое течение гепатита с низкой смертностью и без длительных остаточных явлений.
Напротив, возбудитель гепатита В (HBV) — ДНК-содержащий вирус, вызывающий более тяжелое течение заболевания (особенно в раннем детском возрасте) с преобразованием в хроническую форму, сопровождающуюся постоянной циркуляцией вируса в крови. Заболевание прогрессирует и переходит в хронический гепатит с последующим перерождением в цирроз печени.
Электронная микрофотография: вирусные частицы гепатита А (27-32 нм в диаметре) с антителами на их поверхности. Электронная микрофотография вируса гепатита В.
На срезе видны мелкие сферические частицы с диаметром 28 нм (HBsAg); более крупные сферические двумембранные частицы Дейна (42 нм), продолговатые филаментозные частицы.
Вирус гепатита С (HCV) — РНК-содержащий. Подобно вирусу гепатита В передается парентеральным путем. Гепатит С представляет собой наиболее распространенное хроническое заболевание печени: им в мире поражены около 200 млн человек. Диаметр вируса составляет 30—60 нм. Геном возбудителя состоит из одноцепочечной молекулы РНК. Строение вируса показано на рисунке. Структурные и неструктурные белки закодированы на 5' и 3'-концах открытой рамки считывания. Нетранслируемые области располагаются как на 3', так и на 5'-конце рамки считывания и необходимы для процессов трансляции белков и репликации вируса.
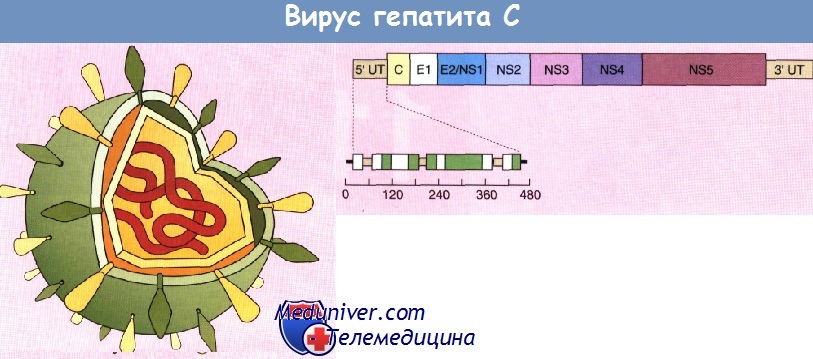
Вирус гепатита С (схема). Структурные и неструктурные компоненты с некоторыми антигенами используют при диагностике с помощью антител.
Вирус гепатита D (дельта-антиген) имеет небольшой размер и содержит РНК. Сам по себе он не патогенен, но при одновременном инфицировании с вирусом гепатита В приводит к более тяжелому течению болезни, прогрессированию и развитию скоротечной формы.
Вирус гепатита Е передается фекально-оральным путем, он вызывает эпидемии в Азии, Африке, Латинской Америке, при которых заражение происходит через воду. Течение заболевания обычно доброкачественное, по типу гепатита А, однако достаточно высока смертность среди беременных.
Электронная микрофотография вирусных телец гепатита Е (100 нм).
Дифференциальная диагностика различных типов острых гепатитов клинически затруднена, и поэтому ее проводят с помощью серологических тестов. В силу тех же причин гистологическая диагностика в большинстве случаев также невозможна. Классические гистологические признаки при неосложненном остром (лобулярном) гепатите — повреждение печеночных клеток и некроз в центре дольки. Наблюдают дистрофию гепатоцитов в виде гидропической вакуолизации и накопления дегенеративных ацидофильных телец. Активность клеток Купфера повышена вследствие поглощения ими поврежденных или отмерших гепатоцитов.
Наряду с этими изменениями внутри долек накапливается воспалительный инфильтрат преимущественно в виде лимфоцитов с небольшим количеством плазматических клеток. Также обычно обнаруживают небольшой отек, скопление мононуклеаров и макрофагов в стенках воротной вены. Пролиферация клеток желчных протоков минимальна. Возникающий при данной болезни холестаз выражен в различной степени. В некоторых случаях у пациентов с сильной желтухой изменения в системе воротной вены могут имитировать симптомы внепеченочной обструкции.
По мере уменьшения воспаления дольки в центре ее более выраженным становится спадение фибрилл ретикулина, и происходит деформация клетки, однако эти явления преходящи. Воспаление стенок сосудов системы воротной вены — процесс длительный, который может приводить к формированию фиброзных перегородок.
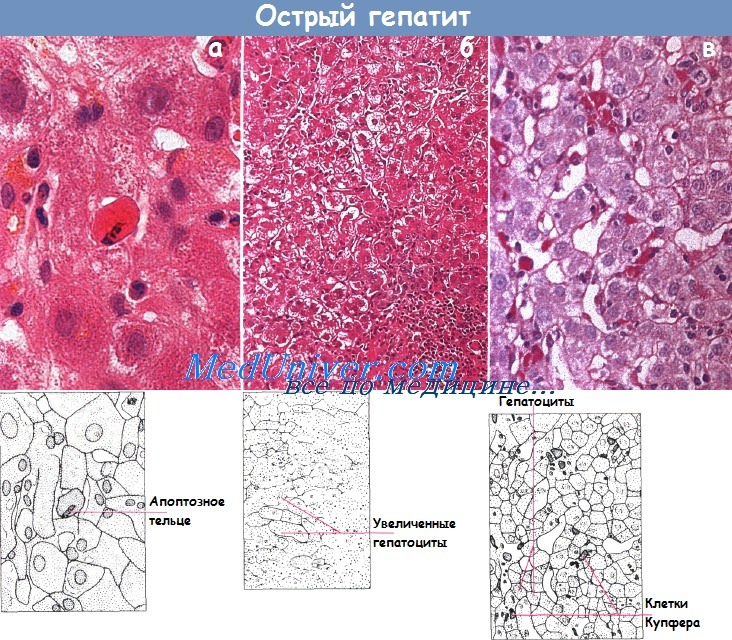
Гистологическая картина острого долькового гепатита (а) (видны апоптозные тельца: х 320, окраска гематоксилин-эозином).
Увеличенные вследствие баллонной дегенерации гепатоциты (б) (х 125, окраска гематоксилин-эозином).
Активированные клетки Купфера (в) с PAS-позитивным содержимым (х 320, окрашивание PAS):
В более тяжелых случаях острого гепатита возникают мостовидные некрозы между центральными венами и портальными трактами (подострые печеночные некрозы). Портальные тракты при этом расширены, наблюдают пролиферацию стенок желчных протоков и инфильтрацию их нейтрофилами, что можно ошибочно принять за внепеченочную обструкцию. Граница между печеночной долькой и портальным трактом (пограничная пластинка) обычно сохранена.
Ее разрушение может быть связано с развитием хронического гепатита (см. выше). Подострый печеночный некроз может приводить к печеночной недостаточности и летальному исходу, хотя также возможно полное выздоровление. Более острый и тяжелый гепатит приводит к скоротечной печеночной недостаточности, при которой остается незначительное количество жизнеспособных клеток паренхимы, печень сморщена и окрашена в желтый цвет (острая желтая атрофия).
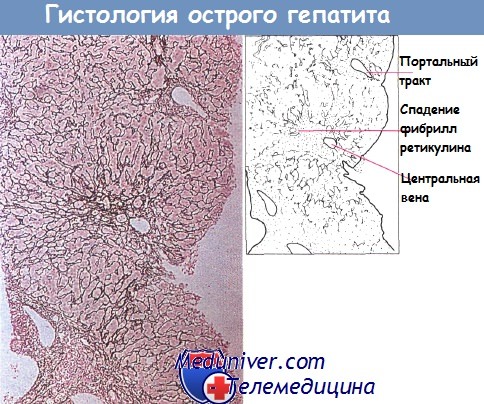
Гистологическая картина острого долькового гепатита: видно спадение фибрилл ретикулина в центре дольки.
Острые формы гепатитов В и С часто переходят в хронические. При этом в портальных трактах заметны основные гистологические изменения в виде скопления большого числа лимфоцитов и плазматических клеток. В процесс могут быть включены и прилежащие тракты. В некоторых случаях диагноз гепатита можно поставить на основании гистологической картины.
Видео лабораторная диагностика вирусных гепатитов
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

