Перинатальная передача вируса это как
Обновлено: 26.04.2024
Перинатальные инфекции: виды, возбудители, клиника, диагностика
Перинатальные инфекции: бактериемия и пневмония. В первые дни жизни новорождённого существует лишь несколько характерных клинических симптомов, указывающих на бактериемию: увеличение количества нейтрофилов (этот показатель не всегда диагностически значим), уменьшение содержания тромбоцитов, брадикардия, повышение концентрации С-реактивного белка.
Развитие менингита не считают характерным признаком инфекции. Для установления окончательного диагноза для анализа отбирают кровь, мочу и спинномозговую жидкость, но лечение необходимо начать до получения результатов. Основное направление медикаментозной терапии — эрадикация Escherichia coli и стрептококка группы В (бензилпенициллин в сочетании с гентамицином или цефотаксимом).
В некоторых странах исследование на стрептококк группы В проводят ещё во время беременности и иногда назначают профилактический интранатальный курс антибиотикотерапии пенициллином. В других регионах обследуют только женщин из группы риска.
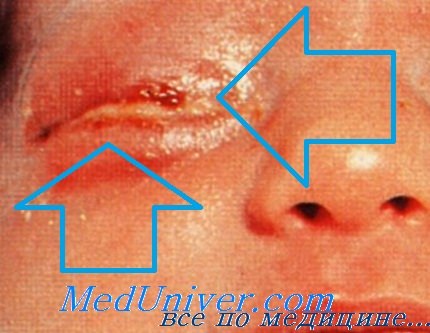
Гонококковая бленнорея у новорожденного
Перинатальные инфекции: гонококковая бленнорея новорождённых. Во время родов может произойти заражение Neisseria gonorrhoeae, вызывающей бленнорею новорождённых (гнойный конъюнктивит). Диагноз устанавливают после микроскопии мазков, окрашенных по Граму. Для лечения системной инфекции применяют пенициллин или цефотаксим (при возникновении устойчивости).
Перинатальные инфекции: хламидиоз. Хламидийная бленнорея новорождённых — тяжелейший конъюнктивит, возникающий в течение первых четырёх дней жизни. На исходе 6-й нед обычно развивается пневмония, характеризующаяся учащением дыхания и кашлем. Для лечения конъюнктивита применяют местные лекарственные средства, содержащие тетрациклин. При хламидийной пневмонии препаратом выбора считают эритромицин.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лица, инфицированные ВГС, служат резервуаром для передачи инфекции другим и имеют риск для развития хронического заболевания печени, ЦП и ГЦК. Установлено, что ВГС определяется при 27% ЦП и 25% ГЦК во всем мире. Подъем заболеваемости и смертности, обусловленной ВГС, который мы сейчас наблюдаем, является результатом беспрецедентного распространения этого возбудителя в XX столетии. Ответственным за это повышение является широкое распространение двух факторов: инвазивной терапии и употребления инъекционных наркотиков [3]. Несмотря на то, что наиболее вероятный путь передачи — это прямое чрескожное попадание ВГС, некоторые исследования демонстрируют, что сексуальный, внутрисемейный, профессиональный и вертикальный пути передачи также могут иметь значение [4].
В условиях эпидемиологического неблагополучия, когда наблюдается значительный рост хронических форм парентеральных вирусных гепатитов, опасность вовлечения женщин фертильного возраста в эпидемический процесс этих инфекций является весьма высокой. К сожалению, в России нет точной статистики о распространенности ХВГ В и ХВГ С среди беременных женщин. Учитывая латентное течение ХВГ, наибольшую значимость для диагностики приобретают серологические методы исследования. В соответствии с нормативно-правовыми документами [7, 8], беременные женщины проходят скрининговое исследование на ВГВ и ВГС путем серологического исследования на наличие HBsAg и суммарных анти-HCV-антител при постановке на учет и в III триместре беременности. При этом у подавляющего большинства женщин ХВГ В и ХВГ С впервые выявляются только во время беременности [9].
Выявление суммарных анти-HCV-антител уже на этапе первичного обследования, как правило, ассоциировано с ХВГ С. Генотипирование ВГС показывает преобладание генотипа 1b, значительно реже выявляются генотипы 1а, 3а, 2b [10].
Клиническая картина ХВГ В и С во время беременности характеризуется малосимптомностью [10, 11, 12]. По нашим данным [13], при обследовании 80 женщин с ХВГ у 22 (27,5%) подтвердился ХВГ В и у 58 (72,5%) — ХВГ С. Клинические проявления в виде гепатомегалии и внепеченочных знаков (телеангиэктазии, сосудистые звездочки), при отсутствии жалоб, были выявлены у 28% с ХВГ В и у 39% женщин с ХВГ С, повышение активности трансаминаз отмечалось лишь у 6,1% и 5,6% женщин с ХВГ В и ХВГ С соответственно. При ультразвуковом исследовании женщин с ХВГ В и ХВГ С обнаруживаются умеренные диффузные изменения печени (55,4%), признаки хронического холецистита (41,9%), в единичных случаях при ХВГ С выявляется жировой гепатоз. 70% женщин имели в анамнезе различные медицинские и парентеральные вмешательства. При изучении акушерско-гинекологического анамнеза было выявлено, что у большинства женщин неоднократно были выполнены искусственные аборты: у 34% женщин с ХВГ В и у 63% женщин с ХВГ С. Случаи самопроизвольных выкидышей на различных сроках беременности встречались у 22% и 31% беременных при ХВГ В и ХВГ С соответственно.
Течение данной беременности осложнялось угрозой прерывания беременности у 36,8% с ХВГ В и у 49,1% беременных с ХВГ С. При допплерометрическом исследовании маточно-плацентарного кровотока и кардиотокографии плода в III триместре беременности у 52,2% с ХВГ В и у 68,4% женщин с ХВГ С была диагностирована плацентарная недостаточность (ПН). Преждевременными родами беременность закончилась у 39,1% женщин с ХВГ В и у 24,6% с ХВГ С. При изучении особенностей течения родов было выявлено, что в 56,5% случаев при ХВГ В и в 43,8% при ХВГ С роды осложнились преждевременным разрывом плодных оболочек. У 7,2% обследуемых женщин с ХВГ В и у 6,3% с ХВГ С диагностирована аномалия родовой деятельности в виде первичной слабости. При определении генома вируса с помощью полимеразной цепной реакции в III триместре беременности положительные результаты были диагностированы у 28% женщин, инфицированных ВГВ, и у 60% женщин, инфицированных ВГС [13].
В большинстве развитых стран мира, где распространенность ХВГ В низкая, инфицирование происходит в основном среди взрослой популяции групп высокого риска, таких как инъекционные потребители наркотиков и имеющие множество гетеросексуальных партнеров. Напротив, в областях с высоким уровнем заболеваемости заражение происходит в перинатальном периоде или раннем детском возрасте. Риск передачи ВГВ от матери к ребенку очень высокий, до введения иммунизации составлял от 10% до 90%, в зависимости от уровня вирусной нагрузки [14, 15]. Риск передачи ВГС от матери к ребенку намного ниже и составляет около 3,5–7,5% [9; 16]. Сочетание ХВГ С с ВИЧ-инфекцией ведет к увеличению частоты перинатальной передачи вируса гепатита С до 16,3–40% [9, 16].
Величина уровня нуклеиновых кислот (НК) вирусов гепатита В и С в единице объема сыворотки (вирусная нагрузка) является независимым и статистически значимым фактором, ассоциированным с большей частотой вертикального инфицирования ребенка. Четко прослеживается зависимость перинатальной передачи вирусов гепатитов В и С от величины вирусной нагрузки матери [9, 15]. Реализация этого пути заражения имеет место лишь при наличии у матери в крови НК этих вирусов [9, 17].
Считается, что основным путем перинатального инфицирования ВГВ и ВГС является интранатальный [9, 18, 19], возможна также трансплацентарная передача ВГВ в III триместре [20]. Установлено, что грудное вскармливание не приводит к увеличению частоты вертикальной передачи при ХВГ В и С [9, 20].
Последствием перинатального инфицирования ВГВ и ВГС является формирование преимущественно первично-хронических форм вирусных гепатитов у детей первого года жизни, которые протекают с маловыраженной клинической симптоматикой [21]. У 20% детей, инфицированных ВГВ перинатально, в последующем развивается цирроз печени или гепатоцеллюлярная карцинома во взрослом состоянии [21, 22]. При перинатальном инфицировании ВГС клинические проявления у детей отсутствуют, генотип ВГС у детей соответствует генотипу матери, отмечается, как правило, низкий уровень аланин-аминотрансферазы (АЛТ), незначительные гистологические изменения в печени [21, 23].
Перинатальная передача при ХВГ В может быть снижена путем проведения соответствующей профилактики (вакцинация новорожденных против гепатита В совместно с иммуноглобулином против гепатита В). Вакцинация в 85–95% случаев предотвращает риск инфекции и является строго обязательной для лиц с высоким риском инфицирования [24]. Однако вертикальная передача ВГВ при высокой вирусной нагрузке у матери все же происходит, несмотря на пассивно-активную иммунизацию, передача ВГВ ребенку достигает 28% [25]. Отмечено, что использование ламивудина на последнем месяце беременности приводит к снижению риска передачи инфекции более чем в 2 раза (до 12,5%) [25]. Хотя некоторые исследователи не выявляют статистически значимую разницу в перинатальном инфицировании детей на фоне применения ламивудина по сравнению с контрольной группой [15].
При ХВГ С, кроме проведения противовирусной терапии до начала беременности, других профилактических мер не предполагается [11, 24], комбинированная противовирусная терапия препаратами интерферона (ИФН) и рибавирина противопоказана во время беременности. Некоторые авторы предлагают с целью предотвращения передачи инфекции во время родов у беременных женщин с ХВГ С при высоком уровне вирусной нагрузки и сопутствующей ПН проводить родоразрешение путем операции кесарева сечения [10], хотя предыдущие исследования свидетельствуют о том, что вертикальная передача не зависит от способа родоразрешения, а обусловлена только уровнем вирусной нагрузки и ко-инфекцией с ВИЧ [19].
Таким образом, до настоящего времени остается не разработанной стратегия минимизации риска передачи ВГВ и ВГС от матери новорожденному ребенку. Требуется поиск эффективных методов предотвращения перинатальной трансмиссии ВГВ и ВГС. Проблема ведения беременных с инфекционными заболеваниями заключается в сложности их этиотропного лечения. Большинство антибактериальных, противовирусных препаратов и иммуномодуляторов противопоказаны во время беременности. Существующие данные указывают, что высокие уровни материнского ИФН в течение беременности могут защищать плод от передачи инфекции, поэтому с этой целью в последние годы успешно применяют рекомбинантные ИФН [26, 27].
ИФН относятся к цитокинам (медиаторам иммунитета) и представлены семейством белков, обладающих антивирусной, иммуномодулирующей и противоопухолевой активностью, что позволяет отнести их к полифункциональным биорегуляторам широкого спектра действия и гомеостатическим агентам [28]. Нарушение функционирования системы ИФН, проявляющееся глубоким угнетением интерфероногенеза, является ключевым звеном в патогенезе ХВГ [29]. В отечественной литературе имеются единичные исследования, касающиеся опыта назначения препаратов ИФН беременным женщинам с ХВГ с целью профилактики перинатального инфицирования [17, 30].
Убедительные данные, полученные при комплексном обследовании беременных, а также при морфологическом и гистохимическом исследовании последа, свидетельствуют о необходимости коррекции показателей иммунитета и интерфероногенеза при хронической ПН инфекционного генеза [31, 32, 33]. С этой целью во время беременности используется иммуноглобулинотерапия, препараты ИФН [33].
В качестве противовирусного и иммунокорригирующего препарата у беременных женщин с ХВГ В и С для профилактики вертикальной передачи инфекции нами выбран препарат Кипферон®, суппозитории для вагинального или ректального введения (Кипферон ® ).
Кипферон® (регистрационное удостоверение Р N000126/01 от 31.03.2006), разработанный в Московском НИИ эпидемиологии и микробиологии им. Г. Н. Габричевского, является одним из новых отечественных иммунобиологических препаратов. Представляет собой комбинацию комплексного иммуноглобулинового препарата (КИП) — 60 мг, содержащего иммуноглобулины трех основных классов G, А и М, и рекомбинантного человеческого интерферона альфа-2b не менее 500 000 МЕ. Применение ИФН в суппозиториях (вагинально или ректально), в отличие от внутримышечного введения, позволяет избежать появления гриппоподобного синдрома, выработки аутоантител на ИФН, кроме того, его действие в крови продлевается до 24 ч (при в/м введении — 12 ч) [34].
Кипферон® показан для применения при внутриутробной инфекции, инфекции урогенитального тракта у беременных — кандидоз, генитальный герпес, микоплазмоз, уреаплазмоз, хламидиоз, ЦМВ-инфекция, гонорея, гнойно-септические инфекции, бактериальный вагиноз — в разных триместрах беременности; в прегравидарном периоде у женщин с урогенитальной инфекцией для профилактики заражения плода во время родов [34, 35]. Кипферон® активно используется для терапии различных неспецифических воспалительных заболеваний женской половой сферы, в том числе во время беременности [35, 36]. Имеется опыт клинического применения препарата Кипферон® при высоком риске внутриутробного инфицирования [27], при инфекционных осложнениях у беременных, в том числе при рецидивирующем генитальном герпесе [36] и генитальном кандидозе [37, 38].
Было установлено, что сочетанное влияние компонентов препарата Кипферон ® обусловливает мощные антивирусный и антимикробный эффекты, проявляющиеся как внутри клетки, так и вне ее, за счет прямого действия на возбудителей заболеваний и стимуляции механизмов местного и общего иммунитета, а также миграции активизированных клеток из слизистых вагины и кишечника. Кроме того, при поступлении иммуноглобулинов повышается местный секреторный иммунитет, усиливаются терапевтический антивирусный и антибактериальный эффекты. В результате воздействия соответствующих специфических антител повышается активность местно образуемых цитокинов [34].
Все указанные характеристики послужили основанием для выбора Кипферона® для профилактического использования у беременных женщин с ХВГ В и С с целью предотвращения вертикальной передачи инфекции. Предварительные наблюдения показали положительный антивирусный эффект Кипферона® при ХВГ В и С у беременных женщин, проявляющийся в снижении вирусной нагрузки. Дальнейшие исследования предполагают проведение оценки в динамике показателей иммунного статуса, функционального состояния плаценты, что позволит установить терапевтическую и профилактическую эффективность препарата Кипферон® у беременных женщин с ХВГ В и С.
Таким образом, актуальность проблемы хронических вирусных гепатитов В и С, вовлечение в эпидемический процесс беременных женщин требуют разработки стратегии минимизации риска вертикальной передачи инфекции во время беременности и родов, поиска безопасных и эффективных средств для профилактики перинатального инфицирования вирусами гепатитов В и С.
Конкретные этапы оценки эффективности применения Кипферона® с целью предупреждения вертикальной передачи вируса гепатита В и С от матери к ребенку будут представлены в последующих публикациях.
Литература
WHO. Global surveillance and control of hepatitis C. Report of a WHO Consultation organized in collaboration with the Viral Hepatitis Prevention Board, Antwerp, Belgium // J Viral Hepat. 1999; 6: 35–47.
Alter M. J. Epidemiology of hepatitis C virus infection // World J Gastroenterol. 2007; 13 (17): 2436–2441.
Онищенко Г. Г. О состоянии заболеваемости инфекционными гепатитами в Российской Федерации и неотложных медицинских мерах по ее стабилизации // Вопр. вирусол. 2001; 46 (4): 4–7.
Шахгильдян И. В., Ясинский А. А., Михайлов М. И. и др. Эпидемиологическая характеристика хронических гепатитов В и С в Российской Федерации // Мир вирусных гепатитов. 2008; 5: 11–16.
Профилактика вирусных гепатитов. Общие требования к эпидемиологическому надзору за вирусными гепатитами. Санитарно-эпидемиологические правила СП 3.1.958.00.
Ершова О. Н. Современные проявления эпидемического процесса гепатита С, активность естественных путей передачи, совершенствование профилактики этой инфекции. Автореф. дис. … д-ра мед. наук. М., 2006; 47 с.
Гурская Т. Ю. Беременность и хронический HCV-гепатит: вопросы патогенеза, клиники, диагностики, состояния фето-плацентарной системы. Автореф. дис. … д-ра мед. наук. М., 2006; 48 с.
Ranger-Roqez S., Alain S., Denis F. Hepatitis viruses: mother to child transmission // Pathol Biol (Paris). 2002; 50 (9): 568–575.
Yang S., Liu M., Wang L. Effect of high viral hepatitis B virus DNA loads on vertical transmission of hepatitis B virus in late-pregnant women // Zhonghua Fu Chan Ke Za Zhi. 2008; 43 (5): 329–331.
Papaevangelou V., Pollack H., Rochford G. Increased Transmission of Vertical Hepatitis C Virus (HCV) Infection to Human Immunodeficiency Virus (HIV)–Infected Infants of HIV- and HCV-Coinfected Women // J Infect Dis. 1998; 178: 1047–1051.
Фарбер Н. А., Мартынов К. А., Гуртовой Б. Л. Вирусные гепатиты у беременных. М.: Медицина, 1990; 208 с.
Terrault N. F. Epidemiological Evidence for perinatal transmission of hepatitis C // Viral hepatitis. 1998, 4: 245–248.
Учайкин В. Ф., Нисевич Н. И., Чередниченко Т. В. Вирусные гепатиты от А до TTV у детей. М.: Новая волна, 2003; 432 с.
Fiqueroa D. R., Sanchez F. L., Benavides C. E. et al. The behavior and perinatal impact of viral hepatitis in pregnancy // Rev Gastroenterol Mex. 1994; 59 (3): 246–253.
Oliveira U. B. Hepatitis C Virus Perinatal Transmission // Brazilian Journal Infectious Diseases. 2007; 11 (5). Suppl. 1: 10–11.
Bernard P. H. Hepatitis B and C virological tests: interpretation and practical results in women // Gynecol Obstet Fertil. 2005; 33 (6): 423–428.
Van Zonneveld M., Van Nunen A. B., Niesters H. G. M. et al. Lamivudine treatment during pregnancy to prevent perinatal transmission of hepatitis B virus infection // J Viral Hepat. 2003; 10 (4): 294–297.
Сидорова И. С., Алешкин В. А., Афанасьев С. С., Матвиенко Н. А. Состояние иммунной системы у беременных и новорожденных группы высокого риска по внутриутробному инфицированию // Рос. вест. перинат. и пед. 1999; 6: 10–16.
Ершов Ф. И., Киселев О. И. Интерфероны и их индукторы (от молекул до лекарств). М.: ГЭОТАР-Медиа, 2005; 368 с.
Павлова Л. Е., Макашова В. В., Токмалаев А. К. Система интерферона при вирусных гепатитах // Эпидемиология и инфекционные болезни. 2000; 1: 48–51.
Пустотина О. А., Фанченко Н. Д., Бубнова Н. И. и др. Клинико-патогенетическое обоснование акушерской тактики при много- и маловодий инфекционного генеза // Проблемы репродукции. 2006; 6.
Сидорова И. С., Макаров И. О., Матвиенко Н. А. и др. Состояние фетоплацентарной системы при высоком риске внутриутробного инфицирования плода // Рос. вест. перинат. и пед. 2000; 2: 5–8.
Орджоникидзе Н. В., Тютюнник В. Л. Особенности ведения беременных при плацентарной недостаточности и инфекции // Гинекология. 2007; 9 (6).
Сидорова И.С,Афанасьев С.С,Микаелян Л.С .Влияние иммунокорригирующей терапии на течение генитальной герпетической инфекции в III триместре беременности. Рос.вестн.акуш.гинек.2003; 2
Савченко Т. Н., Точиева М. Х., Протопопова Л. О. Клиническая эффективность сочетанного применения антимикотической и иммуномодулирующей терапии у женщин с невынашиванием беременности и генитальным кандидозом. Трудный пациент 2009; 7 (8–9): 21–24.
Подзолкова Н. М., Плахов И. В., Коджаева М. Х. и др. Кипферон в комплексной терапии вагинального кандидоза у беременных женщин. Terra medica 2002, 3.
Ключевые слова: хронические вирусные гепатиты, беременность, иммуномодулирующая терапия.
К. И. Чуйкова, доктор медицинских наук
Т. А. Ковалева, кандидат медицинских наук
И. Д. Евтушенко, доктор медицинских наук
СибГМУ, Томск
Долгое время в научной литературе отсутствовали какие-либо четкие доказательства вертикальной передачи COVID-19 от матери к плоду. По данным J. Yan и соавт. о результатах беременности у 116 женщин, инфицированных SARS-CoV-2 во время беременности, а также о протекании неонатального периода у их детей COVID-19 не был связан с повышенным риском преждевременных родов. Исследователи не получили также доказательств вертикальной передачи COVID-19 при заражении матери в III триместре беременности [1].
N. Li и соавт. сообщили о 17 детях, рожденных от матерей, которые были инфицированы SARS-CoV-2. Частота преждевременных родов составила 23,5%, а частота низкого веса при рождении – 17,6%; оба показателя были выше, чем в общей популяции, но это было обусловлено осложнениями беременности, а не самим COVID-19 [2].
H. Zeng и соавт. опубликовали данные о том, что ни один из 6 детей, рожденных женщинами с COVID-19, не был инфицирован SARS-CoV-2, однако у 2 младенцев в крови был выявлен повышенный уровень иммуноглобулинов М (IgM) [3].
В марте 2020 г. Journal of the American Medical Association опубликовал отчет D.W. Kimberlin, S. Stagno [4] о 3 новорожденных с повышенным уровнем IgM к SARS-CoV-2, хотя результаты повторных исследований мазков из носоглотки методом полимеразной цепной реакции (ПЦР) у детей были отрицательными. Предположение о внутриутробной передаче инфекции у этих 3 новорожденных было основано на обнаружении IgM в крови, хотя данный анализ считается спорным способом диагностики многих других врожденных инфекций. IgM слишком крупные, чтобы проникать через плаценту, и поэтому можно предположить, что обнаружение IgM у новорожденного может отражать их продукцию у плода после внутриутробного инфицирования. Однако большинство других врожденных инфекций не диагностируется только лишь на основании обнаружения IgM, потому что данный анализ может давать ложноположительные, ложноотрицательные и сомнительные результаты, а также перекрестную реактивность.
F. Parazzini и соавт. обследовали матерей с COVID-19 после естественных родов (n = 6) и кесарева сечения (n = 31). У 2 новорожденных получен положительный результат исследования мазка на наличие SARS-CoV-2 методом ПЦР; у 3 новорожденных в крови был выявлен повышенный уровень антител к SARS-CoV-2 классов IgG и IgM, но результат исследования методом ПЦР был отрицательным. Авторы сделали вывод о том, что частота вертикальной или перинатальной передачи COVID-19 является низкой или нулевой при кесаревом сечении, но данные об этом показателе при вагинальных родах отсутствуют [5].
Противоречивые данные исследований мазка методом ПЦР и анализов крови на наличие антител в неонатальном периоде у детей, рожденных от матерей с COVID-19, вызывали разногласия по вопросу о риске вертикальной передачи этой инфекции во время беременности. Однако в исследовании L. Zeng и соавт. в группе из 33 детей у 3 (9%) выявлена ранняя инфекция SARS-CoV-2. Поскольку во время родов строго соблюдались меры по инфекционному контролю и профилактике, вполне вероятно, что источником передачи SARS-CoV-2 новорожденным (вирус обнаружен при анализе мазков из носоглотки и ануса) были зараженные матери. Несмотря на то что в предыдущих исследованиях не выявлено никаких клинических данных, свидетельствующих о наличии COVID-19 в неонатальном периоде у детей, рожденных у заболевших матерей, и получены отрицательные результаты исследования амниотической жидкости, пуповинной крови и грудного молока на наличие SARS-CoV-2, в этой когорте вертикальная передача от матери к плоду не могла быть исключена. Из 3 описанных новорожденных с симптомами COVID-19 состояние наиболее тяжело больного младенца, скорее всего, было обусловлено перенесенной асфиксией и развитием сепсиса на фоне недоношенности, а не течением COVID-19 [6].
Недавняя публикация в Journal of the American Medical Association D. Baud и соавт. посвящена описанию случая выкидыша во II триместре у женщины с COVID-19, связанной с инфекцией плаценты SARS-CoV-2. На фетальной поверхности плаценты был обнаружен SARS-CoV-2. При гистологическом исследовании выявлен смешанный воспалительный инфильтрат и фунисит. Хотя вертикальная передача не была доказана, никакой другой этиологии гибели плода установлено не было [10].
По-видимому, существует как минимум 2 пути, по которым SARS-CoV-2 может вызвать внутриутробную инфекцию при вертикальной передаче. Показано, что ангиотензинпревращающий фермент 2-го типа, который был определен как предполагаемый поверхностный рецептор к SARS-CoV-2 чувствительных клеток, экспрессируется в человеческой плаценте. Это повышает вероятность трансплацентарного распространения SARS-CoV-2 через ангиотензинпревращающий фермент 2-го типа. В частности, гликопротеин (S-белок) вирусной поверхности SARS-CoV-2 расщепляется трансмембранной протеазой серина 2 для повышения эффективности проникновения и репликации вируса. Появляются новые доказательства того, что SARS-CoV-2 вовлекает дополнительные протеазы организма-хозяина для проникновения в клетку. Однако неизвестно, существует ли плацентарная экспрессия протеаз хозяина (таких, как трансмембранная протеаза серина 2 и др.), необходимых для расщепления S-белка и прайминга рецепторов. С другой стороны, повреждение плацентарного барьера, вызванное тяжелой гипоксемией у матерей с COVID-19, также может быть одним из возможных путей, по которым SARS-CoV-2 может вызвать внутриутробную инфекцию [11].
Новорожденные все еще могут заразиться SARS-CoV-2 при тесном контакте с инфицированными матерями. A.C. Lobato и соавт. описали случаи COVID-19, подтвержденные при исследовании назофарингеальных мазков методом ПЦР, у 5 новорожденных. Все дети были госпитализированы из семейных очагов и, скорее всего, имели постнатальную инфекцию. У этих младенцев отмечалось повышение температуры тела, однако никаких дыхательных нарушений или отклонений в анализах и данных дополнительного обследования обнаружено не было [12].
Таким образом, данные научной литературы не исключают риск вертикальной передачи нового коронавируса от беременной женщины к плоду [11, 13, 14]. Существует острая необходимость в дальнейшем изучении возможности вертикальной передачи SARS-CoV-2. Кроме того, новорожденные могут заболеть COVID-19 постнатально при тесном контакте с больными матерями или родственниками. Течение COVID-19 у новорожденных преимущественно бессимптомное или легкое, однако дети могут составлять трансмиссивный потенциал для продолжения пандемии, поэтому крайне важно проводить скрининг беременных женщин и строго соблюдать меры по инфекционному контролю, карантин инфицированных матерей и тщательный мониторинг новорожденных с риском развития COVID-19.
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
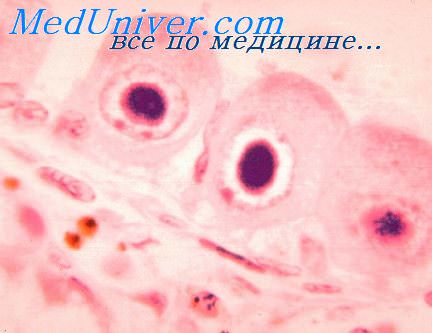
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

