Препараты растительного происхождения для лечения гриппа
Обновлено: 11.05.2024
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около
Острые респираторные инфекции (ОРВИ) являются наиболее распространенными среди всех инфекционных заболеваний. На долю ОРВИ, а также гриппа приходится не менее 70% инфекционных заболеваний. В России ежегодно регистрируется около 50 млн инфекционных заболеваний, из которых до 90% случаев приходится на ОРВИ и грипп.
Почти 90% населения как минимум один раз в году переносят одну из респираторных инфекций вирусной этиологии, что в целом предопределяет высокую заболеваемость и даже влияет на показатель смертности [2].
Столь высокая частота заболеваний респираторного тракта объясняется многообразием этиологических факторов (вирусы гриппа, парагриппа, аденовирусы, риновирусы, реовирусы, респираторно-синцитиальные (РС) вирусы, микоплазмы, хламидии, бактериальные агенты), а также легкостью передачи возбудителя и высокой изменчивостью вирусов.
Дифференциальная диагностика гриппа и ОРВИ затруднена из-за сходства клинической картины этих заболеваний, но вполне возможна. Основными отличиями можно считать начальные признаки заболевания, симптомы интоксикации, характер катаральных явлений и лихорадки, тип развивающихся осложнений и др. Клинический диагноз, подтвержденный данными лабораторных анализов, и определяет выбор терапии.
Клиническая картина ОРВИ и гриппа зависит от вируса-возбудителя (см. таблицу).
Следует отметить, что осложнения при ОРВИ, особенно в период эпидемии, регистрируются в 20–30% случаев. Основными причинами осложнений являются нарушения иммунной защиты, приводящие к длительной недостаточности в работе иммунной системы. Снижение антибактериальной резистентности организма приводит к затяжным периодам реконвалесценции и обусловливает возможность осложнений в течение длительного времени. Особое место среди осложнений занимает так называемый синдром послевирусной астении (СПА), который может развиваться у 65% больных в течение 1 мес от начала заболевания. Ведущими симптомами СПА являются усталость, эмоциональные нарушения и различные психические расстройства.
Круг препаратов, используемых при лечении ОРВИ и гриппа, широк и разнообразен. Он включает живые и инактивированные вакцины, химиопрепараты этиотропного действия, а также средства, применяющиеся для иммунокорригирующей и патогенетической терапии.
Тем не менее течение гриппа и других ОРВИ по-прежнему плохо поддается контролю. Это связано не только с полиэтиологичностью данных заболеваний, но и с уникальной изменчивостью вирусов и глобальным характером эпидемий. Распространение ОРВИ в значительной степени зависит от экологической, социально-экономической ситуации, наличия у пациентов аллергических заболеваний и ряда других факторов.
Противовирусные препараты
Химиопрепараты
Механизм действия этой группы препаратов основан на избирательном подавлении отдельных звеньев репродукции вирусов, без нарушения жизнедеятельности клетки макроорганизма. При респираторных инфекциях используются две группы препаратов — блокаторы М2-каналов и ингибиторы нейроаминидазы, а также рибавирин, активный против РС-вируса.
Блокаторы М2-каналов
В 1961 г. был синтезирован симметричный амин — амантадин, а затем и ряд его производных (римантадин, мидантан, дейтифорин). В нашей стране получил широкое применение римантадин, который используется для лечения и профилактики гриппа, вызванного вирусом типа А. Эффективность этого средства составляет 70–90%.
Противовирусный эффект реализуется путем блокирования особых ионных каналов (М2) вируса, что сопровождается нарушением его способности проникать в клетки и высвобождать рибонуклеопротеид. Тем самым ингибируется важнейшая стадия репликации вирусов. Примерно в 30% случаев может развиваться резистентность к римантадину [6].
Римантадин выпускается в форме ремантадина в таблетках по 50 мг и сиропа для детей от 1 до 7 лет альгирем—2 мг/мл. С лечебной целью препарат назначается с момента регистрации первых симптомов. Длительность терапии не должна превышать 5 дней во избежание появления резистентных форм вируса. Профилактически римантадин необходимо принимать не менее 2 нед.
Ингибиторы нейроаминидазы
Препараты этой группы эффективны не только против вирусов гриппа типа А, но и против вирусов типа В.
Нейроаминидаза (сиалидаза) — один из ключевых ферментов, участвующих в репликации вирусов гриппа. При ингибировании нейроаминидазы нарушается способность вирусов проникать в здоровые клетки, снижается их устойчивость к защитному действию секрета дыхательных путей и таким образом тормозится дальнейшее распространение вируса в организме. Ингибиторы нейроаминидазы способны уменьшать продукцию цитокинов (ИЛ-1 и фактора некроза опухоли), препятствуя развитию местной воспалительной реакции и ослабляя такие системные проявления вирусной инфекции, как лихорадка, боли в мышцах и суставах, потеря аппетита [7].
Предварительные исследования показали, что эффективность такого ингибитора в качестве профилактического средства составляет 70–80%. Прием этих препаратов позволяет сократить длительность болезни на 1–1,5 дней (если препарат начать принимать не позднее, чем через 36–48 ч с момента появления первых симптомов). В начале заболевания и на ранних его стадиях средняя продолжительность репликации вируса сокращается в среднем на 3 дня, а число тяжелых форм ОРВИ и гриппа, характеризующихся повышенной температурой, — на 85%. Препараты не оказывают вредного воздействия на центральную нервную систему. Однако следует отметить, что далеко не всегда представляется возможность их применения в первые 48 ч: из-за сложностей, связанных с дифференциальной диагностикой гриппа и других ОРВИ.
Представителями ингибиторов нейроаминидазы являются озельтамивир и занамивир.
Озельтамивир (тамифлю) назначается по 75–150 мг 2 раза в день в течение 5 дней. Для профилактики — по 75 мг 1 или 2 раза в день в течение 4–6 нед. У пациентов с клиренсом креатинина менее 30 мл/мин доза снижается в 2 раза.
Занамивир (реленца) является структурным аналогом сиаловой кислоты — естественного субстрата нейроаминидазы вирусов гриппа — и, следовательно, обладает способностью конкурировать с ней за связывание с активным центром. Ингалируется с помощью специального устройства — дискхалера. С лечебной целью назначается по 10 мг 2 раза в день (с интервалом 12 ч) в течение 5 дней, для профилактики — по 10 мг 1 раз в день в течение 4–6 нед. Ингаляционный способ введения имеет преимущество, так как обеспечивает достаточно быстрый противовирусный эффект в зоне первичного очага инфекции.
Побочные реакции данной группы препаратов составляют не более 1,5% случаев. Чаще всего это головная боль, головокружение, тошнота, диарея, явления синусита. У пациентов с обструктивными бронхолегочными заболеваниями возможно развитие бронхоспазма.
Препараты, активные против других вирусов
Рибавирин (виразол, ребетол), действующий на многие РНК- и ДНК-содержащие вирусы, в аэрозольной лекарственной форме используется при лечении инфекций, вызванных РС-вирусом. Предполагается, что препарат ингибирует ранние этапы вирусной транскрипции, нарушая синтез рибонуклеопротеидов, информационной РНК, блокируя РНК-полимеразу. Применяется ингаляторно с помощью небулайзера только в условиях стационара.
При приеме рибавирина могут отмечаться бронхоспазм, сыпь, раздражение глаз, причем не только у пациентов, но и у медперсонала. В редких случаях наблюдаются лейкопения, бессонница, раздражительность. Существует риск кристаллизации препарата в дыхательных путях и интубационных трубках. Обладает тератогенным действием.
Перспективным противовирусным препаратом является недавно разработанный в США пленоконарил. В исследованиях in vitro и в экспериментах на животных выявлена его активность против энтеровирусов и риновирусов. Данные первых плацебо-контролируемых исследований свидетельствуют об эффективности препарата при респираторных инфекциях и энтеровирусном менингите [8].
В России применяются оригинальные противовирусные препараты, созданные на основе отечественных разработок. Наиболее широко известный из них — арбидол. Он оказывает ингибирующее действие на вирусы гриппа типа А и В и другие респираторные вирусы, механизм которых до конца не выяснен. Предполагают, что подобное воздействие связано и с интерферониндуцирующими и с иммуномодулирующими свойствами препарата. В частности, арбидол стимулирует активность фагоцитарных клеток. Выпускается в таблетках по 0,1 г. В лечебных целях назначается по 0,2 г 3–4 раза в день в течение 3–5 дней. С профилактической целью применяется по 0,2 г/сут в течение 10–14 дней.
Интерфероны
Интерфероны (ИФН) относятся к числу регуляторов иммуногенеза. Они продуцируются различными клетками и не только реализуют противовирусный ответ, но и регулируют иммунологические реакции. Основные эффекты интерферонов можно подразделить на антивирусные, антимикробные, антипролиферативные, иммуномодулирующие и радиопротективные.
Несмотря на разнообразие генетического материала вирусов, ИФН подавляют их репродукцию на стадии, обязательной для всех вирусов: они блокируют начало трансляции, т. е. синтез вирусспецифических белков. Этим можно объяснить универсальность антивирусного действия интерферона. Под воздействием интерферона в организме усиливается активность естественных киллеров, Т-хелперов, цитотоксических Т-лимфоцитов, фагоцитарная активность, интенсивность дифференцировки В-лимфоцитов, экспрессия антигенов МНС I и II типа [1].
Для лечения вирусных инфекций применяются α- и β-интерфероны. Хороший эффект при лечении дает комбинированное применение химиопрепаратов и препаратов ИФН.
β-интерферон (бетаферон) выпускается в форме порошка, во флаконах, содержащих по 9,5 млн ЕД ИФН. При гриппе его закапывают или распыляют в носовые ходы не менее 4–5 раз в сутки [2].
Человеческий лейкоцитарный интерферон представляет собой смесь интерферонов, синтезируемых лейкоцитами донорской крови в ответ на воздействие вирусного индуктора. Препарат вводят ингаляторно или закапывают в носовые ходы водный раствор, приготавливаемый из сухого вещества в ампуле или флаконе.
Виферон — рекомбинантный интерферон-α 2b — выпускается в форме ректальных свечей и применяется при лечении ОРВИ и гриппа. Повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, является причиной снижения противовирусной активности интерферона. Токоферола ацетат и аскорбиновая кислота, входящие в состав виферона, являются мембраностабилизирующими компонентами, антиоксидантами, в сочетании с которыми противовирусная активность рекомбинантного интерферона-α 2b возрастает в 10–14 раз [1].
Особенности введения лекарственной формы обеспечивают длительную циркуляцию в крови интерферона-α 2b.
Препарат применяется как у новорожденных детей, так и у взрослых больных при ОРВИ и гриппе в возрастных дозировках. Детям до 7 лет назначается виферон-1, детям старше 7 лет и взрослым — виферон-2.
Индукторы интерферона
Амиксин — низкомолекулярный синтетический индуктор эндогенного интерферона ароматического ряда, относящийся к классу флуоренонов. Основными структурами, продуцирующими интерферон в ответ на введение амиксина, являются клетки эпителия кишечника, гепатоциты, Т-лимфоциты, гранулоциты. В лейкоцитах человека амиксин индуцирует образование интерферона, уровень в крови которого составляет 250 ЕД/мл. После приема амиксина внутрь максимум интерферона у человека определяется последовательно в кишечнике, печени, крови через 4–24 ч [2].
При лечении гриппа и ОРВИ амиксин назначается в первые часы заболевания, на курс достаточно 5–6 таблеток. С целью профилактики назначается 1 раз в неделю в течение 4–6 нед.
Циклоферон является низкомолекулярным индуктором ИФН-α , что определяет широкий спектр его биологической активности. Он быстро проникает в клетки, накапливаясь в ядре и цитоплазме. Циклоферон интеркалирует ДНК клетки, с чем связан механизм его интерферониндуцирующей активности [3].
Циклоферон быстро проникает в кровь. Отмечается низкое связывание его с белками крови и в то же время широкое распространение в различных органах, тканях, биологических жидкостях организма.
Ввиду того что циклоферон является низкомолекулярным препаратом, он легко преодолевает гематоэнцефалический барьер, вызывая образование ИФН в мозге. Циклоферон быстро выводится из организма: 99% введенного препарата элиминируется почками в неизмененном виде в течение 24 ч.
Циклоферон хорошо переносится больными и назначается с первого дня от начала заболевания в виде таблетированной формы или парентерально [4].
Ридостин — высокомолекулярный индуктор ИФН природного происхождения. Ридостин представляет собой двуспиральную РНК, полученную из лизата киллерных дрожжей Saccharamyces cervisiae.
Системное введение ридостина стимулирует продукцию раннего ИФН. Максимальное накопление ИФН в сыворотке отмечается через 6–8 ч после инъекции; через 24 ч в кровотоке не определяется [1].
Препарат проявляет выраженный иммуномодулирующий эффект. Он стимулирует Т-клеточное и гуморальное звенья иммунитета, пролиферацию стволовых клеток костного мозга и фагоцитарную активность макрофагов и нейтрофилов периферической крови. Ридостин повышает уровень кортикостероидных гормонов; применяется для лечения и профилактики гриппа и других ОРВИ.
В настоящее время незаслуженно забывают препарат дибазол, применяемый для лечения и профилактики гриппа и ОРВИ. Дибазол обладает иммуномодулирующей активностью и индуцирует выработку эндогенного интерферона. Для профилактики назначается по 1 таблетке (0,02–0,05 г) 1 раз в день — 3–4 нед, для лечения — по 1 таблетке 3 раза в день — 5 дней.
Незаменимы в лечении гриппа и ОРВИ такие комплексные препараты, как гриппостад, ринза, терафлю, фервекс, а также препараты для наружного и местного применения — мазь от простуды доктор Мом, туссамаг бальзам от простуды.
Несмотря на многообразие препаратов, представленных для лечения ОРВИ и гриппа на современном этапе, выбор лекарственного препарата остается актуальной задачей для практикующего врача. Выбор тактики назначения и ведения больного с ОРВИ или гриппом напрямую связан с тяжестью течения инфекционного процесса, формой заболевания и наличием осложнений. Успех лечения зависит от правильной оценки состояния больного и раннего начала лечения.
Поиск новых биологически активных соединений растительного происхождения для лечения и профилактики иммуносупрессии инфекционных заболеваний остается активной частью фармацевтических исследований. Основой противовирусной терапии является воздействие на вирус или его составляющие компоненты на той или иной стадии репродукции. Практическая медицина обладает достаточно внушительным арсеналом противовирусных средств, способных подавлять репродукцию вируса на любой из трех стадий репродукции вируса. Однако противовирусная химиотерапия начинает сталкиваться с серьезной проблемой появления вариантов вируса, устойчивых к тем или иным препаратам. Описаны препараты растительного происхождения с различной химической структурой, способные проявлять антивирусную активность на различных стадиях репродукции вируса. Большое разнообразие биологически активных соединений, находящихся в растениях, позволяет рассчитывать на возможность получения новых высокоактивных препаратов, обладающих способностью блокировать различные вирусы, в том числе резистентные к существующим коммерческим химиопрепаратам.

1. Этиотропная лекарственная терапия вирусных инфекций / Г.А. Галегов, В.Л. Андронова, Н.А. Леонтьева и др. // Вопр. вирусол. – 2004. – № 3. – С. 35–40.
2. Покpовский В.И., Онищенко Г.Г., Чеpкасский Б.Л. Совpеменные пpедставления об инфекционной патологии и основные напpавления совеpшенствования стpатегии ее пpофилактики // Вестник РАМН. – 2000. – № 1. – C. 3–6.
4. Balunas, M.J.; Kinghorn, A.D. Drug discovery from medicinal plants // Life Sci. – 2005. – 78. – P. 431–441
5. Bantia S., Parker C.D., Ananth S.L. et al. Comparison of the anti-influenza virus activity of RWJ-270201 with those of oseltamivir and zanamivir // Antimicrob. Agents and Chemother. – 2001. – Vol. 45, № 4. – Р. 1162–1167.
6. Boltz D.A., Aldrige J.R., Webster R.G., et al. Drugs in development for influenza // Drugs. – 2010. – Vol. 70. – P. 1349–1362.
7. Calland, N.; Albecka, A.; Belouzard, S.; Wychowski, C.; Duverlie, G.; Descamps, V.; Hober, D.; Dubuisson, J.; Rouillé, Y.; Séron, K. (−)-Epigallocatechin-3-gallate is a new inhibitor of hepatitis C virus entry // Hepatology – 2012. – Vol. 55. – P. 720–729.
8. Calland N., Dubuisson J., Rouillé Y., Séron K. Hepatitis C Virus and Natural Compounds: A New Antiviral Approach? // Viruses. – 2012. – № 4. – P. 2197–2217.
9. Ciesek, S.; von Hahn, T.; Colpitts, C.C.; Schang, L.M.; Friesland, M.; Steinmann, J.; Manns, M.P.; Ott, M.; Wedemeyer, H.; Meuleman, P.; et al. The green tea polyphenol, epigallocatechin-3-gallate, inhibits hepatitis C virus entry// Hepatology. – 2011. – Vol. 54. – P. 1947–1955.
10. Deyrup M., Sidwell R., Little R. et al. Improved delivery through biological membranes. Synthesis and antiviral activity of a series of ribavirin chemical delivery systems: 2’ and 3’ derivatives // Antiviral Chem. and Chemother. – 1991. – Vol. 2. – P. 337–356.
11. Fabricant D.S., Farnsworth N.R. The value of plants used in traditional Medicine for drug discovery // Environmental Health Perspectives. – 2001. – Vol. 109. – P. 69–75.
12. Krug R.M., Aramini J.M. Emerging antiviral targets for influenza A virus // Trends. Pharmacol. Sci. – 2009. – Vol. 30. – P. 269–277.
13. Li Y., Jiang R., Ooi L.S. et al. Antiviral triterpenoids from the medicinal plant Schefflera heptaphylla // Phytother. Res. – 2007. – Vol. 21. – P. 466–470.
14. Patick A.K., Potts K.E. Protease inhibitors as antiviral agents // Clinic. Microbiol. Rev. –1998. – Vol. 11, № 4. – P. 614–627.
15. Preziosi P. Influenza pharmacotherapy: present situation, strategies and hopes // Expert Opin. Pharmacotherapy. – 2011. – P. 23–30.
16. Ryu Y. B., Curtis-Long M.J., Kim J.H., Jeong S.H., Yang M.S., Lee K.W., Lee W.S., Park K.H. Pterocarpans and flavanones from Sophora flavescens displaying potent neuraminidase inhibition // Bioorganic & Medicinal Chemistry Letters. – 2008. – Vol. 18. – P. 6046–6049.
17. Safrin S. Antiviral agents. Basic and clinical pharmacology. In: Katzung B.G., editor, McGrow-Hill. – New York, 2007. – P. 815.
18. Sidwell R. Ribavirin: A review of antiviral efficacy // Abstr. Recent. Res. Devel. in Antimicrob. Agents and Chemother. (G. Pandalai, ed.) Research Signpost. – India, 1995. – Vol. 1. – Р. 219–256.
20. Wagoner, J.; Morishima, C.; Graf, T.N.; Oberlies, N.H.; Teissier, E.; Pécheur, E.I.; Tavis, J.E.; Polyak, S.J. Differential in vitro effects of intravenous versus oral formulations of silibinin on the HCV life cycle and inflammation // PLoS One. – 2011. – P. e164–174.
21. Wagoner, J.; Negash, A.; Kane, O.J.; Martinez, L.E.; Nahmias, Y.; Bourne, N.; Owen, D.M.; Grove, J.; Brimacombe, C.; McKeating, J.A.; et al. Multiple effects of silymarin on the hepatitis C virus lifecycle // Hepatology. – 2010. – Vol. 51. – P. 1912–1921.
На протяжении всей своей истории человечество соприкасалось с царством растений, используя последние для удовлетворения своих хозяйственных, пищевых и лекарственных целей. Поэтому неудивительно, что даже современные лекарственные препараты разработаны на основе природных соединений. Среди них наиболее известны витамин С, аспирин, хинин, морфин и кодеин. В последние десятилетия большое внимание уделяется изучению свойств таксола, арглабина, винбластина и некоторых других соединений, полученных на основе растительных препаратов.
Поиск новых биологически активных соединений растительного происхождения для лечения и профилактики иммуносупрессии, инфекционных заболеваний, онкологии и метаболических заболеваний остается активной частью фармацевтических исследований [15]. В последние годы на рынке появилось более 40 новых препаратов природного происхождения, прошедших полный путь от исследования до клинических испытаний [2]. Такое внимание исследователей к природным соединениям обусловлено в первую очередь меньшей токсичностью растительных препаратов и более широким спектром действия. Некоторые лекарственные соединения растительного происхождения обнаружили способность эффективно блокировать развитие различных вирусов, включая вирус простого герпеса, гриппа, вирус иммунодефицита человека, вирусы гепатита С и В и многие другие [4, 8, 17, 19,].
Основой противовирусной терапии является воздействие на вирус или его составляющие компоненты на той или иной стадии репродукции. Весь процесс репродукции вирусов может быть условно разделен на три фазы [15]. Первая фаза охватывает события, которые ведут к адсорбции и проникновению вируса в клетку, освобождению его внутренних структурных компонентов и модификации его таким образом, что он способен вызвать инфекцию. Вторая фаза репродукции связана со сложными процессами, в течение которых происходит экспрессия вирусного генома. Заключительной стадией репродукции является выход вирусного потомства из клетки путем почкования или за счет лизиса, причем в последнем случае клетка погибает [12]. Имеющийся на сегодняшний день арсенал противовирусных средств способен оказывать воздействие на любой из этапов репродукции вируса.
Адсорбция и проникновение вируса в клетку
Рис. 1. Соединения, блокирующие стадию адсорбции вируса [4, 8, 13]
Освобождение внутреннего компонента вируса
После проникновения вириона в клетку происходит целый комплекс превращений вируса, смысл которых заключается в удалении вирусных защитных оболочек, препятствующих экспрессии вирусного генома. Этот процесс сопровождается рядом характерных особенностей: исчезает инфекционность вируса, появляется чувствительность к нуклеазам, возникает устойчивость к нейтрализующему действию антител. Основной группой растительных соединений, способных подавлять репродукцию вирусов на этой стадии, являются аналоги силимарина, лютеолина и кверцетина (рис. 2) [4, 20, 21].
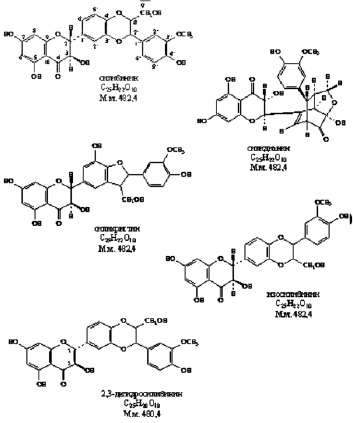
Рис. 2. Соединения, блокирующие освобождение внутреннего компонента вируса
Экспрессия вирусного генома и сборка вирусных частиц
Экспрессия вирусного генома и сборка вирионов являются самыми сложными этапами, включающими транскрипцию нуклеиновых кислот, трансляцию белков, посттрансляционные модификации вирусных белков, репликацию нуклеиновых кислот, сборку вирусных частиц. Этот этап репродукции вирусов успешно блокируется 2 основными группами растительных соединений: ингибиторами РНК полимераз и ингибиторами посттрансляционных модификаций белков. К таким препаратам относятся алпизарин, госсипол, эпиген и др (рис. 3).
Механизм действия подобных препаратов связан с образованием ацил-ферментных производных и основан на блокировании одной из трех основных областей, критичных для активности аспарагиновой протеазы вируса: каталитическое ядро фермента, содержащее пару Asp-Thr/Ser-Gly триад, мобильная flap-область и домен димеризации на N- и С-концах протеазы [1, 10, 14].
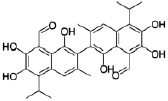
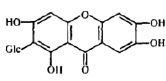
Рис. 3. Соединения, блокирующие экспрессию вирусного генома
Выход вирусного потомства
Завершающим этапом репродукции вируса является выход вирионов из инфицированной клетки. Этот процесс может протекать с помощью почкования вируса и лизиса клетки. Лизис клетки, как правило, сопровождается гибелью клетки. Блокировать такой механизм выхода вируса практически невозможно.
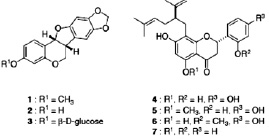
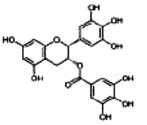
Рис. 4. Структура ингибиторов нейраминидазы [7, 9, 16]
На сегодняшний день практическая медицина обладает достаточно внушительным арсеналом противовирусных средств, способных подавлять репродукцию вируса на любой стадии процесса. Однако, несмотря на определенные успехи, достигнутые в вирусной химиотерапии, клиническая практика сталкивается с серьезной проблемой появления вариантов вируса, устойчивых к тем или иным препаратам.
Изучение растительных препаратов, обладающих антивирусными свойствами (алпизарин, эпиген, протефлазид, госсипол), показало, что за счет разных механизмов действия препаратов (противовирусное и иммуностимулирующее) появление вирусов, устойчивых к данным препаратам, не наблюдается. Большое разнообразие биологически активных соединений, находящихся в растениях, позволяет рассчитывать на возможность получения новых высокоактивных препаратов, обладающих способностью блокировать различные вирусы, в том числе, резистентные к существующим коммерческим химиопрепаратам. Подобные препараты, сочетающие в себе свойства иммуностимулирующих и противовирусных соединений, можно рекомендовать для лечения и профилактики инфекционных заболеваний, ассоциированных с иммунодефицитным состоянием, в том числе таких, как грипп, ВИЧ, гепатит С и др. [11, 17].
Рецензенты:
Острые респираторные заболевания, в том числе простуда, грипп и другие являются на сегодняшний день одной из важнейших проблем из-за того ущерба, который они наносят здоровью человека. Как правило, эти заболевания начинаются с повышения температура тела, головной и мышечной боли, озноба, слабости, через некоторое время появляется заложенность носа, насморк, першение в горле и кашель. Состояние больного может варьировать от легкого (недомогание, повышенная температура тела) до тяжелого и крайне тяжелого с выраженными симптомами интоксикации. Лечат эти болезни, как правило, симптоматически. Лекарства должны снизить температуру тела, снять головную и мышечную боль, облегчить носовое и бронхиальное дыхание, подавить кашель, особенно в ночное время. Пациенту необходимы постельный режим, обильное питье (включая горячее молоко с медом), обеспечивающее быстрое выведение токсинов, сухое тепло на область носа и пазух (для снижения риска развития синусита), молочно-растительная пища (для нормализации пищеварения и выведения кислых продуктов метаболизма) и ингаляции (например, натертым луком или чесноком) для снижения вероятности присоединения бактериальных инфекций.
Из лекарств чаще всего используют:
– антиконгестанты (для снятия заложенности носа и лечения насморка);
Парацетамол выгодно отличается от других жаропонижающих анальгетиков тем, что снижает температуру тела постепенно без резкого падения до нормальной или субфебрильной (до 38 °C). Кроме того, в отличие от нестероидных противовоспалительных средств (смотри главу 2.9), он не вызывает бронхиального спазма. Повышенная температура тела (гипертермия) является нормальной защитной реакцией организма. Она способствует выработке эндогенного интерферона и ряда других белков, оказывающих противовирусное действие. Поэтому следует стремиться к постепенному снижению температуры, лучше до субфебрильного уровня. Парацетамол именно так и действует.
Для устранения заложенности носа применяют сосудосуживающие лекарственные средства местного и системного действия (антиконгестанты), такие как ксилометазолин, нафазолин, фенилэфрин, псевдоэфедрин. Для местного применения чаще используют ксилометазолин и нафазолин, однако они, как и системные препараты (за исключением фенилэфрина), могут повышать артериальное давление и вызывать нарушения ритма сердца. Кроме того, местно действующие препараты могут вызывать раздражение, отек и/или сухость слизистой оболочки носа. Поэтому более широкое распространение в качестве средства для уменьшения застойных явлений в носу получил фенилэфрин, который включают в состав многих комбинированных препаратов. Свойствами антиконгестантов обладают и антигистаминные средства (дифенгидрамин, клемастин, прометазин, хлорфенирамин и другие), которые, кроме того, оказывают успокаивающее (седативное) действие и способствуют наступлению сна. Последнее также весьма полезно, так как сон у больного обычно нарушен.
Как правило, простуда и грипп (так же как и большинство бронхолегочных заболеваний) сопровождаются кашлем. При этом различают (как уже отмечалось выше) продуктивный кашель, то есть с отхождением мокроты и непродуктивный или сухой кашель. Продуктивный кашель полезен для организма, и в этих случаях могут назначаться отхаркивающие средства, способствующие разжижению и отхождению мокроты. Такими средствами являются терпингидрат, ацетилцистеин, амброксол, бромгексин, гвайфенезин, препараты из лекарственных растений (алтей, термопсис, солодка) и другие. Их используют самостоятельно или в составе комбинированных, так называемых мультисимптомных, препаратов. Непродуктивный кашель чаще подавляют с помощью противокашлевых средств центрального действия (декстрометорфан, кодеин и другие), или переводят в продуктивный с помощью отхаркивающих (муколитических) средств, если он обусловлен образованием густой мокроты.
При простуде можно принимать препарат, целенаправленно устраняющий симптом (лихорадка, кашель, заложенность носа или другой), доставляющий вам наибольшее беспокойство.
В настоящее время широкое распространение при лечении простуды и гриппа получили комбинированные препараты, содержащие вышеуказанные компоненты в одной лекарственной форме. Как правило, в их состав включают жаропонижающий анальгетик (чаще всего парацетамол), антиконгестант, противокашлевое или отхаркивающее средство, антигистаминный компонент и аскорбиновую кислоту (необходима для стимулирования выработки эндогенного интерферона и нормализации обмена веществ, при простуде и гриппе потребность в ней увеличивается) в различных комбинациях и соотношениях. Такие препараты более выгодны с точки зрения фармакоэкономики, так как цена на них, как правило, ниже суммарной стоимости однокомпонентных лекарств, необходимых для облегчения симптомов простуды и гриппа.
Для одновременного устранения наиболее часто встречающихся проявлений простуды созданы комбинированные препараты, действие которых направлено на облегчение кашля и носового дыхания, снижение температуры тела.
Достаточно эффективным и безопасным способом симптоматического лечения простуды является использование лекарственных средств растительного происхождения, например, препарата Синупрет ® немецкой фирмы “Bionorica”. В дополнение к отхаркивающему секретолитическому действию этот препарат обладает противовоспалительным и противовирусным эффектами, что позволяет успешно применять его, в частности, у пациентов с гайморитом и другими воспалительными заболеваниями околоносовых пазух.
Вирусная инфекция является более сложной проблемой для химиотерапии, чем бактериальная. Сложность заключается в том, что вирусы паразитируют и размножаются внутри клетки организма-хозяина, перестраивают ее обмен веществ. Невозможно воздействовать на вирус, не затрагивая пораженную им клетку. Кроме того, вирусные заболевания часто связаны с “пробуждением” скрытых вирусов, которые какое-то время никак не проявляли себя в организме-хозяине. Очень часто вирусные инфекции проявляются на фоне снижения иммунной защиты организма, то есть при различных состояниях иммунодефицита.
Как известно, вирус (от латинского virus – яд) является неклеточной формой жизни, способной к воспроизведению лишь в клетках более высокоорганизованных существ. Процесс воспроизведения вируса состоит из нескольких этапов. Сначала вирус закрепляется на клетке и проникает внутрь нее. Затем внедряется в синтетические процессы клетки-хозяина и создает собственные РНК или ДНК, необходимые для размножения. Клетка переполняется вирусными частицами и погибает, распадается, а вирусы, освобождаясь, ищут новую клетку, чтобы продолжить свое воспроизведение. Одна вирусная частица дает огромное потомство. Существует более тысячи разновидностей вирусов, около половины из них опасны для человека, и среди них – вирусы натуральной оспы, герпеса, аденовирусы (вызывающие острые респираторные заболевания, или ОРЗ), вирусы гриппа, возбудители бешенства, краснухи, энцефалитов, полиомиелита и, наконец, вирусы иммунодефицита человека (ВИЧ), вызывающие в том числе и СПИД – чуму нашего времени.
Противовирусные лекарства могут действовать на любом из вышеупомянутых этапов воспроизводства вирусов, однако большинство из существующих препаратов блокируют синтез вирусной ДНК.
Зная механизм размножения вирусов, легко понять высокую профилактическую эффективность противогриппозного средства римантадина. Это соединение препятствует проникновению вируса внутрь клетки, поэтому его применение позволяет бороться с вирусом еще до того, как он начнет размножаться. Таким образом римантадин снижает заболеваемость и выраженность симптомов заболевания гриппом.
В качестве противовирусных средств используют соединения различной химической природы. Большинство из них являются веществами, угнетающими активность ферментов, участвующих в реакциях сборки вирусных белков. Но поскольку аналогичные ферменты участвуют и в синтезе белков в клетке-хозяине, то не исключено токсическое действие этих средств. Степень токсического действия зависит от скорости связывания противовирусного средства с ферментом. Например, ацикловир связывается с вирусным ферментом гораздо быстрее, чем с ферментом клетки человека, поэтому у него более выражена противовирусная активность и относительно низкая токсичность.
Обычными показаниями для противовирусных препаратов являются герпес кожи, слизистых оболочек и роговицы, опоясывающий лишай, цитомегаловирусные инфекции, грипп, ветряная оспа и другие. Многие из них эффективны как при лечении, так и при профилактике вирусных инфекций, в особенности это касается препаратов против гриппа, а также против инфекций, проявляющихся на фоне иммунодефицита (при ВИЧ-инфекции, СПИДе, трансплантации органов и аналогичных состояниях). Имеется ряд противовирусных средств, проявляющих свое действие за счет стимуляции иммунной защиты организма. К ним относятся в частности инозин пранобекс, тилорон, интерфероны.
Стремительно распространяющаяся эпидемия СПИДа (синдрома приобретенного иммунодефицита), вызываемого вирусом иммунодефицита человека (ВИЧ), побудила ученых к созданию специальных средств, эффективных в отношении этой разновидности ретровируса. Хотя, в последние годы в этом направлении достигнуты некоторые успехи, предотвратить и вылечить СПИД пока не удается. Врачи в состоянии только продлить больному жизнь и облегчить его страдания. Специфическими средствами лечения ВИЧ-инфекции и СПИДа являются зидовудин, зальцитабин, ламивудин, нелфинавир.
Авонекс (интерферон бета-1a) противовирусное, иммуномодулирующее, антипролиферативное пор.лиоф.д/ин. Schering-Plough (США)
Агенераза (ампренавир) противовирусное капс.; р-р для приема внутрь GlaxoSmithKline (Великобритания)
Альгирем (римантадин) противовирусное сироп детск. Олифен Корпорация ЗАО (Россия)
Амиксин (тилорон) противовирусное, иммуномодулирующее табл.п.о. МастерЛЕК (Россия), произв.: Дальхимфарм (Россия)
Амиксина таблетки 0,125 г (тилорон) противовирусное, иммуномодулирующее табл.п.о. МастерЛЕК (Россия), произв.: ЛЭНС-Фарм (Россия)
Арбидол-ЛЭНС (арбидол) противовирусное, иммуностимулирующее табл.п.о. МастерЛЕК (Россия), произв.: ЛЭНС-Фарм (Россия)
Ацикловир-Акри (ацикловир) противовирусное мазь; табл. Акрихин (Россия)
Бетаферон (интерферон бета-1б) иммуномодулирующее пор.лиоф.д/ин. Schering (Германия)
Валтрекс (валацикловир) противовирусное табл. GlaxoSmithKline (Великобритания)
Веро-ацикловир (ацикловир) противовирусное крем Верофарм (Россия), произв.: Okasa Pharma (Индия)
Веро-рибавирин (рибавирин) противовирусное капс. Верофарм (Россия), произв.: Верофарм (Белгородский филиал) (Россия)
Видекс (диданозин) противовирусное капс.; пор.д/р-ра для приема внутрь детск.; табл.д/разжев. или д/сусп. для приема внутрь Bristol-Myers Squibb
Виразол (рибавирин) противовирусное крем ICN Pharmaceuticals (США), произв.: ICN Mexico (Мексика)
Вирамун (невирапин) противовирусное сусп. для приема внутрь; табл. Boehringer Ingelheim Pharma (Австрия)
Вобэ-мугос Е (папаин+трипсин+химотрипсин) иммуномодулирующее, фибринолитическое, противовоспалительное, антиагрегационное табл.п.о.раствор./кишечн. Mucos Pharma (Германия)
Герпевир (ацикловир) противовирусное крем Брынцалов-А (Россия)
Гипорамина таблетки сублингвальные 0,02 г (средство растительного происхождения) противовирусное табл.сублингв. ВИЛАР ПЭЗ (Россия)
Гипораминовая мазь 0,5% (средство растительного происхождения) противовирусное мазь ВИЛАР ПЭЗ (Россия)
Гриппферон (интерферон альфа) противовирусное, иммуномодулирующее, противовоспалительное, противомикробное капли наз. Фирн М (Россия)
Гроприносин (инозина пранобекс) иммуностимулирующее, противовирусное табл. Grodziskie Zaklady Farmaceutyczne “Polfa” (Польша)
Зерит (ставудин) противовирусное капс.; пор.д/р-ра для приема внутрь Bristol-Myers Squibb
Зеффикс (ламивудин) противовирусное р-р для приема внутрь; табл.п.о. GlaxoSmithKline (Великобритания)
Зиаген (абакавир) противовирусное р-р для приема внутрь; табл.п.о. GlaxoSmithKline (Великобритания)
Зовиракс (ацикловир) противовирусное мазь глазн.; пор.д/ин.; сусп. для приема внутрь; табл. GlaxoSmithKline (Великобритания)
Изопринозин (инозина пранобекс) иммуномодулирующее, противовирусное табл. Biogal (Венгрия)
Йодантипирина таблетки 0,1 г (йодантипирин) противовирусное, противовоспалительное, иммуномодулирующее табл. Асфарма (Россия)
Комбивир (зидовудин+ламивудин) противовирусное табл.п.о. GlaxoSmithKline (Великобритания)
Милайф (гриба фузариум биомасса) общеукрепляющее, адаптогенное, регенерирующее, дезинтоксикационное, иммуномодулирующее субст.; табл. ДИЖА (Россия)
Моликсан гепатопротективное, иммуномодулирующее, противовирусное р-р д/ин. ФАРМА ВАМ (Россия)
Неовир (криданимод) противовирусное, антибактериальное, иммуностимулирующее р-р д/ин. Фармсинтез ЗАО (Россия)
Никавир (фосфазид) противовирусное капс.; табл. АЗТ-Фарма (Россия)
Офтан Иду (идоксуридин) противовирусное капли глазн. Santen (Финляндия)
ПК-Мерц (амантадин) противопаркинсоническое, нейропротективное р-р д/инф.; табл.п.о. Merz & Co. (Германия)
Полудан (полиадениловая кислота+полиуридиловая кислота) противовирусное, иммуномодулирующее пор.д/капель глазн.; пор.лиоф.д/ин. ЛЭНС-Фарм (Россия)
Реальдирон (интерферон альфа-2б) противовирусное, иммуностимулирующее, антипролиферативное, противоопухолевое пор.лиоф.д/ин. Биотехна (Литва)
Реленца (занамивир) противовирусное пор.д/ингал.доз. GlaxoSmithKline (Великобритания)
Ретровир АЗиТи (зидовудин) противовирусное капс.; р-р д/инф.; р-р для приема внутрь GlaxoSmithKline (Великобритания)
Суправиран (ацикловир) противовирусное (противогерпетическое) крем; пор.д/инф.; табл. Grunenthal (Германия)
Цикловир (ацикловир) противовирусное (противогерпетическое) крем; табл. Cadila Healthcare (Индия)
Цикловирал СЕДИКО (ацикловир) противовирусное табл. SEDICO (Египет)
Эпивир ТриТиСи (ламивудин) противовирусное р-р для приема внутрь; табл.п.о. GlaxoSmithKline (Великобритания)
К основным причинам, затрудняющим защиту от гриппа и других острых респираторных вирусных инфекций (ОРВИ), относят многочисленность возбудителей ОРВИ и неполноценность специфического иммунитета к ним. Существование более 200 вирусов исключает возможность разработки вакцин против всей группы ОРВИ, кроме гриппа – важнейшей инфекции, на долю которой приходится до 30% случаев ОРВИ. Неполноценность специфического иммунитета к возбудителям ОРВИ способствует многократному развитию заболеваний одной и той же этиологии в течение жизни. Генетически обусловленная иммунологическая недостаточность вирусов гриппа как антигенов препятствует созданию вакцин со 100%-ной эффективностью. Перспективным в профилактике и лечении гриппа и ОРВИ служит использование препаратов, обладающих широким спектром биологической активности и одновременно стимулирующих естественную противовирусную резистентность организма человека. Преимуществом обладают пролонгированные препараты, к которым относятся индукторы эндогенного интерферона (ИФН), обладающие многоплановыми эффектами, сочетающие вирусоспецифическое действие с ИФН-индуцирующими, иммуномодулирующими свойствами. К таким препаратам относится низкомолекулярный индуктор эндогенного интерферона – тилорон. Проведенные клинико-эпидемиологические исследования показали высокую эффективность и хорошую переносимость тилорона при гриппе и ОРВИ как в профилактическом, так и в лечебном режиме для взрослых и детей.
Острые респираторные вирусные заболевания, включая грипп, продолжают оставаться серьезной социальной, медицинской и экономической проблемой. Вирусы гриппа циркулируют повсеместно при ежегодной частоте заболеваемости, оцениваемой в 5–20% у взрослых и 20–30% у детей [1, 2]. Ежегодно во время гриппозных эпидемий в Европе, США, России и других странах болеют до 10% населения, а в случае возникновения пандемий число заболевших возрастает до 50%. По оценкам Всемирной организации здравоохранения (ВОЗ), в результате ежегодных эпидемий во всем мире на заболевания тяжелой формой гриппа приходится от 3 до 5 млн случаев, умирают ежегодно от 250 тыс. до 500 тыс. человек. В США за прошедшие три десятилетия предполагаемое ежегодное число связанных с гриппом смертельных случаев колебалось от 3349 до 48 614.
Для сезонного гриппа характерны внезапное начало и преобладание симптомов интоксикации: высокая температура, озноб, головная, мышечная боль и боль в суставах, сильное недомогание; затем присоединяются боль в горле, сухой кашель и насморк. Болезнь часто приводит к госпитализации и смерти. Эпидемии гриппа наносят серьезный вред всем возрастным группам населения, при этом самый высокий риск осложнений наблюдается у детей младше 2 лет, взрослых в возрасте 65 лет и старше, а также у людей любого возраста с определенными медицинскими состояниями, такими как хронические заболевания сердечно-сосудистой системы, легких, почек, печени, крови или нарушения обмена веществ (диабет и др.). Опасность заболевания усугубляется тем, что вирус гриппа способен подавлять иммунные реакции организма и усиливать тяжесть хронических заболеваний, вызывая их декомпенсацию [3]. Особенно высока летальность в период эпидемии гриппа среди лиц старше 65 лет, детей раннего возраста, в т.ч. первого года жизни. Экономический ущерб от эпидемий гриппа в различных странах составляет десятки миллиардов долларов.
Оптимальные условия для инфицирования респираторными вирусами создаются в организованных коллективах и у лиц, контактирующих с больными. В современных условиях респираторные заболевания служат инфекцией преимущественно тех организованных коллективов, где условия определяют активность механизма передачи возбудителя и гетерогенность состава людей. Наличие в коллективе лиц с разным уровнем иммунитета или иммунокомпрометированных, лиц с бессимптомными формами заболевания (вирусоносителей), а также близкие интенсивные контакты неизбежно приводят к подъему уровня заболеваемости и развитию вспышек инфекции [4]. Именно в таких коллективах заболеваемость гриппом и другими ОРВИ в 2–4 раза превышает средние показатели заболеваемости всего населения. Наиболее значимыми возбудителями респираторных вирусных инфекций считаются орто-, парамиксовирусы, пикорна-, адено-, коронавирусы и представители семейства микоплазм. В 25–30% случаев заболеваний наблюдается смешанная вирусно-бактериальная этиология. Подавляющее большинство вирусов, кроме вирусов гриппа, до сих пор мало контролируется существующими способами специфической и неспецифической профилактики.
Самым эффективным путем профилактики гриппа и его тяжелых последствий остается специфическая профилактика – вакцинация. Среди здоровых взрослых людей вакцина может предотвращать заболеваемость гриппом на 70–90%. Среди пожилых людей вакцина уменьшает количество тяжелых заболеваний и осложнений на 60% и случаев смерти – на 80%. ВОЗ ежегодно рекомендует обновленный состав вакцины с включением трех актуальных циркулирующих штаммов. Однако значительная прослойка взрослого населения и школьников от гриппа не прививаются как по причине имеющихся временных или постоянных медицинских противопоказаний, так и в связи с существующим негативным отношением к вакцинации вообще. Вакцин против других актуальных возбудителей ОРВИ не существует. Кроме специфического этиотропного контроля с применением гриппозных вакцин, которые необходимо применять заблаговременно, до начала эпидемического подъема ОРВИ существует неспецифическая профилактика этих заболеваний препаратами различного происхождения, обладающими непосредственным воздействием на различные стадии жизнедеятельности вирусов (вирусоспецифическое действие) и на активизацию собственных защитных факторов организма. К ней относят химический контроль с использованием химиопрепаратов, избирательно подавляющих репродукцию вируса, и неспецифический контроль (интерфероны и их индукторы) [5]. Существуют различные классы таких препаратов.
Большим достижением в профилактике и лечении гриппа в 1960–1970-е гг. были разработки препаратов адамантанового ряда – амантадина и римантадина, являющихся ингибиторами ионных каналов вирусов гриппа. Следующая группа препаратов – ингибиторы нейраминидазы вируса гриппа (осельтамивир и занамивир). а также ингибитор фузии умифеновир. Эффективность химического типа контроля колеблется от низкой к средней, антивирусный спектр узкий, длительность эффекта короткая [5].
Возникновение у некоторых возбудителей резистентности к антивирусным препаратам зачастую снижает эффективность самих препаратов. Этиотропные химиопрепараты используют для лечения и экстренной профилактики контактных лиц в семейных или иных очагах гриппа и других ОРВИ в условиях начавшейся эпидемии. Успех лечения и проводимой профилактики зависит от наиболее ранних сроков начала проводимого курса. К недостаткам всех химиопрепаратов следует отнести возможность быстрого формирования резистентности (устойчивости) вирусов гриппа при их приеме. В связи с этим в последние годы рекомендуют ограничить профилактическое применение химиопрепаратов, а использовать их только с лечебной целью.
Неспецифический тип контроля, обеспечиваемый препаратами неспецифического действия – ИФН, и их индукторами, наиболее эффективный, его антивирусный спектр очень широк [5]. Как противовирусные, так и иммунотропные препараты для неспецифической профилактики часто рассчитаны на многократное ежедневное применение, что в ряде случаев весьма затруднительно. Кроме того, известно, что респираторные вирусы индуцируют иммуносупрессию и создают условия для развития бактериальных осложнений. В последние годы значительное внимание уделяется т.н. синдрому послевирусной астении (СПА), формирующемуся в течение месяца у 65% лиц, переболевших гриппом или другой респираторной вирусной инфекцией. Это осложнение характеризуется эмоциональной лабильностью, беспричинной усталостью и даже психическими расстройствами. Перспективным в профилактике и лечении гриппа и ОРВИ остается использование препаратов, обладающих широким спектром биологической активности и одновременно стимулирующих естественную противовирусную резистентность организма человека. Преимуществом обладают препараты с пролонгированным действием, к которым относятся индукторы эндогенного ИФН, обладающие многоплановыми эффектами, сочетающие вирусоспецифическое действие с ИФН-индуцирующими, иммуномодулирующими свойствами.
Индукторы ИФН сочетают ряд положительных качеств – высокий уровень и широкий спектр специфической активности, достаточную длительность противовирусного действия, высокий химиотерапевтический индекс, способность подавлять вирусную репродукцию. К современным препаратам (индукторам ИФН) относится тилорон – первый низкомолекулярный синтетический пероральный индуктор эндогенных ИФН. Тилорон по химической структуре относится к низкомолекулярным ароматическим соединениям – флуоренонам. Клетками эпителия кишечника, гепатоцитами, Т-лимфоцитами и гранулоцитами тилорон индуцирует образование ИФН как первого типа (α, β), отвечающих за противовирусную защиту, так и второго (γ), обладающих в большей степени иммуномодулирующими свойствами [6, 7]. После приема внутрь максимум продукции ИФН отмечается в течение первых суток и определяется в последовательности кишечник–печень–кровь через 4–24 часа. Повышенные титры ИФН предотвращают инфицирование незараженных клеток. Запуская механизм интерфероногенеза, тилорон поддерживает содержание ИФН в терапевтических концентрациях сывороточного ИФН в крови, способствуя активизации естественных механизмов защиты и повышению сопротивляемости организма инфекциям вирусной этиологии, в течение 2–3 недель. Препарат нормализует соотношение Т-хелперы/Т-супрессоры, повышает активность естественных киллерных клеток и цитотоксичность лимфоцитов. Нормализует гуморальный иммунный ответ: увеличивает продукцию иммуноглобулина М (IgM) и IgG, восстанавливает соотношение высоко- и низкоавидных антител. Является регулятором про- и контравоспалительных цитокинов. Обладает прямым противовирусным действием, связанным с его способностью связываться с нуклеиновыми кислотами вирусов. Важной особенностью тилорона является длительная циркуляция препарата (до 8 недель), поддержание терапевтической концентрации ИФН (50–100 ЕД/мл) после приема препарата по одной таблетке в неделю в течение двух месяцев. Тилорон способствует снижению частоты противогриппозных осложнений, тяжести заболевания, степени клинической выраженности гриппа и ОРВИ, а также эффективен в отношении вирусов гепатита и герпесвирусов.
Крупномасштабное эпидемиологическое наблюдение проведено Е.П. Сельковой и соавт., в котором была показана профилактическая эффективность тилорона в отношении ОРВИ в период сезонного подъема заболеваемости среди медицинских работников стационаров Москвы. В рандомизированном плацебо-контролируемом исследовании принял участие 39 051 человек [10]. Профилактика тилороном респираторных инфекций среди медицинского персонала проводилась по двум схемам: первая (n=31 677) – по 1 таблетке (125 мг) в неделю, всего 6 таблеток на курс (полный курс); вторая схема (n=1741) – по 1 таблетке (125 мг) в неделю, 4 таблетки на курс (неполный курс). В контрольную группу вошли 5633 медицинских работника, получавших плацебо.
Серологическая расшифровка заболеваний до начала профилактики показала, что в коллективах циркулировали одновременно возбудители респираторных заболеваний (вирусы гриппа, парагриппа, РС-вирусы, аденовирусы), что способствовало обмену возбудителями и формированию смешанных инфекций как в основной, так и в контрольной группах. В условиях полиэтиологичной вспышки в организованном коллективе первостепенной остается задача предотвращения распространения уже возникшей инфекции. В результате применение тилорона снизило частоту проявлений симптомов ОРВИ в 3,4 раза. Установлена зависимость снижения заболеваемости от схемы приема препарата: среди лиц, получавших полный курс, она оказалась значительно ниже (6,7%), чем в группе с неполным курсом приема препарата (15,2%).
Терапевтическую эффективность тилорона при лечении ОРВИ изучали на больных 17–76 лет с сопутствующими соматическими заболеваниями и аллергическими реакциями на различные медикаментозные препараты [11, 12].
Тилорон в таблетках по 125 мг назначали 70 больным ОРВИ, из них 22 больным с диагнозом грипп, 8 – с аденовирусной инфекцией, 8 – с парагриппом, 32 – с респираторной вирусной инфекцией неуточненной этиологии по следующей схеме: 250 мг (2 таблетки) в первые 2 дня, далее по 125 мг через день – до 10 таблеток на курс лечения. Кроме того, всем пациентам проведена стандартная симптоматическая терапия, а в случае присоединения осложнений ее дополнили противомикробными препаратами. Больные контрольной группы (70 человек) получали только базисную терапию с плацебо. При сравнении симптомов заболевания была выявлена существенная разница в их продолжительности среди больных основной и контрольной групп: у лиц, получавших лечение тилороном, катаральные явления и насморк исчезали значительно быстрее, а средняя продолжительность лихорадки, длительность и интенсивность интоксикационного синдрома были меньше, чем у пациентов контрольной группы. Наглядным доказательством эффективности применения препарата при лечении ОРВИ является разница в частоте осложнений, развившихся у лиц основной и контрольной групп: пневмония – 3,5 и 12%, бронхит – 28 и 49%, пиелонефрит – 7 и 10,5% соответственно. Кроме того, в контрольной группе выявлены осложнения, которых не было в группе больных, получавших тилорон: отит – в 3,5% случаев, гайморит – в 3,5%, обострение хронического тонзиллита – в 7,5%.
Тилорон разрешен к применению для лечения, профилактики гриппа и ОРВИ у взрослых и детей старше 7 лет для лечения осложненных и неосложненных форм этих заболеваний. В отношении детей применяется детская форма препарата (таблетки 60 мг).
Эффективность и безопасность применения детской формы тилорона изучали в многоцентровом рандомизированном плацебо-контролируемом исследовании. В него вошли 180 детей старше 7 лет, страдавших гриппом или другими ОРВИ [13]. Больные были рандомизированы в основную группу численностью 90 человек, получавших тилорон, и равную по численности контрольную группу больных, получавших плацебо. В исследование включили пациентов с длительностью заболевания 48 часов при неосложненной форме и 72 часа при наличии осложнений. Больные основной группы принимали тилорон по 60 мг один раз в сутки после еды на 1-й, 2 и 4-й дни от начала лечения при неосложненных формах болезни (курсовая доза – 180 мг в течение 4 дней) и на 1-й, 2, 4 и 6-й дни при возникновении осложнений (курсовая доза – 240 мг в течение 6 дней). Основная и контрольная группы были сопоставимыми по возрастному составу, этиологической структуре, степени тяжести и осложнениям заболевания, а также по качеству и составу базисной терапии. В качестве средств базисной терапии разрешено использовать все препараты для лечения гриппа и ОРВИ, кроме противовирусных. Терапевтическое действие тилорона при неосложненных формах ОРВИ выражалось в достоверном сокращении длительности периода интоксикации и катаральных явлений. У детей с осложненными формами ОРВИ, получавших тилорон на фоне антибиотикотерапии, продолжительность симптомов интоксикации сократилась до 7,0±0,9 дня; в контрольной группе величина этого показателя составила 14,7±1,9 дня. Ни в одном из случаев не потребовалось отмены препарата из-за появления побочных эффектов.
Таким образом, проведенные клинические исследования и эпидемиологические наблюдения показали высокую эффективность тилорона в отношении широкого спектра респираторных вирусов, а также его хорошую переносимость при гриппе и ОРВИ при профилактическом и лечебном применении взрослыми и детьми. Накопленный обширный положительный опыт применения тилорона определяет возможность его широкого использования в лечении и профилактике ОРВИ и гриппа, в т.ч. в период сезонного и эпидемического подъема заболеваемости.
Литература
1. WHO position paper – Vaccines against influenza November 2012. Weekly epidemiological record. 2012;47(87):461–76.
3. Greenberg D.P., Robertson C.A., Noss M.J., Blatter M.M., Biedenbender R., Decker M.D. Safety and immunogenicity of a quadrivalent inactivated influenza vaccine compared to licensed trivalent inactivated influenza vaccines in adults. Vaccine. 2013;31(5):770–76.
4. Дриневский В.П., Осидак Л.В., Цыбалова Л.М. Острые респираторные инфекции у детей и подростков. Практическое руководство. СПб., 2003. 180 с.
5. Романцов М.Г., Сологуб Т.В. Экстренная неспецифическая профилактика и лечение гриппа и ОРВИ. Лекция для врачей. СПб., 2008. 40 с.
6. Григорян С.С., Иванова А.М., Ходжаев Ш.Х., Ершова Ф.И. Интерферониндуцирующая активность амиксина и его влияние на интерфероновый статус. Вопр. вирусологии. 1990;35(1):61–4.
7. Ершов Ф.И., Григорян С.С. Рекомендации по применению препарата Амиксин в клинической практике: Пособие для врачей. М., 2007.
8. Отчет Главного военно-медицинского управления МО РФ. Изучение препарата Амиксин с целью профилактики в войсках острых респираторных вирусных инфекций инфекций. 1998.
9. Ерофеева М.К. Профилактика гриппа и других острых респираторных заболеваний в группах риска. Дисс. докт. мед. наук. СПб., 2001.
10. Селькова Е.П., Яковлев Н.В., Семененко Т.А, Филатов Н.Н., Готвянская Т.П., Данилина Г.А., Пантюхова Т.Н., Никитина Г.И., Турьянов М.Х. Оценка профилактического эффекта Амиксина в отношении острых респираторных вирусных инфекций. ЖМЭИ. 2001;(3):42–6.
11. Селькова Е.П. Применение Амиксина для профилактики и лечения острых респираторных вирусных инфекций: Методические рекомендации. М., 2000. 32 с.
12. Селькова Е.П. Современные подходы к профилактике и лечению острых респираторных вирусных инфекций. РМЖ. 2001;9(21).
13. Учайкин В.Ф., Чешик С.Г., Балаболкин И.И. Терапевтическая эффективность и безопасность амиксина при гриппе и других респираторных вирусных инфекциях у детей. РМЖ. 2001;9(19).
Об авторах / Для корреспонденции
Читайте также:

