Пролиферативный гепатит это одно и
Обновлено: 05.05.2024
Изучение хронических вирусных поражений печени выявило широкий спектр внепеченочных проявлений хронического гепатита В (ХГВ), а впоследствии, при открытии вируса гепатита С, и хронического гепатита С (ХГС). В России ведущая роль в изучении системности поражения при вирусных заболеваниях печени принадлежит исследованиям, проведенным в клинике им. Е.М.Тареева: изучение хронического активного гепатита как системного заболевания (Апросина З.Г., 1974, 1981 гг.), внепеченочных поражений при ХГС (Игнатова Т.М., 2000 г., Русских А.В., 2004 г., Милованова С.Ю., 2005 г., Карпов С.Ю., 2005 г.); при ХГВ (Ильянкова А.А., 2001 г., Абдурахманов Д.Т., 2003 г., Ибрагимова М.М., 2004 г., Крель П.Е., 1995 г., Тэгай С.В., 2003 г., Русских А.В., 2004 г.), поражения системы крови (Гусейнова Л.А., 1981 г.), легких (Дроздова А.С., 1989 г.), почек (Потапова А.В., 1989 г., Косминкова Е.Н., 1992 г.), синдрома Шегрена (Лопаткина Т.Н., 1980 г., Чернецова О.В., 2004 г.), системных васкулитов при вирусных гепатитах (Семенкова Е.Н., 1994).
В развитии внепеченочных поражений основное значение имеют иммунные реакции, возникающие в ответ на репликацию вирусов гепатита В или С в печени, в тканях лимфоидного и нелимфоидного происхождения. Предположения о наличии внепеченочных сайтов репликации вирусов гепатита В и С возникли в связи с наблюдением случаев быстро развивающегося острого гепатита у пациентов с вирусным циррозом печени после пересадки здоровой донорской печени. Инфицирование донорского органа у больных после ортотопической трансплантации печени объяснялось внепеченочной локализацией вирусов [1]. Помимо иммунных нарушений в возникновении системных поражений имеет значение прямое цитопатическое действие вирусов гепатита. Нередко внепеченочные поражения (ВПП) являются единственным проявлением вирусной инфекции и могут определять прогноз и тактику лечения заболевания.
Особенности хронического гепатита В с внепеченочными проявления гепатита
Внепеченочные проявления гепатита встречаются у 10-20% больных хроническим гепатитом В и включают широкий спектр поражений различных органов и систем [2]. Поражения кожи, наблюдаемые при острых и хронических болезнях печени, обусловленных HBV, весьма вариабельны и включают макулярные, макулопапулярные, папуловезикулярные высыпания, рецидивирующую крапивницу, петехии, пурпуру, узловатую эритему, скарлатиноподобную сыпь, гангренозную пиодермию, витилиго, гиперпигментацию и изъязвления в области нижних конечностей, аллергический капиллярит, пурпуру Шенлейна-Геноха 4.
Смешанная криоглобулинемия (СКГ) встречается среди больных ХГВ в 3-17% случаев, может проявляться кожной пурпурой, артритами и/или артралгиями, поражением почек, синдромом Рейно [5, 6, 8, 9]. Поражение почек при ХГВ протекает в трех формах – хронический гломерулонефрит (ХГН), тубулоинтерстициальный нефрит (ТИН), в рамках васкулита при узелковом полиартериите, ассоциированном с HBVинфекцией 13. Частота поражения почек при ХГВ составляет 14%, в том числе ХГН – 12,6%, ТИН – 1,4% [11]. В клубочках выявляются депозиты различных антигенов HBV, включая HBsAg, HBeAg, HBcAg; у части больных в ткани почки была обнаружена HBV ДНК [13]. ИК могут активировать комплемент и вызывать поражение клубочков путем формирования мембраноатакующих комплексов и дальнейшего каскада реакций, таких как индукция протеаз, оксидативное повреждение и разрушение цитоскелета нефрона [14]. Узелковый полиартериит (УП) является системным васкулитом с поражением средних и мелких артерий. Циркулирующие ИК, содержащие вирусные белки, вовлекаются в патогенез УП, ассоциированного с HBV инфекцией [15]. По данным Е.Н. Семенковой, инфицирование вирусом гепатита В выявляется в 56,9% случаев УП. [16] Отмечено, что почти все случаи HBV-ассоциированного УП связаны с инфекцией вируса гепатита В дикого типа, характеризующейся HBe-антигенемией и высокой репликацией HBV. Предположительно повреждение почек происходят в результате отложения вирусных HBeAg-HBeAb ИК [15]. В целом, хроническая HBV-инфекция демонстрирует широкий спектр внепеченочных поражений, в генезе которых имеют значение как иммунокомплексные реакции, так и реакции гиперчувствительности замедленного типа.
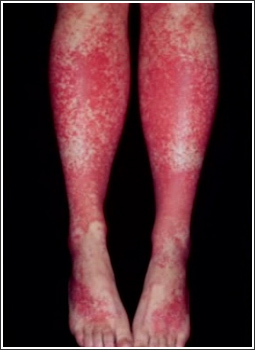
Рис.1. Пурпура на коже нижних конечностей у больного хроническим гепатитом С
Внепеченочные проявления гепатита В могут длительно маскировать поражение печени, являясь ведущими клиническими проявления гепатита болезни и нередко определяющими прогноз заболевания. Однако, с введением программ массовой вакцинации против вируса гепатита В инфицированность населения начала снижаться. А после открытия в 1989 году вируса гепатита С все большее значение стало придаваться изучению обширного спектра поражений при этой инфекции.
Особенности хронического гепатита С с внепеченочными проявления гепатита
Согласно различным исследованиям, от 40 до 74% пациентов, инфицированных вирусом гепатита С, могут иметь хотя бы одно внепеченочное проявление (ВПП) за время течения болезни [17, 18, 19]. Более того, ВПП могут являться первым признаком HCV инфекции в отсутствии у ряда больных признаков поражения печени. Основной особенностью ХГС является частое развитие внепеченочных поражений преимущественно иммунокомплексного генеза, в первую очередь обусловленных смешанной криоглобулинемией (СКГ), выявляемой у 19-56% больных [18, 20, 21]. Только небольшая группа больных ХГС с СКГ (менее 15%) имеет симптомное течение – криоглобулинемический синдром [21, 22].
Распространенность смешанной криоглобулинемии увеличивается с длительностью HCV-инфекции в организме и продолжительностью заболевания и чаще наблюдается у женщин на 2-м-3-м десятилетии болезни. В некоторых исследованиях показано, что длительность HCV инфекции у больных ХГС со СКГ почти в 2 раза выше, чем у пациентов без СКГ, у 40% больных со СКГ выявляют признаки цирроза печени [20]. В настоящее время установлено, что вирус гепатита С имеет высокий тропизм к мононуклеарам периферической крови, которые могут служить его резервуаром и местом репликации. Вирус гепатита С связывается с лигандом CD81 на поверхности В-лимфоцитов через Е2-белок, что приводит к активации этих лимфоцитов. На первом этапе продуцируются только поликлональные криоглобулины, затем доминирующий клон В-клеток начинает продуцировать моноклональные иммуноглобулины. Смешанная криоглобулинемия является причиной системного васкулита с поражением сосудов мелкого и среднего калибра с возможным вовлечением в патологический процесс различных органов и систем [18, 23, 24]. Известно, что при ХГС васкулиты могут быть обусловлены не только СКГ, но и (со значительно меньшей частотой) – иммунными комплексами, не обладающими свойствами преципитировать на холоде, то есть не содержащими IgM РФ [18, 25, 26]. Поражение кожи чаще всего (95% случаев) представлено кожным васкулитом от пурпуры (лейкоцитокластический васкулит) и петехий на нижних конечностях (рис. 1) до выраженных некротических язв. Биопсия кожи в местах повреждений выявляет иммунокомплексный васкулит мелких сосудов с мононуклеарной инфильтрацией. HCV-антитела выявляются в кожных повреждениях в 40% случаев [19]. Пурпура у больных ХГС без СКГ характеризуется меньшей распространенностью и отсутствием язвенно-некротических изменений кожи по сравнению с больным со СКГ [27]. Синдром Рейно при ХГС часто является ранним клиническим проявлением КГ-синдрома, как правило, протекает без дигитальных некрозов. Однако, при высоком криокрите частота дигитальных некрозов увеличивается [10, 27]. Поражение мышц. Миалгии часто наблюдаются при ХГС, особенно в рамках КГ-синдрома в сочетании с артралгиями, кожным васкулитом.
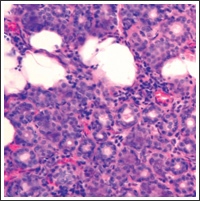
Рис. 2. Очаговая лимфоцитарная инфильтрация слюнной железы, характерная для синдрома Шегрена
По данным клиники им. Е.М.Тареева частота поражения легких была выше у больных без СКГ (11,3%), чем с КГ (6,3%). В группе пациентов без КГ поражение легких характеризовалось развитием фиброзирующего альвеолита, у больных с КГ наблюдалась картина легочного васкулита [27]. Поражение сердца. Имеются наблюдения миокардита хронического течения на фоне HCV-инфекции. Поражение миокарда, ассоциированное с HCV-инфекцией, может быть обусловлено: прямым (вирусным) воздействием на миокард; непрямым (иммунологическим) механизмом поражения и апоптозом клеток, обусловленным внутренними и внешними сигналами [34]. Имеются данные о прямом повреждающем действии на миокард core-белка вируса. Иммуноопосредованный путь повреждения миокарда осуществляется при участии В-клеток, Т-клеток и макрофагов. Обнаружение (+) и (-)-цепей HCV РНК в ткани миокарда у больных миокардитом, дилатационной миокардиопатией и (+)-цепи HCV РНК в миокарде больных гипертрофической кардиомиопатией, сочетающихся с HCV-инфекцией, позволяют обсуждать возможность репликации HCV в ткани миокарда. Обсуждается также роль реакций клеточного иммунитета на тканевые антигены вируса и индуцированные им аутоантигены, роль иммунных комплексов в патогенезе поражения миокарда. Кроме того, не исключается роль цитокинов (продуцируемых активированными вирусом иммуноцитами), которые через механизм повышения продукции оксида азота вызывают отрицательный инотропизм и повреждение сердечной мышцы [35].
Поражение суставов. Артралгии и/или артриты встречаются у 21-74% больных ХГС [19, 24]. Артриты при хронической HCV-инфекции могут рассматриваться как часть аутоиммунного процесса (например, в связи с криоглобулинемией) или как независимый процесс. Описано два вида поражения суставов: полиартрит мелких суставов, подобный ревматоидному артриту, который встречается очень редко и имеет мягкое течение; и неэрозивный олигоартрит с вовлечением средних и крупных суставов, часто интермиттирующего течения, как правило, связанный с криоглобулинемией. Ревматоидный фактор в сыворотке крови выявляется в 50-80% случаев. Антитела к циклическому цитруллиновому пептиду (АЦЦП) обнаруживаются менее, чем у 6% больных с HCV-ассоциированным артритом, что можно использовать для дифференциального диагноза ревматоидного артрита и поражения суставов в рамках HCV-инфекции [19]. Синдром Шегрена (СШ). У больных ХГС с высокой частотой (14-77%) выявляются морфологические признаки лимфоцитарного сиалоаденита и поражение слезных желез (у 26-50%).
Морфологические изменения малых слюнных желез характеризовались небольшой воспалительной инфильтрацией (рис. 2) и распространенным фиброзом ацинарной ткани [36, 37]. Клинически ксерофтальмия и ксеростомия имеют субклиническое течение у 73,8% больных, клинически очевидный СШ отмечается у больных ХГС с КГ [37]. Синдром Шегрена у больных является фактором риска развития злокачественной В-клеточной лимфомы, особенно при сочетании со СКГ [38]. Поражение щитовидной железы. Прямая связь между HCV-инфекцией и заболеванием щитовидной железы до конца не установлена, однако, поражение щитовидной железы (особенно гипотиреоз) чаще встречается среди больных ХГС, чем в общей популяции. У 13% больных, инфицированных HCV, выявляется гипотиреоз и у 25% обнаруживаются антитиреоидные антитела. В 30% случаев поражение щитовидной железы выявляется в ходе ПВТ. В связи с этим остается открытым вопрос, является ли нарушение функции щитовидной железы вирус-индуцированным или нежелательным эффектом противовирусной терапии. ПВТ, возможно, вызывает развитие нарушения функции щитовидной железы de novo или вызывает обострение уже существующего субклинического поражения щитовидной железы [39, 40].
Как и при ХГВ, внепеченочные проявления гепатита ХГС создают определенные трудности в дифференциальном диагнозе ХГС, определяя у части больных неблагоприятный прогноз криоглобулинемического васкулита, поражения почек, В-клеточной лимфомы. Особенности лечения хронических гепатитов В и С с системными проявления гепатита. Адекватный подход к лечению хронических вирусных гепатитов с внепеченочными проявлениями гепатита включает в себя две независимые, но тесно связанные цели. Первая – эрадикация вируса или снижение вирусной нагрузки с помощью этиотропной противовирусной терапии. Вторая – патогенетическое лечение аутоиммунных нарушений с использованием иммуносупрессивной терапии и/или плазмафереза с целью контроля образования иммунных комплексов. По мнению большинства исследователей, для лечения хронической HBV-инфекции оптимальна комбинированная терапия: использование препаратов, различающихся по механизму действия, – сочетание ИФН-? с аналогами нуклеоз(т)идов, сочетание нескольких аналогов нуклеоз(т)идов. Преимуществом интерферона-? является более низкая частота рецидивов после отмены препарата, а аналогов нуклеоз(т)идов – отсутствие нежелательных эффектов, в том числе иммуностимулирующего действия, что обусловливает его применение у больных с внепеченочными проявлениями гепатита и декомпенсированным циррозом печени. В ряде случаев при наличии миокардита, тубулоинтерстициального нефрита, полимиозита оправдано применение иммуносупрессивной терапии, несмотря на усиление репликации вируса гепатита В под влиянием стероидов [6,43-46]. Лечение ХГС со СКГ направлено на подавление вирусной репликации и угнетение В-клеточной пролиферации. Эрадикация HCV при противовирусной терапии приводит к исчезновению СКГ и регрессу клинических проявлений, но часть больных ХГС не отвечает на ПВТ, у ряда пациентов отмечаются выраженные нежелательные эффекты лечения. Применение кортикостероидов при хроническом вирусном гепатите с аутоиммунными нарушениями может приводить к увеличению вирусной нагрузки. В то же время, известно, что интерферонотерапия может вызывать ухудшение таких внепеченочных проявлений HCV-инфекции, как периферическая нейропатия, миокардит, тубуло-интерстициальный нефрит, полимиозит. Недавно было предложено использовать ритуксимаб (химерные моноклональные антитела к CD20) в качестве анти-В-клеточной терапии у больных ХГС с криоглобулинемией, не отвечающих на ПВТ [47, 48]. Его действие связано с быстрым, но обратимым, угнетением CD20+ В-клеток в периферической крови [49, 50]. Ряд исследований свидетельствуют об эффекте ритуксимаба у больных ХГС с периферической нейропатией и комбинации ритуксимаба и плазмафереза у больных ХГС с криоглобулинемическим васкулитом [47, 51], а также эффективность ритуксимаба и ПВТ у больных ХГС с КГ-гломерулонефритом и сосудистой пурпурой [23, 52]. Таким образом, лечение больных хроническими вирусными гепатитами с внепеченочными проявления гепатита не разработано, представляет серьезные проблемы и нуждается в дальнейшем изучении и выработке тактики.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной. От гепатита С во всем мире страдают по меньшей мере 200 млн человек.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной.
От гепатита С во всем мире страдают по меньшей мере 200 млн человек. Последствиями перенесенного заболевания могут быть хронический гепатит, цирроз и первичный рак печени.
Эпидемиология
Распространенность хронической HCV-инфекции на земном шаре варьирует от 0,5 до 2%. Существуют регионы, для которых характерна более высокая распространенность этого заболевания: 6% в Заире и Саудовской Аравии, 16% в изолированных поселениях в Японии. В России наблюдается рост заболеваемости гепатитом С (3,2 на 100 тыс. населения в 1994 году и 19,3 в 1999 году). Источниками заражения вирусным гепатитом C служат больные острыми и хроническими формами HCV-инфекции, причем в основном это люди, у которых отсутствует желтуха и наблюдается бессимптомное или малосимптомное течение заболевания.
В настоящее время HCV чаще всего инфицируются молодые люди, преимущественно мужчины в возрасте около 20 лет, примерно 40% из них заражаются при внутривенном введении наркотиков. Основным путем инфицирования HCV является парентеральный. Так, у 6,1% больных, которым производилось переливание крови и ее компонентов во время кардиохирургических операций, развивался острый вирусный гепатит C, у 60% из них гепатит принимал хроническую форму.
Существует и риск заражения гепатитом C половым путем, однако он невелик (5-8%). Возможна передача HCV от матерей с острой или хронической формой инфекции; это также редкое явление, встречается не чаще чем в 5-6% случаев. Риск заражения вышеуказанными путями уступает таковому при гепатите В.
Приблизительно у половины больных путь инфицирования HCV установить не удается.
Вирус гепатита С
Вирус гепатита С относится к семейству флавивирусов. Геном вируса представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. Вирус гепатита С вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян.
Определение генотипов вируса гепатита С имеет большое значение для практической медицины. Хотя до сих пор не установлено четкой корреляции между генотипами и уровнем виремии, характеристиками пациента, тяжестью течения заболевания, большинство исследователей соглашаются с выводами о значении генотипов вируса как важного фактора, влияющего на эффективность противовирусной терапии.
Вакцину против гепатита С создать пока не удалось из-за высокой изменчивости вируса гепатита С (ВГС).
Патогенез
Считают, что вирус оказывает прямое цитопатическое действие и вызывает иммуноопосредованное повреждение гепатоцитов. Высокая степень хронизации вирусного гепатита С обусловлена некоторыми особенностями действия вируса:
- возможностью внепеченочной репликации вируса, включая иммунокомпетентные клетки (клетки, предшественники гемопоэза, лимфоциты и моноциты периферической крови, миофибробласты);
- гетерогенностью генотипов и частыми мутациями генома вируса;
- индукцией каскада иммунопатологических реакций;
- активизацией процессов перекисного окисления липидов в печени.
В течении хронической HCV-инфекции может происходить нейтрализация мажорного варианта вируса, но тогда генерируются минорные варианты. Квазивиды HCV представляют собой движущуюся мишень, которую ограничивает иммунная система хозяина. Появление нового мажорного квазивида сопровождается повышением виремии и увеличением титра Ig M антител к вирусным белкам. Постепенно и этот новый мажорный вариант заменяется. Такой процесс приводит к периодической волнообразной виремии, сопровождающейся обострением хронического гепатита С (ХГС) и повышением уровня антител.
Возможно, антивирусному Т-клеточному ответу отведена центральная роль в элиминации ВГC, так как нейтрализующие антитела, по-видимому, очень часто оказываются неэффективными. Т-хелперные (Th) лимфоциты распознают вирусные антигенные пептиды, представленные HLA-комплексом II класса на поверхностной мембране антиген-презентирующих клеток. В зависимости от типа цитокинового профиля Th-клетки делятся на две группы: Th1 и Th2. Первые продуцируют IFNg и IL2, стимулируя Т-клеточный ответ и цитотоксическую Т-лимфоцитную активность, а вторые продуцируют IL4 и IL10, стимулируя В-клеточный ответ. Таким образом, Тh-лимфоциты играют существенную роль в регуляции иммунного ответа. У пациентов, у которых болезнь перешла в хроническую стадию, в острой фазе вирус-специфический Th ответ был ниже и преобладали цитокины типа Th2.
У хронически ВГC-инфицированных пациентов значительно увеличено содержание вирусоспецифических Th2-клеток и их цитокинов. Нарушение баланса Th1/Th2 цитокиновой продукции может играть важную роль в иммунопатогенезе хронической ВГC-инфекции. Показано снижение уровня IFNg и IL12 при ХГС. Этот дефицит является следствием повышенного уровня IL10, предполагаемого отрицательного регулятора для IFNg. Повышенное содержание Th2-клеток при ХГС может снижаться при комбинированной терапии рибавирином и IFNa. Обнаружено, что у пациентов с клинико-биохимическим улучшением после лечения IFNa произошло увеличение уровня Th1-цитокинов.
Цитотоксические лимфоциты (CTL) играют, по-видимому, некоторую роль в ограничении репликации ВГС. Этот ответ недостаточен для полной элиминации вируса при хронической инфекции и, кроме того, может вызывать повреждение печени. Известно, что CTL способны быстро опознавать и направленно лизировать клетки, несущие ВГC-антигены, не провоцируя значительного воспаления, с помощью перфоринового, FasL- и TNFα-базируемых механизмов.
ТNF, как предполагается, индуцируют апоптоз клеток, опосредуя высвобождение свободных радикалов из митохондриальных электронно-транспортных путей и модуляцию синтеза некоторых белков. Взаимодействие нуклеокапсидного белка ВГC с внутрицитоплазматической частью рецептора TNFb, вероятно, представляет собой эволюционно-отобранный механизм, с помощью которого вирус препятствует преждевременному апоптозу клетки-хозяина. В отсутствие доступных модельных клеточных культур прямая цитопатичность вируса гепатита С не может быть исследована в полном объеме.
В подавляющем большинстве случаев острого гепатита С иммунной системе не удается элиминировать вирус. До сих пор нет ясного представления о том, почему это происходит. Очевидно, ВГС обладает эволюционно-закрепленными способностями, обеспечивающими ему персистенцию.
Однако иммунная система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев острого гепатита С она эффективно уничтожает вирус, а у хронически ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти 20 лет. Возможно, ослабление какого-либо звена антивирусных иммунных механизмов позволяет вирусу активно воздействовать на иммунную систему. Длительная ВГC-персистенция может привести к развитию В-клеточных лимфопролиферативных нарушений, таких, как смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление органоспецифических и неспецифических аутоантител. Таким образом, хроническую ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Диагностика
Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться разрешенными МЗ РФ к применению диагностическими препаратами отечественного или зарубежного производства в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований.
HCV RNA — самый ранний маркер репликации вируса, определяемый с помощью полимеразной цепной реакции (ПЦР) спустя несколько недель после заражения. Для выявления анти-ВГС применяют иммуноферментный анализ (ИФА). В настоящее время используют тест-системы третьего поколения ELISA-3. Подтверждающим методом является рекомбинантный иммуноблотинг (RIBA). У 60% больных анти-ВГС определяются в острой фазе, у 35% они появляются спустя 3-6 месяцев после инфицирования, у 5% инфицированных лиц анти-ВГС не определяются.
Болезнь может протекать бессимптомно. Наиболее распространенным симптомом является слабость. Целенаправленный опрос больных часто помогает выявить такие факторы риска, как переливание крови, внутривенное введение наркотиков, хронический гемодиализ и др. Кроме слабости больной может жаловаться на быструю утомляемость, тяжесть в правом подреберье, боли в правом верхнем квадранте живота, диспепсические явления.
Критериями постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови в течение не менее 6 месяцев.
Гепатоспленомегалия выявляется не более чем у 50% обратившихся за помощью больных, активность сывороточных трансаминаз редко превышает верхнюю границу нормы в 6 раз. Следует обратить внимание на то, что активность сывороточных трасаминаз не отражает степени изменений в печени: она может быть нормальной, несмотря на значительные морфологические изменения. Концентрация РНК ВГС в сыворотке имеет существенное значение для определения контагиозности и для мониторинга результатов лечения. При наличии в крови HCV-РНК биопсия печени, как правило, выявляет ряд изменений. Концентрация HCV-РНК в сыворотке, превышающая 105 молекулярных эквивалентов (копий) в 1 мл, наблюдается в активной фазе заболевания и совпадает с пиками активности трансаминаз.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный).
Для раннего выявления ГЦК у больных циррозом печени, особенно у мужчин старше 40 лет, каждые 6 месяцев определяют уровень сывороточного α-фетопротеина и выполняют УЗИ печени.
Естественное течение и прогноз
Инфицирование ВГС приводит к развитию острого гепатита С, протекающего в манифестной (желтушной) или чаще в латентной (безжелтушной) формах, которые развиваются в соотношении 1:6. Около 17-25% больных острым гепатитом С выздоравливают спонтанно, у остальных 75-83% развивается хронический гепатит С. Большинство больных с биохимическими и иммунологическими признаками хронического гепатита имеют слабовыраженную или умеренную степень воспалительно-некротического поражения печени и минимально выраженный фиброз. Примерно у 26-35% больных хроническим гепатитом С в течение 10-40 лет развивается фиброз печени и может наступить смерть от цирроза печени и его осложнений. У 30-40% больных с циррозом печени высок риск заболевания раком печени.
Считается, что не более чем у 30% больных ВГС с минимальной морфологической активностью через 20 лет возможно развитие цирроза печени. Таким образом, больные, у которых при гистологическом исследовании биоптата печени выявляется наличие минимального воспаления и минимального фиброза, нуждаются в динамическом наблюдении.
Если персистенция РНК ВГС сохраняется более 6 месяцев, то спонтанное разрешение хронической HCV-инфекции маловероятно.
Клиническая картина
У большинства больных с хроническим гепатитом С заболевание протекает бессимптомно. Если жалобы существуют, то это чаще всего слабость, тупые боли в правом подреберье, тошнота, снижение аппетита, кожный зуд, артралгии и миалгии. Физикальный осмотр пациента помогает установить диагноз зачастую только на стадии цирроза печени.
Внепеченочные проявления HCV-инфекции
Ассоциация хронического гепатита С с различными внепеченочными проявлениями — хорошо известный врачам факт. Наиболее вероятным для большинства заболеваний и синдромов, наблюдаемых при HCV-инфекции, представляется иммунный патогенез, хотя конкретные механизмы во многом еще не выяснены. Доказанные и предполагаемые иммунные механизмы включают:
- моно- или поликлональную пролиферацию лимфоцитов;
- образование аутоантител;
- отложение иммунных комплексов;
- секрецию цитокинов.
Частота иммуноопосредованных заболеваний и синдромов у больных хроническим гепатитом С достигает 23%. Наиболее характерны аутоиммунные проявления для больных с гаплотипом HLA DR4, который ассоциируется с внепеченочными проявлениями при аутоиммунном гепатите. Этот факт подтверждает гипотезу о триггерной роли вируса в инициации аутоиммунных процессов у генетически предрасположенного индивидуума.
Заболевания, ассоциированные с HCV-инфекцией
Ассоциированные с продукцией или отложением иммуноглобулинов:
- Криоглобулинемия
- Лейкоцитокластерный васкулит
- Мембранозно-пролиферативный гломерулонефрит
- В-клеточная лимфома
- Плазмоцитома
- MALTома
- Тиреоидит
- Синдром Шегрена
- Гемолитическая анемия
- Тромбоцитопения
- Красный плоский лишай
Ассоциированные с неизвестным механизмом:
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции, который диагностируют у 40-65% больных. Спектр аутоантител достаточно широк и включает ANA (до 28%), SMA (до 11%), анти-LKM-1 (до 7%), антифосфолипидные (до 25%), антитиреоидные (до 12,5%), ревматоидный фактор, анти-ASGP-R и др. Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии.
Анти-GOR являются антителами, специфичными для HCV-инфекции, и их выявляют не менее чем у 80% больных. Эпитоп, распознаваемый анти-GOR, локализуется на пока неидентифицированном ядерном белке, гиперэкспрессию которого наблюдают при гепатоцеллюлярной карциноме. Выработка анти-GOR ассоциирована только с HCV-инфекцией, но не с АИГ.
Аутоиммунные расстройства наблюдаются в среднем у 23% больных хроническим гепатитом С. Наиболее часто встречаются патология щитовидной железы.
Гистологическое исследование печени
Гистологическая картина не является патогномоничной, при этом достаточно часто выявляются характерные изменения. Отличительная особенность ее — лимфоидные агрегаты или фолликулы в портальных трактах, которые могут быть как изолированными, так и частью воспалительных изменений портальных трактов. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Жировая дистрофия обнаруживается в 75% случаев. Кроме того, выявляются следующие характерные изменения: негнойный холангит с лимфоидной и плазмоклеточной инфильтрацией стенок протоков; лимфогистиоцитарная инфильтрация перипортальной зоны; слабовыраженные ступенчатые некрозы; мостовидные некрозы (обнаруживаются редко), пролиферация и активация сателлитных клеток печени, пролиферация эпителия желчных канальцев.
Отмечено, что индекс гистологической активности (ИГА) и индекс фиброза (ИФ) у больных хроническим гепатитом С с наличием жировой дистрофии достоверно выше, чем у пациентов без сопутствующей жировой дистрофии. У 93% больных с жировой дистрофией в гепатоцитах обнаруживался Core-протеин ВГС, при отсутствии жировой дистрофии — лишь у 39%. Этим фактом подчеркивается роль Core-протеина в развитии жировой дистрофии гепатоцитов.
Биопсия печени играет существенную роль в уточнении диагноза и оценке активности и стадии заболевания.
РНК ВГС можно определить в ткани печени методом ПЦР.
Лечение
Основная цель лечения — предотвратить прогрессирование заболевания.
Режим отдыха, диета и прием витаминов не оказывают лечебного действия.
Отбор пациентов для лечения. Показанием к назначению терапии интерфероном служит умеренное (но не минимальное) либо тяжелое воспаление и/или фиброз. Решение о лечении пациентов с циррозом печени принимают индивидуально в каждом конкретном случае. Больные, у которых гистологическая активность минимальна, должны находиться под динамическим наблюдением, так как они имеют хороший жизненный прогноз без лечения и очень низкий риск развития цирроза печени через 10-20 лет.
Факторы, связанные с благоприятным эффектом противовирусной терапии при хронической HCV-инфекции:
- Возраст моложе 45 лет
- Женский пол
- Отсутствие ожирения
- Срок инфицирования менее 5 лет
- Отсутствие коинфекции HBV
- Отсутствие иммунодепрессии
- Отсутствие алкоголизма
- Умеренное повышение АЛТ
- Отсутствие цирроза
- Низкое содержание железа в печени
- Низкий уровень HCV RNA в сыворотке
- Генотип 2 или 3
- Однородность популяции вируса
Больным с нормальным уровнем АЛТ и положительным тестом на HCV RNA без результатов гистологического исследования противовирусное лечение проводить не рекомендуется.
Основной препарат, эффективность которого в лечении гепатита С доказана, — это интерферон альфа (ИФα).
В настоящее время принята оптимальная схема монотерапии ИФ: разовая доза составляет 3 млн МЕ, ее вводят подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Через 3 месяца необходимо исследовать РНК ВГС. Если результаты ПЦР положительные схему лечения меняют. Если же РНК не выявляется, лечение продолжают до 12 месяцев. Стойкий положительный ответ в этом случае регистрируется у 15-20% больных.
Оптимальная схема лечения хронического гепатита С в настоящее время — это комбинация ИФa и рибавирина.
- в течение 6 месяцев - при генотипах 2 и 3;
- в течение 6 месяцев - при генотипе 1 и низком уровне виремии;
- в течение 12 месяцев - при генотипе 1 и высоком уровне виремии.
Стойкий положительный ответ при комбинированном лечении ИФa с рибавирином наблюдается в 40-60% случаев.
Суточная масса рибавирина составляет 1000-1200 мг в зависимости от массы тела.
В последние годы для повышения эффективности интерферона применяют пегилирование, которое заключается в присоединении к молекуле интерферона полиэтиленгликоля. В итоге образуется ПЭГ-интерферон, имеющий более длительный период полураспада. Предварительные данные свидетельствуют о большей эффективности такого лечения по сравнению с терапией интерфероном альфа.
Другие противовирусные препараты в лечении хронического гепатита С
Имеются данные, свидетельствующие о положительном действии таких препаратов, как ремантадин, урсодеоксихолевая кислота, пегилированные интерфероны, препараты глициризиновой кислоты, однако эта информация нуждается в дальнейшей проверке.
ВПП — внепеченочное поражение
ИК — иммунные комплексы
КГС — криоглобулинемический синдром
МКГН — мезангиокапиллярный гломерулонефрит
ПВТ — противовирусная терапия
РФ — ревматоидный фактор
СКГ — смешанная криоглобулинемия
СШ — синдром Шегрена
ТИН — тубулоинтерстициальный нефрит
УП — узелковый полиартериит
ФА — фиброзирующий альвеолит
ХГВ — хронический гепатит В
ХГН — хронический гломерулонефрит
ХГС — хронический гепатит С
ЦП — цирроз печени
ЩЖ — щитовидная железа
HBV — вирус гепатита В
HCV — вирус гепатита С
Изучение хронических вирусных поражений печени выявило широкий спектр внепеченочных проявлений хронического гепатита В (ХГВ), а впоследствии, при открытии вируса гепатита С, и хронического гепатита С (ХГС).
В России ведущая роль в изучении системности поражения при вирусных заболеваниях печени принадлежит исследованиям, проведенным в клинике им. Е.М. Тареева: изучение хронического активного гепатита как системного заболевания (З.Г. Апросина, 1974 г., 1981 г.), внепеченочных поражений при ХГС (Т.М. Игнатова, 2000 г.; А.В. Русских, 2004 г.; С.Ю. Милованова, 2005 г.; С.Ю. Карпов, 2005 г.) и ХГВ (А.А. Ильянкова, 2001 г.; Д.Т. Абдурахманов, 2003 г.; М.М. Ибрагимова, 2004 г.; П.Е. Крель, 1995 г.; С.В. Тэгай, 2003 г.; А.В. Русских, 2004 г.), поражения системы крови (Л.А. Гусейнова, 1981 г.), поражения легких (А.С. Дроздова, 1989 г.), синдрома Шегрена (Т.Н. Лопаткина, 1980 г.; О.В. Чернецова, 2004 г.), поражения почек (А.В. Потапова, 1989 г.; Е.Н. Косминкова, 1992 г.), системных васкулитов при вирусных гепатитах (Е.Н. Семенкова, 1994).
В развитии внепеченочных поражений основное значение имеют иммунные реакции, возникающие в ответ на репликацию вирусов гепатита В (HBV) или С (HCV) в печени, в тканях лимфоидного и нелимфоидного происхождения. Предположения о наличии внепеченочной локализации репликации HBV или HCV возникли в связи с наблюдением случаев быстро развивающегося острого гепатита у пациентов с вирусным циррозом печени (ЦП) после пересадки здоровой донорской печени, что объяснялось внепеченочной локализацией вирусов [1]. Помимо иммунных нарушений в возникновении системных поражений имеет значение прямое цитопатическое действие вирусов гепатита, при этом часто внепеченочное поражение (ВПП) служит единственным проявлением вирусной инфекции и может определять прогноз и тактику лечения заболевания.
Особенности ХГВ с ВПП. У 10—20% больных ХГВ [2]встречаются ВПП, которые включают широкий спектр поражений различных органов и систем.
Поражения кожи, наблюдаемые при острых и хронических болезнях печени, обусловленные HBV, весьма вариабельны и включают макулярные, макулопапулезные, папуловезикулярные высыпания, рецидивирующую крапивницу, петехии, пурпуру, узловатую эритему, скарлатиноподобную сыпь, гангренозную пиодермию, витилиго, гиперпигментацию и изъязвления в области нижних конечностей, аллергический капиллярит, пурпуру Шенлейна—Геноха [3—7].
Смешанная криоглобулинемия (СКГ) встречается у 3—17% больных ХГВ, может проявляться кожной пурпурой, артритами и/или артралгиями, поражением почек, синдромом Рейно [5, 6, 8, 9].
Поражение почек при ХГВ протекает в 3 формах — хронический гломерулонефрит (ХГН), тубулоинтерстициальный нефрит (ТИН), а также при HBV-ассоциированном узелковом полиартериите (УП) [10—16]. Частота поражения почек при ХГВ составляет 14%, в том числе ХГН 12,6%, ТИН 1,4% [11]. В клубочках выявляются депозиты различных антигенов HBV, у отдельных больных в ткани почки обнаружена ДНК HBV [13]. Иммунные комплексы (ИК) могут активировать комплемент и вызывать поражение клубочков путем формирования мембраноатакующих комплексов и дальнейшего каскада реакций, таких как индукция протеаз, оксидативное повреждение и разрушение цитоскелета нефрона [14].
УП—системный васкулит с поражением средних и мелких артерий. В патогенезе HBV-ассоциированной формы важную роль играют циркулирующие ИК, содержащие вирусные белки [15]. По данным Е.Н. Семенковой, инфицирование HBV выявляется в 56,9% случаев УП. [16] Отмечено, что почти все случаи УП, ассоциированного с HBV, связаны с инфекцией HBV дикого типа, характеризующейся HBe-антигенемией и выраженной репликацией HBV. Предположительно повреждение почек происходит в результате отложения вирусных ИК HBeAg-HBeAb [15].
В целом хроническая инфекция HBV вызывает широкий спектр ВПП, в генезе которых имеют значение как иммунокомплексные реакции, так и реакции гиперчувствительности замедленного типа. ВПП ХГВ могут длительно маскировать поражение печени, являясь ведущими клиническими признаками болезни и нередко определяющими прогноз заболевания. Однако с введением программ массовой вакцинации против HBV инфицированность населения начала снижаться. Открытие HСV в 1989 г. положило начало активному изучению обширного спектра ВПП при этой инфекции.
Особенности ХГС с ВПП. Согласно различным исследованиям у 40—74% пациентов, инфицированных HСV, может быть хотя бы одно ВПП за время течения болезни [17—19]. Более того, часто внепеченочные симптомы служат первыми проявлениями инфекции HCV в отсутствие у ряда больных признаков поражения печени. Для ХГС характерно развитие ВПП преимущественно иммунокомплексного генеза, в первую очередь обусловленных СКГ, которая наблюдается у 19—56% больных [18—21]. Только у небольшой группы больных ХГС с СКГ (менее 15%) имеются клинические проявления — криоглобулинемический синдром (КГС) [21, 22]. Распространенность СКГ повышается при более продолжительной персистенции HCV в организме и чаще наблюдается у женщин на 2—3-м десятилетии болезни. В некоторых исследованиях показано, что длительность инфекции HCV у больных ХГС со СКГ почти в 2 раза больше, чем у пациентов без СКГ [20], у 40% больных со СКГ выявляют признаки ЦП.
Установлено, что HCV имеет высокий тропизм к мононуклеарам периферической крови, которые могут служить его резервуаром и местом репликации. HCV связывается с лигандом CD81 на поверхности В-лимфоцитов через белок Е2, что приводит к их активации. На первом этапе продуцируются только поликлональные криоглобулины (КГ), затем доминирующий клон В-клеток начинает продуцировать моноклональные иммуноглобулины. СКГ является причиной системного васкулита с поражением сосудов мелкого и среднего калибра с возможным вовлечением в патологический процесс различных органов и систем [18, 23, 24]. Известно, что при ХГС васкулиты могут быть обусловлены не только СКГ, но и (со значительно меньшей частотой) — иммунными комплексами, не обладающими свойствами преципитировать на холоде, т.е. не содержащими ревматоидный фактор (РФ) класса IgM [18, 25, 26].
Поражение кожи в 95% случаев представлено васкулитом от пурпуры (лейкоцитокластический васкулит) и петехий на нижних конечностях до выраженных некротических язв. Биопсия кожи выявляет иммунокомплексный васкулит мелких сосудов с мононуклеарной инфильтрацией, в 40% случаев определяются антитела к HCV [19].
У больных ХГС без СКГ по сравнению с больным с СКГ пурпура характеризуется меньшей распространенностью и отсутствием язвенно-некротических изменений кожи [27]. Синдром Рейно при ХГС часто проявляется на ранней стадии КГС, некрозы фаланг пальцев, как правило, не наблюдаются [10]. Однако при высоком криокрите частота развития последних увеличивается [27].
Поражение почек при СКГ, связанной с инфекцией HCV, наблюдается в 35—60% случаев. Наиболее часто встречающийся тип гломерулонефрита, ассоциированного с СКГ, — мезангиокапиллярный гломерулонефрит (МКГН). РНК HCV определяется в сыворотке у 81% больных МКГН с СКГ против 25% случаев некриоглобулинемического МКГН. В почечной паренхиме экспрессируются рецепторы CD81 и SR-B1, с помощью которых HCV связывается с мембраной клетки и проникает внутрь путем эндоцитоза [29]. Поражение почек может наблюдаться в дебюте заболевания у 20% больных ХГС. У 25% пациентов при инфекции HCV развиваются протеинурия нефротического уровня (>3 г/сут), отеки, артериальная гипертония и гипокомплементемия; у 30% в дебюте отмечаются остронефритический синдром и острая почечная недостаточность (олигурическая в 5% случаев). У 55% больных наблюдаются только легкая гематурия, протеинурия и начальные стадии почечной недостаточности. При биопсии почки обнаруживаются иммунокомплексные депозиты IgG, IgM с активностью РФ и компонент С3-комплемента. Наиболее характерной гистологической картиной при световой микроскопии являются капиллярные тромбы, состоящие из преципитированных КГ. Менее часто HCV вызывает фокальный сегментарный гломерулярный склероз или мембранозный, или пролиферативный гломерулонефрит [30]. Картина ассоциированного с HCV некриоглобулинемического МКГН существенно не отличается по клиническим и морфологическим признакам от таковой при идиопатическом МКГН [31].
У 30% больных клиническое течение поражения почек при ХГС замедлено, и функция почек остается сохранной многие годы. В 20% случаев болезнь характеризуется рецидивирующими эпизодами остронефритического синдрома. Менее чем 15% больных требуется диализ в связи с развитием терминальной стадии почечной недостаточности [19, 30].
В основном это мононевропатия, а также поражение периферической нервной системы, ассоциированное с УП, которое обычно представлено асимметричной полиневропатией с ведущими моторными нарушениями [19, 27].
Поражение легких. Описано вовлечение сосудов легких (легочный васкулит) в рамках СКГ, проявляющееся легочными инфильтратами, альвеолярным кровотечением [18]. Имеется ряд наблюдений фиброзирующего альвеолита (ФА) у больных ХГС, в том числе с морфологическим подтверждением и обнаружением РНК HCV в ткани легкого [28]. В некоторых регионах мира (Италия, Япония) частота выявления инфекции HCV у больных ФА составляет 13—14%, что значительно выше, чем в целом в популяции [32]. Эти данные, а также результаты исследований бронхоальвеолярной жидкости у больных ХГС, выявляющих повышенное содержание лимфоцитов и эозинофилов, позволили обсуждать пусковую роль HCV в развитии альвеолита [18]. В то же время в Англии частота инфекции HCV у больных ФА оказалась невысокой (1,6%) и роль HCV в его патогенезе ставится под сомнение [33]. По данным Клиники им. Е.М. Тареева, частота поражения легких была выше у больных без СКГ (11,3%), чем с КГ (6,3%). В группе пациентов, у которых КГ не обнаруживались, поражение легких характеризовалось развитием ФА, у больных с КГ наблюдалась картина легочного васкулита [27].
Поражение сердца. Описаны наблюдения хронического миокардита на фоне инфекции HCV. Поражение миокарда, ассоциированное с инфекцией HCV, может быть обусловлено следующими причинами: 1) прямое (вирусное) воздействие на миокард; 2) непрямой (иммунологический) путь; 3) апоптоз клеток, вызванный внутренними и внешними сигналами [34]. Выявлена репликация HCV в миокарде. Кроме того, высказано предположение о прямом повреждающем действии на миокард core-белка HCV. Непрямой иммуноопосредованный путь повреждения миокарда осуществляется при участии В-, Т-клеток и макрофагов. Обнаружение цепей (+) и (–) РНК HCV в ткани миокарда у больных миокардитом, дилатационной миокардиопатией и цепи (+) РНК HCV в миокарде больных гипертрофической кардиомиопатией, сочетающихся с инфекцией HCV, позволяют обсуждать возможность репликации HCV в ткани миокарда, а также роль реакций клеточного иммунитета на тканевые антигены вируса и индуцированные им аутоантигены, роль иммунных комплексов в патогенезе поражения миокарда. Кроме того, не исключается роль цитокинов (продуцируемых активированными вирусом иммуноцитами), которые путем повышения продукции оксида азота вызывают отрицательный инотропный эффект и повреждение сердечной мышцы [35].
Поражение суставов. Артралгии и/или артриты встречаются у 21—74% больных ХГС [19, 24], могут наблюдаться как в рамках КГС, так и в отсутствие СКГ. Описано 2 вида поражения суставов: полиартрит мелких суставов, подобный ревматоидному артриту, который встречается очень редко и имеет мягкое течение, и неэрозивный олигоартрит с вовлечением средних и крупных суставов, часто интермиттирующего течения, как правило, связанный с криоглобулинемией. РФ в сыворотке крови выявляется в 50—80% случаев. Антитела к циклическому цитруллиновому пептиду обнаруживаются менее чем у 6% больных с артритом, ассоциированным с HCV, что можно использовать для дифференциальной диагностики ревматоидного артрита и поражения суставов в рамках инфекции HCV [19].
Синдром Шегрена (СШ). У 14—77% больных ХГС выявляются морфологические признаки лимфоцитарного сиалоаденита, а также поражение слезных желез (у 26—50%), морфологические изменения малых слюнных желез характеризовались небольшой воспалительной инфильтрацией и распространенным фиброзом [36, 37]. Клинически ксерофтальмия и ксеростомия протекают мягко или отсутствуют у 73,8% больных, наибольшая клиническая выраженность СШ отмечалась у больных ХГС с КГ [37]. Наличие СШ у больных с инфекцией HCV является фактором риска развития злокачественной В-клеточной лимфомы, особенно при сочетании со СКГ [38].
Поражение щитовидной железы (ЩЖ). Прямая связь между инфекцией HCV и заболеванием ЩЖ до конца не установлена, однако поражение ЩЖ (особенно гипотиреоз) у больных ХГС встречается чаще, чем в общей популяции. Примерно у 13% больных, инфицированных HCV, выявляется гипотиреоз и у 25% обнаруживаются антитиреоидные антитела. В 30% случаев поражение ЩЖ выявляется в ходе противовирусной терапии (ПВТ).
В связи с этим остается открытым вопрос, является ли нарушение функции ЩЖ индуцированным HCV или нежелательным эффектом ПВТ. Возможно, ПВТ вызывает развитие нарушения функции ЩЖ de novo или обостряет существующее субклиническое поражение ЩЖ [39, 40].
Инфекция HCV и неходжкинская В-клеточная лимфома. В настоящее время доказана этиологическая роль HCV в развитии КГ II типа, представляющей собой доброкачественное лимфопролиферативное заболевание, в основе которого лежит клональная (IgMκ) пролиферация В-лимфоцитов. У отдельных больных ХГС доброкачественная лимфопролиферация трансформируется в злокачественную. У 8—10% больных с СКГ II типа развивается В-клеточная лимфома. Показана высокая распространенность инфекции HCV и при моноклональной иммуноглобулинопатии, обусловленной пролиферацией других (не продуцирующих СКГ) клонов лимфоцитов, а также значительная (до 11%) частота обнаружения моноклональной иммуноглобулинопатии у больных ХГС. HCV персистирует в иммунокомпетентных клетках кроветворной системы, но не способен к интеграции в геном клетки хозяина. Процесс лимфомогенеза при инфекции HCV рассматривается как длительный многостадийный процесс, в основе которого лежит патологическая пролиферация клеток, сочетающаяся с повреждением их генома. Патологическая пролиферация связывается со снижением порога активации В-лимфоцитов, обусловленной взаимодействием HCV со специфическими рецепторами В-клеток (CD81), а также подавлением вирусом апоптоза. В В-лимфоцитах при инфекции HCV повышается экспрессия белка bcl-2 вследствие транслокации t(14;18), играющего важную роль в подавлении апоптоза. Показано также, что core-белок HCV регулирует транскрипцию с-myc и что bcl-2 и c-myc взаимодействуют друг с другом в процессе лимфомогенеза. Гистологически наиболее распространены фолликулярная лимфома, В-клеточная хроническая лимфоцитарная лейкемия/лимфома из малых лимфоцитов, лимфоплазмоцитарная лимфома и лимфома маргинальной зоны. Среди последних описана особая ассоциация инфекции HCV с MALT-лимфомой [18, 41, 42]
Таким образом, при ХГС многообразие ВПП инфекции обусловлено в первую очередь смешанной криоглобулинемией и характеризуется развитием у ряда больных КГС с поражением кожи, суставов, мышц, почек и других органов и систем. Особенностью доброкачественной лимфопролиферации, свойственной ХГС, является возможность трансформации в злокачественную с развитием В-клеточной лимфомы. Как и при ХГВ, внепеченочные проявления ХГС создают трудности при дифференциальном диагностике ХГС, определяя у отдельных больных неблагоприятный прогноз криоглобулинемического васкулита, поражения почек, В-клеточной лимфомы.
Лечение больных ХГВ и ХГС с системными проявлениями. Адекватный подход к лечению хронических вирусных гепатитов с ВПП включает две независимые, но тесно связанные цели. Первая — эрадикация вируса или снижение вирусной нагрузки с помощью этиотропной ПВТ. Вторая — патогенетическое лечение аутоиммунных нарушений с использованием иммуносупрессивной терапии и/или плазмафереза с целью контроля образования иммунных комплексов.
По мнению большинства исследователей, для лечения инфекции хронической HBV оптимальна комбинированная терапия: использование препаратов, различающихся по механизму действия, — сочетание α-интерферона (ИФН-α) с аналогами нуклеоз(т)идов, сочетание нескольких аналогов нуклеоз(т)идов. Преимуществом ИФН-α является более низкая частота рецидивов после отмены препарата, а аналогов нуклеоз(т)идов — отсутствие нежелательных эффектов, в том числе иммуностимулирующего действия, что обусловливает его применение у больных с выраженными ВПП и декомпенсированным ЦП. В ряде случаев при выраженных системных поражениях оправданно применение иммуносупрессивной терапии, несмотря на активирующее влияние глюкокортикостероидов на репликацию HВV [6, 43—46].
Лечение больных ХГС со СКГ направлено на подавление вирусной репликации и угнетение В-клеточной пролиферации. Эрадикация HCV при ПВТ приводит к исчезновению СКГ и регрессу клинических проявлений, но некоторые больные ХГС не отвечают на ПВТ, у ряда пациентов отмечаются выраженные нежелательные эффекты лечения. Применение глюкокортикостероидов при хроническом вирусном гепатите с аутоиммунными нарушениями может приводить к увеличению вирусной нагрузки. В то же время известно, что интерферонотерапия может вызывать усугубление таких ВПП инфекции HCV, как периферическая невропатия, миокардит, тубулоинтерстициальный нефрит, полимиозит. Недавно предложено использовать ритуксимаб (химерные моноклональные антитела к CD20) в качестве анти-В-клеточной терапии у больных ХГС с криоглобулинемией, не отвечающих на ПВТ [47, 48]. Его действие связано с быстрым, но обратимым, угнетением CD20+ В-клеток в периферической крови [49, 50]. Ряд исследований свидетельствуют об эффекте ритуксимаба у больных ХГС с периферической невропатией и комбинации ритуксимаба и плазмафереза у больных ХГС с криоглобулинемическим васкулитом [47, 51], а также об эффективности ритуксимаба и ПВТ у больных ХГС с криоглобулинемическим гломерулонефритом и сосудистой пурпурой [23, 52].
Таким образом, лечение больных хроническими вирусными гепатитами с ВПП не разработано, представляет серьезные проблемы и нуждается в дальнейшем изучении и определении тактики.
Читайте также:

