Простой герпес дерматологические аспекты
Обновлено: 25.04.2024
Для цитирования: Халдин А.А., Самгин М.А. Дифференцированный подход к лечению и вторичной профилактике рецидивов простого герпеса. РМЖ. 2004;4:179.
ММА имени И.М. Сеченова
С реди многих проблем, связанных с вирусом простого герпеса (ВПГ), особого внимания заслуживает вопрос лечения рецидивов и профилактики обострений простого герпеса (ПГ). Его актуальность в связи с увеличением степени инфицированности возбудителем и частоты клинических проявлений вирусного процесса все более возрастает. Вместе с тем успешная терапия невозможна без понимания патогенеза заболевания, что не раз подчеркивали многие исследователи. Именно его расшифровка является ключом к решению самой важной задачи, стоящей перед клиницистом, в лечении хронически персистирующей герпес–вирусной инфекции [1,2,3].
Сегодня существует достаточно большой арсенал противогерпетических средств. Однако оценка их фармакологического действия говорит о наличии всего лишь двух приоритетных направлений терапии ПГ – иммунного и этиотропного. Оба они патогенетически обоснованы. Первое базируется на восстановлении контроля системы иммунитета над латентным состоянием ВПГ в сенсорных паравертебральных ганглиях ЦНС. Второе основано на нарушении репликации и активации возбудителя в случае выхода провируса герпеса из–под иммунного контроля [4].
Терапия иммунной направленности, т.е. патогенетический подход, по–видимому, – наиболее естественный метод профилактики ПГ. Ее обоснованием служит принципиальная возможность управлять формированием и уровнем напряженности приобретенного противогерпетического иммунитета [1]. Этиотропные же препараты наиболее эффективны при купировании клинических проявлений инфекции. Но, как показывает опыт, различные средства патогенетического (иммунного) влияния позволяют добиться искомого результата далеко не во всех случаях, а противовирусные средства оказывают действие только на активные формы возбудителя.
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия.
Однако следует отметить, что анализ полученных во всех случаях клинических результатов не позволяет говорить о достижении при таких подходах достоверно значимого повышения профилактического влияния комбинированных методов лечения по сравнению с монотерапией, например, герпетической вакциной или индукторами интерферона.
Также безуспешными явились попытки разработки комплексных программ терапии, включающих использование на разных этапах лечения синтетических нуклеозидов, герпетической вакцины и иммуностимулирующих средств.
Таким образом, ни этиотропная, ни иммуностимулирующая терапия не гарантируют 100% клинического эффекта. Это связано с рядом причин, например, с хронической персистенцией возбудителя. Следствием последней является восстановление репликации ВПГ и возобновление обострений заболевания после прекращения сколь угодно продолжительного по времени приема противовирусных химиопрепаратов. Неудачи иммунокоррекции можно объяснить назначением различных по патогенетическому действию препаратов без учёта особенностей нарушений системы иммунитета [1,4].
Сложившаяся ситуация свидетельствует о необходимости дифференцированного подхода к выбору терапевтической тактики при ПГ.
С этой целью нами было проведено изучение особенностей клинического течения заболевания и углублённое исследование иммунного статуса больных. Выявленные в результате закономерности между тяжестью течения вирусного процесса и глубиной дефектов иммунитета позволили разработать методологический подход к дифференцированному выбору терапии ПГ, который имеет математическое выражение.
Иммунологические исследования включали определения интерферонового статуса (ИФС), отдельных составляющих T–клеточного звена (CD–4 и CD–8 – клетки, индекс цитотоксической активности естественных киллеров), а также цитокинового профиля (интерлейкины 1, 2, 4, 6, 8, факторы некроза опухоли) и уровня специфических иммуноглобулинов к ВПГ. Изучение иммунограмм больных ПГ позволило констатировать их неоднородность. Различия имелись как количественные, так и качественные.
Количественные варианты отличались глубиной нарушений иммунитета, в первую очередь системы интерферона и цитотоксичности естественных киллеров (ЕК). Было выделено два типа иммунной несостоятельности. При редких рецидивах она носила транзиторный характер. В случаях частых обострений имела свойства вторичного иммунодефицита со снижением уровня интерферонов и индекса активности ЕК в 2 и более раз.
Качественные различия соответствовали механизму формирования вторичного иммунодефицитного состояния. Их характеристики были связаны с медиаторами иммунитета – интерлейкинами (ИЛ) и продуцирующими их клетками. На фоне общего снижения уровня цитокинов и способности к индукции иммунокомпетентных клеток в 65% случаев отмечалось превалирование выработки ИЛ–6, в 25% – ИЛ–4. В 10% иммунограмм выявлено выраженное снижение синтеза всех исследованных ИЛ и значительное понижение функциональной активности Т–хелперов.
Выявление указанных иммунологических различий позволило сделать заключение о неоднородности иммуногенеза рецидивов ПГ, выделив несколько его вариантов (табл. 1).
Иммунологические особенности, свидетельствующие о разнообразии формирования противогерпетического ответа, наглядно подтверждают необходимость различных подходов к тактике ведения и выбору терапии больных ПГ. Это обусловлено тем, что определенные иммунологические нарушения должны восстанавливаться соответствующими патогенетически обоснованными методами.
Работа с пациентом начинается со сбора анамнеза. Выявление нами прямой корреляции между тяжестью течения вирусного процесса и глубиной дефектов иммунитета привело к созданию клинического индекса терапевтической тактики (КИТТ). Он позволяет, на основании оценки клинических составляющих заболевания, определить подход к ведению больного ПГ. Возможны два варианта – купирование каждого конкретного рецидива или системная терапия с целью профилактики последующих обострений. Раньше выбор основывался исключительно на частоте манифестаций ВПГ. Однако анализ совокупности клинических данных говорит о значимости и других анамнестических параметров.
Расчёт КИТТ основан на введении в его формулу числовых значений соответствующих шкал.
КИТТ= [(a–1)x(3a+2d+e+2z–9,14)] / (3,66a–3,62),
a – значение по шкале частоты рецидивов;
z – значение по шкале склонности к нарастанию частоты обострений;
d – значение по шкале их длительности;
e – значение по шкале продолжительности самого заболевания.
При показаниях к проведению терапии направленной только на купирование рецидива наиболее эффективными препаратами являются ациклические синтетические нуклеозиды. Так, назначение Фамвира в дозе 250 мг достаточно быстро купирует клинические проявления заболевания. Однако при этом необходимо ориентировать пациента на необходимость приема противовирусных средств на ранних сроках обострения, что позволяет значительно повысить эффективность лечения.
КИТТ позволяет также определить, когда пациенту показано проведение системной терапии, направленной на профилактику рецидивов. Однако он не дает ответа на вопрос о том, какой она должна быть по этиопатогенетическому действию. Это связано с тем, что сходные нарушения противовирусного иммунитета возникают при разных по характеру изменениях продукции медиаторов иммунитета и продуцирующих их клеток.
Поэтому для того, чтобы учесть это важное обстоятельство, был создан второй клинико–иммунологический индекс этиопатогенетической терапии (КИИЭПТ).
Его расчёт также основан на введении в формулу значений соответствующих шкал, где за единицу уровня продукции принято значение нормы.
i – значение по шкале ИЛ–4
f – значение по шкале ИЛ–6
t – значение по шкале отношений CD–4/CD–8.
На основании анализа значений индекса и клинико–иммунологических результатов лечения больных ПГ различными методами был разработан следующий алгоритм выбора этиопатогенетической терапии заболевания, направленной на профилактику рецидивов (табл. 3).
Для пролонгированной терапии наиболее эффективными и удобными являются фамцикловир (Фамвир) (по 250 мг два раза в день) и валацикловир (по 500 мг дважды в сутки). Фамцикловир является предшественником пенцикловира и обладает рядом существенных преимуществ по сравнению с ацикловиром: высокое сродство к тимидинкиназе вируса (в 100 раз выше) и более выраженное блокирование репликации вируса между приемами препарата; фамцикловир обладает самой высокой биодоступностью (77% против 10–20% у ацикловира) и самым длительным периодом нахождения в инфицированной вирусом клетке (до 20 часов); постоянная концентрация препарата в инфицированных клетках обеспечивает длительный противовирусный эффект и дает возможность реже принимать препарат; фамцикловир обладает свойством проникать в шванновские клетки, окружающие нервные волокна. В клетках, инфицированных ВЗВ, периоды полувыведения составляют 9 часов для фосфорилированного пенцикловира и 0,8 часа для фосфорилированного ацикловира. Поэтому фамцикловир является единственным противовирусным препаратом, уменьшающий длительность постгерпетической невралгии при опоясывающем лишае (на 100 дней по сравнению с плацебо).
В качестве индукторов интерферона могут использоваться различные препараты данной группы.
Схема вакцинотерапии носит традиционный характер и состоит из двух курсов по 5 внутрикожных инъекций, при разовой дозе 0,2 мл, с интервалами 3–4 дня и двухнедельным перерывом между ними.
Для иммунозаместительной терапии наиболее эффективным препаратом сегодня является интерферон a–2b. Он назначается по одной ректальной свече, содержащей 1 млн МЕ действующего начала, дважды в сутки в течение первого месяца с последующим переходом на дозировку 500000 МЕ по той же схеме, как минимум, еще 5 месяцев.
Несомненным преимуществом данного индекса является объективный подход к назначению лечения больных ПГ. Он исключает предпочтение одних методов терапии другим. Позволяет избегать случаев утяжеления герпесвирусного процесса. Его практическое применение показало, что при подходе к лечению пациента с помощью КИИЭПТ во всех случаях достигается нормализация иммунного статуса. Как следствие этого, наблюдается 100% клинический эффект, чего не удается достичь при выборе терапии без учёта иммунологических особенностей патогенеза заболевания [7].
2. Баринский И.Ф., Шубладзе А.К., Каспаров А.А., Гребенюк В.Н. Герпес:этиология, диагностика и лечение, Медицина, Москва, 1986, 268 с.
3. Сухих Г. Т., Ванько Л. В., Кулаков В. И. Иммунитет и генитальный герпес. Нижний Новгород. 1997, 220 с.
4. Халдин А. А. Простой герпес. Российский журн. кожных и венерических болезней. 2002, №2, с. 42–50.
5. Spruance S.L., Kriesel J.D. Treatment of Herpes Simplex Labials, Herpes, V. 9, № 3, 2002, p. 64 –69
6. Spruance S.L., Jones T.M., Blatter M.M., Oral valaciclovir for the treatment of herpes labialis two trials of early, high–dose, short–course therapy. Antiviral Res., 2002, 53, A. 53.
В результате обобщения собственного опыта авторов и анализа литературы предлагается патогенетически обоснованный алгоритм выбора тактики и стратегии ведения больных рецидивирующим простым герпесом. Алгоритм базируется на выявленных клинико-иммунологических особенностях разных типов течения вирусного процесса, вариабельности иммунопатогенеза обострений инфекции, а также на корреляционной оценке эффективности различных методов лечения и вторичной профилактики инфекции в зависимости от характера и степени выраженности иммунных нарушений, лежащих в основе реактивации возбудителя.
- КЛЮЧЕВЫЕ СЛОВА: герпес, Виферон, Ацикловир, Фамвир
В результате обобщения собственного опыта авторов и анализа литературы предлагается патогенетически обоснованный алгоритм выбора тактики и стратегии ведения больных рецидивирующим простым герпесом. Алгоритм базируется на выявленных клинико-иммунологических особенностях разных типов течения вирусного процесса, вариабельности иммунопатогенеза обострений инфекции, а также на корреляционной оценке эффективности различных методов лечения и вторичной профилактики инфекции в зависимости от характера и степени выраженности иммунных нарушений, лежащих в основе реактивации возбудителя.
Таблица 2. Соответствие типов иммунопатогенеза обострений простого герпеса и терапевтических подходов
Одним из основных практических вопросов, связанных с проблемой простого герпеса (ПГ), в дерматологии продолжает оставаться отсутствие единого подхода к лечению и вторичной профилактике рецидивов инфекции. Несмотря на достаточно большой выбор противогерпетических препаратов, направленных как на купирование обострений, так и на восстановление иммунного контроля над латентным состоянием вируса простого герпеса (ВПГ), их назначение в большинстве случаев остается импирическим. Это, безусловно, отражается на степени эффективности терапии и нередко приводит к дискредитации лекарственных средств. Более того, отсутствие общепризнанных критериев выбора тактики лечения, патогенетически обоснованных подходов к назначению этиотропных или иммунных препаратов не позволяет сегодня реально оценить степень клинической эффективности предлагаемых фармацевтическим рынком лекарственных средств, особенно иммунной направленности.
Мы не раз подчеркивали, что разработка подходов к ведению больных ПГ должна базироваться не только на оценке частоты манифестаций и локализации высыпаний, но и на степени и характере иммунных нарушений, лежащих в основе обострений заболевания, которые достаточно четко коррелируют с тяжестью течения герпесвирусного процесса [3, 4, 6, 7]. Основанием для данного заключения являются выявленные нами особенности иммунных нарушений, в зависимости от частоты рецидивов вирусного процесса, которые легли в основу предложенной в 2000-м г. классификации типов иммунопатогенеза обострений ПГ (табл. 1). Понимание неоднородности нарушений механизмов иммунорезистентности, в результате которых происходит потеря контроля над латентным состоянием ВПГ, позволяет по-новому посмотреть на тактику и стратегию лечения и вторичной профилактики ПГ и предложить патогенетически обоснованный алгоритм ведения больных (табл. 2). Необходимо отметить, что при разработке алгоритма мы учитывали как личный опыт, так и опыт наших коллег, в том числе зарубежных, что позволило аккумулировать два разных подхода (этиотропный и иммунный) в единую концепцию.
Более того, наше отношение к вопросу не как к чисто дерматологической проблеме, а как к системной герпетической болезни, а также многочисленные совместные исследования с психоневрологами, гинекологами, урологами, эндокринологами и другими специалистами дали возможность унифицировать не только терапевтическую тактику, но также объем и направленность обследования пациентов [5, 10, 12].
Основополагающими моментами, лежащими в основе алгоритма, являются клинико-иммунологические критерии выбора стратегии и тактики ведения пациента; клинико-анамнестические признаки, дающие основания для его дополнительного обследования; подход к консультированию и психореабилитации больных ПГ.
Первым этапом работы с пациентом является верификация диагноза. Несмотря на кажущуюся банальность, это далеко не всегда простая задача, так как наряду с типичными формами мы сегодня все чаще сталкиваемся с клиническим патоморфозом ПГ, особенно при его генитальной локализации [6, 8].
К сожалению, лабораторная диагностика ВПГ в настоящее время далека от совершенства. Поэтому в случаях необычных клинических проявлений заболевания лучше отталкиваться от оценки жалоб и анамнеза заболевания. Наиболее важными диагностическими критериями являются наличие предвестников обострения, периодичность возникновения высыпаний и ее приуроченность к одному и тому же локусу кожи или видимых слизистых. Нельзя ориентироваться на кем-то и когда-то выставленный диагноз, врач должен всегда сам убедиться в его правомочности.
В наиболее сложных случаях следует проводить вирусологические тесты. Существенную помощь может оказать и diagnosis ex juvantibus (диагноз на основании оценки результатов примененных лекарств или методов лечения).
Несколько слов следует сказать о так называемом бессимптомном течении ПГ. Диагноз в данном случае базируется исключительно на положительных результатах полимеразной цепной реакции (ПЦР), которая в данном случае малоинформативна, так как может позитивироваться не на сам ВПГ, а на его структурные компоненты, сохраняющиеся неопределенно долго после гибели возбудителя. Более того, незрелые вирионы постоянно присутствуют в организме инфицированного человека, что также может обуславливать положительность ПЦР. По-видимому, такие пациенты требуют динамического наблюдения. Наши зарубежные коллеги в этих случаях рекомендуют лечение противовирусными препаратами, считая, что инфицированные люди являются потенциальными источниками заражения своих половых партнеров. Этот подход представляется дискутабельным, так как пока нет ни одного доказательного исследования в его пользу.
После подтверждения диагноза ПГ, собственно, и начинается индивидуальный выбор тактики и стратегии ведения пациента на основании оценки спектра жалоб, анамнеза заболевания и жизни, а также, при необходимости, лабораторного или иного обследования больного.
Пожалуй, главным в дальнейшей работе становится выяснение тяжести течения вирусного процесса, т.е. частоты обострений в год. В основном мы сталкиваемся с тремя вариантами: легкого течения – 1–2 рецидива в год, умеренной тяжести – 3–4 манифестации вирусного процесса, и с тяжелым проявлением заболевания, когда у пациента наблюдается от 6 до 12 эпизодов инфекции. Таким образом, формируется три основных варианта тактики ведения больных. Варианты имеют свои особенности (см. рис.).
При первом варианте, когда герпетические высыпания возникают не чаще 2 раз в год, терапия больных должна быть направлена исключительно на купирование каждого конкретного обострения. Препаратами выбора в этом случае являются парентеральные формы синтетических ациклических нуклеозидов (Ацикловир, Валтрекс, Фамвир). Местные противовирусные препараты могут назначаться только как вспомогательные средства дополнительно к системной терапии. Необходимо остерегаться назначения необоснованно рекомендуемых иммуномодуляторов с целью купирования рецидивов, независимо от их частоты. Особенно это касается легкого течения вирусного процесса, так как иммунные сдвиги в этих случаях транзиторны и не требуют коррекции, но могут усугубиться при дополнительной нагрузке интерфероногенами. Из иммунных препаратов для ускорения регресса кожных высыпаний можно и целесообразно использовать только рекомбинантные альфа-2-интерфероны (Виферон), которые практически не оказывают иммуностимулирующего эффекта, а действуют вирусопатически на сам ВПГ. Более того, в ряде исследований было показано, что, в частности, Виферон способен усиливать клинический эффект ациклических нуклеозидов [11].
Однако при обращении пациента с легким течением ПГ врач может столкнуться с двумя ситуациями.
В одном случае больной обращается за помощью в самом начале рецидива, в другом – на высоте развития высыпаний. Если мы видим, что вирусный процесс находится в стадии предвестников или инициальных проявлений, то это является прямым показанием к назначению системных противовирусных средств. Когда же кожные высыпания существуют более двух дней, то их назначение будет малоэффективно, так как репликация ВПГ уже произошла. Здесь нужно рекомендовать применение свечей Виферон в сочетании с местной терапией (1% крем Фенистил Пенцивир, гели Веру-Мерц серол и Виферон, мазь Гевизош и др.), что значительно сокращает сроки регресса кожной и субъективной симптоматики. Однако очень важно помнить, что в процессе консультирования необходимо ориентировать пациента на своевременный прием ациклических нуклеозидов при следующем обострении, который необходимо начинать со стадии появления предвестников рецидива.
Второй вариант, когда течение герпесвирусной инфекции характеризуется как умеренное (3–4 раза в год), можно назвать пограничным.
В данных случаях необходим тщательный сбор анамнеза заболевания, который помогает сориентироваться в необходимости и направленности дальнейшего обследования. Здесь важно оценить динамику течения заболевания и его длительность. В том случае, если пациент страдает ПГ несколько лет и обострения изначально имели такую частоту, – это монотонный тип, свидетельствующий о транзиторности иммунных нарушений, и ведение больного должно быть аналогично таковому при легком варианте течения. Более сложными являются ситуации, когда у пациента наблюдается нарастание частоты рецидивов (нарастающий вариант ПГ) или же они появились недавно. В таких случаях необходимо обязательное иммунологическое тестирование (интерфероновый статус и цитокиновый профиль) для выявления степени и характера иммунодефицита. От результатов обследования и зависит выбор терапевтической тактики. Если нет тенденции к формированию вторичного иммунодефицита, то лечение пациента должно ограничиваться этиотропной терапией, если иммунные нарушения носят более выраженный характер, то необходима консультация клинического иммунолога для назначения иммуннотропной терапии, которая направлена не на купирование обострений, а на их профилактику за счет восстановления контроля над латентностью ВПГ.
Третий вариант – тяжелого и крайне тяжелого течения ПГ – наиболее сложный для определения терапевтического подхода. Более того, в данном случае нередко стоит вопрос не только о лечении самого вирусного заболевания, но и о психореабилитации пациента. Единственное, в чем не должен сомневаться в этих случаях врач, это в выборе стратегии – вторичной профилактике рецидивов заболевания. Однако тактические подходы здесь могут иметь два основных варианта: это иммунокоррекция или супрессивная противовирусная химиотерапия (длительная или эпизодическая). Выбор подхода целиком и полностью зависит от результатов иммунологического обследования, целью которого является установление варианта вторичного иммунодефицитного состояния.
Определение варианта иммунопатогенеза ПГ основано на оценке спонтанной и индуцированной выработки двух интерлейкинов (ИЛ) – ИЛ-4 и ИЛ-6 [1, 7]. Немаловажным аспектом являются сроки проведения иммунных тестов. Мы, основываясь на собственных наблюдениях, считаем, что их проведение наиболее целесообразно в межрецидивном периоде, не ранее чем через две недели после стихания очередного обострения. Обоснованием этого является то, что результаты иммунного реагирования на активацию ВПГ носят, безусловно, важный, но малоинформативный характер с позиции дальнейшего лечения. Они не позволяют прогнозировать способность адекватного ответа со стороны иммунокомпетентных клеток и иммунорегуляторных реакций при их следующей нагрузке (вирусом или лечением). Таким образом, только в состоянии относительного покоя, in vitro, мы можем более или менее достоверно оценить как степень иммунодефицита, так и возможную реакцию системы иммунитета на ее лекарственную стимуляцию.
Необходимо сказать и о ситуациях, когда вирусный процесс течет перманентно. Для того чтобы провести обследование, мы настоятельно рекомендуем назначение синтетических ациклических нуклеозидов (Валтрекс, Фамвир) в течение месяца. После того как через две недели на фоне противовирусных средств проводится исследование и получены его результаты, пациент либо остается на длительной супрессивной химиотерапии, либо ему проводится иммунокоррекция.
На основании многолетних кли-нико-иммунологических исследований с одновременной оценкой эффективности различных профилактических подходов мы сегодня можем предложить патогенетически обоснованный выбор терапевтической тактики. Он напрямую зависит от выявленного в результате иммунного тестирования типа иммунопатогенеза ПГ (табл. 2).
Наиболее благоприятным вариантом является вторичный иммунодефицит по Т-клеточному типу. В данном случае методом выбора вторичной профилактики является иммунокоррекция, которая может предусматривать назначение герпетической вакцины, интерфероногенов или кислородно-озоновой терапии. Важно знать и помнить сроки проведения данного профилактического метода лечения – только в межрецидивном периоде, не ранее чем через две недели после купирования обострения.
Пациентам, страдающим ПГ, особенно с часто рецидивирующими формами или с локализацией высыпаний в области гениталий наряду с фармакологической помощью нередко требуется психореабилитация. Существенную помощь в ней оказывает грамотное консультирование больных [2]. Для проведения консультирования врач должен не только знать суть вопроса, т.е. проблему ПГ, но и обладать навыками и владеть инструментами, которые используются с этой целью. Главная задача консультирования по вопросам ПГ – это помощь пациенту в адаптации к нормальной жизни после выставленного диагноза. Необходимо нивелировать эмоции и переживания, постараться убрать фобии, изменить ложные представления о заболевании и научить управлять самим вирусным процессом. Залогом успеха консультирования является установление конфиденциальных доверительных отношений между врачом и больным, базирующихся на высоком профессионализме консультанта.
В заключение следует сказать, что предложенный нами алгоритм ведения больных ПГ уже прошел испытание временем. Мы и ряд наших коллег с успехом применяем его в течение пяти лет, что позволяет рекомендовать его использование в клинической практике более широко, а при обсуждении на соответствующем уровне рекомендовать за основу при последующем составлении протокола лечения больных простым герпесом.
Что такое герпетический стоматит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кожевникова С. Н., стоматолога со стажем в 28 лет.
Над статьей доктора Кожевникова С. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Герпетический стоматит — это инфекционное заболевание, которое вызывает вирус простого герпеса первого типа [6] . Сопровождается лихорадкой, слабостью, головной болью, появлением язв на слизистой полости рта и воспалением региональных лимфоузлов.
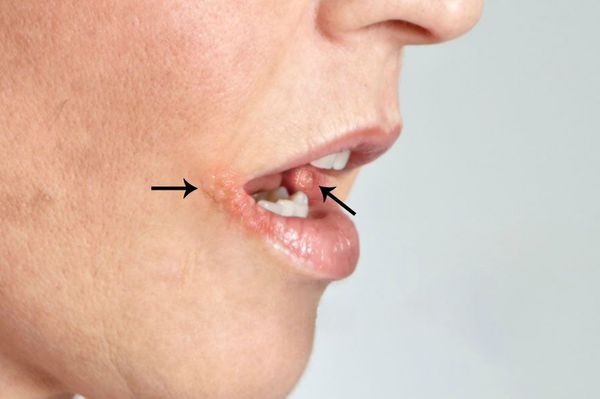
Этот вид стоматита составляет примерно 80 % всех инфекционных стоматитов полости рта. Он возникает чаще у детей, очень редко — у подростков и взрослых. Наиболее распространён в возрасте от 1 до 3 лет (до 70%) [7] . Это связано с расширением контактов у детей в этот период и особенностями местного иммунитета слизистой рта. В этом возрасте у ребёнка исчезают антитела, полученные от матери, которые защищали его в первые месяцы жизни. У каждого седьмого-десятого ребёнка заболевание переходит в рецидивирующую форму.
Вирус простого герпеса распространён по всему миру. Он содержит ДНК, в котором присутствует около 80 генов [6] . Развивается вирус внутри клеток. Во внешней среде при температуре 20-25 ℃ сохраняется в течение суток. При 50 ℃ разлагается через 30 минут. Устойчив к холодным температурам. На различных металлических предметах выживает до двух суток. Неустойчив к действию физических и химических факторов, разрушается под влиянием ультрафиолета и рентгеновских лучей, чувствителен к этиловому спирту и дезинфицирующим средствам [8] .
Герпетический стоматит — заразное заболевание. Источником является больной или бессимптомный носитель. Распространение идёт при непосредственном контакте. Никаких особых ситуаций и факторов для заражения не требуется, потому что вирус распространён повсеместно и контакт с ним происходит в детском возрасте. Большинство взрослых уже инфицированы.
Инкубационный период — скрытое течение болезни до появления его первых признаков — может длиться 2-26 дней, чаще 5-7 дней. Срок инкубации не влияет на тяжесть заболевания [9] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы герпетического стоматита
При лёгкой форме состояние ребёнка удовлетворительное. Инкубационный период не выражен, однако в процессе развития болезни (продромальном периоде) обязательно появляется субфебрильная лихорадка — до 38℃. Других симптомов в этот момент не возникает. Через 1-3 дня слизистая оболочка полости рта краснеет, усиливается слюнотечение. Далее покраснение становится ярче, появляется боль, ребёнок плохо ест и спит. Впоследствии возникают единичные или сгруппированные мелкие язвочки — афты (3-5 штук). Так начинается стадия разгара. Высыпания появляются однократно в течение 1-2 дней. После этого температура снижается, но боль ещё сохраняется, постепенно уменьшаясь. Общее состояние нормализуется, появляется аппетит, улучшается сон. Афты полностью заживают в течении 3-5 дней. Небольшое покраснение слизистой может сохраняться до 10 дней. Иногда увеличиваются шейные и подчелюстные лимфоузлы, но чаще при лёгкой форме этого не происходит. Изменения в крови не характерны.
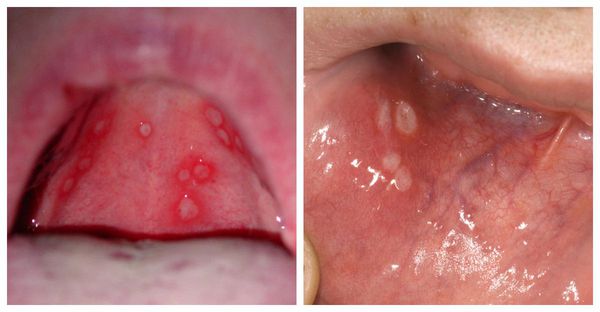
На пике лихорадки и интоксикации появляются изменения на слизистой и коже вокруг рта. На покрасневшей отёчной слизистой возникают афты. Обычно их количество достигает 25-30 штук, элементы могут сливаться. Усиливается слюноотделение, кровоточивость дёсен. После высыпания температура снижается, однако элементы могут появиться повторно вместе с новым подъёмом температуры. Воспаляются лимфоузлы.
Период разгара продолжается до 10 дней. В дальнейшем состояние постепенно улучшается: снижается температура, появляется аппетит, нормализуется сон. Элементы на слизистой и коже заживают. Дольше всего сохраняются покраснение и воспаление лимфоузлов. Появляются изменения в крови: снижается уровень лейкоцитов и увеличивается уровень лимфоцитов, может повыситься СОЭ (скорость оседания эритроцитов).
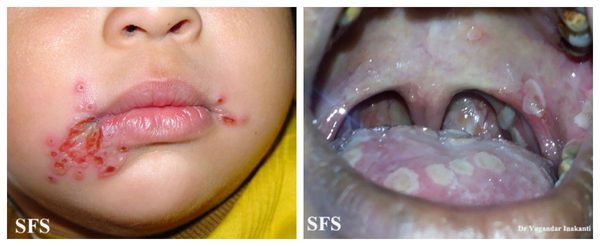
Тяжёлая форма встречается значительно реже. Уже в продромальном периоде у ребёнка выражены все признаки острого инфекционного процесса: вялость, слабость, головная боль, боль в мышцах и суставах. Температура повышается до 40℃. Сразу в первые сутки появляются изменения на слизистой и коже вокруг рта. Губы становятся сухими, слизистая отекает, приобретает ярко красный оттенок, сильно кровоточит, появляется много афт по всей слизистой рта и глотки, а также много пузырьков на коже вокруг рта, мочках ушей и век. Возможно развитие герпетических паронихиев на пальцах рук (гнойных воспалений). В местах слияния элементов имеются некротические (омертвевшие) участки. Высыпания неоднократно появляются снова и снова. Ярко выражено воспаление лимфоузлов. Выздоровление длительное. Наблюдаются изменения крови в виде понижения количества лейкоцитов со сдвигом формулы влево, может быть токсическая зернистость нейтрофилов, повышение СОЭ и С-реактивного белка.
У некоторых детей заболевание переходит в рецидивирующую форму. Последующие рецидивы уже могут протекать менее остро, без значимого нарушения самочувствия и лихорадки, т. к. в крови появляется некоторое количество антител. Но поражение слизистой полости рта будет возникать всегда [4] [5] [6] [7] [9] .
Патогенез герпетического стоматита
Механизм развития острого герпетического стоматита очень сложен и изучен не до конца [4] . Однако известны следующие звенья патогенеза.
В момент заражения вирус простого герпеса прикрепляется к рецепторам мембраны клетки, которая чувствительна к вирусу. Происходит слияние клеточной мембраны и внешней оболочки вируса, при этом клеточная мембрана не повреждается, и вирус проникает внутрь. Затем клеточные ферменты растворяют внутреннюю оболочку вируса, и он проникает внутрь ДНК клетки. В таком состоянии вирус простого герпеса может находиться длительное время [6] .
Прикрепление и размножение вируса, как правило, происходит в клетках местных тканей и близлежащих лимфоузлов. Этим объясняется лимфаденит (воспаление лимфоузлов), который наблюдается ещё до появления афт в полости рта [11] .
В разгар болезни вирус нарушает баланс между свёртывающей и антисвёртывающей системами крови, из-за чего дёсны и слизистая рта могут кровоточить. Предполагается, что эта же причина приводит к образованию микротромбов в капиллярах, из-за чего возникают участки некроза слизистой [11] .
После выздоровления выделение вируса со слюной может продолжаться ещё несколько недель [4] . Он способен сохраняться в нервных ганглиях в течение всей жизни человека. В это период он практически не поддаётся противовирусному лечению. После активации вирус переносится по аксиону в первичный очаг проникновения, из-за чего возникает повторное поражение. Бессимптомное выделение вируса в слюне наблюдается у 5-10 % людей.
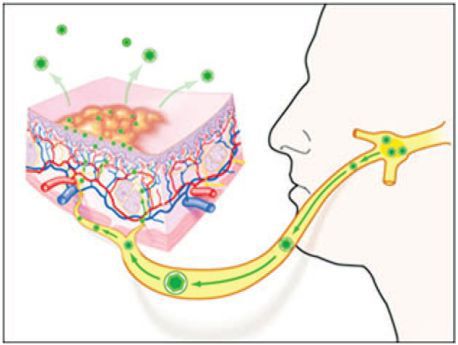
Классификация и стадии развития герпетического стоматита
Согласно Международной классификации болезней (МКБ-10), герпетический стоматит относится к инфекциям, вызванным вирусом герпеса и классифицируется как "В00.2 Герпетический гингивостоматит и фаринготонзиллит" [4] .
По течению бывает острым и хроническим рецидивирующим. При этом острый герпетический стоматит имеет три степени тяжести: лёгкую, среднетяжёлую и тяжёлую. Тяжесть течения болезни оценивается на основе совокупности общих и местных симптомов. К общим симптомам относятся рост температуры, слабость, чувство усталости; к местным — покраснение слизистой и появление афт.
Кроме этого выделяют пять периодов болезни: инкубационный, продромальный, начальный, разгар заболевания и реконвалесцентный — период выздоровления.
Осложнения герпетического стоматита
Как правило, герпетический стоматит не опасен, за исключением его развития у детей с первичным иммунодефицитом, проходящих химиотерапию, принимающих иммуносупрессивную терапию после пересадки органов и тканей, которая направлена на подавление нежелательной реакции иммунитета. У таких детей заболевание протекает в тяжёлой форме. Может сопровождаться кровотечением из слизистой рта и носа.
Наиболее частое осложнение — переход болезни в рецидивирующую форму. Рецидивы могут следовать один за другим, сильно изматывая пациента. Иногда возможны и другие, более серьёзные осложнения:
- герпетический миокардит — учащается пульс, снижается артериальное давление, возникает одышка, лихорадка;
- герпетический менингоэнцефалит — резко поднимается температура, отмечается головная боль, рвота, судороги;
- генерализованная герпетическая инфекция с поражением нескольких органов [4] .
Кроме этого может присоединяться вторичная бактериальная инфекция, бронхит, пневмония, отит, кератит, инфекционно-токсический шок — токсическое поражение мозга вирусом.
Диагностика герпетического стоматита
Диагноз острого герпетического стоматита ставится на основании совокупности данных: анамнеза (истории болезни), клинической картины, течения болезни и результатов лабораторных исследований.
При типичных формах заболевания диагностика трудностей не вызывает, поэтому дополнительные методы не используются. Лабораторная и инструментальная диагностика может помочь в выявлении осложнений либо при возникновении трудностей в диагностике: при нетипичном случае, затяжном течении, генерализованных формах болезни. Для этого могут использоваться следующие методы:
- микроскопический анализ — проводится не раньше второго дня болезни; под микроскопом исследуются мазки, взятые с поражённой слизистой, чтобы определить причину заболевания;
- иммунофлюоресцентный анализ (МФА) — проводится в период появления высыпаний; позволяет определить количество антигенов в крови;
- вирусологическое исследование — проводится в острый период болезни; используется для обнаружения клетки вируса и антигенов в крови;
- молекулярно-генетический метод (ПЦР) — проводится в острый период; помогает определить генотип вируса и верно подобрать способ лечения;
- иммуноцитохимия — проводится в острый период для выявления вируса;
- серологический тест— проводится на 7-10 день болезни, чтобы выяснить срок заболевания;
- исследование цереброспинальной жидкости — может потребоваться при осложнениях, чтобы подтвердить поражение центральной нервной системы;
- клинический анализ крови и мочи — проводится для определения осложнений;
- биохимический анализ крови — проводится в острый период для определения, поражены ли внутренние органы;
- инструментальная диагностика — УЗИ, КТ, МРТ, электроэнцефалография (ЭЭГ), рентгенография, электрокардиография (ЭКГ), офтальмоскопия.

Оценку всех исследований проводит только врач в комплексе с клиническими и анамнестическими данными [5] .
Лечение герпетического стоматита
Лечение пациентов с лёгкими и среднетяжёлыми формами заболевания проводится амбулаторно, т. е. дома, но с регулярным посещением врача. Госпитализации подлежат пациенты с тяжёлыми формами стоматита, осложнениями и генерализованными формами болезни — когда вирус поражает весь организм. Лечение включает в себя соблюдение режима, диеты, местной и общей терапии [5] .
Все пациенты нуждаются в щадящем режиме. Если ребёнок лежит, его нужно обеспечить свежим воздухом, регулярной сменой белья. Если он играет и отказывается от постели, не нужно его укладывать насильно — лучше занять спокойными играми, чтением и т. д. Не следует ходить с больным ребёнком в детский сад, школу, магазины, торговые центры, кинотеатры, детские площадки. Нужно помнить, что заболевание очень контагиозное, и другие дети могут заразиться. Но в период выздоровления прогулки на свежем воздухе отдельно от других детей возможны.
Помещение, где находится ребёнок, должно проветриваться 3-4 раза в день, необходима ежедневная влажная уборка. Также ребёнок нуждается в более продолжительном сне. Но если он спит почти весь день и с трудом просыпается или наоборот почти не спит, то требуется дополнительный осмотр врача.
А вот отказ от еды не так страшен. Приём пищи становиться для очень болезненным, поэтому не следует настаивать и тем более кормить ребёнка насильно. Стоит предлагать жидкую пищу, кашу, кисель, протёртые супы.
Важно заняться профилактикой обезвоживания. Маленькие лихорадящие дети очень быстро обезвоживаются, это усиливает интоксикацию и утяжеляет состояние. Поэтому необходимо обильно поить ребёнка. Стоит предлагать любые жидкости: воду, компот, чай, разведённые соки без сахара. Количество выпитой жидкости должно быть не меньше 1,5-2 литров. Если есть рвота или ребёнок отказывается от питья, нужно выпаивать его по чайной ложке каждые 5-7 минут.
Также немаловажную роль играет обезболивание. В разгар заболевания пациенты испытывают сильные головные боли и боли во рту. Для обезболивания чаще используют парацетамол и ибупрофен. Доза рассчитывается в зависимости от массы тела, препараты можно чередовать.
Лихорадку выше 38,5℃ у маленьких детей, у детей с фебрильными судорогами в анамнезе или при плохой переносимости следует сбить. Лихорадку выше 39,5℃ нужно снизить у всех пациентов. Если при приёме жаропонижающего средства температура снизилась хотя бы на градус — это хорошо, но если не снизилась или поднялась ещё выше, то требуется дополнительный осмотр врача.
При лёгкой степени тяжести вполне можно обойтись местным лечением. Для этого необходима тщательная гигиена полости рта, полоскание или обработка антисептическими растворами, которые не содержат спирт: фурацилин 1:5000, 2 % водный раствор хлоргексидина и т. д. Для обработки афт используется мазь ацикловир — 3 % для слизистых, 5 % для кожи. Примерно с третьего дня болезни добавляются заживляющие средства на основе масляного раствора витамина А, облепиховое масло, аекол, солкосерил. Местное лечение проводится 5-6 раз в день до полного заживления элементов поражения.
ВАЖНО: применение местных обезболивающих препаратов на основе лидокаина не рекомендуется детям до 12 лет [5] . Использование местных аэрозольных антисептиков при остром герпетическом стоматите также нежелательно.
При среднетяжёлых формах одного местного лечения недостаточно. Добавляется общее противовирусное лечение. Для этого у детей используют ацикловир и валацикловир (валтрекс). Первый препарат применяется в возрастной дозировке 5 раз в сутки — это важно. Валтрекс же применяется 2 раза в сутки, что удобнее.
ВАЖНО: препараты интерферонов (виферон, генферон, циклоферон), а также гомеопатические противовирусные средства (анаферон, афлубин) и иммуномодуляторы (имудон, тимоген, ликопид) не показаны, так как их эффективность и безопасность при лечении инфекций, вызванных вирусами герпеса, не доказана.
Рецидивирующие формы требуют дополнительного осмотра врача и назначения пролонгированного курса противовирусного лечения.
Тяжёлые и осложнённые формы болезни лечатся в профильном стационаре, так как амбулаторное лечение будет малоэффективным [1] [2] . Предполагает приём противовирусных средств в форме таблеток и инъекций, дезинтоксикационную терапию, восполнение потерянной жидкости и электролитов, внутривенную подачу необходимых растворов [11] .
Стоит помнить, что острый герпетический стоматит — это заболевание, вызванное вирусом. Поэтому в рутинных случаях не требует назначения антибиотиков, даже если лихорадка длится более трёх суток — это типичное состояние для болезни.
Прогноз. Профилактика
Прогноз заболевания в подавляющем большинстве случаев благоприятный. Герпетический стоматит заканчивается полным выздоровлением, но при этом вирус остаётся с человеком на всю жизнь. В 7-10 % случаев заболевание переходит в рецидивирующую форму. При герпетических менингоэнцефалитах и генерализованных формах прогноз крайне неблагоприятный, требуется обязательное лечение в стационаре [3] .
Профилактика герпетического стоматита заключается в соблюдении простых мер гигиены: мытье рук, проветривании помещений, соблюдении режима сна, закаливании, сбалансированном питании. Заболевшие дети должны быть изолированы. Взрослым с герпетическими высыпаниями на губах не рекомендуется целовать детей, пробовать пищу, облизывать ложку, соску. При контакте с ребёнком необходимо надевать маску. В детских учреждениях, где имеется вспышка или единичные случаи заболевания, необходимо провести дезинфицирующую уборку помещения и игрушек, организовать ежедневный осмотр детей [4] .
Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии Минздравсоцразвития России, Екатеринбург
ФГУ Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии Минздравсоцразвития РФ, Екатеринбург
Герпес-вирусная инфекция в дерматологии: проблемы и современный подход к лечению
Журнал: Клиническая дерматология и венерология. 2015;14(5): 117‑124
Представлены современные данные литературы об особенностях клинических проявлений герпесвирусной инфекции в дерматологии: рецидивирующего фациального и лабиального герпеса, опоясывающего лишая, герпетической экземы, герпес-вирусассоциированной полиморфной экссудативной эритемы. Изложены основные принципы и схемы противовирусной терапии, представлен собственный опыт эффективной терапии заболеваний, вызванных вирусом простого герпеса, препаратом валацикловира (Валвир).
Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии Минздравсоцразвития России, Екатеринбург
ФГУ Уральский научно-исследовательский институт дерматовенерологии и иммунопатологии Минздравсоцразвития РФ, Екатеринбург
В настоящее время герпес-вирусная инфекция (ГВИ) крайне широко распространена в человеческой популяции в связи с пантропностью вирусов и их высокой инвазивностью [1, 2]. Среди всех герпес-вирусов наиболее часто встречаются члены подсемейства Alphaherpesvirinae: вирус простого герпеса 1-го и 2-го типов (ВПГ-1 и ВПГ-2; Herpes simplex virus-1 и Herpes simplex virus-2), вызывающие фациальные (лабиальные, орофациальные) и генитальные поражения кожи и слизистых, а также вирус Varicella zoster (Human herpesvirus-3), являющийся этиологическим фактором ветряной оспы и опоясывающего лишая [2—4].
По данным ВОЗ, до 95% жителей планеты инфицированы ВПГ-1 и ВПГ-2, причем имеющиеся данные указывают на прогрессирующий рост заболеваемости в большинстве стран Европы и Америки, опережающий темпы прироста населения. Эпидемиологические и серологические исследования показывают, что распространенность инфицированности ВПГ-2 в мире достигает 400 млн человек, из них около 267 млн женщин и до 150 млн мужчин [3].
В прошлом существовало мнение об избирательном поражении ВПГ-1 исключительно области лица, а ВПГ-2 — наружных половых органов, однако в последние десятилетия были получены новые данные: ВПГ-1 вызывает оролабиальный герпес лица в 80—90% случаев, а ВПГ-2 — в 10—20%. Результаты проведенных исследований показали, что к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами вируса герпеса [1].
Пациенты с кожными проявлениями герпетической инфекции часто встречаются в практике дерматовенеролога, при этом основными нозологическими формами являются простой герпес кожи и слизистых, в том числе и с рецидивирующим течением; опоясывающий лишай, вызванный вирусом герпес зостер; реже — вирусные осложнения у больных атопическим дерматитом и другими дерматозами, именуемые герпетиформная экзема Капоши или варицеллеформный пустулез, острый оспенновидный пустулез Юлиусберга.
Рецидивирующие формы лабиального герпеса
Рецидивирующими формами герпеса страдают от 10 до 20% населения, а ежегодный прирост составляет 15—17%. По данным зарубежных исследований [5, 6], только у 20% инфицированных вирусом герпеса установлено это заболевание, у 60%, несмотря на явные симптомы, герпес остается нераспознанным, а у 20% лиц он протекает бессимптомно.
По данным S. Pierre и соавт. [6], рецидивирующий простой герпес (РПГ) встречается у 57,7% пациентов, инфицированных ВПГ в возрасте 14—49 лет. Большинство пациентов с РПГ имеют менее двух эпизодов в год, но у 5—10% больных высыпания рецидивируют более 6 раз в год. Частые рецидивы герпетических высыпаний на коже лица и шеи, боль, зуд, ознобы и слабость в продромальном периоде снижают качество жизни пациентов с РПГ. При проведении параллельного наблюдательного исследования у больных РПГ в США и Франции установлено, что при возникновении в течение года не более чем четырех эпизодов РПГ 67,0—68,0% больных отмечали снижение параметров качества жизни, а в подгруппах с более частым рецидивированием заболевания (6 раз год и более) такие изменения фиксировали уже 78,0—90,0% пациентов. Авторы [7] отмечают, что лечение по рекомендации врачей получают в США 63% пациентов с РПГ с обострениями более 6 раз в год, а во Франции — только 46,0%, остальные больные следуют советам фармацевтов или прибегают к самолечению.
Современные рекомендации по лечению РПГ с фациальной и лабиальной локализацией указывают на рациональность эпизодической терапии короткими курсами системными противовирусными препаратами и назначения пролонгированных курсов терапии (супрессивная терапия) при частоте рецидивов более 6 раз в течение 1 года [7, 8].
Герпетиформная экзема Капоши (варицеллеформный пустулез)
Герпетиформная экзема (ГЭ) — это диссеминированная ГВИ, вызванная ВПГ и осложняющая течение атопического дерматита (АтД) или экземы, а также буллезных хронических дерматозов, ожогов II—III степени тяжести, болезни Дарье, грибовидного микоза, синдрома Сезари [9, 10].
При ГЭ высыпания дебютируют в области кожи лица, но быстро диссеминируют, часто присоединяется пиодермия, нарушается общее состояние больных до среднетяжелого и тяжелого, развивается гипертермия, лимфаденопатия. ГЭ, как правило, возникает у пациентов с АтД в возрасте 10—30 лет преимущественно на фоне распространенного кожного процесса. Установлено, что ГЭ чаще развивается у больных, недостаточно активно и правильно лечившихся по поводу АтД. Пациенты с ГЭ чаще страдают рецидивирующими вторичными пиодермиями и контагиозным моллюском по сравнению с лицами, не имеющими экземы Капоши: 78% против 8% [11]. Показано, что у ГЭ-позитивных больных АтД наблюдаются более значимые изменения в системном иммунитете, значимо высокое содержание в сыворотке крови иммуноглобулина Е, более супрессированы антимикробные пептиды эпидермиса [9, 10, 12].
Герпес и полиморфная экссудативная эритема
Полиморфная экссудативная эритема (ПЭЭ) — острое реактивное заболевание кожи и слизистых оболочек, развивающееся в ответ на действие инфекционных агентов (бактерии, грибы, вирусы), медикаментов (сульфаниламиды, пенициллины, барбитураты, аллопуринол, фенилбутазон), а также при системных аутоиммунных и онкогематологических заболеваниях. В последние годы обоснованно считают, что причиной части случаев ПЭЭ является персистирующая инфекция ВПГ, которая проявляется рецидивами лабиального герпеса, однако может быть бессимптомной. Подобные случаи выделены в особую разновидность заболевания и получили наименование герпес-ассоциированная ПЭЭ (НАЕМ, herpes-associated erythema multiforme). Доказательством этиологической роли ВПГ в ПЭЭ служит обнаружение ДНК ВПГ-1 и ВПГ-2 методом полимеразной цепной реакции (ПЦР) в биоптатах кожи у 60% из числа обследованных пациентов с НАЕМ, причем у 66,7% больных обнаружили ВПГ-1, у 27,8% — ВПГ-2, у 5,6% — оба типа вируса. Показано, что НАЕМ рецидивирует у 20—25% пациентов, при этом число рецидивов составляет от 4 до 24 в течение года [13—15]. Так, R. Osterne и соавт. [14] описывают случай рецидивирующей трижды в течение года HAEM у подростка, протекавшей с выраженным нарастанием тяжести процесса в отсутствии противовирусной терапии.
Герпес у спортсменов
Опоясывающий герпес
Опоясывающий герпес (ОГ), или опоясывающий лишай — спорадическое заболевание, представляющее собой реактивацию латентной вирусной инфекции, вызванной вирусом герпеса 3-го типа, поражающее преимущественно кожный покров и нервную систему, в отдельных случаях — конъюнктиву и роговицу [19]. Заболеваемость О.Г. увеличивается среди лиц старших возрастных групп (после 60 лет), рецидивы заболевания возникают примерно у 5,0% переболевших, часто сопровождаются формированием постгерпетической нейропатии (ПГН). Риск возникновения ОГ увеличен у пациентов с хроническими заболеваниями, такими как ревматоидный артрит и другие аутоиммунные поражения, обструктивные заболевания легких, заболевания почек, сахарный диабет 1-го типа, лимфопролиферативные заболевания, причем сочетание нескольких факторов риска особенно значимы для пациентов более молодого возраста. Наиболее часто ОГ развивается у больных с онкопатологией, иммунокомпроментированных субъектов, инфицированных ВИЧ, пациентов, получающих системную иммунодепрессивную терапию [20]. Данные исследований показали, что среди дерматологических больных частота верификации ОГ (на 1000 пациенто-лет) составляет 8,03%, тогда как у больных раком и системной красной волчанкой — 11,7 и 15,2% соответственно. По данным S. Chen и соавт. [21], к числу контингента лиц с высоким риском развития ОГ относятся и больные псориазом, для которых характерны девиации клеточно-опосредованного и гуморального звеньев иммунитета, а также пациенты, использующие иммунодепрессивные и цитостатические препараты, фотохимиотерапию. Значимым является факт более частого развития ОГ у больных псориазом, получавших иммунодепрессивную терапию, с повышением показателя до 10,8%. Отмечено нарастание частоты ОГ у пациентов с псориазом в старшей возрастной группе и, как следствие, при увеличении длительности заболевания. Так, в группе больных псориазом старше 65 лет частота диагностирования ОГ достигает 15,4% [20—22]. В работе G. Shalom и соавт. [22] представлены результаты оценки риска развития ОГ у больных псориазом, получающих системную терапию. Авторы отмечают увеличение такого риска при сочетании генно-инженерных биологических препаратов с метотрексатом. Рекомендации по лечению ОГ у больных с другой патологией кожи однозначно указывают на необходимость проведения системной противовирусной терапии, с момента установления диагноза и желательно в первые 72 ч. Выбор противовирусного препарата и пути его введения, госпитальный или амбулаторный режим лечения, длительность терапии определяются клиническими особенностями процесса, тяжестью заболевания [23, 24].
Подходы к терапии герпес-вирусной инфекции кожи
В настоящее время для лечения больных ГВИ общепризнана необходимость противовирусной химиотерапии с использованием ациклических нуклеозидов — высокоспецифичных препаратов, обладающих доказанным противовирусным эффектом. В группу ациклических нуклеозидов входят ацикловир, валацикловир и фамцикловир. Первым из противовирусных препаратов был синтезирован ацикловир, модифицированный аналог компонента ДНК вируса. Для приобретения биологической активности в организме ацикловир проходит три этапа фосфорилирования, в результате которых образуется ацикловир-трифосфат, конкурентно подавляющий вирусную ДНК-полимеразу.
Для этиотропной терапии герпетической инфекции используют следующие схемы назначения валацикловира:
— терапию первичной герпетической инфекции, направленную на купирование острых проявлений и предотвращение распространения процесса;
— терапию рецидива (эпизодическая терапия), позволяющую предупреждать рецидивы инфекции и купировать уже возникшее обострение;
— терапию межрецидивную, эпизодическую супрессивную (пролонгированную) терапию, проводимую для предотвращения рецидива при воздействии известного и ожидаемого триггера обострения ГВИ;
— терапию межрецидивную, профилактическую супрессивную длительную, назначаемую при крайне частых рецидивах заболевания, эффективно снижающую частоту рецидивов и предотвращающую передачу ВПГ партнеру;
— однодневную терапию, обеспечивающую радикальное купирование проявлений лабиального герпеса в течение 1 сут.
Препарат Валвир, в отличие от оригинального валацикловира, выпускается в форме таблеток, покрытых пленочной кишечно-растворимой оболочкой, которая защищает действующее вещество от разрушения в кислой среде желудка. Валвир выпускается в дозировке 500 и 1000 мг, при этом новая дозировка в 1000 мг выпущена в 2014 г., и в настоящее время препарат Валвир в дозе 1000 мг — единственный на рынке.
Опыт лечения больных различными формами ГВИ кожи с использованием препарата Валвир (рис. 1, а, б; рис. 2, а, б; рис. 3, а, б; рис. 4, а, б).

Рис. 2. Опоясывающий герпес у больной В., 72 лет. До терапии — а и после лечения препаратом Валвир — б.

Рис. 3. Опоясывающий герпес у больной Н., 69 лет. До лечения — а, б; в, г — после 7-дневного курса терапии препаратом Валвир.

Рис. 4. Опоясывающий герпес у больной К., 58 лет. До лечения — а, б, в; после терапии препаратом Валвир — г, д, е.
Клинико-анамнестические данные о группе пациентов с ГВИ представлены в табл. 1.

Таблица 1. Клинико-анамнестические характеристики наблюдаемых больных с различными формами ГВИ кожи
Пациентам с РПГ (лабиальные, фациальные локализации) в случае умеренного количества рецидивов было назначено лечение препаратом Валвир в дозе 500 мг 2 раза в день в течение 5 дней, пациенту с выраженными первичными проявлениями герпеса (отек, гиперемия, везикулы на коже губы и в углах рта) была проведена однодневная экспресс-терапия в дозе 2000 мг, разделенные на 2 приема.
При ОГ пациентам назначали Валвир в дозе 1000 мг 3 раза в сутки в течение 7—14 дней, больным герпетиформной экземой — по 500 мг 2 раза в день в течение 7—10 дней. Лечение герпес-ассоциированной ПЭЭ проводили в режиме длительной супрессивной терапии по 500 мг в день в течение 4 мес. Все пациенты в процессе лечения и после его окончания находились под наблюдением, проходя ежемесячные клинические осмотры.
В табл. 2 представлены клинико-катамнестические данные результативности проведенной терапии.

Таблица 2. Эффективность терапии препаратом Валвир (на основании данных клинического мониторирования больных ГВИ)
Приведенные результаты мониторирования пациентов с различными формами ГВИ, получавшими терапию препаратом Валвир, свидетельствуют о его высокой клинической эффективности: отмечалось быстрое купирование остроты процесса и эпителизации вторичных эрозивных проявлений, значимое уменьшение субъективных симптомов, а также отсутствие ПГН, уменьшение частоты и тяжести последующих рецидивов.
Клинические наблюдения
Больная С., 60 лет, с диагнозом: рецидивирующий простой герпес (рис. 1). Больна в течение 3 лет, отмечает рецидивы ежемесячно. Методом ПЦР обнаружен ВПГ-1. Проведено лечение препаратом Валвир по 1000 мг в сутки в течение 5 дней. После курса лечения рецидивов в течение 6 мес не отмечали.

Рис. 1. Рецидивирующий простой герпес у больной С., 60 лет. До лечения — а, б и после лечения — в, г.
Больная В., 72 лет, с диагнозом: опоясывающий герпес (рис. 2). Больна более 6 мес: впервые высыпания появились после офтальмологической операции, сопровождались ярко выраженным болевым синдромом. После постановки диагноза пациентке было проведено лечение препаратом Фамвир в дозе 500 мг ежедневно в течение 21 дня. Женщина отмечала регулярное появление единичных пузырьков и выраженную болезненность. Больной был назначен 7-дневный курс лечения препаратом Валвир в суточной дозе 1000 мг. После терапии отмечен полный регресс высыпаний, отсутствие ПГН.
Больная Н., 69 лет, с диагнозом: опоясывающий герпес (рис. 3). Дебют заболевания произошел на фоне ОРВИ, отита правого уха (сохранялся субфебрилитет). Лечение препаратом Валвир (по 1000 мг 3 раза в день) было начато на 3-й день и продолжалось 7 дней.
Больная К., 58 лет, с диагнозом: опоясывающий герпес (см. рис. 4). Пациентка страдает хроническим лимфолейкозом. Лечение препаратом Валвир (по 1000 мг 3 раза в день) по поводу ОГ было начато на 7-й день от первых признаков заболевания и продолжено в течение 7 дней. Отрицательной динамики в общем состоянии и показателях гемограммы не отмечалось.
Заключение
Тяжелые и рецидивирующие формы ГВИ кожи распространены и часто встречаются в практике дерматолога.
Частые рецидивы заболевания значимо влияют на качество жизни пациентов, требуют обоснованной патогенетической противовирусной терапии.
Препарат валацикловир (Валвир) является особой транспортной формой ацикловира, содержит L-валин и лучше усваивается в желудочно-кишечном тракте, чем ацикловир.
Валацикловир (Валвир) блокирует размножение вируса, предотвращая появление новых герпетических высыпаний на коже.
Апробированы дифференцированные схемы терапии заболеваний кожи, вызванных ВПГ-1 и ВПГ-2 и Varicella zoster, препаратом валацикловира (Валвир), в том числе терапии в течение 1 дня. Собственные клинические наблюдения свидетельствуют о хорошей клинической эффективности и переносимости препарата Валвир в терапии различных форм герпес-вирусных инфекций.
Читайте также:

