Противовирусные препараты и билирубин
Обновлено: 25.04.2024
Учитывая роль печени в метаболизме химических веществ, можно априори утверждать, что не существует лекарств, которые в определенных условиях не вызывали бы повреждения печени. Многочисленные сведения о гепатотоксическом действии многих лекарственных
Учитывая роль печени в метаболизме химических веществ, можно априори утверждать, что не существует лекарств, которые в определенных условиях не вызывали бы повреждения печени. Многочисленные сведения о гепатотоксическом действии многих лекарственных препаратов позволяют сделать вывод, что медикаментозные поражения печени — одна из важнейших проблем гепатологии.
Патогенез медикаментозных поражений печени, несмотря на многочисленные исследования, изучен недостаточно. Выделяют три механизма медикаментозного поражения печени:
- прямое токсическое действие препарата на клетки печени;
- оксическое действие метаболитов лекарственных средств;
- иммуноаллергические поражения печени.
Прямое токсическое действие препаратов на гепатоциты в настоящее время встречается крайне редко, вследствие ужесточения контроля за побочным действием лекарственных препаратов. В качестве примера лекарственного средства, вызывающего подобные негативные эффекты, можно привести препарат галотан.
Токсическое действие метаболитов лекарственных средств можно представить в следующей последовательности: первая фаза — метаболизм лекарственных препаратов; вторая фаза — биотрансформация лекарственных метаболитов; экскреция продуктов биотрансформации с желчью или мочой.
Первая фаза. Основная система, метаболизирующая лекарства, расположена в микросомальной фракции гепатоцитов — гладкой эндоплазматической сети (рис. 1). К ней относятся монооксигеназы со смешанной функцией, цитохром С — редуктаза, цитохром Р450. Кофактором служит восстановленный НАДФ в цитозоле. Лекарства подвергаются гидроксилированию или окислению, что обеспечивает усиление их поляризации.
Система гемопротеинов Р450, расположенная в эндоплазматической сети гепатоцитов, обеспечивает метаболизм лекарств. При этом образуются токсичные метаболиты. Идентифицированы по меньшей мере 50 изоферментов системы Р450, и нет сомнений, что на самом деле их еще больше. У человека метаболизм лекарств обеспечивают цитохромы, относящиеся к трем семействам: P450-I, P450-II, P450-III (см. рис. 1).
Увеличение содержания ферментов системы цитохрома Р450 в результате индукции приводит к повышению выработки токсичных метаболитов. Когда два активных препарата конкурируют за один участок связывания на ферменте, метаболизм препарата с меньшей аффинностью замедляется и срок его действия увеличивается. Этанол индуцирует синтез Р450-II-Е1 и тем самым увеличивает токсичность парацетамола (рис. 1). Повреждение клеток печени редко бывает обусловлено самим лекарственным препаратом. Токсичность парацетамола увеличивается и при лечении изониазидом, который также индуцирует синтез Р450-II-Е1. Некроз наиболее выражен в зоне 3, где отмечается самая высокая концентрация ферментов, метаболизирующих лекарства (рис. 2).
Вторая фаза. Механизм действия биотрансформации состоит в конъюгации метаболитов лекарственных препаратов с мелкими эндогенными молекулами. Обеспечивающие ее ферменты неспецифичны для печени, но обнаруживаются в ней в высоких концентрациях.
Продукты биотрансформации лекарств могут выделяться с желчью или с мочой. Способ выделения определяется многими факторами, некоторые из них еще не изучены. Высокополярные вещества, а также метаболиты, ставшие полярными после конъюгации, выделяются с желчью в неизмененном виде.
Иммуноаллергические поражения печени связывают с метаболитом, который может оказаться гаптеном для белков клеток печени и вызвать их иммунное повреждение. При наличии генетического дефекта в печени лекарство превращается в токсический метаболит, ковалентно связывается с клеточным белком (глутатионом), приводя к некрозу гепатоцита, а также стимулирует образование антигена (гаптена) и сенсибилизирует Т-лимфоцит, который запускает иммунную гепатотоксичность. Повторная экспозиция (назначение лекарственного препарата) приводит к усилению иммунной реакции.
В этом процессе могут участвовать ферменты системы Р450. На мембране гепатоцитов имеется несколько изоферментов Р450, индукция которых может привести к образованию специфических антител к иммунному повреждению гепатоцита.
Идиосинкразия к диуретикам и тиениловой кислоте сопровождается появлением аутоантител, взаимодействующих с микросомами печени.
Лекарственные поражения печени могут развиваться в зависимости от свойств лекарственного препарата, особенностей больного и прочих факторов. Известно, что вероятность побочных реакций возрастает с увеличением количества одновременно принимаемых лекарств. Установлено, что, если больной принимает одновременно шесть или более препаратов, вероятность побочных воздействий у него достигает 80%.
Беременность, стресс, бедное белками питание увеличивают риск проявления токсичности медикаментов. Медикаменты, которые являются энзиматическими индукторами, могут потенцировать действие другого препарата. Так, риск развития гепатита увеличивается у больных, принимающих одновременно с изониазидом рифампицин. При этом гепатиты возникают в 5–8% случаев, тогда как при монотерапии изониазидом — в 1,2% случаев, а при монотерапии рифампицином — в 0,3%.
Примеры взаимодействия лекарственных препаратов, обусловленного индукцией ферментов печени, представлены на рисунке 3.
До настоящего времени отсутствуют четкие критерии клинико-лабораторной и морфологической диагностики лекарственных гепатитов, недостаточно выяснены вопросы патогенеза, нет единой классификации и не разработаны адекватные подходы к лечению.
Гепатотоксический эффект лекарственных препаратов может быть дозозависимым, т. е. проявляющимся при приеме большого количества того или иного препарата, и дозонезависимым, связанным с идиосинкразией; могут быть также поражения печени без нарушения пигментного обмена. На рисунке 4 представлены фармакотерапевтические группы лекарственных препаратов, способных вызывать желтуху. Применение препаратов из представленных фармакотерапевтических групп при определенных условиях может повлечь за собой поражения печени без желтухи.
Острые медикаментозные гепатиты подразделяются на цитолитические, холестатические и смешанные формы, сочетающие признаки холестаза и цитолиза. Фактором, способствующим переходу гепатита в хронический, является длительный прием лекарств.
Современную классификацию лекарственных реакций печени представляет Ш. Шерлок (табл.).
Также известны пять форм медикаментозной патологии печени: изолированное повышение уровня аминотрансфераз; гепатит, протекающий с желтухой; псевдохирургические формы гепатита; тяжелые формы гепатита; хронический гепатит.
В большинстве случаев осложнения со стороны печени реализуются изолированным повышением уровня аминотрансфераз, без отчетливых клинических проявлений, или сопровождаются астеническим синдромом. Бессимптомное повышение уровня аминотрансфераз может наблюдаться при использовании таких лекарственных средств, как изониазид, допегит, амиодарон. При повторном приеме перечисленных препаратов могут развиться тяжелые гепатиты со смертельным исходом. Поэтому на изолированное повышение активности аминотрасфераз необходимо обращать внимание, так как оно может свидетельствовать о развитии лекарственной патологии печени. Диапазон клинических проявлений лекарственных гепатитов разнообразен — от небольшого повышения уровня аминотрансфераз, не сопровождающегося клинической симптоматикой, до молниеносных форм гепатита и развития циррозов. У человека лекарственные поражения могут напоминать почти все существующие заболевания печени.
Лекарственные гепатиты, сопровождающиеся желтухой, способны протекать по цитолитическому, холестатическому или смешанному варианту. В ряде случаев может развиваться псевдохирургическая симптоматика (боли в животе, лихорадка, желтуха, увеличенный желчный пузырь). К лекарствам, вызывающим острую псевдохирургическую симптоматику, относятся цитостатики, антидепрессанты, антиаритмические препараты.
Диагностика медикаментозных гепатитов представляет сложную проблему. Предлагается несколько критериев, позволяющих уточнить диагноз и подтвердить, что возникшие симптомы вызваны именно лекарствами: хронология возникновения осложнений; регресс клинической симптоматики после отмены лечения; рецидив осложнения после повторного введения препарата; отсутствие другой возможной этиологии; результаты лабораторно-инструментальных исследований.
Хронологический критерий очень показателен, хотя время появления осложнений после приема лекарства варьирует — от нескольких дней (иногда часов) до нескольких недель и месяцев. В случае полипрагмазии хронологический фактор очень трудно оценить.
Регресс клинических признаков осложнения после отмены лечения — довольно четкий диагностический признак. Регресс может быть длительным (более месяца), при этом учитывается нормализация уровня аминотрансфераз. При повторном применении лекарства, ранее уже вызвавшего гепатит, рецидив осложнения рассматривается как результат действия данного лекарства.
В ряде работ указывается на необходимость дифференциальной диагностики между медикаментозными гепатитами и вирусными гепатитами, гепатомой, первичным билиарным циррозом печени, алкогольным гепатитом. Кроме того, важно исключить поражение печени вследствие тяжелого инфекционного заболевания, шока, сердечно-сосудистой недостаточности, глистных инвазий, заболеваний желчных путей.
К исследованиям, позволяющим проводить дифференциальную диагностику лекарственного гепатита с другой возможной патологией печени, относятся биохимические исследования сыворотки крови (спектр печеночных ферментов), иммуноферментный анализ (маркеры вирусных гепатитов и опухолевого процесса) и инструментальные методы исследования (УЗИ, КТ, лапароскопия с биопсией печени, ЭРХПГ).
Интенсивная желтушная окраска кожи и слизистых оболочек является симптомом, требующим срочной госпитализации больного для выяснения причины желтухи. Необходимость точного этиологического диагноза объясняется большим диапазоном взаимоисключающих мероприятий при желтухах различного происхождения.
Для коррекции лекарственных поражений средней и тяжелой степени тяжести рекомендовано использовать гепатопротекторы, основной функцией которых является предохранение печеночных клеток от повреждающего воздействия увеличенного количества продуктов распада, образующихся при интенсивных физических нагрузках у профессиональных спортсменов.
Наиболее распространены гепатопротекторы: гептрал, метионин, карсил, эссенциале, урсосан, глутоксим, берлитион 300 ЕД, эссливер форте. Условно к этой группе можно отнести препараты животного и растительного происхождения: сирепар, лив.52, хофитол, гепабене, тыквеол, способствующие синтезу печеночных клеток и восстановлению нарушенных функций печени, а также бетаин (Ц. Б. Б.), коферменты, коэнзимы, витамин Е.
Гептрал (адеметионин) обладает детоксикационным, регенерирующим, антиоксидантным, антифибринизирующим, нейропротективным эффектом, действует как метаболический субстрат важнейших биохимических реакций в организме. Прием: 2–4 таблетки в течение 2–4 нед.
Эссенциале форте — комбинированный препарат, основным действующим веществом которого являются эссенциальные фосфолипиды, а также сбалансированный набор витаминов. Прием эссенциале способствует восстановлению поврежденных тканей печени, нормализации активности печеночных ферментов. При значительных мышечных нагрузках предохраняет печень от повреждения. Назначают по 2 капсулы 2–3 раза в день или по 2 ампулы в день (введение внутривенное) в течение 2–3 нед.
Карсил (аналог — легалон) — препарат на растительной основе (действующее начало — силимарин). Стабилизирует клеточную мембрану, восстанавливает поврежденные клетки печени. Назначают по 1 драже 3 раза в день в период интенсивных тренировочных нагрузок и увеличенного потребления белка.
Ц. Б. Б. — цитрат бетаина Бофур — в его состав входит бетаин и цитрат (анион лимонной кислоты). Бетаин — это аминокислота, присутствующая в печени и почках человека, основной липотропный фактор. Цитрат представляет собой важное звено в цикле трикарбоновых кислот (цикл Кребса).
Инозин, рибоксин способствуют синтезу нуклеиновых кислот, улучшению метаболизма печеночных клеток.
Препараты растительного и животного происхождения оптимально назначать при наличии патологии желчевыводящих путей — дискинезиях, холециститах.
Наиболее оправданно в коррекции ятрогенных поражений печени использовать медикаменты, содержащие в своем составе адеметионин, который обладает антитоксическими и гепатопротективными свойствами. Лечебный эффект адеметионина (гептрала) заключается во внутриклеточной реакции синтеза глутатиона. Глутатион же, как известно, предупреждает повреждения печени. При достаточном количестве глутатиона гепатоцит наименее подвержен токсическому действию метаболитов лекарственных препаратов, а при определенных условиях может происходить даже их детоксикация.
Синтез глутатиона при введении адеметионина в виде медикамента гептрала в суточной дозе 800 мг в течение 7–14 дней внутривенно, с переходом к приему в таблетированной форме по 400–800 мг (1–2 табл.) в течение 14 дней приводит к восстановлению функции печени и нормализации клинико-лабораторных признаков лекарственных повреждений.
Таким образом, диагностика лекарственных гепатитов сопряжена со значительными трудностями, поэтому диагноз лекарственного гепатита устанавливается достаточно редко. Вследствие этого статистика лекарственных гепатитов изучена недостаточно. Отсутствует единая классификация лекарственных гепатитов. Практически выявление медикаментозных поражений печени осуществляется на стадии развернутой клинической картины, сопровождающейся желтухой, гепатомегалией. Отсюда возникает настоятельная необходимость разработки алгоритма дифференциальной диагностики лекарственных гепатитов для своевременной профилактики тяжелых гепатитов и циррозов печени. Точное знание свойств каждого препарата и условий, при которых проявляются их нежелательные эффекты, является наиболее верным способом оптимального использования медикаментов.
Для коррекции лекарственных гепатитов необходимы: отмена медикамента являющегося причиной гепатита; проведение дезинтоксикационной терапии и выбор гепатопротектора. При холестатическом поражении с нарушением обмена билирубина рекомендовано назначение гептрала в дозе 800 мг/сут внутривенно длительностью 14 дней под контролем биохимического печеночного спектра, что позволяет предотвратить прогрессирование холестатических процессов, снизить токсическое воздействие на гепатоциты, стабилизировать вязкость клеточных мембран.
Необходимо выявлять лекарственные препараты, применяемые в России и обладающие гепатотоксическим эффектом, проводить описание клинических вариантов течения лекарственных поражений печени.
Обычно очень много вопросов вызывает.
Ара Романовна Рейзис, профессор, доктор медицинских наук:
Существуют заболевания, которые сквозной линией проходят через всю жизнь человека – от детства и отрочества до самых преклонных лет. На этом пути попадают в поле зрения врачей самых разных специальностей, очень широкого круга врачей. Важно, чтобы этот широкий круг был в курсе того нового, что происходит в наших представлениях об этом заболевании.
К таким заболеваниям относится синдром Жильбера (СЖ). С тех пор как в 1901-м году Августин Жильбер описал этот синдром, прошло более века. За это время появилось много нового в наших представлениях об этом заболевании. Именно в аспекте этого нового мне и хочется сегодня представить эту патологию.
С институтских времен мы помним, что это такое. Синдром Жильбера – то наследственное нарушение обмена билирубина, которое состоит в недостаточности его глюкуронирования (обязательного для его поступления в желчевыводящие пути) и развитии в связи с этим доброкачественной неконьюгированной гипербилирубинемии.
Мы знаем также тот набор клинических и лабораторных критериев, которые всегда лежали в основе постановки этого диагноза нами. Известно, что он выявляется в основном у подростков в препубертатном и пубертатном возрасте. Чаще всего в семье мы имеем некие данные о наследственной семейной предрасположенности к этому синдрому.
Как правило, интенсивность желтухи небольшая. Максимум – субиктеричность кожи и иктеричность склер. Появление или усиление желтухи часто связано с интеркурентными заболеваниями или с голоданием, физическим или психоэмоциональным перенапряжением. А также с применением ряда лекарств. Особенно так называемых аглюконов, сульфамидов, группы салицилатов. Об этом мы будем говорить чуть дальше более подробно.
Чаще всего гепатомегалия отсутствует либо незначительная. В лабораторных тестах повышение билирубина в 2-5 (редко более) раз за счет преимущественно свободной фракции. При нормальной активности трансаминаз и отсутствии маркеров вирусных гепатитов и данных за гемолитическую анемию.
Такого набора клинико-лабораторных данных нам бывало достаточно, чтобы диагностировать этот синдром.
Последнее время ситуация изменилась в том смысле, что мы получили возможность объективного генетического анализа, который подтверждает или не подтверждает этот диагноз.
Стало известно генетическое лицо СЖ, которое заключается в том, что в промоторной области кодирующего фермента глюкуронил-трансферазы происходит мутация. Она заключается в ди-нуклеотивной вставке тирозин-аргинин. Эта вставка повторяется различное число раз. В зависимости от этого мы имеем либо классический вариант СЖ, либо его вариации (аллели).
Возможность объективного подтверждения этого диагноза, объективной его постановки во многом коренным образом изменила наши представления об этом синдроме. Изменила некоторые мифы, которые были достаточно устойчивы на протяжении всего века, что мы знакомы с этим синдромом.
Первое – распространенность СЖ. Считалось, что это достаточно редкое заболевание. С помощью генетического диагноза стало очевидно, что это достаточно частое заболевание. От 7% до 10% Земного шара страдают СЖ. Это каждый десятый. Для наследственного заболевания это необычайная частота.
В африканской популяции до 36%. В нашей популяции (европейской и азиатской) 2-5%. В нашей стране и в нашей популяции происходит учащение постановки этого диагноза.
Данные нашей клиники, где с СЖ мы встречаемся как с объектом дифференциальной диагностики вирусного гепатита. За 20 лет мы имеем (с 1990-х годов до нынешнего времени) рост частоты постановки этого диагноза более чем в 4 раза.
Второй миф, который уходит в прошлое с возможностью генетической постановки диагноза СЖ. Это миф о том, что СЖ – это, прежде всего, желтуха. Это совершенно необязательный симптом для СЖ. Это лишь верхушка, видимая часть айсберга. Основная часть больных СЖ не имеет желтухи или проявляет ее в каких-то особых жизненных ситуациях. Это совсем не обязательный симптом, что тоже очень важно.
Третий миф, с которым мы должны в наше время расстаться. Миф о том, что СЖ – заболевание совершенно безобидное. Мы привыкли к тому, что это так и есть. Он не ведет к фиброзированию или переходу в цирроз печени. В связи с этим он не требует нашего внимания.
На самом деле в последнее время выяснилось, что он вносит очень серьезную лепту в развитие и частоту развития желчнокаменной болезни (ЖКБ) в мире. В частности, ряд исследований об этом говорит достаточно масштабно.
Генетическое исследование 2009-го года, где около двухсот пациентов с ЖКБ и около 150-ти пациентов без таковой были обследованы генетически на СЖ. Выяснилось с высокой достоверностью, что среди тех, кто имеет СЖ, существенно чаще встречается ЖКБ.
В 2010-м году появилось еще более масштабное исследование. Это мета-анализ целого ряда исследований. Оно охватывает около трех тысяч пациентов с ЖКБ и около полутора тысяч пациентов без нее. Выяснилось, что пациенты, у которых генетически подтвержден СЖ, имеют полный риск ЖКБ. Главным образом, этот привар имеют мужчины.
Женщины вообще чаще страдают ЖКБ в силу гормонального устройства, эстрогенов и так далее. Мужчины же попадают в эту категорию, главным образом, если имеют СЖ. Увеличение ЖКБ у мужчин при СЖ происходит на 21%.
Еще одно новое направление, совершенно новый аспект в наших современных представлениях о СЖ. Этот тот факт, что изучение особенностей метаболизма лекарств на фоне СЖ легло в основу возникновения совершенно нового направления в фармакологии. Так называемые фармакогенетики, которые имеют огромное значение для разработки лекарственных средств и их практического использования.
Многие лекарства, так называемые аглюконы для того, чтобы быть выведенными из организма и вообще пройти свой путь метаболизма в организме, должны также соединиться с глюкуроновой кислотой, как билирубин. Нагружают тот же самый фермент – глюкуронил-трансферазу.
Соответственно, билирубин из связи с глюкуроновой кислотой вытесняют. Нарушают его выведение в желчные канальцы, в результате чего и появляется желтуха.
При разработке и испытании целого ряда препаратов на большом контингенте пациентов фармакологи столкнулись с тем, что ряд пациентов выявляют выраженную желтуху. Это могло трактоваться как истинная гепатотоксичность препарата, что иногда бросало тень на весьма важные и перспективные препараты, существенные для соответствующей категории больных.
Это вывело этот препарат из под подозрения в плане истинной гепатотоксичности.
Но количество соответствующих публикаций множится. Вот еще одно указание на это. При таком заболевании как акромегалия сейчас нередко бывает устойчивость к соматостатину. Новый препарат, который при этом испытывался, показал высокую степень, высокую частоту развития желтухи. Выяснилось, что у всех этих пациентов был СЖ.
До сих пор речь шла преимущественно о данных мировой литературы. Хочу привести собственные данные за 20 лет детской клиники. Мы за это время наблюдали 181-го ребенка и подростка с СЖ. Выяснилось, что очень высокий процент этих пациентов (более половины из них) имели дискинезию желчевыводящих путей со сладж-синдромом и без такового, имели развитие ЖКБ, при том, что это дети.
У этих пациентов нормальное состояние билиарного тракта было только у 11,8% детей. У 76,5% имелась дискинезия желчевыводящих путей, почти у половины из них со сладж-синдромом. Почти у 12% детей уже развившаяся ЖКБ.
Результаты. У этих пациентов почти в 65% случаев нормальное состояние билиарного тракта. Количество больных с ЖКБ сократилось в 4,5 раза (до 2,8%).
Это говорит о том, что все-таки СЖ заслуживает нашего внимания и некоторого терапевтического воздействия. Оно направлено на снижение общего уровня билирубина, как непрямого, свободного для уменьшения общей интоксикации (поскольку непрямой билирубин токсичен для нервной системы). А также снижение прямого связанного билирубина для предотвращения поражений билиарного тракта.
Здесь есть стрелочка от УДХК к уменьшению влияния на ЦНС. Нам попались на глаза любопытные данные пока экспериментальных исследований. Они говорят о том, что УДХК способна уменьшить чувствительность нервных клеток к поражающему действию непрямого билирубина.
Культура нервных клеток крысы (астроциты и нейроны) инкубировались с непрямым билирубином или с непрямым билирубином в присутствии УДХК. В случае инкубации моно имелось повышение апоптоза в 4-7 раз в этих клетках.
В случае, когда они инкубировались непрямым билирубином в присутствии УДХК, шла существенная защита (60%). Снижение уровня апоптоза менее 7%.
Таким образом, лечение СЖ на сегодня, как нам представляется, что должно в себе содержать. Что касается диетических ограничений, то они могут быть связаны только с возможной фолий-патией и носить такой характер. Достаточно строгими они быть не должны, но в порядке здорового образа жизни.
Что касается второго пункта – режим щажения – он очень важен. Пациенты должны об этом хорошо знать. Физическое и психоэмоциональное перенапряжение чрезвычайно неблагоприятно и напрямую приведет к пожелтению.
Что касается УДХК, то 10 – 12 мг на килограмм в сутки. Профилактические курсы по 3 месяца (весна-осень) ежегодно полезны и, как я показала на нашем опыте, достаточно эффективны в плане профилактики поражения желчевыводящих путей и ЖКБ.
Показано при повышении прямого билирубина до его нормализации. При возникновении дискинезии желчевыводящих путей со сладж-синдромом до их ликвидации и 1-2 месяца после для удержания полученного.
Таким образом, СЖ – это наследственное нарушение билирубинного обмена, своевременное распознавание и коррекция которого имеет существенное значение, как для пациента, так и для популяции в целом.
Современный этап развития медицины, сделавший возможным объективное подтверждение диагноза СЖ генетическими методами, ставит его диагностику на новую ступень.
Доброкачественность синдрома, состоящая в отсутствии фиброзирования и исхода в цирроз печени, не исключает таких неблагоприятных последствий, как заболевания билиарного тракта, вплоть до ЖКБ.
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Синдром Жильбера — это генетический пигментный гепатоз с аутосомно-доминантным типом наследования, протекающий с повышением уровня неконъюгированного (свободного) билирубина, чаще проявляющееся в период полового созревания и характеризующийся доброкачественным течением [1] .
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
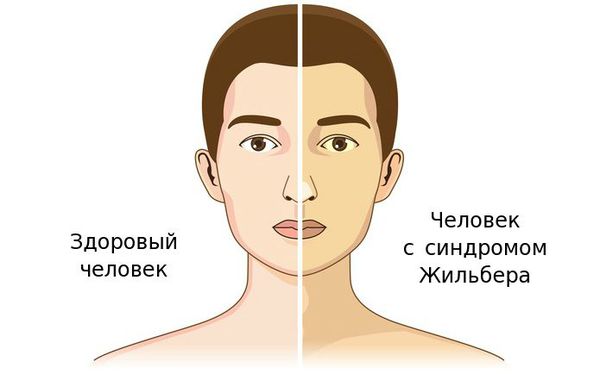
К провоцирующим факторам проявления синдрома можно отнести:
- голодание или переедание;
- жирную пищу;
- некоторые лекарственные средства;
- алкоголь;
- инфекции (грипп, ОРЗ, вирусный гепатит);
- физические и психические перегрузки;
- травмы и оперативные вмешательства.
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
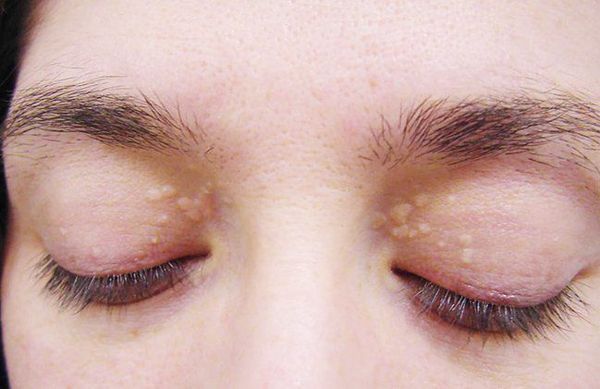
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
- желтуха различной степени выраженности;
- ксантелазмы век (жёлтые папулы);
- периодичность появления симптомов [1] .
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
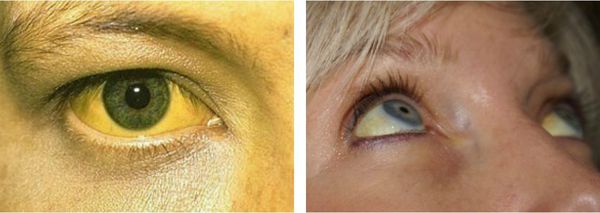
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
- слабость;
- недомогание;
- подавленность;
- плохой сон;
- снижение концентрации внимания.
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
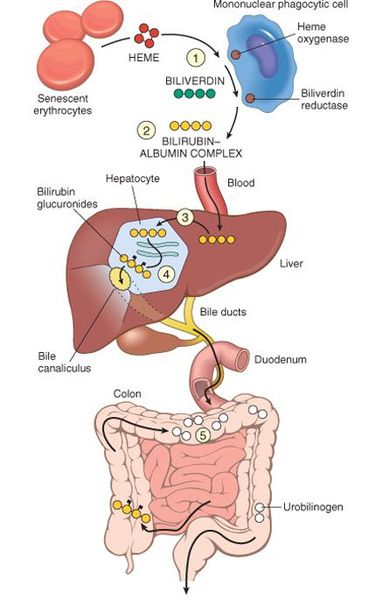
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами ("жирами") клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
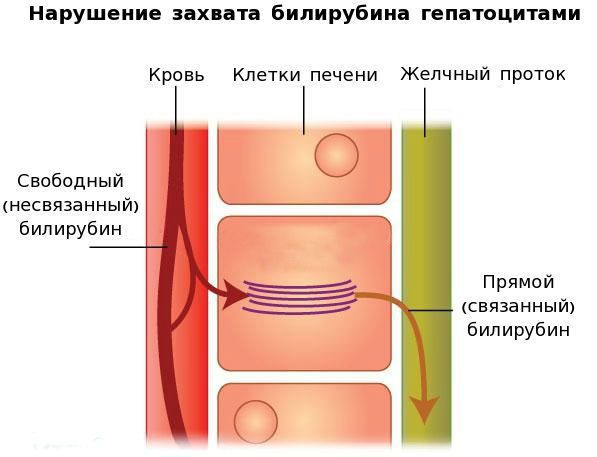
В конечном итоге вышеперечисленные патологические процессы приводят к увеличению содержания свободного (несвязанного) билирубина в плазме, что обуславливает клинические проявления заболевания [6] .
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Повышенный билирубин в крови – признак желтухи, разных форм гепатита, анемии, онкологических патологий, за обмен данного пигмента отвечает печень. Выявить причины отклонений можно при помощи специфических анализов, скорректировать значения помогут лекарства и правильное питание.

Симптомы повышенного билирубина
Билирубин – жёлто-зелёный пигмент, образуется после разрушения эритроцитов в печени, селезёнке, костном мозге, высвобождения гемоглобина.
Непрямой билирубин возникает сразу после распада красных клеток крови, негативно влияет на работу ЦНС, обезвреживание пигмента происходит в печени, образуется связанный (прямой) билирубин.
Симптомы патологии:
- тянущая боль ниже рёбер с правой стороны, плотный серый или белый налёт на языке;
- тошнота, отрыжка, привкус горечи – неприятные симптомы проявляются интенсивно после употребления вредной пищи;
- метеоризм, диарея, запоры;
- зуд;
- слабость, апатия, нарушение памяти, мигрень, приступы головокружения;
- повышение температурных показателей;
- кожа и слизистые приобретают ярко-жёлтый, зеленоватый оттенок.
Почему повышен билирубин в крови
В норме у взрослых содержание общего билирубина – 5,2–17 ммоль/л, показатели непрямого билирубина – 3,4–11,9 ммоль/л. У женщин значения несколько ниже, поскольку у них в крови эритроцитов содержится меньше.
Незначительное повышение – 85 ммоль/л, тяжёлые формы патологии значения поднимаются до 170 ммоль/л и более.

Из-за чего повышается уровень печёночного фермента
- первичный цирроз;
- камни в жёлчном пузыре, сбои в процессе оттока жёлчи;
- опухоли различного происхождения в печени;
- гепатит различного происхождения – нарушается процесс вывода билирубина печенью.
- гепатит A, B, мононуклеоз;
- бактериальные, хронические, аутоиммунные разновидности гепатита;
- длительный приём гормональных препаратов, НПВС, лекарств для лечения туберкулёза, опухолевых процессов;
- сильна интоксикация на фоне отравления;
- рак органов пищеварительной системы.
- синдром Жильбера;
- серьёзные инфекционные патологии – малярия, заражение крови, брюшной тиф;
- гемолитическая анемия врождённого происхождения;
- аутоиммунные заболевания;
- обширные гематомы;
- реакция на трансплантацию органов, переливание крови.
Физиологическое повышение показателей возникает при чрезмерных физических нагрузках, переедании, длительном голодании, после жёстких диет.
Повышение общего билирубина практически всегда связано с наличием патологий печени, прямого – означает нарушение оттока жёлчи, непрямого – свидетельствует о высокой скорости гибели эритроцитов.
Повышение билирубина у женщин и детей
У женщин повышение уровня пигмента часто возникает во время вынашивания ребёнка – желтуха беременных считается нормальным явлением. Причины повышения показателей – стресс, неправильное питание, малоподвижный образ жизни, токсикоз, инфекции, давление матки на близлежащие органы.

У новорождённых наблюдается значительное уменьшение уровня эритроцитов из-за распада внутриутробного гемоглобина, поэтому показатели билирубина завышены. Проявляется это в виде желтушности кожи и склер, в норме состояние нормализуется самостоятельно через 5–7 дней. Тяжёлые печёночные патологии могут возникнуть при резус-конфликте, у недоношенных детей, билирубин начинает отравлять ткани головного мозга, требуется интенсивная терапия.
Спровоцировать повышение билирубина у ребёнка могут наследственные факторы, инфекционные заболевания печени, заражение глистами, у подростков причины патологии такие же, как и взрослых.
К какому врачу обращаться?
При появлении признаков патологического состояния необходимо посетить терапевта или педиатра, поле осмотра и первичной диагностики врач даст направление к гепатологу. Дополнительно может потребоваться консультация инфекциониста, онколога, гастроэнтеролога.
Диагностика
Признаки повышения билирубина можно обнаружить уже при внешнем осмотре, пальпации печени. Для определения степени тяжести патологии, причин её появления назначают ряд лабораторных и инструментальных анализов.

Основные методы диагностики:
- клинический анализ мочи и крови;
- анализ крови на разные фракции билирубина;
- проба Кумбса;
- биохимический анализ крови – позволяет определить уровень АСТ, АЛТ, щелочной фосфатазы;
- УЗИ органов пищеварительной системы.
За 2 недели до сдачи анализов необходимо прекратить приём анальгетиков и желчегонных лекарственных средств, напитков с кофеином. За 5 дней до обследования нужно свести к минимуму физические нагрузки, исключить из рациона вредную, тяжёлую пищу. Кровь из вены сдают натощак, пить можно за 4 часа до забора материала.
Что делать при высоком билирубине?
Чтобы снизить концентрацию печёночного фермента, нужно выявить и устранить основное заболевание, которое вызвал повышение показателей. В терапии используют комплексный подход, – медикаментозное лечение, диета, физиотерапевтические методы.

Билирубин выше нормы – как лечить:
- Инфузионная терапия – внутривенно вводят специальные растворы, чтобы снять проявления интоксикации, очистить организм.
- Фототерапия – облучение синими лампами, что ускоряет процесс преобразования непрямого билирубина в прямой, метод безопасен даже для маленьких детей.
- Назначение лекарственных средств для устранения признаков основной болезни.
- Коррекция питания.
При незначительном повышении показателей лечение можно проводить в домашних условиях, тяжёлые формы лечат в стационаре.
Медикаментозное лечение
Если билирубин повышен, для коррекции используют различные препараты, действие которых направлено на устранение неприятных симптомов, восстановление печени.

Какие препараты назначают при повышении билирубина:
- гепатопротекторы – Карсил, Эссенциале форте;
- лекарства на основе урсодезоксихолевой кислоты – Урсосан, Урдокса, устраняют воспалительные процессы, разжижают жёлчь, способствуют её лучшему оттоку;
- противовирусные средства – интерфероны длительного действия, Рибаверин;
- иммуномодуляторы – Тактивин, Тималин;
- антибиотики – Неомицин, Ванкомицин;
- желчегонные препараты – Аллахол, Холагол;
- ферменты – Панзинорм, Фестал;
- энтеросорбенты – Энтеросгель;
- глюкокортикостероиды – Преднизолон, назначают при высоком уровне прямого билирубина;
- Фенобарбитал – назначают при синдроме Жильбера, некоторых других серьёзных печёночных патологиях.
Диета при увеличении показателей
Чтобы снизить концентрацию пигмента, необходимо пересмотреть рацион – диету обязательно включают в список лечебных мероприятий.
- овощи и фрукты в любом виде;
- нежирные сорта мяса, рыбы;
- яичные белки;
- кисломолочная обезжиренная продукция;
- гречка, рис, овсянка;
- мёд, варенье;
- компоты, травяные чаи из ромашки, мяты, зверобоя.
- жирная, кислая, солёная, тяжёлая и вредная пища, специи;
- морепродукты;
- насыщенные бульоны;
- сыр;
- какао, шоколад.
- спиртные, газированные напитки, кофе;
- консервы, копчёности;
- квашеная капуста;
- пшённая крупа;
- мучные изделия, особенно с кремом;
Чем опасен повышенный билирубин в крови?
При своевременной терапии нормализовать показатели билирубина можно без каких-либо опасных последствий для здоровья
Повышен билирубин – чем это грозит:
- при излишнем скоплении пигмента он проникает в клетки, что приводит к их гибели – нарушается работа всех систем и органов;
- энцефалопатия;
- гиповитаминоз;
- хронический холецистит, образование камней в жёлчном пузыре;
- цирроз, вирусный гепатит, возникают патологические необратимые процессы в печени;
- кома.
Особенно опасно значительное отклонение показателей от нормы для детей – наблюдается отклонения в развитии, развивается слепота, глухота.
Профилактика
Чтобы оградить себя от патологий печени, поджелудочной железы и жёлчного пузыря, необходимо правильно и регулярно питаться, избавиться от пагубных привычек, следить за весом.

Предотвратить повышение билирубина поможет своевременная диагностика и лечение заболеваний ЖКТ, укрепление иммунитета.
Уровень билирубина – один из основных показателей работы печени, при повышении показателей развиваются тяжёлые патологии, ухудшается самочувствие в целом. Чтобы снизить значения соблюдайте диету, принимайте лекарства, согласно рекомендациям врача.
Читайте также:

