Противовирусные препараты при лейкозе
Обновлено: 25.04.2024
Интерферон (ИФН-а) в лечении хронического миелолейкоза (ХМЛ) - схема терапии, эффективность
С внедрением в клиническую практику рекомбинантного ИФН-а во всех странах началось его активное использование, в том числе при хроническом миелоидном лейкозе (ХМЛ). Была изучена эффективность различных доз и режимов применения препарата. При ежедневной дозе 2—4 MU/m2 частота гематологического ответа с количеством лейкоцитов 9•109/л и менее и нормализацией лейкоцитарной формулы регистрировалась в 31—38 %, частота цитогенетического ответа — у 18—22 %, а полные цитогенетические ремиссии получены у 0—6—7 % больных. Даже в тех исследованиях, в которых с помощью указанных доз интерферона было получено большое число полных гематологических ремиссий, частота цитогенетического ответа не превышала указанных значений.
В то же время при ежедневной дозе ИФН-а 5 MU/м2 гематологический ответ был достигнут у 59—80%, цитогенетический — у 55—56%, полные цитогенетические ремиссии — у 26—32 % больных. Отечественный опыт подтверждает эти данные. В РАМН при начале лечения ИФН-а на первом году хронической стадии в дозе 3—5 MU через день цитогенетический ответ получили у 33 % больных, а в дозе 5—10 MU сут — у 84 %. Достоверное достижение лучших результатов при дозе интерферона 5 MU/м2 в день по сравнению с меньшими ежедневными дозами или назначением 5 MU/m2 3 раза в неделю подтверждено рандомизированными исследованиями.
Цитогенетический ответ:
- полная онтогенетическая ремиссия: в крови и костном мозге цитогенетическими методами, в том числе методом FISH, не удается обнаружить Рп-по-зитивных клеток;
- частичная цитогенетическая ремиссия: удается обнаружить от 1 до 34 % Ph-позитивных клеток;
- большой цитогенетический ответ: сумма полных и частичных цитогенетических ремиссий;
- минимальный цитогенетический ответ: обнаруживается от 35 до 95 % Ph-позитивных клеток;
- отсутствие цитогенетического ответа: все исследованные клетки крови и костного мозга являются Ph-позитивными.
Так, по данным Н. Kantarjian и соавт., общая медиана выживаемости при лечении интерфероном составила 89 мес, а в группе больных с благоприятным прогнозом — 104 мес. Даже у больных с неблагоприятным прогнозом медиана выживаемости при лечении ИФН-а превышает таковую у больных, леченных миелосаном или гидроксимочевиной. Метаанализ показал, что лечение интерфероном на 15 % увеличило 5-летнюю выживаемость по сравнению с полученной при цитоста-тической терапии. Предполагаемая на основании этих расчетов 10-летняя выживаемость должна составить 40 %, а для больных с полной цитогенетической ремиссией — 80 %. Как известно по данным всех публикаций, при цитостатической терапии 10-летний срок переживают лишь 5 %, в редких наблюдениях — 10 % больных.

В большинстве исследований показано, что продолжительность жизни связана с цитогенетическим ответом на терапию. Так, по данным М. D. Anderson Cancer Center, при лечении интерфероном 5-летняя выживаемость составила 90 % среди больных с полной цитогенетической ремиссией, 88 % — с частичной, 76 % — с малым цитогенетическим ответом и 38 % среди больных с отсутствием цитогенетического ответа. Аналогичные данные получены в других исследованиях: 3 года прожили 100 % больных при наличии цитогенетического ответа, 72 % — при его отсутствии, 5-летняя выживаемость составила 100 % в группе больных с полной цитогенетической ремиссией, 92 % — с частичной, 59 % — с малым цитогенетическим ответом, 47 % — с отсутствием цитогенетического ответа.
К сожалению, когда не только цитогенетическими методами, но и с помощью ПЦР не удается определить наличие Ph-позитивных клеток, полная цитогенетическая ремиссия в большинстве случаев оказывается временной. Показано, однако, что даже при отсутствии цитогенетического ответа 5-летняя выживаемость больных, получающих интерферон, выше, чем при лечении цитостатическими препаратами без интерферона, — 47 % и 34 % соответственно. Наши наблюдения подтверждают эти данные. Это показывает, что даже при отсутствии цитогенетического ответа, но при хорошей переносимости ИФН-а и отсутствии объективных побочных проявлений терапию интерфероном следует продолжать на протяжении всей хронической стадии заболевания.
При использовании ИФН-а в дозе 5 MU/м2 ежедневно у подавляющего числа больных гематологическая ремиссия достигается в течение 3—6 мес, а цитогенетический ответ в тех случаях, когда его удается получить, —в течение 12 мес. У ряда больных, вначале продемонстрировавших лишь минимальный ответ, в течение 18—24 мес удается получить большой цитогенетический ответ. Это показывает, что оценку чувствительности больного к ИФН-а следует проводить не ранее указанного срока.
Отмечена связь продолжительности жизни и времени ответа на терапию ИФН-а. Достоверно выше 5-летняя выживаемость среди больных, у которых полная гематологическая ремиссия получена в течение первых 8 мес терапии и цитогенетическая — в течение 24 мес, чем у ответивших на терапию ИФН-а позже (соответственно 78 и 48 % для гематологической ремиссии, 88 и 65 % для цитогенетической). Наиболее часто большой цитогенетический ответ удается получить у больных, у которых полная гематологическая ремиссия достигается в течение первых 3 мес лечения гидроксимочевиной и интерфероном. В этой же группе получена наилучшая 5-летняя выживаемость.
В костно-мозговом пунктате у больных хроническим миелоидным лейкозом в состоянии полной цитогенетической ремиссии обнаруживаются Ph-позитивные CD34+-клетки. В связи с этим высказывается мнение, что лечебное действие ИФН-а при хроническом миелоидном лейкозе (ХМЛ) обусловлено не элиминацией Ph-позитивных клеток, а восстановлением нормальных взаимоотношений между ними и микроокружением. Это обеспечивает подавление роста чрезмерно пролиферирующего клона, каковым является Ph-позитивный клон при хроническом миелоидном лейкозе (ХМЛ). Может иметь значение и обнаруженное при воздействии ИФН-а увеличение активности натуральных киллеров (NK-клеток).
Интерферон вводят подкожно или внутримышечно. При внутривенном введении препарат быстро выводится из организма, и эффект его действия значительно снижается. В большинстве случаев лечение сопровождается рядом побочных явлений. После первой инъекции практически всегда развивается гриппоподобный синдром с повышением температуры тела нередко до 38—39 °С с ознобом, тахикардией, общим недомоганием, миалгиями, иногда артралгиями. Этот синдром не представляет реальной опасности и быстро снимается приемом жаропонижающих средств. Все эти явления бывают выражены значительно слабее при профилактическом приеме жаропонижающих средств (лучше всего панадол или парацетамол) за 20—30 мин до инъекции препарата. Изредка возникают тошнота и рвота. К редким побочным явлениям относятся повышение или снижение артериального давления, появление цианоза конечностей, повышение уровня трансаминаз, протеинурия. У большинства больных при каждой следующей инъекции побочные явления выражены все слабее и постепенно стихают в первые 1—2 нед лечения.
При нерезко выраженных побочных явлениях многие больные предпочитают инъекции интерферона в вечерние часы, чтобы к утру не испытывать неприятных ощущений.
К поздним побочным эффектам, развивающимся у 10—20 % больных в результате длительного приема препарата, относятся снижение массы тела, редко — выпадение волос, периферические неврологические расстройства, чувство постоянной усталости, бессонница, депрессия, которая чаще возникает у пожилых пациентов; возможны явления паркинсонизма. Менее чем у 2 % больных развиваются гипоплазия костного мозга и аутоиммунная анемия или тромбоцитопения. К очень редким поздним аутоиммунным эффектам относятся гипотиреоидизм и синдром, напоминающий системную красную волчанку, появление плеврального или перикардиального выпота.
Развитие депрессии, паркинсонизма, системной красной волчанки и других аутоиммунных синдромов является показанием к немедленной отмене интерферона. Отмена препарата и назначение стероидных гормонов быстро ликвидируют все симптомы аутоиммунного процесса. Депрессия требует более длительного лечения с применением специальных средств и тщательного наблюдения за больным, так как она может сопровождаться суицидальными действиями.
Иногда после длительного периода хорошей переносимости ИФН-а периодически начинает повышаться температура тела, при этом отмечается снижение лечебного эффекта препарата. Нередко это объясняется образованием антител к интерферону. В подобных случаях целесообразно заменить препарат (интрон А на роферон А или наоборот).
Показано, что острые гриппоподобные явления при лечении больных хроническим миелоидным лейкозом ИФН-а выражены тем сильней, чем больше количество лейкоцитов. Это объясняют высвобождением цитокинов из гемопоэтических клеток, которые при хроническом миелоидном лейкозе содержат большое количество лейкотриенов, полипептидов, обусловливающих повышение температуры тела при воспалении.
Интерферон в качестве единственного препарата не следует назначать больному с высоким лейкоцитозом еще и потому, что под его влиянием количество лейкоцитов снижается очень медленно.
Лечение следует начинать с назначения цитостатического препарата, лучше всего гидроксимочевины. При снижении количества лейкоцитов до 10— 15•10 9 /л начинают лечение ИФН-а. Его можно использовать одновременно с цитостатическим препаратом в тех случаях, когда при отмене цитостатика обнаруживается тенденция к увеличению количества лейкоцитов. Если при лечении ИФН-а количество лейкоцитов стабильно сохраняется менее 5•109/л, лечение обычно проводят только интерфероном, хотя в отдельных наблюдениях получена лучшая выживаемость больных, получавших комбинацию ИФН-а с гидроксимочевиной или бусульфаном. В рандомизированном исследовании, проведенном в Германии (376 больных в хронической стадии ХМЛ), показано преимущество комбинированной терапии по сравнению с применением каждого препарата в отдельности: интерферон быстрей вызывает цитогенетическую ремиссию, гидроксимочевина — уменьшение опухолевой массы, а полная гематологическая ремиссия достигается значительно быстрей при комбинации препаратов.
Для уменьшения побочного действия интерферона рекомендуется начинать лечение с дозы 3 MU в день в течение недели. Затем дозу увеличивают до 5 MU в день на неделю, а затем назначают лечебную дозу 5 MU/м2 в день. Наш опыт показывает, что большинство больных хорошо переносят более быстрое наращивание дозы интерферона с выходом на лечебную дозу уже к концу 1-й недели.
У многих больных после нескольких месяцев лечения количество лейкоцитов снижается до 2,0— 1,5•10 9 /л, нередко с одновременным уменьшением количества тромбоцитов. В таких случаях лейкоцитарная формула оказывается нормальной, и обычно достигается та или иная степень цитогенетического ответа. Лечение интерфероном таких пациентов следует продолжить, снизив частоту введения препарата, поскольку назначение ИФН-а даже 1—3 раза в неделю в подобных случаях позволяет сохранить полную клинико-гематологическую, а нередко и цитогенетическую ремиссию на протяжении очень долгого времени, иногда на годы.
Существуют рекомендации снижать дозу интерферона только при содержании лейкоцитов 2•10 9 /л и тромбоцитов 50•10 9 /л, однако не все согласны с такими рекомендациями. Мы всегда уменьшаем дозу интерферона уже при количестве лейкоцитов менее 3•109/л и тромбоцитов менее 100•109/л. Большинство авторов снижают дозу интерферона и в тех случаях, когда у больного полная цитогенетическая ремиссия сохраняется на протяжении 2 лет.
Показано, что даже при длительном лечении ИФН-а у большинства пациентов не отмечается развития миелофиброза — постоянного спутника продолжительной миелосанотерапии. Предотвратить развитие миелофиброза удается только при использовании полных лечебных доз ИФН-а. При дозе 5 MU/м2 в день, особенно в комбинации с малыми дозами цитозин-арабинозида, удавалось не только предотвратить развитие миелофиброза, но и добиться его обратного развития.
Лечение ИФН-а существенно изменило прогноз при хроническом миелоидном лейкозе. Международной европейской группой экспертов разработана новая прогностическая модель на основании сопоставления клинико-гематологических признаков у 1303 больных хроническим миелоидным лейкозом до лечения и продолжительности их жизни при лечении ИФН-а. Эта прогностическая модель, получившая название Европейской модели, в настоящее время широко используется так же, как модель Sokal. Она имеет следующий вид:
0,6666 х индекс возраста [0, если возраст менее 50 лет, 1 — во всех других случаях] + 0, 0420 х размеры селезенки [сантиметры ниже реберной дуги] + 0,0584 х процент бластных клеток в крови + 0, 0413 х процент эозинофилов в крови + 0, 2039 х индекс базофилов [0, если базофилов в крови менее 3 %, 1 — во всех других случаях] + 1,0956 х х индекс тромбоцитов [0, если количество тромбоцитов менее 1500•109/л, 1— во всех других случаях] х 1000.
При прогностическом индексе менее 780 пациент относится к группе благоприятного прогноза, при индексе более 780, но менее 1480 — промежуточного, при индексе более 1480 — неблагоприятного прогноза. Медиана выживаемости при лечении ИФН-а оказалась равной 98 мес для больных с благоприятным прогнозом, 65 мес — с промежуточным и 42 мес — с неблагоприятным прогнозом, а 5-летняя выживаемость — соответственно 76, 55 и 25 %. Ценность этой прогностической модели подтверждена разными исследовательскими группами при использовании ее для определения предполагаемой выживаемости больших групп больных при лечении ИФН-а. Получено практически полное совпадение расчетных и истинных результатов.
Наилучшие результаты по длительности хронической стадии болезни и выживаемости при лечении ИФН-а достигаются в тех случаях, когда полная клинико-гематологическая ремиссия получена после 6 мес лечения, частичная цитогенетическая ремиссия — не поздней 12 мес, полная — к концу 2-го года лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза
ОРВИ при злокачественных новообразованиях: риски и сложности терапии
Острые респираторные вирусные инфекции (ОРВИ), в том числе и грипп, составляющие основную долю инфекционной патологии населения всех возрастов, представляют существенную угрозу пациентам из групп риска: пожилым, беременным, детям младшего возраста и пациентам с хроническими заболеваниями, в том числе онкологическими.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза.
При ОРВИ на фоне онкологического процесса лечащий врач сталкивается со следующими трудностями:
- Длительность ОРВИ у иммунокомпрометированных пациентов может достигать нескольких недель, в течение которых состояние больных значительно ухудшается, и не только по иммунным показателям.
- Инфекционный процесс заставляет откладывать очередной курс химиотерапии, что сильно сказывается на прогнозе.
- Назначение противовирусной терапии может вызвать осложнения, а в частности лекарственную гепатотоксичность, так как ее эффект накладывается на гепатотоксичное действие фармакотерапии злокачественного заболевания 1 .
Таким образом, можно сказать, что необходимость в профилактике и терапии ОРВИ у онкологических пациентов неоспорима, но последнее упомянутое обстоятельство резко ограничивает выбор конкретного средства.
Варианты противовирусной терапии
Вирус-специфические препараты римантадин, занамивир и осельтамивир доказали свою эффективность, которая распространяется однако только на вирус гриппа. Кроме того, эти средства имеют ряд противопоказаний, которые зачастую делают невозможным их применение у онкологических пациентов.
В случае назначения средств, действующих на определенные вирусные белки, следует учитывать также проблему резистентности, которую вырабатывают к ним вирусы 2 . Так, появились данные о повышении до 18% частоты устойчивости вирусов гриппа А (H3N2) к осельтамивиру среди детей, получавших данный препарат для лечения гриппа 3 .
В связи с вышесказанным сегодня как никогда высока потребность в противовирусных препаратах, действующих не на инфекционный агент, а на иммунные защитные механизмы.
Оптимальное противовирусное средство, которое может быть рекомендовано для онкологической практики, должно:
- не вызывать резистентности, вероятно вследствие отличного механизма действия;
- быть безопасным, в частности при длительном применении;
- иметь минимальный риск побочных эффектов при лекарственном взаимодействии.
Перспективы использования иммуномодуляторов
Указанным критериям в полной мере соответствуют иммуномодулирующие средства, благодаря чему интерес к ним клиницистов-онкологов в последние годы резко возрос.
Иммуномодуляторы – это лекарственные средства, которые обладают иммунотропной активностью и в терапевтических дозах восстанавливают эффективную иммунную защиту. Растущая опухоль вызывает существенные изменения в иммунном ответе, а проводимая химио- и лучевая терапия, а также любые оперативные вмешательства вызывают или усугубляют иммунную недостаточность 4 . Поэтому использование иммуномодуляторов, в частности для лечения сопутствующих инфекций, является оправданным.
Эргоферон: элегантное решение непростого вопроса
Главной особенностью релиз-активных препаратов является способность воздействовать на биологически активные молекулы мишени (эндогенные регуляторы), модифицируя их физико-химические свойства. Эффект проявляется не только на молекулярном, но и на клеточном, органном, системном и организменном уровнях.
Так, прием Эргоферона усиливает функциональную активность макрофагов, натуральных киллеров и ИФН при помощи релиз-активных антител к ИФН-γ и CD4+. На этапе цитотоксических клеточных реакций CD8+ и CD4+ Т-лимфоцитов Эргоферон поддерживает противовирусный иммунитет при участии компонента релиз-активных антител к CD4+. На более поздних этапах релиз-активные антитела к CD4+ через стимуляцию рецепторов CD4 Тх2 поддерживают гуморальный противовирусный иммунитет.
Третий компонент Эргоферона – релиз-активные антитела к гистамину – обеспечивает противовоспалительный и антигистаминный эффекты, которые проявляются уменьшением длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу 7 . Это является важным преимуществом Эргоферона перед другими противовирусными препаратами, так как позволяет снизить потребление других средств и нивелировать риск лекарственного взаимодействия при параллельно проводящейся противоопухолевой терапии.
Клинический опыт
Эргоферон применяется в клинической практике с 2011 года, и его эффективность была доказана в ходе рандомизированных клинических исследований. На данный момент завершено 3 клинических исследования и продолжаются еще 4.
Исследований по лечению ОРВИ именно у онкологических больных не проводилось. Однако в клинической практике накоплен опыт назначения Эргоферона госпитализированным больным с солидными опухолями (Шаповалова Ю.С). Учитывая актуальность проблемы отсрочек курсов химиотерапии и продления сроков госпитализации, в 2012 г. был разработан внутрибольничный протокол лечения ОРВИ у госпитализированных пациентов с солидными злокачественными новообразованиями. В него включены следующие противовирусные препараты: для лечения гриппа – ингибиторы нейраминидазы занамивир и осельтамивир, а также римантадин, умифеновир и Эргоферон; для лечения ОРВИ – умифеновир и Эргоферон. Эргоферон применялся в виде монотерапии (37 пациентов) или в комбинации с римантадином (14 пациентов) в течение первых 48 часов от начала проявления симптомов заболевания. Все пациенты выздоровели через 5-9 дней лечения; нежелательных реакций, связанных с изучаемой терапией, отмечено не было. Учитывая благоприятный профиль переносимости Эргоферона и отсутствие гепатотоксичности, его применение может быть востребовано для лечения ОРВИ у пациентов онкологического профиля, в том числе находящихся в процессе химиотерапии.
Следует также отметить, что согласно экспериментам использование релиз-активных антител к ИФН-γ не приводит к гиперпродукции ИФН-γ. Этот факт немаловажен в свете недавних исследований, показавших, что ИФН-γ в больших дозах может приводить к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии 11 .
Учитывая безопасность Эргоферона, доказанную в исследованиях высокого методологического качества, можно сделать вывод, что препарат стоит рекомендовать для лечения ОРВИ у пациентов со злокачественными новообразованиями 12 .
Выводы
Как доказали результаты экспериментальных и клинических исследований Эргоферон является перспективным противовирусным препаратом с принципиально новым механизмом и мишенями воздействия, и он может помочь решить проблему лечения больных в условиях изменчивости антигенных свойств вирусов и исходно скомпрометированного иммунного статуса. Комплексный препарат, сочетающий противовирусное, иммуномодулирующее, противовоспалительное и антигистаминное действие, оказывает выраженный терапевтический эффект при ОРВИ у пациентов с онкологической патологией. Препарат имеет благоприятный профиль безопасности, и его назначение позволяет снизить лекарственную нагрузку и риск лекарственного взаимодействия с противоопухолевыми препаратами.
2 Heaton NS et al. Genome-wide mutagenesis of influenza virus reveals unique plasticity of the hemagglutinin and NS1 proteins. Proc Natl Acad Sci USA 2013; 25.
3 Антимикробная терапия по Джею Сэнфорду. Под ред. Д.Гилберта, Р.Меллеринга мл., Дж.Элиопулоса и др. М.: ГРАНАТ, 2013.
5 Сыроешкин А.В., Никифорова М.В., Колдина А.М., Горнак А.А., Тарабрина И.В. Лекарственные препараты на основе релиз-активных антител. Справочник поликлинического врача. 2018 (3):15-20
6 Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008.
7 Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40-3.
8 Архивъ внутренней медицины. 2013; 14 (6): 46.
9 Шиловский И.П., Корнилаева Г. В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата Эргоферон. Иммунология. 2012; 33 (3): 144-8.
11 Taniguchi K, Petersson M, Höglund P et al. Interferon gamma induces lung colonization by intravenously inoculated B16 melanoma cells in parallel with enhanced expression of class I major histocompatibility complex antigens. Proc Natl Acad Sci USA 1987; 84 (10): 3405-9.
Хронический лимфолейкоз (ХЛЛ) — опухолевое заболевание, возникающее вследствие мутаций в геноме В-лимфоцита. Основная функция В-лимфоцитов — обеспечение гуморального иммунитета. Конечная стадия развития В-лимфоцита в организме — иммуноглобулинсекретирующ
Хронический лимфолейкоз (ХЛЛ) — опухолевое заболевание, возникающее вследствие мутаций в геноме В-лимфоцита. Основная функция В-лимфоцитов — обеспечение гуморального иммунитета. Конечная стадия развития В-лимфоцита в организме — иммуноглобулинсекретирующая плазматическая клетка. В-лимфоциты при ХЛЛ вследствие изменений в клеточном геноме не развиваются до плазматических клеток. Это ведет к резкому уменьшению в организме больного выработки иммуноглобулинов, к которым относятся все антитела.
ХЛЛ — наиболее распространенный вид лейкоза в странах Европы и Северной Америки, в которых на его долю приходится около 30% всех лейкозов. Ежегодная заболеваемость им составляет 3–3,5 случая на 100 000 человек, увеличиваясь для лиц старше 65 лет до 20, а старше 70 — до 50 случаев на 100 000 человек.
Как самостоятельное заболевание ХЛЛ выделен в 1856 г. знаменитым немецким патологом Р. Вирховым.
Мужчины заболевают ХЛЛ в 2 раза чаще женщин. ХЛЛ в основном болезнь людей пожилого возраста, средний возраст заболевших составляет 65—69 лет. Более 70% заболевают в возрасте старше 60 лет, менее 10% — до 40 лет.
Не наблюдается увеличения частоты ХЛЛ среди лиц, подвергавшихся воздействию ионизирующей радиации или часто контактировавших с бенолом и автомобильным бензином, т. е. факторами, играющими ведущую роль в возникновении миелоидных лейкозов.
Диагностика ХЛЛ в подавляющем большинстве случаев не вызывает трудностей. Это заболевание должно быть заподозрено при увеличении в крови количества лейкоцитов и лимфоцитов. Если абсолютное количество лимфоцитов достигает 5х109/л, диагноз ХЛЛ становится очень вероятным. Нужно иметь в виду, что абсолютное количество лимфоцитов 5х109/л — это 55% при общем количестве лейкоцитов 9х109/л, и такая картина крови часто не привлекает внимания врача. Иногда на протяжении 2–3 лет при нормальном количестве лейкоцитов наблюдается постепенно нарастающий лимфоцитоз — 55–60–70% лимфоцитов в формуле крови. Пациенту с такой картиной крови обязательно нужно повторять анализ крови не реже 1 раза в полгода, так как после длительного периода спокойного течения может начаться быстрое прогрессирование заболевания. В настоящее время в терапии ХЛЛ имеются широкие возможности, поэтому каждый больной с подозрением на это заболевание должен быть проконсультирован гематологом, независимо от наличия у него другой патологии.
В большинстве случаев при установлении диагноза ХЛЛ количество лейкоцитов составляет 20–50х109/л, но иногда при первом обращении к врачу имеется высокий лейкоцитоз, достигающий 100–500х109/л и свидетельствующий о длительном недиагностированном периоде заболевания. При подсчете лейкоцитарной формулы содержание лимфоцитов обычно составляет 60–70%, при высоком лейкоцитозе достигает 95–99%. Уровень гемоглобина и число тромбоцитов обычно бывают нормальными, но при высоком лейкоцитозе и лимфоцитозе, превышающем 85–90%, может быть некоторое снижение показателей гемоглобина и числа эритроцитов и тромбоцитов. При биохимическом анализе крови вначале никаких изменений не отмечается, с течением времени в большинстве случаев выявляются гипопротеинемия и гипогаммаглобулинемия.
В костно-мозговом пунктате на ранних этапах болезни обнаруживается небольшое содержание лимфоцитов (40–50%), при высоком лейкоцитозе лимфоциты могут составлять 95–98% костно-мозговых элементов.
Только морфологического исследования недостаточно для установления диагноза ХЛЛ, поскольку аналогичная картина крови и костного мозга может наблюдаться при некоторых видах лимфом. Согласно современным критериям, диагноз ХЛЛ может считаться установленным только после иммунологического исследования. Лимфоциты при ХЛЛ имеют абсолютно характерный иммунофенотип. Они экспрессируют на своей поверхности антигены CD19, CD5, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов (экспрессируются IgM, нередко одновременно с IgD) и антигенов CD20 и CD22.
При значительном увеличении периферических лимфоузлов, как правило, оказываются увеличенными лимфоузлы брюшной полости, что выявляется при УЗИ. Лимфоузлы могут сливаться между собой, образуя конгломераты. Медиастинальные лимфоузлы увеличиваются редко и обычно незначительно. Размеры лимфоузлов у разных больных могут изменяться в очень широких пределах — от 1,5–2 до 10–15 см в диаметре. У одного больного эти размеры в разных областях варьируются, однако резкое увеличение лимфоузлов какой-либо одной области нехарактерно. В подобных случаях обязательна пункция или биопсия данного узла для исключения трансформации ХЛЛ в агрессивную лимфому.
Спленомегалия у большинства больных появляется позже, чем увеличение лимфоузлов. Увеличение селезенки без увеличения лимфоузлов совершенно не характерно для ХЛЛ и чаще всего в таких случаях речь идет о других заболеваниях. Гепатомегалия наблюдается нечасто и обычно появляется позже, чем спленомегалия.
В начале заболевания жалобы обычно отсутствуют. С течением времени появляются жалобы на повышенную утомляемость, слабость и главным образом на резкую потливость, особенно в жаркое время года.
У большинства пациентов процесс отличается медленным развитием и в течение ряда лет довольно успешно контролируется терапией. При современной терапии продолжительность жизни большинства больных составляет 7–10 лет и более.
Существуют две современные классификации ХЛЛ, делящие его на стадии в зависимости от клинических проявлений. Одна из них предложена в 1975 г. американскими учеными K. Rai и его коллегами, она используется преимущественно в США (табл. 1). Другая классификация опубликована в 1981 г. французскими учеными J. L. Binet и соавторами, она получила распространение в Европе и в нашей стране (табл. 2). В основу обеих классификаций положен единый принцип: учет массы опухоли и ее распространения, отражением чего являются: количество лейкоцитов, лимфоцитоз, размеры лимфоузлов, печени и селезенки, наличие или отсутствие угнетенных здоровых ростков кроветворения. Этот последний фактор оказывает даже большее влияние на продолжительность жизни больных, чем объем опухолевой массы.
В связи с гипогаммаглобулинемией, которая постепенно углубляется по мере прогрессирования заболевания и к 7–8 годам болезни отмечается у 70% больных, при ХЛЛ имеется повышенная склонность к развитию оппортунистических инфекций, чаще всего легочных.
Инфекционные осложнения при ХЛЛ могут возникнуть в любой стадии заболевания, в том числе и в начальной, но гораздо чаще они развиваются у больных с выраженными клинико-гематологическими проявлениями болезни. Этот факт показывает, что не следует откладывать лечение больного даже в пожилом возрасте и при наличии других заболеваний, если есть признаки прогрессирования ХЛЛ.
Терминальная стадия ХЛЛ чаще всего характеризуется рефрактерностью к терапии и учащением инфекционных эпизодов без каких-либо изменений прежней картины крови. Инфекции становятся причиной смерти большинства больных. Лечение инфекций у больных ХЛЛ должно начинаться немедленно при их возникновении и до получения данных бактериологического анализа проводиться антибиотиками широкого спектра, лучше всего в стационаре.
Помимо инфекционных, для ХЛЛ характерны аутоиммунные осложнения — аутоиммунная гемолитическая анемия (АИГА) и аутоиммунная тромбоцитопения. АИГА развивается в течение заболевания у 10–25% больных ХЛЛ. Аутоиммунный гемолиз эритроцитов может носить характер остро и бурно развившегося гемолитического криза, сопровождаясь повышением температуры, появлением желтушного окрашивания кожи и темной окраски мочи, увеличением содержания непрямого билирубина в сыворотке. Быстрое развитие и прогрессирование анемии становится причиной резкого ухудшения состояния больного и может быть опасным для жизни, особенно при наличии сопутствующих заболеваний сердца или легких. Чаще аутоиммунный гемолиз развивается постепенно. Иммунная тромбоцитопения встречается реже, чем АИГА, всего в 2–3% случаев, но может быть опасней, чем АИГА, из-за часто возникающих жизненно опасных кровотечений или кровоизлияний в головной мозг, становящихся причиной смерти больных.
Аутоиммунные осложнения всегда требуют лечения. Чаще всего для этого применяются кортикостероидные гормоны в высоких дозах — 1–2 мг/кг веса в расчете на преднизолон.
В лечении ХЛЛ в настоящее время имеются широкие возможности. До начала ХХ в. терапия всех лейкозов была одинаковой: мышьяк, уретан, симптоматическое лечение. С 1902 г. основным средством лечения хронических лейкозов стала рентгенотерапия, которая при ХЛЛ оставалась ведущим лечебным методом на протяжении 50 лет. Она давала хороший местный эффект, но не меняла темпов развития болезни: средняя продолжительность жизни при симптоматическом лечении составляла 40 мес, при рентгенотерапии — 42 мес.
Современная эра в терапии ХЛЛ началась с середины ХХ столетия, когда были получены данные об уменьшении лимфоидной пролиферации под влиянием стероидных гормонов. Широкий диапазон действия быстро сделал стероидные гормоны универсально используемым средством при этом заболевании. Однако кратковременность достигнутого эффекта, неизбежно наступающая при длительном приеме, снижение эффективности, наличие серьезных побочных явлений и нередкие осложнения сузили область применения гормональной терапии при ХЛЛ, оставив на первом месте среди показаний к ее назначению аутоиммунные осложнения.
Важнейшим событием в развитии терапии ХЛЛ было появление алкилирующих препаратов. Первый из них — хлорамбуцил — используется в настоящее время. Терапия хлорамбуцилом или его комбинация с преднизолоном в случаях медленного нарастания лейкоцитоза позволяет на определенное время контролировать проявления болезни. Продолжительность жизни больных ХЛЛ при такой терапии составляет 55–60 мес. Вместо хлорамбуцила нередко используется циклофосфамид. Терапия хлорамбуцилом или циклофосфамидом и их комбинация с преднизолоном у подавляющего числа больных позволяют получать лишь частичные ремиссии. Стремление улучшить имеющиеся результаты привело к созданию в 70–80-е годы ХХ в. комбинированных лечебных схем, включающих циклофосфамид, преднизолон, винкристин и какой-либо из антрациклинов (Рубомицин, Адрибластин или Идарубицин). Наибольшее распространение получили схемы COP, CHOP и CAP. Эти схемы позволяют у большинства больных добиться сокращения размеров лимфоузлов и селезенки и уменьшить количество лейкоцитов, а в результате проведения нескольких курсов у 30–50% больных получить даже полные ремиссии, которые, однако, всегда оказываются кратковременными. Международные рандомизированные исследования показали, что продолжительность жизни при использовании этих лечебных схем не превосходит полученную при лечении ХЛЛ хлорамбуцилом и преднизолоном.
При лечении флударабином ремиссии, нередко полные, удается получить у большинства больных, в том числе и рефрактерных ко всем другим средствам. Однако со временем выяснилось, что даже полные ремиссии после лечения флударабином, хоть и являются, как правило, довольно длительными, все же временны. Это стало причиной разработки комбинированных схем терапии, содержащих флударабин и какой-либо другой препарат — циклофосфамид, митоксантрон, доксорубицин.
Наиболее эффективным и вызывающим менее всего серьезные побочные явления оказалось сочетание флударабина с циклофосфамидом. Многочисленные исследования, проведенные в разных странах, показали, что эта комбинация препаратов позволяет получить ремиссии у 70–80% ранее леченных и у 90–95% ранее нелеченных больных ХЛЛ, при этом у многих ремиссии, особенно полные, имеют продолжительность 20–28 мес. Эта комбинация оказалась эффективной даже у ряда больных, рефрактерных к предыдущей комбинированной терапии и, что не менее важно, при повторном использовании в случае возникновения рецидива.
В конце 1990-х годов появился флударабин для перорального приема. Его эффективность в соответствующей дозе аналогична эффективности внутривенного препарата. Появление флударабина для приема внутрь позволяет комбинировать его с пероральной формой циклофосфамида. Эта комбинация очень удобна для больных, особенно пожилого возраста, так как избавляет их от необходимости посещения поликлиники для внутривенных инъекций препаратов.
Новым и важнейшим этапом в лечении ХЛЛ стало появление и внедрение в клиническую практику моноклональных антител. Первым в терапии ХЛЛ стал применяться препарат ритуксимаб (Мабтера) — моноклональные антитела к антигену CD20. Антиген CD20 — это фосфопротеин, часть молекулы которого располагается на поверхности клетки, другая — в цитоплазме. Он участвует в доставке кальция к ядру клетки. Антитела к антигену CD20 — это химерные антитела, имеющие вариабельный мышиный и константный человеческий регион IgG. Соединение антител с антигеном CD20 индуцирует в клетке сигналы апоптоза.
При ХЛЛ имеется малая плотность молекул антигена CD20 на лимфоцитах, поэтому антитела к этому антигену при ХЛЛ в монорежиме оказались эффективными лишь в больших дозах. Ко времени появления ритуксимаба (Мабтеры) флударабин показал себя как наиболее эффективный препарат в терапии ХЛЛ, поэтому были предприняты исследования эффективности сочетания ритуксимаба и флударабина. Они показали, что это сочетание высокоэффективно как у ранее леченных, так и у нелеченых больных: частота ремиссий у ранее леченных составляет 60–70%, у нелеченых — 90–95%, у половины больных достигаются полные ремиссии. После такого лечения у большинства ранее нелеченных больных ремиссии сохраняются 2 года и дольше. Сочетание флударабина, циклофосфамида и ритуксимаба позволяет получить эффект у 95–100% ранее нелеченных больных и у ранее получавших терапию хлорамбуцилом (Лейкераном) или сочетанием преднизолона, винкристина, циклофосфамида (СОР), а у 70–75% больных достигаются полные ремиссии.
Терапия ритуксимабом оказалась эффективной и у ряда больных с аутоиммунной анемией и тромбоцитопенией. В этих случаях ее применяют либо в монорежиме, либо в сочетании с преднизолоном или с СОР.
Еще более высокие результаты могут быть достигнуты при использовании антител к антигену CD52 (Alemtuzumab, Campath-1H).
Антиген CD52 — это гликопротеин, который экспрессирован на мембране большинства зрелых нормальных и опухолевых Т- и В- лимфоцитов, эозинофилов, моноцитов и макрофагов, но не обнаружен на мембране стволовых клеток, эритроцитов и тромбоцитов. Его функция в клетке до сих пор не выяснена. В то время как антиген CD20 экспрессирован на патологических лимфоцитах при ХЛЛ с плотностью примерно 8000 молекул на клетку, плотность молекул антигена CD52 очень высока — примерно 500 000 молекул на клетку.
Campath-1H — это гуманизированные антитела, в которых только маленький участок, непосредственно связывающийся с антигеном, является крысиным IgG2a, вся остальная часть молекулы антитела — человеческий IgG1.
Применение Campath-1H часто оказывается эффективным даже у больных, получивших несколько курсов лечения флударабином и ставших к нему резистентными. В большом многоцентровом международном исследовании Campath-1H получили 152 пациентов, рефрактерных к флударабину, у 42% получены ремиссии, в том числе у 5% — полные. Этот результат свидетельствует о высокой эффективности Campath-1H, поскольку резистентность к флударабину — крайне неблагоприятный прогностический признак.
Дальнейшие исследования показали, что применение препарата у ранее нелеченных больных позволяет получить эффект в 80% случаев, у 2/3 больных можно получить полную костно-мозговую ремиссию.
Еще лучшие результаты были получены при комбинации Campath-1H с флударабином (FluCam) у 36 больных ХЛЛ, которые ранее получали флударабин с ритуксимабом или ритуксимаб в сочетании с комбинацией препаратов, включающей алкилирующие агенты. Эффект был достигнут у 83% этих тяжелых и плохо отвечающих на терапию больных, при этом у 30% были получены полные ремиссии. Медиана продолжительности жизни в этой группе составила 35,6 мес и не была достигнута за время наблюдения у больных с полной ремиссией. У двух больных с аутоиммунной анемией, имевшейся до начала лечения, к концу терапии уровень гемоглобина полностью нормализовался без гемотрансфузий и все признаки гемолиза исчезли.
В нескольких исследованиях Campath-1H был использован в качестве консолидирующей терапии у больных, эффективно леченных флударабином. В самом большом исследовании, включившем 56 больных, после флударабина полные ремиссии отмечены у 4%, частичные у 52% больных, после добавочного лечения Campath-1H число полных ремиссий возросло до 42%, число частичных ремиссий составило 50%, таким образом общий эффект увеличился с 56% после лечения флударабином до 92% после добавочного лечения Campath-1H.
Лечение Campath-1H должно проводиться только в стационаре под наблюдением гематологов, так как в связи с резким уменьшением в результате лечения количества не только В-, но и Т-лимфоцитов без профилактических мер у больного часто развиваются осложнения. Наиболее грозное осложнение лечения Campath-1H — частое присоединение инфекций. Самым опасным является развитие септицемии, пневмоцистной пневмонии, системного аспергиллеза или кандидоза, появление распространенного herpes zoster, реактивация цитомегаловирусной инфекции. Учитывая эту опасность, при проведении лечения и не менее 2 мес после его окончания больной профилактически должен получать Бисептол (для профилактики пневмоцистной пневмонии), противогрибковые и антивирусные средства. При обнаружении реактивации цитомегаловируса проводится лечение ганцикловиром, при появлении грибковой инфекции — лечение противогрибковыми препаратами высокой эффективности.
Несмотря на возможные осложнения, применение Campath-1H становится все более распространенным. Те положительные результаты, которые достигаются при его применении, поставили его в ряд наиболее эффективных препаратов в терапии ХЛЛ.
Анализ возможностей терапии ХЛЛ на протяжении столетия показывает, что в течение последних двух десятилетий ХЛЛ из неизлечимого заболевания превратился в заболевание, которое в большинстве случаев при своевременном начале можно успешно лечить, продлевая жизнь и соматическое благополучие больных, и которое в настоящее время стало принципиально излечимым.
Литература
- Руководство по гематологии/ под ред. А. И. Воробьева. М.: Ньюдиамед, 2005.
- Клиническая онкогематология / под ред. М. А. Волковой. М.: Медицина, 2001.
- Chronic lymphoid leukemias edited by B. D. Cheson, Marcell Dekker A.G. New York, 2001.
- Волкова М. А., Бялик Т. Е. Ритуксимаб в терапии аутоиммунных осложнений при хроническом лимфолейкозе// Гематология и трансфузиология. 2006. № 3. С. 11–17.
- Волкова М. А. Моноклональные антитела к антигену CD52: оптимизация терапии хронического лимфолейкоза// Гематология и трансфузиология. 2006. № 2. С. 27–33.
М. А. Волкова, доктор медицинских наук, профессор
Онкологический научный центр им. Н. Н. Блохина РАМН, Москва
Профилактика и лечение инфекционных осложнений острого лейкоза. Лечение инфекций при лейкозе
У многих пациентов уже до начала лечения выявляются лихорадка и нейтропения. Нераспознанные инфекции могут быстро диссеминировать и закончиться фатально, поэтому недопустима отсрочка назначения антибиотиков до появления развернутой клинической картины.
Наиболее важным предрасполагающим фактором развития инфекций является нейтропения. Риск инфекции зависит от уровня и длительности постцитостатической нейтропении и возрастает при количестве нейтрофилов меньше 1 • 10 9 /л.
При развитии агранулоцитоза (нейтрофилов меньше 0,5 • 10 9 /л) вероятность инфекции очень велика, а при количестве нейтрофилов меньше 0,1 • 10 9 /л инфекции развиваются у большинства пациентов и имеют чрезвычайно тяжелое течение.
До середины 1980-х годов грамотрицательные бактерии кишечного происхождения были причиной 70-80% бактериальных инфекций у больных острым лейкозом. В настоящее время 60-80% бактериальных инфекций вызывается грамположительными микроорганизмами. Это обусловлено:
1) использованием сосудистых катетеров;
2) проведением деконтаминации кишечника, подавляющей грамотрицательную микрофлору;
3) выбором антибактериальных препаратов для эмпирической антибактериальной терапии.
Наряду с бактериальными инфекциями большое значение у больных с нейтропенией имеют грибковые (кандидоз, аспергиллез), вирусные (вызванные herpes simplex и zoster, ЦМВ) и протозойные инфекции.
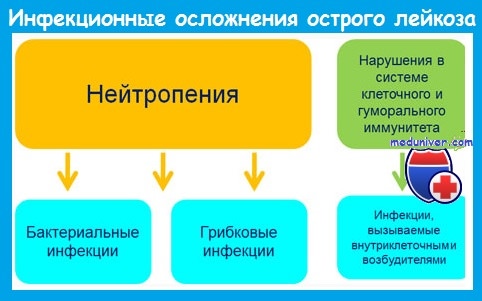
Инфекционные осложнения при остром лейкозе отличаются атипичным течением. Это обусловлено следующими обстоятельствами:
1) агранулоцитоз существенно изменяет реакцию организма на инфекционный агент, что клинически чаще всего проявляется развитием фебрильной температуры без других признаков локальной или системной инфекции;
2) многие антибиотики нарушают микрофлору больного, подавляют чувствительные микроорганизмы и способствуют пролиферации резистентных бактерий и грибов рода Candida (суперинфекция);
3) большое влияние на защитные механизмы оказывает химиотерапия, вызывающая миелосупрессию и повреждение эндотелия;
4) глюкокортикостероиды, часто вводимые больным как часть специфической терапии, также отрицательно влияют на защитные механизмы;
5) интубация, зондовое энтеральное питание и использование сосудистых катетеров вызывают нарушение целостности кожных покровов и/или повреждение слизистых оболочек.
В связи с высокой вероятностью развития инфекционных осложнений у больных острым лейкозом разработан комплекс профилактических мероприятий:
1) изоляция больного в период нейтропении, которая обеспечивает снижение частоты инфекций, передающихся воздушно-капельным путем;
2) обработка кожи и слизистых оболочек дезинфицирующими растворами (хлоргексидин и др.);
3) деконтаминация кишечника (per os назначаются неабсорбируемые антибактериальные препараты, например канамицин, и противогрибковые средства, чаще всего нистатин или суспензия амфотерицина В), позволяющая снизить количество грамотрицательных организмов кишечного происхождения;
4) гигиена ротовой полости (регулярное полоскание и использование мягких зубных щеток с целью предотвращения травмирования десен);
5) системная профилактика (бисептол или фторхинолоны);
6) отказ от ректальных и вагинальных манипуляций (кроме проводимых по неотложным и жизненным показаниям);
7) назначение препаратов гранулоцитарного или гранулоцитарно-моноцитарного колониестимулирующего фактора (КСФ) для более быстрого восстановления нейтрофилов и уменьшения вероятности инфекционных осложнений.
Показанием к назначению эмпирической антибактериальной терапии на фоне агранулоцитоза является фебрильная температура тела (выше 38 °С) более 2 часов, не связанная с инфузиями или аллергическими реакциями. Оптимально сочетание антипсевдомонального пенициллина или цефалоспорина с аминогликозидом.
Допустима монотерапия цефалоспорином 3-го или 4-го поколения или карбепенемом, например имепенемом. При отсутствии эффекта в течение 2-3 суток необходимо дополнение эмпирической антибактериальной терапии ванкомицином; в случае сохранения лихорадки в течение 4-6 дней назначается амфотерицин В в связи с высокой вероятностью системной грибковой инфекции. После идентификации возбудителя проводится целенаправленная антибактериальная, противовирусная и антимикотическая терапия.
Антибактериальная терапия проводится до повышения абсолютного содержания нейтрофилов в крови больше 0,5 • 10 9 /л и нормализации температуры тела. Длительность терапии у пациентов с документированной инфекцией должна быть не менее 10-14 дней.
Трансфузии гранулоцитов используются крайне редко. Единственным показанием к трансфузии является развившийся на фоне агранулоцитоза бактериальный сепсис при отсутствии ответа на адекватную антибактериальную терапию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Новые методы лечения острых лейкозов
Современная стратегия химиотерапии острого лейкоза, разработанная 20—25 лет назад и претерпевшая за это время определенные изменения в плане интенсификации, к сожалению, уже не может принципиально изменить результаты лечения: ни частоты достижения ремиссий, ни долгосрочной выживаемости.
Эффективность стандартной химиотерапии, по-видимому, еще может быть повышена, но в основном благодаря усовершенствованию тактики выхаживания пациентов после цитостатического воздействия. Собственно антилейкемический потенциал самой стратегии химиотерапии уже исчерпан, поэтому все современные исследования в лейкозологии направлены на поиск и внедрение новых, порой не связанных с цитостатическими эффектами способов воздействия на лейкемические клетки. Основные направления этой работы отражены в таблице.
Данные, представленные в таблице, отражают лишь те новые подходы, которые были испытаны в клинических исследованиях I—II и даже III фаз. Безусловно, не перечислены еще многие исследовательские работы, в основном те, которые не вышли из рамок поисковых. К ним относится, например, так называемая вакцинация:
1) введение в организм больного собственных лейкемических клеток (аутологичная клеточная вакцина), в которые с помощью ретровирусов были введены гены определенных молекул (например, В7-1), являющихся мощными костимуляторами Т-клеточного ответа;
2) коммитирование и культивирование, а затем введение в организм больного собственных дендритных (антигенпрезентирующих) клеток, полученных из лейкемических, с целью усиления иммунного ответа на опухолевые антигены.
Традиционным направлением многих исследований является разработка новых противоопухолевых препаратов. Особого внимания заслуживают ингибиторы тирозинкиназ, в частности c-ABL-тирозинкиназа (Гливек). Этот препарат полностью изменил терапевтические подходы в лечении ХМЛ. В программах терапии острого лейкоза его используют в случае обнаружения химерного транскрипта BCR-ABL или t(9;22).
У 30 % больных острым миелоидным лейкозом выявляют мутации гена FLT3, продуктом которого является FLT3-тирозинкиназа. Проведены первые клинические испытания II фазы по применению ингибиторов FLT3 тирозинкиназы.
Новые подходы в терапии острых лейкозов
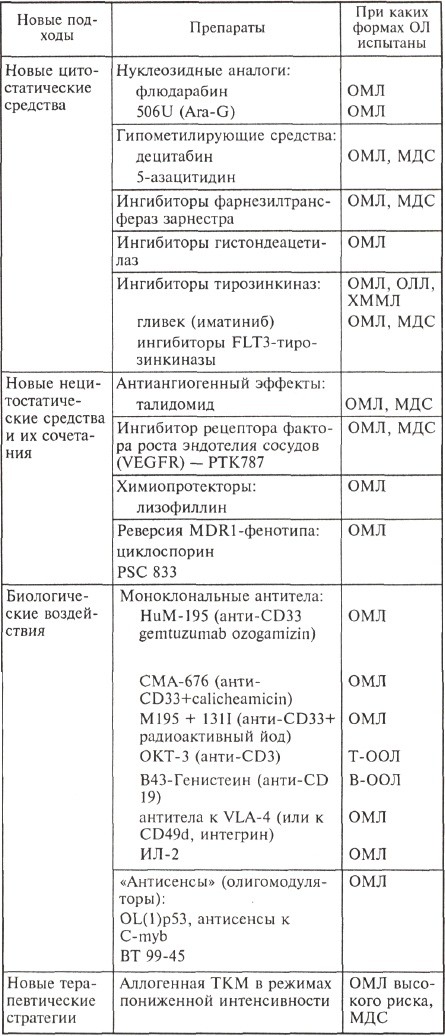
При использовании молекулы РКС412 были зафиксированы выраженные эффекты у больных с рефрактерным острым миелоидным лейкозом. Так, из 20 больных у одного достигнута полная ремиссия, у 6 отмечено значительное (более чем в 100 раз) уменьшение числа властных клеток в крови, у 7 больных оно составило на 50 % от исходного. Аналогичные эффекты наблюдались и при использовании другого ингибитора FLT3-тирозинкиназы - СЕР-701.
Ингибиторы гистондеацетилаз — это препараты, которые влияют на процесс транскрипции. Создано несколько молекул различных классов: производные бутировой кислоты — ВА (пивалоилоксиметил бутират, бутироилоксиалкиловые эфиры глутаровой и никотиновой кислот, бутироилоксиметиловые эфиры); диэтиловый эфир фосфорной кислоты; субероиланилидгидроксаминовая кислота (SAHA); циннамил гидроксамат LAQ824 и др.
Большинство из этих молекул демонстрирует высокую активность в лабораторных условиях на клеточных линиях острого лейкоза. Клинические исследования проводят лишь с единичными препаратами. Так, применение SAHA у больных с периферическими Т-клеточными лимфомами позволило у 5 из них получить частичную ремиссию, у 5 — стабилизацию. У 25 больных рефрактерным острым миелоидным лейкозом исследование I фазы по применению ингибитора гистондеацитилаз МС-275 было не столь эффективным — получены лишь незначительные гематологические эффекты.
Создается впечатление, что в скором времени из огромного числа синтезируемых ингибиторов гистондеацетилаз будут отобраны наиболее эффективные препараты.
В настоящее время проходят клинические испытания препараты из новой группы лекарственных средств — ингибиторы фарнезилтрансферазы. Основой для разработки использования этих препаратов стали исследования, свидетельствующие об увеличении частоты мутаций онкогена RAS у больных острым миелоидным лейкозом. RAS-протеины являются важным звеном в цепи передачи сигналов внутри клетки и становятся функционально активными после присоединения фарнезильтных остатков с помощью фарнезилтрансферазы.
Результаты первых клинических испытаний препарата типифарниба (R115 777, Зарнестра) свидетельствуют об его определенной активности: общий гематологический эффект отмечен у 37 % больных острым миелоидным лейкозом старше 60 лет.
Нуклеозидные аналоги завоевывают место в программах лечения не только острый миелоидный лейкоз и хронических лимфопролиферативных заболеваний, определенный оптимизм внушает эффективность некоторых из них при остром лимфобластном лейкозе. Так, арабинозилметоксигуанин (Ara-G или 506U), вводимый в дозе 40—50 мг/кг внутривенно 1 раз в день в течение 5 дней, позволил добиться полной ремиссии у 44 % и частичной ремиссии у 32 % больных с рецидивами Т-клеточного острого лимфобластного лейкоза.
Анализ работ по применению гипометилирующих агентов — 5-азацитидина и 5-аза-деоксицитидина (децитабина) — позволяет сделать заключение о более высокой эффективности децитабина. Его применение в дозе 50—75 мг/м2 в виде постоянной инфузии в 1—3-й день позволяет получить полную ремиссию у 30—37 % больных ОМЛ или МДС из группы высокого риска. При использовании децитабина в сочетании с антрациклинами или амсакрином полный ответ отмечен у 35 % больных ОМЛ из группы высокого риска. Следует подчеркнуть, что клинических исследований по изучению этих препаратов еще очень мало, и требуется время, чтобы реально оценить эффективность каждого из них.
Бесспорным является лишь тот факт, что эти средства обладают уникальным механизмом действия: помимо гипометилирующих эффектов (а гиперметилирование ДНК является признаком опухолевой устойчивости и прогрессии), они вызывают клеточную дифференцировку, активируют супрессорные гены и могут in vitro ингибировать пролиферацию клоногенных лейкемических клеток.
Очень интересным направлением в разработке новых противоопухолевых препаратов является создание средств, влияющих на ангиогенез. Талидомид как антиангиогенный препарат давно занял прочное место в лечении множественной миеломы, однако его эффективность при ОЛ и миелодисплазиях незначительна. К новым средствам относятся молекулы, ингибирующие рецепторы ростового фактора эндотелия сосудов (VEGFR). Показано, что ОЛ, при которых бластные клетки экспрессируют VEGFR в больших количествах, отличаются неблагоприятным прогнозом. В испытаниях I фазы исследователи отметили незначительную эффективность ингибитора VEGFR — PTK787 при минимальной токсичности.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

