Схема лечения герпеса в сша
Обновлено: 25.04.2024
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Резюме: Широкое распространение герпетической инфекций урогенитального тракта и ее социальные последствия обуславливают необходимость проведения специфического лечения. Активность клинических проявлений заболевания напрямую связана с состоянием иммунной системы организма, которая непосредственно влияет на развитие инфекционного процесса. Применение ректальных суппозиториев панавир, обладающих противовирусным и иммуномодулирующим действием было эффективным при лечении генитального герпеса у 90 % исследуемых. Препарат < снижает длительность проявлений простого герпеса и увеличивает ремиссию у пациентов с легким и среднетяжелым течением процесса. Предлагаемый метод терапии позволяет усовершенствовать лечение герпетической инфекции.
Важность изучения герпес вирусных инфекций обусловлена чрезвычайно высокой инфицированностью - до 95% и заболеваемостью - более 60% населения во всем мире, причем наблюдается выраженная тенденция к их неуклонному росту во всех возрастных группах [1,4,5] . Вирусы простого герпеса являются политропными агентами: играют существенную патогенетическую роль в развитии многих тяжелых поражений практически любых органов и систем, с преимущественным поражением того или иного органа [2] . Течение инфекции может быть различным: от бессимптомного выделения вируса, до очень болезненных обширных изъязвлений с четкими границами [1,3,9,14] . Рецидивы простого герпеса могут возникать от одного раза в год и реже, до нескольких обострений в месяц. Активность клинических проявлений заболевания напрямую связана с состоянием иммунной системы организма, которая непосредственно влияет на развитие инфекционного процесса [3,] . Как правило, у пациентов страдающих рецидивирующими герпес-вирусными заболеваниями (герпес кожи и слизистых оболочек, генитальный герпес, нейроинфекции и т.д.), имеется изолированный или сочетанный дефект компонентов специфического противогерпетического иммунитета – специфический иммунодефицит [1] . Триггерными факторами обострений служат стрессы, механические травмы слизистых, инфекционные заболевания, сопровождающиеся лихорадкой, переохлаждение, УФ-облучение, циклические (менструации) изменения гормонального статуса [1.2] . У пациентов сексуально активного репродуктивного возраста могут отмечаться неврастенические и депрессивные состояния, т.к. частые рецидивы нарушают нормальную половую жизнь, нередко препятствует созданию семьи, планированию беременности, что в свою очередь ухудшает течение герпетической инфекции 2 .
Поскольку простой герпес является пожизненной инфекцией и элиминации возбудителя в настоящее время достичь невозможно, в тактике лечения выделяют следующие задачи: ослабление выраженности клинических симптомов инфекции (зуд, жжение, боль, лихорадка); сокращение срока полной эпителизации поражений; уменьшение частоты и тяжести рецидивов; предупреждение передачи инфекции половому партнеру.
В последнее время синтезированы и широко используются новые противовирусные препараты этой группы валтрекс и фамвир, в которых преодолен основной недостаток ацикловира – низкая биодоступность при пероральном применении.
В настоящее время существует два варианта терапии рецидивирующего герпеса с использованием аналогов нуклеозидов эпизодическая, чтобы сократить длительность и выраженность клинических проявлений, и супрессивная, чтобы уменьшить частоту рецидивов. Эпизодическая терапия подразумевает пероральный прием препаратов в момент обострения инфекции. Такой режим оптимален у пациентов с редкими клиническими проявлениями. Терапия наиболее эффективна в период продромы или впервые дни высыпаний.
Супрессивная терапия (назначение препарата ежедневно) в 80% случаев предотвращает рецидивы герпеса у пациентов с тяжелым течением процесса.
Противовирусная химиотерапия способствует клиническому улучшению у большинства пациентов с проявлениями заболевания. Однако химические аналоги нуклеозидов не влияют на риск, частоту или тяжесть рецидивов после прекращения лечения. Значительной проблемой является прогрессивное увеличение ацикловир устойчивых штаммов вирусов. Применяемые в современной клинической практике методы иммунотерапии не дают гарантированный клинико-лабораторный эффект при профилактике и лечении герпес-вирусных заболеваний, а кроме того не являются безопасными и плохо контролируются. Становится очевидным необходимость поиска безопасных, высокоэффективных противовирусных средств, также обладающих иммуномодулирующим действием.
Подобным требованиям отвечает Панавир препарат растительного происхождения - очищенный экстракт побегов растения Solanum tuberosum - биологически активный полисахарид.
Целью работы являлось определение клинической эффективности применения ректальных суппозиториев Панавир в терапии пациентов с рецидивирующим генитальным герпесом.
Материалы и методы
Под наблюдением находились 30 больных с рецидивирующей герпетической инфекцией гениталий в возрасте от 20 до 40 лет и давностью заболевания от 12 до 36 месяцев.
Диагностику генитального герпеса проводили при помощи исследования соскобов из уретры, вагины и цервикального канала с выявлением ДНК ВПГ12 типа методом ампфликации нуклеиновых кислот полимеразной цепной реакцией (ПЦР).
Кратность обследования
Осмотр кожи и слизистых гениталий проводили 1раз в 5 дней в течение трех недель, далее 1 раз в месяц 3 месяца.
Забор материала для лабораторных исследований проводился до и через месяц после окончания лечения.
Изучение эффективности, переносимости и безопасности препарата проводилось на основании:
динамики субъективных и объективных симптомов,
отсутствия ДНК ВПГ1/2 в соскобах из урогенитального тракта после лечения при типировании методом ПЦР,
По степени тяжести генитального герпеса больные распределились следующим образом: легкое течение с рецидивами 3-4 раза в год имели 12 человек и средней тяжести с проявлениями 5-6 раз в год 18 пациентов. Методика лечения заключалась в назначении Панавира по 1 суппозиторию ректально на ночь. Процедура повторялась через день 5 свечей на курс. Лечение начинали в период продромы или в 1 -3 день рецидива.
Результаты исследования
До лечения у всех 30 больных в соскобах из урогенитального тракта выделена ДНК ВПГ1/2 типа.
В период продромы обратились 10 человек из них 7 со средней тяжестью процесса и 3 с легким течением. При применении суппозиториев Панавир в продромальный период абортирование рецидива отмечено у 8 (80%) больных: (2 легкое течение и 4 средней тяжести).
В 1-3 день рецидива герпеса начали лечение суппозиториями Панавир 20 больных, 9 человек с легким течением заболевания и 11 пациентов с процессом средней тяжести. Высокая эффективность терапии наблюдалась у 6 человек, все больные начали лечение в 1 день высыпаний, рецидив купировался за 2 дня. Лечение было эффективным у 10 больных. Продолжительность рецидивов уменьшилась в 1,5-2 раза по сравнению с данными до лечения (6,02 ± 0,4 дней) и составила в среднем 3,8 ± 0,51 дня. Применение суппозиториев панавир не повлияла на длительность рецидива у 2 пациентов.
На основании полученных данных можно констатировать, что положительный клинический эффект при лечении генитального герпеса суппозиториями панавир наблюдался у 96 % исследуемых. Необходимо отметить, что все пациенты лечение переносили хорошо: побочных явлений и аллергических реакций не отмечалось. После курса терапии суппозиториями панавир при исследовании соскобов из урогенитального тракта при помощи ПЦР через 21-28 дней ДНК ВПГ1/2 типа не определялась у 28 пациентов.
При наблюдении за больными в период 90 дней после проведенного лечения длительная ремиссия наблюдалась у 29 пациентов.
Выводы:
1.Использование ректальных суппозиториев Панавир в период продромальных явлений способствовало абортированию рецидива у пациентов с легкой и средней тяжестью течения генитального герпеса.
2. Применение Панавира увеличило период ремиссии у 90,6% больных.
3. При наблюдении за больными в течение 3 месяцев после лечения суппозиториями панавир ремиссия отмечалась у 96% человек.
5. Высокая клиническая эффективность и безопасность, хорошая переносимость суппозиториев Панавир, отмеченные у абсолютного числа пролеченных пациентов, позволяет рекомендовать препарат к широкому применению в терапии генитального герпеса.
6. Панавир можно применять у пациентов с непереносимостью синтетических нуклеозидов, и в тех случаях, когда наблюдается резистентность к ацикловиру.
Литература
1. Аковбян В.А., Масюкова С.А. и др. Генитальный герпес: современные проблемы и пути их решения. Клинич. микробиол. и антимикроб. химиотер. 2003; 1 (5): 4–18.
2. Гранитов В.М. Герпесвирусная инфекция. М.: Медицинская книга, 2001.
3. Молочков В.А., Семенова Т.Б. Генитальный герпес: клиника, диагностика, лечение и профилактика. М., 2005.
4. Ramaswamy M, McDonald C et al. The epidemiology of genital infection with Herpes simplex virus types 1 and 2 in genitourinary medicine attendees in inner London. Sex Transm Infect 2005; 81 (4): 306.
5. Sanchez-Aleman MA, Conde-Glez CJ et al. Sexual behavior and Herpes simplex virus 2 infection in college students. Arch Med Res 2005; 36 (5): 74–80.
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Именно эти виды герпеса ответственны за появление высыпаний – на коже лица, губах, слизистой оболочке полости рта, а также они являются причиной и генитального герпеса. Нужно отметить, что если раньше вирус герпеса ВПГ-2 – ассоциировался только с развитием генитального герпеса, то сейчас он также вызывает и герпес на лице, губах и слизистой оболочке рта – примерно у 10% пациентов. Герпес типа ВПГ-2 более патогенен (чем ВПГ-1), и у таких пациентов всегда наблюдаются – как более тяжелые клинические проявления, так и более высокая частота рецидивов.
Герпес: фото
Вирус простого герпеса клинически проявляется образованием группы скученных пузырьков, располагающихся на воспаленном основании (коже или слизистой оболочке). Пузырьки сначала заполнены прозрачным содержимым, которое достаточно быстро становится мутным. Если у вас появился герпес – лечение обязательно нужно начать до момента вскрытия герпетических пузырьков. В противном случае не только мазь от герпеса, но и самые лучшие таблетки от герпеса – уже не позволят хоть как-то заметно ускорить заживление.
Как выглядит герпес –
Вирус герпеса (как происходит заражение) –
Изначально дети рождаются с иммунитетом к вирусу герпеса – благодаря антителам, которые достаются каждому ребенку от матери (еще в период беременности). Однако постепенно количество антител уменьшается, и обычно в период от 6 месяцев до 3 лет максимум – у ребенка развивается первичная герпетическая инфекция. Обычно она протекает в виде первичного герпетического гингивостоматита. И в дальнейшем вирус герпеса сохраняется в организме на всю жизнь, периодически обостряясь.
Как передается герпес –
Лучшее средство от герпеса – это безусловно его профилактика, но ниже мы также расскажем и о специальных мазях и таблетках. Вы должны знать, что контактный путь является основным для передачи герпетической инфекции; более редким является воздушно-капельный путь передачи. Контактный путь передачи означает, что заражение вирусом герпеса происходит:
Наиболее заразными являются люди, имеющие клинические проявления герпеса – речь идет о целых или только что вскрывшихся герпетических пузырьках. Имейте в виду, что риск заражения не исчезает после образования корочек, а только чуть-чуть уменьшается. Современные исследования показывают, что заражение герпесом возможно даже от клинически полностью здорового человека.
Важно: у примерно 10% людей – вирус герпеса постоянно определяется в слюне (даже на фоне полного отсутствия у них каких-либо симптомов герпеса).
Из-за чего происходят рецидивы герпеса –
Под воздействием определенных пусковых факторов вирус активируется, вновь продвигается по нервным стволам к поверхностям кожи и/или слизистых оболочек – где и вызывает образование герпетических пузырьков (везикул). Рецидивы могут повторяться 1 или 2 раза в год, но иногда и намного чаще, что в конечном итоге зависит от состояния вашего иммунитета и нервной системы.
Факторы, которые вызывают рецидив герпеса –
- контакт с человеком, имеющим клинические проявления герпеса,
- снижение иммунитета на фоне гриппа или ОРВИ,
- иммунодефицитные состояния,
- переохлаждение, обезвоживание,
- физическая усталость и эмоциональный стресс,
- порезы и царапины кожи, например, после бритья,
- после визита к стоматологу (из-за того, что при длительном широком открывании рта происходит образование трещин в уголках рта),
- после инвазивных косметологических процедур,
- в период менструаций у женщин,
- длительное пребывание на солнце.
Симптомы герпеса –
Лабиальный герпес: фото
В зависимости от объема поражения кожи и тяжести клинических проявлений могут быть назначены либо крем для кожи с противовирусным действием, либо крем в комбинации с таблетированными противовирусными препаратами. Подробный обзор препаратов для лечения вы можете увидеть в конце статьи.
У детей герпетическому стоматиту очень часто сопутствует еще и гингивит. В этом случае (помимо множественных пузырьков и эрозий на каком-то участке слизистой оболочки полости рта) – можно увидеть ярко-красные воспаленные десны.
Общие симптомы герпеса –
первичная герпетическая инфекция может протекать с симптомами, похожими на грипп или ОРВИ (повышенная температура, мышечные боли и даже увеличение подчелюстных лимфатических узлов). Но такие острые симптомы наблюдаются только у 10% от всех заболевших. При повторных вспышках общее состояние организма обычно не нарушается.
Чем лечить герпес у взрослых (лекарства) –
Но, чтобы лечение герпеса было максимально эффективным – вы должны строго соблюдать следующие правила:
Терапия герпеса покажет хорошую эффективность, если она начата не позже 12 часов с момента появления первых герпетических высыпаний. Имейте в виду, что чем позже будет начато лечение – тем меньше будет эффективность даже самых лучших лекарств от герпеса.
Максимальную эффективность покажет терапия, которая начата еще в продромальном периоде (т.е. когда собственно герпетические пузырьки еще не появились, но пациент уже ощущает зуд, жжение или распирание тканей в этой области). Если лечение начинается в этот период, то количество и размер образовавшихся в дальнейшем герпетических пузырьков будет значительно меньшим, и в этом случае полное заживление может быть достигнуто всего за 4-5 дней.
Помните, что если вы начнете лечение позже 48 часов, либо уже после вскрытия герпетических пузырьков – такая терапия заметно не повлияет на скорость выздоровления (заживление очагов). Однако у пациентов с тяжело протекающими и частыми рецидивами – такая терапия может позволить избежать осложнений.
1. Выбираем мазь от герпеса –
Крем Зовиракс: оригинальный препарат ацикловира
Крем или мазь от герпеса с ацикловиром следует наносить на очаг поражения и кожу вокруг него – минимум 5 раз в день (но лучше каждые 2 часа пока вы не спите). Продолжительность терапии обычно составляет 5 дней, но в случае тяжелого герпетического поражения – длительность применения может быть увеличена до 7-10 дней. Нужно отметить, что форма в виде крема более предпочтительна перед мазью, т.к. из мазевой субстанции активные вещества значительно хуже проникают в кожу.
Стоит обращать внимание и на состав, например, эффективной концентрацией ацикловира является именно 5% (хотя в аптеках можно встретить и средства с 3% концентрацией). Кроме того, в составе желательно должны быть пропиленгликоль и/или цетомакрогол, которые увеличивают проникновение молекул ацикловира сквозь поверхностные слои кожи. Это важно, т.к. сам по себе ацикловир достаточно плохо проникает через эпидермис кожи и образующиеся корочки.
Лучшее средство от герпеса с ацикловиром –
На сегодняшний день лучший препарат для наружного применения от герпеса – это крем Зовиракс Дуо-Актив, который содержит комбинацию 5% ацикловира и 1% гидрокортизона. Ацикловир блокирует размножение вируса, а гидрокортизон уменьшает воспаление и отек. При этом, если применение крема начинается еще до появления герпетических пузырьков, то гидрокортизон иногда позволяет вообще предупредить их образование. Но если пузырьки и образуются, то их количество и размер будут меньшим, что уже само по себе позволит заметно ускорить заживление.
Недостатки препаратов на основе ацикловира –
ацикловир является устаревшим препаратом, но в принципе он неплохо работает у большинства пациентов (с некоторыми исключениями). Например, у пациентов с хорошим иммунитетом устойчивость вируса герпеса к ацикловиру встречается – в среднем всего в 3% случаев, что достаточно мало. Однако проблему составляют пациенты с ослабленным иммунитетом + частыми курсами применения ацикловира в прошлом – в таких группах пациентов устойчивость к ацикловиру может наблюдаться уже от 10 до 27% случаев.
Кроме того, молекулы ацикловира имеют очень низкую тропность к вирусу герпеса, что означает, что ацикловир обычно просто не находит какой-то процент вирусных частиц в клетках (к примеру у препаратов на основе пенцикловира/ фамцикловира – тропность в вирусу намного выше). Кроме того, молекулы ацикловира имеют свойство плохо проникать сквозь кожу, а также сквозь образующиеся корочки (к месту размножения вируса). Чтобы хоть как-то уменьшить эту проблему – часть производителей добавляют в состав наружных средств с ацикловиром пропиленгликоль и цетомакрогол.
Альтернативные наружные средства от герпеса –
Выше мы уже сказали, что у пациентов с ослабленным иммунитетом часто развивается устойчивость вируса герпеса к ацикловиру. Что делать таким пациентам? Международные рекомендации в этом случае говорят о необходимости применения курсов фамцикловира в таблетках – это такие препараты как Фавирокс или Фамвир. Таблетированные препараты на основе валацикловира (при подозрении на резистентность к ацикловиру) – применять не имеет смысла, т.к. валацикловир является предшественником ацикловира. Последнее означает, что при наличии устойчивости к ацикловиру – устойчивость будет и к валацикловиру.
Крем Девирс от герпеса –
К сожалению, клинических исследований эффективности местных средств на основе рибавирина – очень мало, и все они, на наш взгляд, имеют достаточно слабую степень доказательности. Знакомясь с исследованиями, мы обратили внимание на то, что этот препарат очень редко применялся в исследованиях в форме монотерапии (обычно его комбинировали – либо с пероральным рибавирином, либо с пероральным ацикловиром), что уже говорит о достаточно слабой эффективности крема. Поэтому наша редакция не может рекомендовать этот препарат для широкого применения – особенно для лечения герпеса губ и небольших поражений на лице. Но препарат вполне может использоваться в составе комплексной терапии, например, при генитальном герпесе.
Выбираем таблетки от герпеса –
Герпес лечение у взрослых: препараты в таблетках
- Ацикловир,
- Валацикловир,
- Фамцикловир.
1. Ацикловир в таблетках по 200 и 400 мг –
Таблетированный ацикловир обладает теми же недостатками, что и кремы: низкая тропность к вирусу (т.е. молекулы ацикловира плохо находят вирусные частицы); у пациентов с плохим иммунитетом + частыми курсами применения ацикловира в прошлом – в 10-27% случаев вирус герпеса может быть устойчив к ацикловиру; плюс низкая биодоступность при пероральном приеме. Плюсы – нет противопоказаний по возрасту, доступная цена, достаточно мало побочных эффектов.
Примеры препаратов с ацикловиром –

Ацикловир в таблетках безусловно работает, особенно если речь идет о пациентах с хорошим иммунитетом и редкими рецидивами герпеса. Если у вас ослабленный иммунитет, если слишком часто принимали ацикловир в прошлом, если вы решили начать принимать препарат более чем 24-48 часов с момента появления герпетических высыпаний – ацикловир не будет особенно эффективен. В этом случае вам лучше сразу начать принимать препарат Фамцикловир, который лучше работает даже при более поздних сроках начала терапии, а также у пациентов с иммунодефицитными состояниями.
Схема применения –
если смотреть официальную инструкцию, то стандартной схемой у взрослых и детей старше 2 лет – является прием ацикловира по 200 мг 5 раз в день (в течение 5 дней). Однократная дозировка 400 мг в официальной инструкции рекомендуется – либо только при тяжелом течении герпетической инфекции, либо у пациентов с ослабленным иммунитетом. Однако, большинство клинических исследований (источник) показывает, что дозировка 200 мг практически не влияет – ни на длительность симптомов, ни на время заживления герпеса.
Исследования показали, что эффективной однократной дозировкой является только 400 мг (соответственно, 5 раз в день, в течение 5 дней). У детей младше 2 лет дозировка уменьшается ровно в 2 раза – от взрослой дозировки. При тяжелом течении герпетической инфекции – прием препарата может быть продлен до 7-10 дней. Кстати, за рубежом, при хроническом рецидивирующем герпесе ацикловир в настоящий момент практически не применяют, отдавая предпочтение валацикловиру и фамцикловиру.
2. Таблетки Валацикловир (Валтрекс) –
Выше мы уже говорили, что таблетированный ацикловир имеет слабую биодоступность, т.е. всего около 10-20% от его количества всасывается в кишечнике, что затрудняет достижение высоких концентраций ацикловира в тканях. Эту проблему решает Валацикловир, имеющий биодоступность уже на уровне 50%. Валацикловир является предшественником ацикловира (т.е. он превращается в ацикловир, уже попав в кровь). Прием таблеток с валацикловиром позволяет создать такую концентрацию ацикловира в тканях, которую возможно достичь традиционным ацикловиром – только путем внутривенных инфузий последнего.
Схема приема –
существует короткая 1-дневная схема лечения. Клинические исследования показали, что прием высоких дозировок препарата в течение 1 дня – было наиболее эффективным для лечения герпеса на губах и коже лица, а также герпетического стоматита. В этом случае схема приема – по 2000 мг 2 раза в день, с интервалом 12 часов (всего 1 день). Но следует учесть, что такая короткая схема будет эффективной – только если лечение начинается не позже 12 часов с момента появления герпетических высыпаний, а также у пациентов с удовлетворительным или хорошим иммунитетом.
Если с момента появления высыпаний прошло больше 12 часов, а также если у вас ослабленный иммунитет – оптимально использовать стандартную схему лечения по 500 мг 2 раза в день, в течение 3-5 дней (при тяжелой форме герпетической инфекции – до 10 дней). При выборе препарата имейте в виду, что при устойчивости вашего вируса герпеса к ацикловиру – прием валацикловира у вас также будет неэффективен.
3. Таблетки Фамцикловир (Фавирокс, Фамвир) –
Преимущество препаратов фамцикловира типа Фавирокса – быстрый противовирусный эффект благодаря максимальной биодоступности (для фамцикловира она составляет около 74%, например, у валацикловира она всего 54%, а у ацикловира только 10-20%). Поэтому упаковки из трех таблеток по 500 мг – достаточно для короткого 1-дневного курса терапии для купирования проявлений герпеса на губе. Подробности о такой схеме применения – читайте ниже.

Схема применения фамцикловира –
существует короткая 1-дневная схема лечения: либо однократно принять 1500 мг, либо по 750 мг 2 раза в день (с 12 часовым интервалом между приемами) – наш опыт говорит о том, что второй вариант все-таки лучше. Такая 1-дневная схема эффективна только при условии, что вы начали прием препарата до 12 часов с момента появления герпетических высыпаний, а также при нормальном состоянии иммунитета у пациента. При ослабленном иммунитете, и/или если лечение начато позже 12 часов с момента появления герпетических высыпаний – нужно использовать стандартную схему применения.
Стандартная схема согласно инструкции – это по 250 мг 2 раза в день, в течение 5 дней (однако при тяжелой форме герпетической инфекции – прием может быть продлен до 7-10 дней). Тут хочется добавить, что многочисленные клинические исследования показывают слабую эффективность такой стандартной схемы – особенно у пациентов с плохим состоянием иммунной системы. Исследования показали, что эффективность терапии значительно возрастает при назначении фамцикловира в более высоких дозировках. У пациентов с хорошим иммунитетом более эффективной будет схема – по 500 мг 2 раза в день (в течение 5 дней). У пациентов с ослабленным иммунитетом – по 500 мг 3 раза в день (в течение 7 дней).
Важно : еще раз обращаем ваше внимание на то, что короткие 1-дневные схемы лечения герпеса у взрослых (герпеса на губах и кожи вокруг рта, на лице) – хорошо работают только при выполнении следующих условий. Во-первых – только если вы начинаете принимать препараты не позже 12 часов с момента появления герпетических высыпаний. Во-вторых – если у вас удовлетворительное или хорошее состояние иммунитета. Если лечение начато позже 12 часов с момента появления высыпаний, а также у пациентов с ослабленным иммунитетом – короткие 1-дневные курсы терапии обычно неэффективны. Тут уже нужна стандартная схема приема.
Важно : если с момента появления первых высыпаний прошло больше 12 часов (и тем более, если больше 24 или 48 часов) – лучше сделать выбор в пользу фамцикловира, т.к. последний лучше работает при более поздних сроках начала терапии герпетической инфекции.
Лечение иммуномодуляторами, профилактика герпеса –
Если у вас высокая частота рецидивов герпеса, либо пусть редкие, но тяжело протекающие вспышки – вам очень важно заняться профилактикой вспышек герпеса. И дело тут не только в том, что тяжелое течение герпетической инфекции и/или ее частые рецидивы – сами по себе свидетельствуют о проблемах с вашим иммунитетом. Дело в том, что вирус герпеса обладает иммуносупрессивным действием на всю систему иммунитета – и на клеточное, и на гуморальное звено иммунитета.
Это означает, что иммунная система под воздействием вируса герпеса – будет продолжать ослабевать, что приведет к дальнейшему увеличению частоты рецидивов и тяжести вспышек. На данный момент существуют следующие направления профилактики вспышек вируса простого герпеса (ВПГ-1, ВПГ-2), но выбирать тот или иной метод – вы должны только после консультации врача. Всем пациентам с частотой вспышек более 6-ти в течение года необходимо сделать анализ на количество специфических антител IgG и IgM к вирусу простого герпеса, а также получить консультацию врача-иммунолога и сделать иммунограмму (в которой оценивается субпопуляционный состав клеток, NK-активность, а также уровни α- и γ-интерферонов).
Важно : прием иммуномодуляторов показан не только для профилактики рецидивов герпетической инфекции – у часто и/или тяжело болеющих герпесом пациентов. Иммуномодуляторы должны использоваться в составе базовой терапии герпетических инфекций (в дополнение к терапии противовирусными препаратами) – у пациентов с ослабленным иммунитетом.
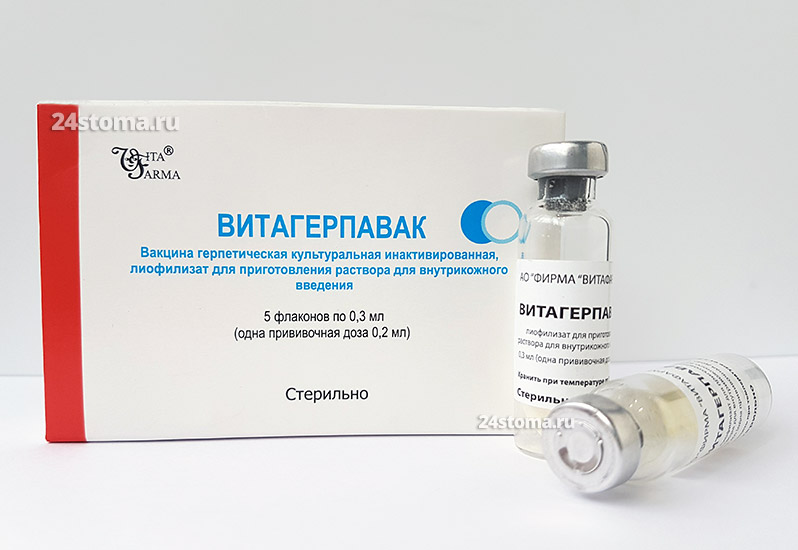
Прививка от герпеса (вакцина Витагерпавак) –
Прививка от герпеса (Вакцина Витагерпавак) –
Источники:
Читайте также:

