Вакцины вирусные и бактериальные
Обновлено: 26.04.2024
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
Препараты для иммунизации по основным характеристикам делятся на три основных класса.
- Живые вакцины. Защищают от полиомиелита, кори, краснухи, гриппа, эпидемического паротита, ветряной оспы, туберкулеза, ротавирусной инфекции. Основу препарата составляют ослабленные микроорганизмы — возбудители болезней. Их сил недостаточно для развития значительного недомогания у пациента, но хватает, чтобы выработать адекватный иммунный ответ.
- Инактивированные вакцины. Прививки против гриппа, брюшного тифа, клещевого энцефалита, бешенства, гепатита А, менингококковой инфекции и др. В составе мертвые (убитые) бактерии или их фрагменты.
- Анатоксины (токсоиды). Особым образом обработанные токсины бактерий. На их основе делают прививочный материал от коклюша, столбняка, дифтерии.
В последние годы появился еще один вид вакцин — молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
Схемы изготовления некоторых видов вакцин
Живые бактериальные

Схема подходит для вакцины БЦЖ, БЦЖ-М.
Живые противовирусные

Схема подходит для производства вакцин от гриппа, ротавируса, герпеса I и II степеней, краснухи, ветряной оспы.
Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться:
- куриные эмбрионы;
- перепелиные эмбриональные фибробласты;
- первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков);
- перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293).
Первичный сырьевой материал очищают от клеточного дебриса в центрифугах и с помощью сложных фильтров.
Инактивированные антибактериальные вакцины

- Культивация и очистка штаммов бактерий.
- Инактивация биомассы.
- Для расщепленных вакцин клетки микробов дезинтегрируют и осаждают антигены с последующим их хроматографическим выделением.
- Для конъюгированных вакцин полученные при предыдущей обработке антигены (как правило, полисахаридные) сближают с белком-носителем (конъюгация).
Инактивированные противовирусные вакцины

- Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться куриные эмбрионы, перепелиные эмбриональные фибробласты, первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков), перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293). Первичная очистка для удаления клеточного дебриса проводится методами ультрацентрифугирования и диафильтрации.
- Для инактивации используются ультрафиолет, формалин, бета-пропиолактон.
- В случае приготовления расщепленных или субъединичных вакцин полупродукт подвергают действию детергента с целью разрушить вирусные частицы, а затем выделяют специфические антигены тонкой хроматографией.
- Человеческий сывороточный альбумин применяется для стабилизации полученного вещества.
- Криопротекторы (в лиофилизатах): сахароза, поливинилпирролидон, желатин.
Схема подходит для производства прививочного материала против гепатита А, желтой лихорадки, бешенства, гриппа, полиомиелита, клещевого и японского энцефалитов.
Анатоксины

Для дезактивации вредного воздействия токсинов используют методы:
- химический (обработка спиртом, ацетоном или формальдегидом);
- физический (подогрев).
Схема подходит для производства вакцин против столбняка и дифтерии.
По данным Всемирной Организации Здравоохранения (ВОЗ), на долю инфекционных заболеваний приходится 25 % от общего количества смертей на планете ежегодно. То есть инфекции до сих пор остаются в списке главных причин, обрывающих жизнь человека.
Одним из факторов, способствующих распространению инфекционных и вирусных заболеваний, являются миграция потоков населения и туризм. Перемещение человеческих масс по планете влияет на уровень здоровья нации даже в таких высокоразвитых странах, как США, ОАЭ и государства Евросоюза.
Задать вопрос специалисту
Вопрос экспертам вакцинопрофилактики
Вопросы и ответы
Я много лет вакцинируюсь от гриппа вакциной французского производителя. В этом году терапевт предложила мне сделать прививку российской вакциной. Я ничего не знаю об отечественных вакцинах, какая из них качественная?
Отвечает Полибин Роман Владимирович
Отвечает Харит Сусанна Михайловна
Муж транспортировал вакцину РотаТек в другой город.Покупая ее в аптеке мужу посоветовали купить охлаждающий контейнер,и перед поездкой его заморозить в морозильной камере,потом привязать вакцину и так ее транспортировать. Время в пути заняло 5 часов. Можно ли вводить такую вакцину ребенку? Мне кажется,что если привязать вакцину к замороженному контейнеру, то вакцина замерзнет!
Отвечает Харит Сусанна Михайловна
Вы абсолютно правы, если в контейнере был лед. Но если там была смесь воды и льда- вакцина не должна замерзать. Однако живые вакцины, к которым относится ротавирусная, не увеличивают реактогенность при температуре менее 0, в отличие от неживых, а, например, для живой полиомиелитной допускается замораживание до -20 град С.
Моему сыну сейчас 7 месяцев.
В 3 месяца у него случился отек Квинке на молочную смесь Малютка.
Прививку от гепатита сделали в роддоме, вторую в два месяца и третью вчера в семь месяцев. Реакция нормальная, даже без температуры.
Но вот на прививку АКДС нам устно дали медотвод.
Я за прививки!! И хочу сделать прививку АКДС. Но хочу сделать ИНФАНРИКС ГЕКСА. Живем в Крыму. В крыму ее нигде нет. Посоветуйте как поступить в такой ситуации. Может есть зарубежный аналог? Бесплатную делать категорически не хочу. Хочу качественную очищеную, что бы как монжно меньше риска.
Отвечает Полибин Роман Владимирович
В Инфанрикс Гекса содержится компонент против гепатита В. Ребенок полностью привит против гепатита. Поэтому в качестве зарубежного аналога АКДС можно сделать вакцину Пентаксим. Кроме того, следует сказать, что отек Квинке на молочную смесь не является противопоказанием к вакцине АКДС.
Подскажите, пожалуйста, на ком и как тестируют вакцины?
Отвечает Полибин Роман Владимирович
Как и все лекарственные препараты вакцины проходят доклинические исследования (в лаборатории, на животных), а затем клинические на добровольцах (на взрослых, а далее на подростках, детях с разрешения и согласия их родителей). Прежде чем разрешить применение в национальном календаре прививок исследования проводят на большом числе добровольцев, например вакцина против ротавирусной инфекции испытывалась почти на 70 000 в разных странах мира.
Почему на сайте не представлен состав вакцин? Почему до сих пор проводится ежегодная реакция Манту (зачастую не информативна), а не делается анализ по крови, например, квантифероновый тест? Как можно утверждать реакции иммунитета на введенную вакцину, если еще ни кому не известно в принципе, что такое иммунитет и как он работает, особенно если рассматривать каждого отдельно взятого человека?
Отвечает Полибин Роман Владимирович
Состав вакцин изложен в инструкциях к препаратам.
Ребёнку 1 год и 8 месяцев, все прививки ставились в соответствии с календарем прививок. В том числе 3 пентаксима и ревакцинация в полтора года тоже пентаксим. В 20 месяцев надо ставить от полиомиелита. Очень всегда переживаю и отношусь тщательно к выбору нужных прививок, вот и сейчас перерыла весь интернет, но так и не могу решить. Мы ставили всегда инъекцию (в пентаксиме). А теперь говорят капли. Но капли-живая вакцина, я боюсь различных побочек и считаю, что лучше перестраховаться. Но вот читала, что капли от полиомиелита вырабатывают больше антител, в том числе и в желудке, то есть более эффективные, чем инъекция. Я запуталась. Поясните, инъекция менее эффективна (имовакс-полио, например)? Отчего ведутся такие разговоры? У каплей боюсь хоть и минимальный, но риск осложнения в виде болезни.
Отвечает Полибин Роман Владимирович
В настоящее время Национальный календарь прививок России предполагает комбинированную схему вакцинации против полиомиелита, т.е. только 2 первых введения инактивированной вакциной и остальные – оральной полиовакциной. Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита. В связи с вышесказанным вашему ребенку необходимо сделать пятую прививку ОПВ или ИПВ.
Следует также сказать, что на сегодняшний день идет реализация глобального плана Всемирной организации здравоохранения по ликвидации полиомиелита в мире, которая предполагает полный переход всех стран к 2019 году на инактивированную вакцину.
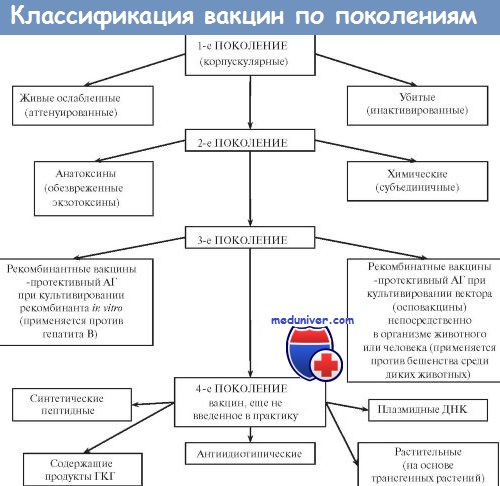
Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные ( аттенуированные ) вакцины. Дивергентные вакцины.
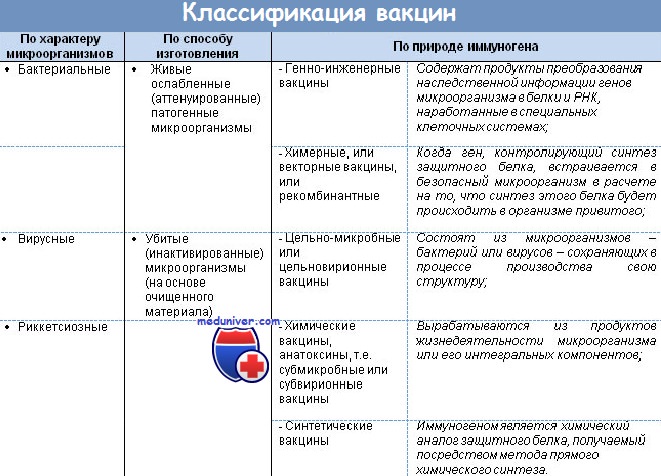
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инактивированные вакцины. Корпускулярные ( цельновирионные ) вакцины. Компонентные ( субъединичные ) вакцины.
В настоящее время также применяют вакцины, изготовленные из убитых микробных тел либо метаболитов, а также из отдельных Аг, полученных биосинтетическим или химическим путём. Вакцины, содержащие убитые микроорганизмы и их структурные компоненты, относят к группе корпускулярных вакцинных препаратов.
Неживые вакцины обычно проявляют меньшую (по сравнению с живыми вакцинами) иммуногенность, что диктует необходимость многократной иммунизации. В то же время неживые вакцины лишены балластных веществ, что значительно уменьшает частоту побочных эффектов, часто развивающихся после иммунизации живыми вакцинами.
Корпускулярные (цельновирионные) вакцины
Для их приготовления вирулентные микроорганизмы убивают либо термической обработкой, либо воздействием химических агентов (например, формалина или ацетона). Подобные вакцины содержат полный набор Аг. Спектр возбудителей, используемых для приготовления неживых вакцин, разнообразен; наибольшее распространение получили бактериальные (например, противочумная) и вирусные (например, антирабическая) вакцины.
Компонентные ( субъединичные ) вакцины
Компонентные (субъединичные) вакцины — разновидность корпускулярных неживых вакцин; они состоят из отдельных (главных, или мажорных) антигенных компонентов, способных обеспечить развитие невосприимчивости. В качестве Аг применяют иммуногенные компоненты возбудителя. Для их выделения используют различные физико-химические методы, поэтому препараты, получаемые из них, также известны как химические вакцины. В настоящее время разработаны субъединичные вакцины против пневмококков (на основе полисахаридов капсул), брюшного тифа (О-, Н- и Vi-Ar), сибирской язвы (полисахариды и полипептиды капсул), гриппа (вирусные нейраминидазы и гемагглютинин). Для придания более высокой иммуногенности компонентные вакцины нередко сочетают с адъювантами (например, сорбируют на гидр оксиде алюминия).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Моновалентные вакцины. Ассоциированные ( поливалентные ) вакцины. Методы вакцинопрофилактики. Методы введения вакцин. Типы вакцинаций. Виды вакцинаций.
В большинстве случаев вакцины и анатоксины применяют для создания невосприимчивости к одному возбудителю (так называемые моновалентные вакцины). Путём одномоментной иммунизации возможно и достижение множественной невосприимчивости. Для этого создают ассоциированные (поливалентные) препараты, совмещая Аг нескольких микроорганизмов.
Для приготовления ассоциированных вакцин обычно используют убитые микробы или их компоненты. Их применение определяют эпидемическая обоснованность (против детских или раневых инфекций), иммунная совместимость и технологическая возможность комбинирования нескольких Аг. Наиболее известные ассоциированные препараты: адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС-вакцина), тетравакцина (вакцины против брюшного тифа, паратифов А и В, а также столбнячный анатоксин) и АДС-вакцина (дифтерийно-столбнячный анатоксин).
Методы вакцинопрофилактики. Методы введения вакцин. Типы вакцинаций. Виды вакцинаций
Вакцинные препараты вводят внутрь, подкожно и внутрикожно, парентерально, интраназаль-но и ингаляционно. Способ введения определяют свойства препарата.
Живые вакцины можно вводить накожно (скарификацией), интраназально или перорально; анатоксины вводят подкожно, а неживые корпускулярные вакцины — парентерально. При массовых иммунизациях выбирают наиболее экономичный способ, обеспечивающий быстрое и эффективное создание иммунной прослойки (невосприимчивых лиц) в популяции, особенно в эпидемический период. Например, интраназальная вакцинация против гриппа в период перед предполагаемой эпидемией или пандемией позволяет быстро и экономически эффективно создать иммунную прослойку в популяции.
По степени необходимости выделяют плановую (обязательную) вакцинацию и вакцинацию по эпидемиологическим показаниям. Первую проводят в соответствии с регламентированным календарём иммунопрофилактики наиболее распространённых или опасных инфекций. Вакцинацию по эпидемиологическим показаниям проводят для срочного создания иммунитета у лиц, подвергающихся риску развития инфекции. Например, у декретированного контингента (персонал инфекционных больниц), при вспышке инфекционного заболевания в населённом пункте или предполагаемой поездке в эндемичные районы (жёлтая лихорадка, гепатит А).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Используя один и тот же плазмидный или вирусный вектор, можно создавать вакцины против различных инфекционных заболеваний, меняя только последовательность, кодирующую необходимые белки-антигены. При этом отпадает необходимость работать с опасными вирусами и бактериями, становится ненужной сложная и дорогостоящая процедура очистки белков. Препараты ДНК-вакцин не требуют специальных условий хранения и доставки, они стабильны длительное время при комнатной температуре.
Уже разработаны и испытываются ДНК-вакцины против инфекций, вызываемых вирусами гепатитов B и C, гриппа, лимфоцитарного хориоменингита, бешенства, иммунодефицита человека (ВИЧ), японского энцефалита, а также возбудителями сальмонеллеза, туберкулеза и некоторых паразитарных заболеваний (лейшманиоз, малярия). Эти инфекции крайне опасны для человечества, а попытки создать против них надежные вакцинные препараты классическими методами оказались безуспешными.
ДНК-вакцинация — одно из самых перспективных направлений в борьбе с раком. В опухоль можно вводить разные гены: те, что кодируют раковые антигены, гены цитокинов и иммуномодуляторов.
Проведя компьютерный (in silico) анализ генома, исследователь получает не только список кодируемых белков, но и некоторые их характеристики, например, принадлежность к определенным группам, возможная локализация внутри бактериальной клетки, связь с мембраной, антигенные свойства.
Третий подход основан на протеомной технологии. Ее методы дают возможность детализировать количественную и качественную характеристики белков в компонентах клетки. Существуют компьютерные программы, которые по аминокислотной последовательности могут предсказать не только трехмерную структуру изучаемого белка, но и его свойства и функции.
Используя эти три метода, можно отобрать набор белков и соответствующие им гены, которые представляют интерес для создания вакцины. Как правило, в эту группу входит около 20-30% всех генов бактериального генома. Для дальнейшей проверки нужно синтезировать и очистить отобранный антиген в количествах, необходимых для иммунизации животных. Очистку белка проводят с помощью полностью автоматизированных приборов. Используя современные технологии, лаборатория, состоящая из трех исследователей, может в течение месяца выделить и очистить более 100 белков.
Важно не только создать вакцину, но и найти наилучший способ ее доставки в организм. Сейчас появились так называемые мукозальные вакцины, которые вводятся через слизистые оболочки рта или носа либо через кожу. Преимущество таких препаратов в том, что вакцина поступает через входные ворота инфекции и тем самым стимулирует местный иммунитет в тех органах, которые первыми подвергаются атаке микроорганизмов.
Терапевтические вакцины
Существующие терапевтические вакцины для лечения хронических воспалительных заболеваний, вызванных бактериями или вирусами, получают классическими методами. Такие вакцины способствуют развитию иммунитета к входящим в их состав микроорганизмам и активизируют врожденный иммунитет.

Одна из важнейших целей разработчиков терапевтических вакцин — ВИЧ-инфекция. Уже проведена серия доклинических и клинических испытаний нескольких препаратов. Их способность вызывать развитие клеточного иммунитета у здоровых людей не вызывает сомнений. Однако убедительных данных о том, что вакцины подавляют размножение вируса у больных, пока нет.
Схема изготовления дендритной вакцины такова: из крови больного выделяют клетки, которые дают начало дендритным клеткам, и размножают их в лабораторных условиях. Одновременно из опухоли пациента выделяют белки-антигены. Дендритные клетки некоторое время выдерживают вместе с опухолевыми антигенами, чтобы они запомнили образ врага, а затем вводят больному. Такая стимуляция иммунной системы заставляет организм активно бороться с опухолью.
У мышей дендритные вакцины помогают предупредить повторное развитие карциномы после удаления опухоли. Это позволяет надеяться, что они будут эффективны для продления безрецидивного периода онкологических больных после хирургического вмешательства.
Читайте также:

