Вирус опухоли молочной железы мышей
Обновлено: 26.04.2024
Мышиные модели с метастазами рака молочной железы представляют собой экспериментальные подходы, в которых мышей генетически манипулируют для развития опухоли молочной железы, приводящей к удаленным очаговым поражениям эпителия молочной железы, создаваемым метастазами . Рак молочной железы у мышей может быть вызван генетическими мутациями , обнаруженными при раке человека. Это означает, что модели могут быть созданы на основе молекулярных повреждений, соответствующих заболеванию человека.
СОДЕРЖАНИЕ
Метастазирование представляет собой процесс миграции из опухолевых клеток от участка первичного рака в отдаленное место , где раковые клетки образуют вторичные опухоли. Метастатический рак молочной железы представляет собой наиболее разрушительный признак рака и считается заболеванием на поздней стадии. [1] Рак груди человека метастазирует во множество отдаленных органов, таких как мозг , легкие , кости и печень .
Классическая теория, разработанная в начале 70-х годов, предполагала, что метастазирование происходит из-за генетически детерминированных субпопуляций в первичных опухолях. [2] Генетическая дисперсия между метастатическими очагами значима только для определенного локуса и в пределах определенных клеточных популяций, или только одноклеточная популяция показывает различия, а некоторые локусы расходятся только в одной клеточной субпопуляции. Это объясняет концепцию гетерогенности опухоли и порядок генетических событий во время эволюции опухоли . Многие из генов, управляющих ростом на первичном участке, могут определять распространение и колонизацию на эктопическом участке . [3] [4] [5] Рак молочной железы считается генетически и клинически гетерогенным заболеванием, поскольку он отражает гетерогенность нормальной ткани молочной железы по своему происхождению17873350. [6] Должен произойти ряд дискретных генетических событий, чтобы позволить отдельным опухолевым клеткам, которые обладают способностью расти на эктопическом участке. Прогрессирование метастазов зависит от регулирования программ развития и событий окружающей среды. [7] Метастатический потенциал субпопуляций в клетках молочных желез мышей теперь рассматривается как относительно раннее событие, и распространение происходит одновременно с преинвазивными или микроинвазивными поражениями. [8] [9] Генетические профили первичных и метастатических Поражения в карциномах молочной железы показывают большую степень клональной принадлежности между поражениями. [10] [11] Существуют различные модели распространенности генетических мутаций в геномах первичной опухоли груди и ее метастазов. [12] [13] [14] Это также подтверждает генетическую гетерогенность между первичным новообразованием больных раком груди и их соответствующими метастазами. [15] [16]
Рак молочной железы фенотипы периодически выражают гены в метастазе, которые необходимы для метастатического процесса. Метастатическое разнообразие опосредуется активацией генов, которые действуют как сцепление с органо-специфическим ростом. [17] Рост поражений на эктопическом участке зависит от множества сложных взаимодействий между метастатическими клетками и гомеостатическими механизмами хозяина . Летальные белок-белковые взаимодействия в месте метастазирования помогают выжить адаптированным клеткам. [18]
Направленная экспрессия онкогенов в эпителиальных клетках молочной железы мышей является способом моделирования рака молочной железы человека. Мутация или сверхэкспрессия онкогенов может контролироваться экспрессией в очень специфическом клеточном контексте, а не во всем организме. Другой способ моделирования рака груди человека - целевое ингибирование гена-супрессора опухоли. [19]
- В 1909 году Кларенс К. Литтл вывел первую инбредную линию мышей DBA (Dilute, brown non-Agouti).
- В 1915 г. Н. М. Холдейн идентифицировал у мышей первое сцепление между мышами- альбиносами и разведением розового глаза на седьмой хромосоме .
- В 1921 году C57BL стала одной из наиболее широко используемых в генетике мышей и первой линией, геном которой был секвенирован .
- В 1982 году Палмитер и Бринстер имплантировали чужеродный ген в оплодотворенную яйцеклетку , наконец получив первых трансгенных мышей, генетически модифицированных для экспрессии доминантных онкогенов. [20]
- В 1982 году , стимуляция экспрессии от MMTV-LTR (опухоль молочной железы мыши вирус-длинный концевой повтор) было сделано несколькими раундами беременности и лактации , чтобы оценить значимость клеточного прото-онкогенов , с-Мус . [21]
Генетические исследования распространенных заболеваний человека имеют значительные ограничения по практическим и этическим причинам. [22] Линии клеток человека можно использовать для моделирования болезни, но трудно изучить процессы на тканевом уровне, внутри органа или во всем теле. Мыши могут быть хорошим представителем болезней человека, потому что: [23]
- У мышей и людей есть много общего в физиологии , развитии и клеточной биологии.
- У людей и мышей около 30 000 генов, кодирующих белок. Количество генов мыши без соответствующего человеческого гомолога составляет менее 1%.
- 90% геномов человека и мыши синтеничны .
- 40% геномов человека и мыши можно выровнять на уровне нуклеотидов .
- У мышей относительно короткий период беременности .
- Мышам требуется короткое время, чтобы достичь половой зрелости.
- У мышей большие размеры помета.
- Наличие сотен мутаций, затрагивающих практически все ткани и аспекты развития.
Мыши не могут быть идеальной моделью для рака груди. В основном это связано с отсутствием точности во многих моделях. Глядя на метастаз, трудно определить точное местоположение, а также частоту его появления. Другая проблема связана с подтипами эпителия и неспособностью целенаправленно воздействовать на них при нацеливании на мутацию. Примером этого может быть определение развития опухолей у мышей K14-Cre BRCA2. В стандартном случае иссечение BRCA2 не приводило к опухолевому генезу, но если р53 был мутирован и инактивирован, то опухольгенез возник бы. Следовательно, нет однозначного ответа относительно происхождения опухоли из-за дополнительной мутации в p53. [24]
Различные клеточные линии карциномы молочной железы мыши, такие как 4T1 [25] и TS / A , являются метастатическими у сингенных иммунокомпетентных мышей и могут использоваться для идентификации генов и путей, участвующих в метастатическом процессе. [26]
Трансплантация опухолевых клеток мышам с иммунодефицитом - это инструмент для изучения рака груди и его метастатических эффектов. Трансплантация происходит в виде аллотрансплантатов или ксенографических трансплантатов. [27] Как правило, человеческие клетки высевали в иммунодефицитом мышиного реципиента. Инокуляция клеток с помощью внутрипротоковых трансплантаций [28] , инъекций очищенных жировых отложений [29] [30] или трансплантаций в хвостовую вену. [31] [32] [33] В разные органы могут быть засеяны клетки рака груди, в зависимости от пути инъекции [34]
- Сердечная инъекция: кость
- Инъекция в хвостовую вену: легкое
- Инъекция в селезенку: печень
- Инъекция сонной артерии: мозг
В качестве мышей со специфическим иммунодефицитом использовались мыши NOD / SCID (диабет без ожирения / тяжелый условный иммунодефицит). Эти мутации позволяют интегрировать новую ткань ксенотрансплантата. Мыши должны сначала иметь гуманизированные жировые подушечки молочных желез путем инъекции иммортализованных телеморазой человеческих стромальных фибробластов молочной железы (фибробласты RMF / EG) в жировые подушечки молочных желез. Без этой инъекции эпителиальные клетки молочной железы человека, привитые к подушечке, не могут колонизировать и расти. Затем необходимо облучить фибробласт RMF / EG, чтобы обеспечить экспрессию ключевых белков и факторов роста. После 4 недель развития вновь привитые эпителиальные клетки молочной железы человека увеличивались в жировой подушке. [35]
Генно-инженерные мыши созданы для моделирования фенотипов и патологий человека . Мутантные мыши могут включать трансгены с использованием различных способов доставки:
- Использование бактериальной системы, индуцируемой тетрациклином, с возможностью включения или выключения (система Tet-On / Tet-Off)[36]
- Нацеленные мутации путем нокаута в гене и нокаутирующей последовательности с использованием системы рекомбинации Cre-Lox[37]
- Введение ретро вирусных мутаций [38]
- Введение химически индуцированных мутаций
Мыши, претерпевающие процесс трансгенеза, известны как трансгенные мыши. Основной трансген имеет промоторную область, последовательность, кодирующую белок, интрон и стоп-кодон . Вирус опухоли молочной железы мыши (MMTV) - это ретро-вирус, который, как известно, вызывает опухоли молочной железы после активации. [39] MMTV является наследственным соматическим мутагеном, диапазон мишеней которого ограничен. Он содержит регуляторную последовательность ДНК, называемую длинным концевым повтором (LTR), которая способствует транскрипции, индуцируемой стероидными гормонами. [40] [41] Опухоль, индуцированная вирусом опухоли молочной железы мыши, также может быть осуществлена путем интеграции вирусного генома. Известно, что сайты интеграции являются критическими генами для клеточной регуляции. [42] Сывороточный кислый белок (WAP), [43] - еще один распространенный промотор, используемый для создания моделей рака молочной железы у мышей. Список других промоторов, специфичных для молочных желез, и моделей мышей см. [44]

MMTV-PyMT представляет собой модель метастазирования рака молочной железы, в которой MMTV-LTR используется для управления экспрессией среднего Т-антигена полиомавируса, специфичного для молочной железы , что приводит к быстрому развитию высокометастатических опухолей. [45] MMTV-PyMT - наиболее часто используемая модель для изучения прогрессирования и метастазирования опухоли молочной железы. Затем мышей MMTV-PyMT скрещивают с другими генетически модифицированными мышами для создания различных типов моделей рака груди, включая:
-
в метастазах может быть продемонстрирована в MMTV-PyMT; Akt1 - / - мыши. [46]
- Chemoattractive паракринная петлю из колониестимулирующий фактор-1 (CSF-1) и ЭФР лиганды между ассоциированных с опухолью макрофагов (ТАМ) и опухолевых клеток, а также метастазов в легких могут быть изучены путем скрещивания MMTV-PyMT мышей с СМЖ-1 - / - мышей. [47]
- Роль врожденного и адаптивного иммунного ответа в содействии метастазированию может быть изучена с помощью MMTV-PyMT; Rag1 - / - мыши, у которых избирательно теряются CD4 + Т-клетки . Интерлейкин-4 (IL4) без модели MMTV-PyMT; IL4 - / - мыши. [48]
- Роль молекулы адгезии CD44 в метастазировании в легкие. [49] клеток рака молочной железы MMTV-PyMT было выполнено для выявления прометастатического действия ангиогенных факторов, фактора роста эндотелия сосудов А (VEGF-A). [50]
- Роль передачи сигналов аутокринноготрансформирующего фактора роста бета 1 (TGF-β1) на подвижность и выживаемость в клетках PymT, полученных из рака молочной железы мыши MMTV-PymT. [51]
- Остальные - MMTV-PyMT; uPA - / - [52] и MMTV-PyMT; МЕКК1 - / -. [53]
MMTV-LTR может также использоваться для стимулирования рецепторной тирозин-протеинкиназы ErbB2 для трансформации эпителия молочной железы мыши. ErbB2 - это онкоген, усиленный и сверхэкспрессируемый примерно в 20% случаев рака груди у человека. У мышей, несущих этот онкоген, примерно через 15 недель после беременности развиваются мультифокальные аденокарциномы с метастазами в легких. [54] [55] Чтобы создать более точное представление о мутациях гена HER2, исследователи объединили ген мыши, содержащий neu, и ген крысы, содержащий neu. Это решает проблему с точки зрения моделирования амплификации HER2 в развитии мышей. У неслитых мышей молочная железа вернется к почти девственной форме, но с этим добавлением молочная железа сохранит развитую функцию. [56]
Мышиные модели с двумя трансгенами называются би-трансгенными. Чтобы проверить взаимодействие двух онкогенов, Тим Стеверт и его группа создали первые би-трансгенные модели мышей в 1987 году. Мышей MMTV- Myc и MMTV- Ras скрестили, что привело к ускорению онкогенеза. [57] Экспрессия TGFβ в клетках рака груди MMTV-ErbB2; Двойные трансгенные мыши MMTV-TGFβ могут индуцировать более высокие уровни циркулирующих опухолевых клеток и метастазирование в легкие. [58] Ген Ras можно комбинировать с rtTA (трансактиватором обратного тетрациклина). для создания би-трансгенной индуцибельной модели мыши посредством контролируемой тетрациклином транскрипционной активации, например, у мышей, несущих TetO-KrasG12D (TOR) и MMTV-rtTA (MTB), трансген, экспрессирующий обратный трансактиватор тетрациклина (rtTA), в эпителиальных клетках молочных желез. [59]
Три-трансгенные мышиные модели состоят из более чем двух генов. Множественные комбинации и генетические модификации выполняются таким образом, что один или все гены переводятся в состояние непрерывной экспрессии или контролируемым образом, чтобы активировать их в разные моменты времени. Например, ТОМ (TetO-myc); ТЗ; Мыши MTB, у которых гены myc (M) и ras (R) находятся под контролем операторов тетрациклина. Их также можно как активировать, так и деактивировать, добавляя доксициклин. Другими комбинациями в этом отношении являются TOM; Крас; MTB, где myc может индуцироваться и не индуцироваться в различные моменты времени, в то время как Kras находится в непрерывно экспрессируемом состоянии, и myc; ТЗ; Модель МТБ наоборот. [60]
Метастатический каскад можно изучить, контролируя активацию гена или добавляя репортерный ген, например, бета-актин GFP (зеленый флуоресцентный белок) или RFP (красный флуоресцентный белок).
Путем включения / выключения определенных генов посредством гомологичной рекомбинации можно измерить степень метастазирования и достичь идентификации новых генов-мишеней, например, ген, который последовательно регулирует метастатическое поведение раковых клеток, представляет собой TGF-β1. Резкое прекращение передачи сигналов TGF-β в опухолевых клетках молочной железы MMTV-PyMT приводит к пятикратному увеличению метастазов в легких. [61] Некоторые области энхансера также могут быть проанализированы и могут быть определены как критически важные части пролиферации клеток, например, область усиления, которая связана с критическим для рака геном p53, который был определен с помощью CRISPR-Cas9. [62]
Стратегии количественного отслеживания клонов оказались успешными в разрешении судьбы клеток в нормальных эпителиальных тканях с использованием тканеспецифичных или специфичных для стволовых клеток трансгенов. Для проведения эксперимента по отслеживанию индуцируемых клонов в геном мыши должны быть встроены два компонента: переключатель и репортер. Переключатель обычно является лекарственно регулируемой формой бактериального фермента Cre-рекомбиназы. Этот фермент распознает определенные последовательности, называемые сайтами LoxP. [63] Белки, которые способны улучшить идентификацию меченых клеток или конкретной популяции немеченых клеток, кодируются репортерными трансгенами. После сбора всех десяти молочных желез мышей у трансгенных мышей обычно готовят суспензию единичных клеток и трансплантируют либо в хвостовую вену нетрансгенных мышей-реципиентов [31], либо в очищенную жировую подушку нетрансгенных мышей, повторно заселяющих жировую подушку молочных желез. [64] Эти клетки затем отслеживаются в кровотоке, легких, костном мозге и печени, чтобы найти благоприятное место для метастазирования. Эти трансгенные клетки могут быть отслежены в соответствии с их особенностями флуоресценции или индуцированы путем помещения реципиентов на доксициклин. еда.
Другой инструмент для изучения метастазов рака молочной железы - это поиск циркулирующих опухолевых клеток у трансгенных мышей, например, мыши MMTV-PyMT могут реагировать на различные методы лечения, выделяя опухолевые клетки в кровь, что приводит к метастазам в легкие. [65] Не только в крови, но и клетки могут быть обнаружены в костном мозге, например, цитокератин- положительные клетки в костном мозге трансгенных мышей MMTV-pyMT и MMTV-Neu были идентифицированы, но не в контроле дикого типа. [66]
В отсутствие специфических маркеров для клеток молочной железы модели с генетической маркировкой опухолевых клеток дают лучшее экспериментальное преимущество, однако небольшой объем периферической крови, который можно получить от живых животных, ограничивает применение этого метода.
Модели трансгенных мышей можно визуализировать с помощью различных неинвазивных методов.

Визуализация биолюминесценции основана на обнаружении света, производимого ферментативным окислением экзогенного субстрата. Субстрат люциферин окисляется до оксилюциферина в присутствии люциферазы и излучает свет, который может быть обнаружен с помощью системы IVIS, такой как аппарат Xenogen. Диссоциированные клетки молочной железы из MMTV-PyMT: IRES: Luc; Животным MTB ( внутреннее место попадания рибосомы : люциферин ) (которые не подвергались воздействию доксициклина) можно вводить инъекции в боковые хвостовые вены мышей с иммунодефицитом на диете без доксициклина. Сигнал биолюминесценции не будет наблюдаться в легких мышей-реципиентов до тех пор, пока им не будет дан корм с доксициклином. Затем биолюминесценция может быть обнаружена в грудной клетке в течение 2 недель после начала воздействия доксициклина. [31] Люцифераза вводится непосредственно перед съемкой.
Прижизненная микроскопия с многофотонным возбуждением - это метод визуализации генно-инженерных клеток непосредственно in vivo. Многоступенчатые метастатические каскады можно визуализировать, пометив их уникальным флуоресцентным цветом под флуоресцентным микроскопом . [67] [68]
Позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ) и компьютерная томография (КТ) использовались для сравнения эффективности этих изображений in vivo для обнаружения поражений на ранней стадии и для оценки реакции на химиотерапию. [69]
Магнитно-резонансная томография требует использования наночастиц (липосом) и контрастного вещества МРТ, называемого гадолинием. Затем частицы помещали в пузырьки через поликарбонатный мембранный фильтр. Наночастицы вводят мышам с метастазами и оставляют там на двадцать четыре часа. Затем этих мышей сканируют, и в программном обеспечении для визуализации обнаруживаются скопления этих частиц в определенных областях, где клетки метастазировали. [22]
Некоторые линии мышей переносят вирус эндогенно, но он также передается вертикально с молоком от матери к щенку. Он содержится в виде ДНК- провируса, интегрированного в ДНК лимфоцитов молока . Вирусы переносятся через желудочно-кишечный тракт к пейеровым пятнам, где они заражают макрофаги нового хозяина , а затем лимфоциты.

Вирус опухоли молочной железы мыши (MMTV) ранее классифицировался как простой ретровирус ; Однако, недавно было установлено, что MMTV кодирует дополнительный саморегулируемой мРНК экспорта белка, Rem, с подобием к вирусу иммунодефицита человека ВИЧ - Rev белка, и , следовательно, первый комплекс мышиный ретровирус быть документированы. [3] [4]
MMTV кодирует структурные гены ретровирусов и, кроме того, суперантиген . Это стимулирует Т-лимфоциты с определенным типом V-бета-цепи в их Т-клеточном рецепторе , что, в свою очередь, стимулирует пролиферацию В-клеток, увеличивая популяцию клеток, которые могут быть инфицированы. [5] В период полового созревания вирус проникает в молочные железы с мигрирующими лимфоцитами и инфицирует пролиферирующие эпителиальные клетки молочных желез. [6]
Когда вирусный геном вставлен в геном хозяина, он может транскрибировать свои собственные вирусные гены. В экспериментах FU Reuss и JM Coffin (2000) упоминается, что экспрессия вирусного генома активируется энхансерным элементом, который присутствует в области U3 длинного концевого повтора генома. [9] Кроме того, экспрессия генома активируется специфически в клетках молочной железы. [9] Эстроген может дополнительно активировать экспрессию вирусного генома. [7] Экспрессия гена sag , присутствующего в провирусе, отвечает за выработку суперантигена. [6]
MMTV может передаваться экзогенным или эндогенным путем. Если вирус передается экзогенно, он передается от матери мыши к ее детенышам через ее молоко. [10]
В качестве альтернативы, детеныши могут заразиться вертикально через эндогенную инфекцию, унаследовав вирус непосредственно от матери в зародышевой линии. У мышей, инфицированных таким образом, чаще возникают опухоли. Ретровирус является эндогенным для своего хозяина, если провирусная ДНК вставлена в хромосомную ДНК. В результате мыши с эндогенным MMTV имеют ДНК вируса в каждой клетке своего тела, поскольку вирус присутствует в ДНК сперматозоидов или яйцеклетки, от которых зачато животное. [ необходима цитата ]
Эндогенный MMTV реагирует на весь спектр гормонов, которые регулируют нормальное развитие молочных желез и лактацию, был продемонстрирован ответ на стероидные гормоны ( андрогены , глюкокортикоиды и прогестины ) [11], а также на пролактин . [12]
Когда мышь достигает половой зрелости, вирус начинает экспрессировать свою информационную РНК в тканях, чувствительных к эстрогену. В результате после полового созревания все клетки молочной железы будут содержать активный ретровирус и начнут реплицироваться в геноме и экспрессировать вирусную информационную РНК во всех новых клетках ткани молочной железы. [10]
LTR ( длинный концевой повтор ) MMTV содержит элемент ответа на глюкокортикоидный гормон . Этот глюкокортикоидный элемент является промотором, который часто используется для создания мышей, у которых развивается заболевание, подобное раку груди, потому что очень востребована модельная система на животных для рака груди, близкая к заболеванию человека. [ необходима цитата ]
Промотор MMTV используется в модельной системе PyMT на мышиных моделях метастазов рака груди . Здесь Py - это аббревиатура от полиомы, а MT - это аббревиатура от среднего T. Существуют и другие модельные системы рака груди, в которых используется промотор MMTV. Средний Т-антиген полиомы взят из вируса полиомы . Модель MMTV-PyMT оказалась надежной моделью метастазирования рака груди. [13] При раке груди человека средний Т-антиген полиомы не обнаружен. [14]
СОДЕРЖАНИЕ
Некоторые линии мышей переносят вирус эндогенно, но он также передается вертикально с молоком от матери к щенку. Он содержится в виде ДНК- провируса, интегрированного в ДНК лимфоцитов молока . Вирусы переносятся через желудочно-кишечный тракт к пейеровым пятнам, где они заражают макрофаги нового хозяина , а затем лимфоциты.

Вирус опухоли молочной железы мыши (MMTV) ранее классифицировался как простой ретровирус ; Однако, недавно было установлено, что MMTV кодирует дополнительный саморегулируемой мРНК экспорта белка, Rem, с подобием к вирусу иммунодефицита человека ВИЧ - Rev белка, и , следовательно, первый комплекс мышиный ретровирус быть документированы. [3] [4]
MMTV кодирует структурные гены ретровирусов и, кроме того, суперантиген . Это стимулирует Т-лимфоциты с определенным типом V-бета-цепи в их Т-клеточном рецепторе , что, в свою очередь, стимулирует пролиферацию В-клеток, увеличивая популяцию клеток, которые могут быть инфицированы. [5] В период полового созревания вирус проникает в молочные железы с мигрирующими лимфоцитами и инфицирует пролиферирующие эпителиальные клетки молочных желез. [6]
Когда вирусный геном вставлен в геном хозяина, он может транскрибировать свои собственные вирусные гены. В экспериментах FU Reuss и JM Coffin (2000) упоминается, что экспрессия вирусного генома активируется энхансерным элементом, который присутствует в области U3 длинного концевого повтора генома. [9] Кроме того, экспрессия генома активируется специфически в клетках молочной железы. [9] Эстроген может дополнительно активировать экспрессию вирусного генома. [7] Экспрессия гена sag , присутствующего в провирусе, отвечает за выработку суперантигена. [6]
MMTV может передаваться экзогенным или эндогенным путем. Если вирус передается экзогенно, он передается от матери мыши к ее детенышам через ее молоко. [10]
В качестве альтернативы, детеныши могут заразиться вертикально через эндогенную инфекцию, унаследовав вирус непосредственно от матери в зародышевой линии. У мышей, инфицированных таким образом, чаще возникают опухоли. Ретровирус является эндогенным для своего хозяина, если провирусная ДНК вставлена в хромосомную ДНК. В результате мыши с эндогенным MMTV имеют ДНК вируса в каждой клетке своего тела, поскольку вирус присутствует в ДНК сперматозоидов или яйцеклетки, от которых зачато животное. [ необходима цитата ]
Эндогенный MMTV реагирует на весь спектр гормонов, которые регулируют нормальное развитие молочных желез и лактацию, был продемонстрирован ответ на стероидные гормоны ( андрогены , глюкокортикоиды и прогестины ) [11], а также на пролактин . [12]
Когда мышь достигает половой зрелости, вирус начинает экспрессировать свою информационную РНК в тканях, чувствительных к эстрогену. В результате после полового созревания все клетки молочной железы будут содержать активный ретровирус и начнут реплицироваться в геноме и экспрессировать вирусную информационную РНК во всех новых клетках ткани молочной железы. [10]
LTR ( длинный концевой повтор ) MMTV содержит элемент ответа на глюкокортикоидный гормон . Этот глюкокортикоидный элемент является промотором, который часто используется для создания мышей, у которых развивается заболевание, подобное раку груди, потому что очень востребована модельная система на животных для рака груди, близкая к заболеванию человека. [ необходима цитата ]
Промотор MMTV используется в модельной системе PyMT на мышиных моделях метастазов рака груди . Здесь Py - это аббревиатура от полиомы, а MT - это аббревиатура от среднего T. Существуют и другие модельные системы рака груди, в которых используется промотор MMTV. Средний Т-антиген полиомы взят из вируса полиомы . Модель MMTV-PyMT оказалась надежной моделью метастазирования рака груди. [13] При раке груди человека средний Т-антиген полиомы не обнаружен. [14]
Вирусология:
Популярные разделы сайта:
Образование вируса саркомы мышей. Вирус опухоли молочных желез
По данным ряда исследователей, заражение ВСМ такого хозяина, в котором обычный вирус-помощник не образуется, может привести к появлению вируса саркомы с резко измененными антигенными свойствами и спектром хозяев. Напрямер, пассажи любого штамма ВСМ на хомячках позволяют получить вирус, который теряет способность трансформировать клетки мыши и индуцировать саркомы у мышей, но приобретает способность трансформировать клетки хомячка и вызывать у него саркомы (Бэсин и др., 1968; Клемент и др., 1970; Сарма и др., 1970; Келлоф и др., 1970b). Кроме того, вирусы, приобретшие тропизм к хомячкам, теряют способность нейтрализоваться антисывороткой против мышиных лейковирусов. По-видимому, такое изменение свойств оболочки вирионов нового саркомного вируса связано с заменой вируса-помощника — вместо мышиного вируса-помощника в этой роли теперь выступает вирус помощник хомячка.
Подобное явление описано также для ВСМ, размножающегося в клетках крысы (Тинг, 1968; Эронсон, 1971b). Роль вирусов-помощников в этих системах выполняют, по-видимому, лейковирусы, присутствующие у хомячков или крыс в скрытой форме и активируемые ВСМ (Гилден и др., 1971). Пока неизвестно, происходит ли при этом изменение генома вируса саркомы, так как генетические маркеры у этого вируса еще не изучены. Однако такая возможность, по-видимому, маловероятна: совместное культивирование линий клеток, полученных из индуцированных вирусом опухолей хомячка, с клетками мыши в присутствии мышиных вирусов-помощников приводит к образованию вируса саркомы, неотличимого по свойствам оболочки от исходных мышиных саркомных вирусов (Клемент и др., 1970; Сарма и др., 1970).
Однако Эронсон (1971), пассируя ВСМ в клетках человека, получил иные результаты. Он трансформировал линию фибробластов человека клоном вируса саркомы мышей (штамм Кирстен) и культивировал трансформированные клетки на протяжении многих генераций. После длительных пассажей из клеток был выделен вирус, который эффективно трансформировал фибробласты эмбриона человека, но был полностью неактивным в клетках мыши. Вирус не ревертировал к своему исходному фенотипу при пассажах на клетках животных. Поэтому Эронсон предположил, что в этом случае произошло генетическое изменение вируса, а не просто замена оболочки. По мнению этого исследователя, измененный вирус возник в результате рекомбинации между геномами ВСМ и латентного лейковируса человека. Однако для подтверждения этой точки зрения необходимы дальнейшие исследования.
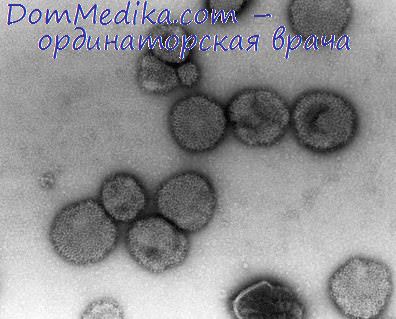
Вирус опухоли молочных желез
Читайте также:

