Вирус скм что это
Обновлено: 12.05.2024
Респираторно-синцитиальная вирусная инфекция (РСВИ) занимает важное место в патологии органов дыхания, как у детей, так и у взрослых. Респираторно-синцитиальный вирус (РСВ) - наиболее частая причина поражения Нижних дыхательных путей (НДП) у детей раннего возраста, причем заболевание может привести к летальному исходу. У детей старшего возраста и взрослых РСВ вызывает более легкое поражение респираторного тракта, проявляющееся ринофарингитом, бронхитом, включая обострение хронического бронхита, пневмонией.
Этиология и эпидемиология
РСВ входит в состав семейства Paramyxoviridae, являясь представителем рода Pneumovirus. Свое название вирус получил в результате характерного цитопатического действия в культуре клеток, ведущего к образованию синцития и симпластов. РСВ не содержит гемагглютинина и нейраминидазы.
РСВИ является, по существу, эндемичной, и в отдельные периоды происходит подъем заболеваемости. Вспышки наблюдаются в различное время года, чаще осенью и зимой. Подъем заболеваемости РСВИ нередко совпадает с эпидемией гриппа, и тогда у детей можно диагностировать микст-инфекцию. Как и грипп, РСВИ увеличивает количество осложнений и летальность от гриппа и пневмонии.
Продолжительность эпидемического подъема заболеваемости ограничивается 3-5 месяцами. Такие вспышки, как правило, имеют место ежегодно в одной и той же местности. В это время РСВ вызывает не только бронхиолиты и пневмонии, но также и легкие заболевания верхних дыхательных путей (ВДП) у детей. Вспышки РСВИ могут протекать в виде ограниченных локальных эпидемий в учреждениях для детей раннего возраста.
Источником инфекции являются больные и вирусоносители. Вирусы выделяются вместе с секретом слизистой оболочки ВДП во время разговора, кашля, чихания, и передача возбудителя здоровым осуществляется воздушно-капельным путем. Опасность заражения от больного человека сохраняется в течение 5-7 дней. Восприимчивость к РСВ очень высока, особенно у детей раннего возраста.
О распространении РСВИ среди различных возрастных групп населения позволяют судить серологические исследования. У большинства новорожденных имеются антитела, полученные от матери. Однако врожденный пассивный иммунитет довольно быстро утрачивается, и уже у детей 4-6-месячного возраста антитела не удается обнаружить. В этот период дети становятся высоко восприимчивыми к РСВ, заболеваемость возрастает, в результате чего увеличивается число детей, которые приобрели антитела, а вместе с ними и иммунитет. У детей в возрасте 5-10 лет антитела к РСВ обнаруживаются у 63-68% обследованных. Примерно такой же результат был получен и при обследовании здоровых взрослых (67%). Заболевания, вызванные РСВ, наблюдаются и среди взрослых различного возраста, при этом у большинства из них имеет место реинфекция, так как болезнь возникает несмотря на наличие нейтрализующих и комплементсвязывающих антител.
Клиника и патогенез
Инкубационный период длится не менее 3 дней, чаще 4-5 дней. Начинается заболевание как остро, так и подостро. У детей грудного возраста чаще наблюдается вовлечение в процесс НДП, в то время как у старших детей и у взрослых изменения обычно ограничиваются областью ВДП и протекают в виде ринита, фарингита, ларингита. Ринит отмечается у большинства пациентов, выделения из носа необильные серозно-слизистые. В ротоглотке может наблюдаться умеренная гиперемия слизистой. Наиболее частый симптом РСВИ - кашель, вначале непродуктивный, затем на 3-4 день болезни появляется мокрота.
Через 2-3 дня от начала болезни, а иногда и в более поздние сроки, обнаруживаются признаки поражения НДП с развитием бронхита, бронхиолита или бронхо-бронхиолита, обусловливающие возникновение БОС. Появляется одышка с втяжением уступчивых мест грудной клетки, обычно экспираторного типа. Дыхание шумное, свистящее.
При бронхите у большинства пациентов на фоне жесткого дыхания выслушивается большее или меньшее количество сухих свистящих хрипов, у части больных - средне- и крупнопузырчатые влажные хрипы. Выдох удлинен. Для бронхиолита характерно обилие мелкопузырчатых влажных и крепитирующих хрипов, выслушиваемых по всей поверхности обоих легких, обычно в конце вдоха. Из-за вздутия легких при перкуссии грудной клетки определяется коробочный звук.
Одним из важных признаков, характеризующих БОС, является цианоз. У детей первых месяцев жизни с бронхиолитом отмечается общий цианоз, дети становятся чугунного цвета. Поражение органов дыхания происходит на фоне лихорадки, которая в отдельных случаях может и отсутствовать.
При рентгенологическом обследовании наиболее характерным признаком РСВИ является повышение прозрачности легочных полей, расширение межреберных промежутков, усиление легочного рисунка за счет расширения крупных сосудистых стволов и обогащения его мелкими линейными тенями. Наблюдается перестройка всего легочного рисунка по сетчато-трабекулярному типу.
В крови в первые дни болезни может обнаруживаться лейкоцитоз за счет гранулоцитов, однако чаще имеет место нормоцитоз или, реже, лейкопения. СОЭ обычно повышена.
Общая продолжительность РСВИ составляет от 5-7 дней до 3-х недель.
У новорожденных и детей второго месяца жизни, особенно недоношенных, при РСВИ могут возникать приступы апноэ. Такие приступы, хотя часто повторяются во время острой инфекции, обычно купируются самостоятельно и, как правило, не сопровождаются неврологическими или системными повреждениями, но требуют наблюдения.
У детей старшего возраста и взрослых РСВИ обычно протекает в стертой форме или проявляется только как афебрильное заболевание ВДП, но может иметь и клиническую симптоматику гриппа. Полагают, что РСВ служит причиной 15% обострений хронического бронхита.
Особого внимания заслуживают тяжелые формы РСВИ у детей раннего возраста, проявляющиеся бронхиолитом или бронхо-бронхиолитом с бронхообструктивным синдромом (БОС), требующие неотложной помощи и могущие привести к летальному исходу. Половина больных этой группы приходится на детей первых 3 месяцев жизни, начиная с раннего неонатального периода. Бронхиолиты в изолированном виде обычно наблюдаются у детей первых месяцев жизни, однако в большинстве случаев, наряду с бронхиолитом, имеются клинические признаки поражения и крупных бронхов. Клинически эту группу больных характеризует выраженная дыхательная недостаточность, определяющая тяжесть болезни, в то время как явления интоксикации выражены слабо или в умеренной степени.
Клиническая диагностика РСВИ представляет определенные трудности ввиду сходства с другими респираторными заболеваниями. И все же некоторые клинические особенности отличают РСВИ от других ОРВИ. Для РСВИ в типичных случаях характерно поражение НДП с развитием бронхита или бронхиолита и возникновением БОС. Дифференциальная диагностика у детей первого полугодия жизни должна включать все другие причины острых заболеваний НДП - вирусы парагриппа, особенно 3 типа, аденовирусы, вирусы гриппа, риновирусы, а также Chlamydia trachomatis. Последняя вызывает интерстициальную пневмонию с кашлем, и, в некоторых случаях, затрудненное дыхание, хотя лихорадка обычно отсутствует. У детей с иммунодефицитом должна быть принята во внимание возможность инфекции Pneumocystis carinii. При бактериальной пневмонии шумного выдоха обычно не бывает, а симптомы общей интоксикации более выражены.
Для диагностики РСВИ имеют значение и эпидемиологические данные. Если это семейный очаг, то взрослые и дети старшего возраста переносят обычное, легкое респираторное заболевание, в то время как у детей раннего возраста наблюдается тяжелое течение, и у них часто возникает бронхит или бронхиолит.
Таким образом, имеющихся клинико-эпидемиологических данных нередко бывает достаточно для предположительного диагноза. Для окончательной верификации диагноза РСВИ используются различные лабораторные методы диагностики.
В практической работе в настоящее время наиболее широко используют экспресс-методы, направленные на определение антигена РСВ в материалах от больных. Антиген РСВ можно обнаружить методом иммунофлюоресценции либо ИФА. Оба метода достаточно специфичны и чувствительны и, по существу, имеют равновеликую ценность. Ответ получают через несколько часов.
Образцы для исследования лучше забирать при аспирации, устанавливая катетер над входом в гортань. Материал можно также получить из полости носа, используя сухой ватный тампон на металлическом стержне, реже пользуются носоглоточными смывами. Взятие материала из НДП для рутинного диагноза не является необходимым, хотя это может повысить результативность диагностики.
У умерших детей исследуют ткань легких, трахеи и бронхов на антиген РСВ или они используются для выделения вируса.
Специфический антиген выявляют методом иммунофлуоресценции в цитоплазме эпителиальных клеток носа с первых дней болезни и в последующие 10 дней. Однако при тяжелых формах болезни мы обнаруживали антиген РСВ до 29-49 дней от начала болезни.
При легких формах РСВИ, которые широко распространены, применяются симптоматические средства, и они не требуют каких-либо специфических мер.
При тяжелых формах заболевания, сопровождающихся БОС, необходима госпитализация детей. Лечение тяжелых форм РСВИ с поражением НДП носит неотложный характер. Первоочередными являются следующие мероприятия:
Несомненно, что главной задачей терапии является обеспечение адекватной оксигенации крови, что достигается как прямой ингаляцией кислорода, так и воздействием на различные механизмы БОС. Уже такое простое мероприятие, как своевременное удаление с помощью электроотсоса слизи, накапливающейся в ВДП, может привести к улучшению дыхательной функции.
При БОС показано применение средств, уменьшающих отек слизистой дыхательных путей, гиперсекрецию и бронхоспазм. Применяются бронходилятаторы и муколитики.
В связи с возникновением тяжелых, иногда критических состояний при БОС в качестве неотложной терапии показано применение глюкокортикоидов, которые применяют в сочетании с бронхолитиками. Преднизолон или гидрокортизона гемисукцинат вводят внутривенно, а затем переходят на пероральный прием. Преднизолон назначается из расчета 2-3 мг/кг, а гидрокортизона гемисукцинат 5-6 мг/кг в сутки.
Патогенетически обосновано применение диуретиков быстрого действия (фуросемид) в лечении обструктивного синдрома, если он обусловлен бронхиолитом. Фуросемид вводится в разовой дозе 1 мг/кг внутривенно или внутримышечно. Повторное введение фуросемида следует проводить с осторожностью, и чаще всего в его повторном введении в ближайшие 24 часа нет необходимости. Бикарбонат натрия для коррекции декомпенсированного ацидоза у детей с БОС не применяется.
Оптимальным вариантом поддержания функционального состояния слизистой дыхательных путей является пребывание ребенка в условиях кислородного аэрозоля (тумана) и применение медикаментозных аэрозольных ингаляций. Получение тумана достигается с помощью производителя аэрозолей эжекционного типа. Аэрозоль направляют под тент-палатку ДКП-1 или под колпак кювеза (для детей первых месяцев жизни). В камере создается кислородный аэрозольный туман с 50-60% содержанием кислорода и высокой влажностью (100%). С помощью производителя аэрозолей распыляют обычную воду, 2% раствор бикарбоната натрия, физиологический раствор, которые оказывают муколитическое действие и способствуют отхождению мокроты и снижению потери жидкости.
Постоянная ингаляционная терапия позволяет достичь, прежде всего, удовлетворительной оксигенации крови. При этом улучшаются и другие показатели газового состава крови и кислотно-щелочного состояния, особенно уменьшается метаболический компонент ацидоза.
С целью поддержания гомеостаза почти всем детям проводится инфузионная терапия, тем более, что полноценное энтеральное кормление часто не может быть обеспечено из-за тяжести состояния, однако она осуществляется в небольших объемах (20-25 мл/кг массы) и кратковременно. Обычно вводится 10% раствор глюкозы с электролитами.
В терапии БОС, особенно при выраженном бронхо-спазме, могут быть использованы бронходилятаторы короткого действия из группы b2-агонистов. Например, сальбутамол (0,2 мг/кг в день) при бронхиолите у детей в возрасте 1-9 месяцев.
Из средств этиотропной терапии для лечения РСВИ у детей раннего возраста в настоящее время в мире препаратом выбора является рибавирин, который является синтетическим нуклеозидом и принадлежит к противовирусным препаратам широкого спектра действия. Условием назначения рибавирина является лабораторно подтвержденный диагноз и ранние сроки заболевания. Показаниями для ингаляций рибавирина являются тяжелые формы РСВИ у детей раннего возраста и больные с врожденными пороками сердца. Применяется в виде длительных ингаляций аэрозолей в дозе 10 мг/кг в сутки. Длительность курса лечения 3-5 дней.
Применение рибавирина приводит к уменьшению тяжести клинической картины заболевания, сокращению длительности БОС, быстрой элиминации возбудителя, ускорению выздоровления.
При применении рибавирина следует самым строгим образом учитывать предупреждения о возможных токсических проявлениях.
Создание вакцин против РСВИ имеет долгую и поучительную историю. Более чем за 30 лет были получены инактивированные, живые аттенуированные и субъединичные РСВ-вакцины. Однако все они оказались неэффективными. Более того, после применения инактивированной вакцины естественное заражение РСВ приводило к более тяжелому течению заболевания. Тем не менее, усилия по созданию новых вакцин против РСВИ не ослабевают, и есть надежда, что эффективная вакцина будет разработана.
1. Медицинская микробиология (под ред. В.И. Покровского и О.К. Поздеева). М.: Гэотар Медицина,1998.
2. Simoes E.A. Respiratory syncytial virus infection. Lancet 1999; 354: 847-52.
4. Rodriguez W.J. Management strategies for respiratory syncytial virus infections in infants. J Pediatr 1999; 135: 45-50.
5. Ottolini M.G., Hemming V.G. Prevention and treatment recommendations for respiratory syncytial virus infection. Background and clinical experience 40 years after discovery. Drugs 1997; 54: 867-84.
6. Hussell T.; Openshaw P. Recent developments in the biology of respiratory syncytial virus: are vaccines and new treatments just round the corner? Curr Opin Microbiol 1999; 4: 410-4.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
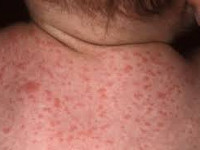
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Респираторно-синцитиальная инфекция – заболевание вирусной этиологии, характеризующееся воспалением нижних отделов дыхательных путей, умеренным катаральным и интоксикационным синдромом. Клинические проявления респираторно-синцитиальной инфекции включают субфебрильную температуру, познабливание, слабость, упорный сухой, приступообразный кашель, экспираторную одышку. Диагноз респираторно-синцитиальной инфекции подтверждается путем выделения вируса из смывов носоглотки и серологической диагностики. Лечение, как правило, амбулаторное, препаратами интерферона, отхаркивающими и муколитическими средствами.
Общие сведения
Респираторно-синцитиальная инфекция (РС-инфекция) – ОРВИ, протекающая с преимущественным поражением нижних дыхательных путей в виде бронхита, бронхиолита и интерстициальной пневмонии. Название заболевания отражает место размножения вируса в организме (респираторный тракт) и цитопатогенные эффекты, вызываемые в культуре клеток образование обширных синцитиальных полей (слияния клеток). В структуре различных ОРВИ на долю респираторно-синцитиальной инфекции приходится 15-20% всех случаев. Наиболее уязвимы перед лицом инфекции дети первого года жизни и раннего возраста. В связи с этим особое внимание респираторно-синцитиальной инфекции уделяется со стороны педиатрии.

Причины респираторно-синцитиальной инфекции
Респираторно-синцитиальный вирус принадлежит к роду Pneumovirus, семейству Paramyxoviridae. Вирионы имеют округлую или нитевидную форму, диаметр 120-200 нм, липопротеидную оболочку. Отличительной особенностью РС-вируса служит отсутствие в оболочке гемагглютинина и нейраминидазы. Во внешней среде вирус быстро инактивируется при нагревании и использовании дезинфицирующих средств, однако хорошо переносит низкие температуры и может до нескольких часов сохраняться в капельках слизи.
Респираторно-синцитиальная инфекция относится к вирусным болезням с воздушно-капельным путем передачи. Вирус способны распространять как больные люди, так и его носители. Для респираторно-синцитиальной инфекции характерны семейные и коллективные вспышки; регистрируются случаи внутрибольничной инфекции, особенно в педиатрических стационарах. Распространенность инфекции повсеместная и круглогодичная с вспышками заболеваемости в зимне-весеннее время. Наибольшая восприимчивость к респираторно-синцитиальной инфекции отмечается среди недоношенных, детей в возрасте от 4-5 месяцев до 3-х лет. Как правило, в раннем возрасте большая часть детей переболевает респираторно-синцитиальной инфекцией. Ввиду нестойкости приобретенного иммунитета нередки повторные случаи возникновения РС-инфекции, которая на фоне остаточного иммунитета протекает в более стертой форме. Однако при полном исчезновении из организма специфических секреторных антител (IgA) вновь может развиться манифестная форма респираторно-синцитиальной инфекции.
Симптомы респираторно-синцитиальной инфекции
В зависимости от преимущественной заинтересованности тех или иных отделов респираторного тракта, РС-инфекция может протекать в форме назофарингита, бронхита, бронхиолита или пневмонии. Обычно первые симптомы респираторно-синцитиальной инфекции появляются спустя 3-7 дней после заражения. Развитие заболевания постепенное: в первые дни беспокоят субфебрилитет, познабливание, умеренная головная боль, скудные серозно-слизистые выделения из носа. В некоторых случаях появляются признаки конъюнктивита, инъекция сосудов склер. Характерным симптомом респираторно-синцитиальной инфекции служит упорный сухой кашель.
Наиболее тяжело респираторно-синцитиальная инфекция протекает у детей первого года жизни. При этом отмечается высокая лихорадка, возбуждение, судорожный синдром, постоянный кашель, рвота, кашицеобразный или жидкий стул. Летальные исходы регистрируются в 0,5% случаев.
Диагностика и лечение респираторно-синцитиальной инфекции
Лечение легких и среднетяжелых случаев респираторно-синцитиальной инфекции проводится амбулаторно; детям первого года жизни и пациентам с осложненным течением заболевания необходима госпитализация. В остром периоде показаны постельный режим, полноценная щадящая диета, кислородотерапия, щелочные ингаляции. Назначаются препараты противовирусного действия (акридонуксусная кислота, умифеновир, кагоцел), отхаркивающие средства и бронхолитики, при наличии обструктивного синдрома – глюкокортикоиды. При развитии бактериальных осложнений назначаются антибиотики.
Прогноз и профилактика респираторно-синцитиальной инфекции
В большинстве случаев прогноз благоприятный; в госпитализации нуждаются около 2% пациентов. Летальные исходы возможны среди недоношенных и новорожденных, детей с врожденными пороками сердца, легких, иммунодефицитом. Перенесенный в раннем детстве бронхиолит, связанный с респираторно-синцитиальной инфекцией, является фактором риска развития бронхиальной астмы у детей в будущем.
Профилактические мероприятия направлены на предупреждение внутрибольничных и коллективных вспышек респираторно-синцитиальной инфекции путем изоляции больных, дезинфекции и частого проветривания помещений. Вакцина против респираторно-синцитиальной инфекции находится на стадии разработки; в качестве меры специфической иммунопрофилактики может применяться иммуноглобулин против РС-вируса.
МКБ-10



Общие сведения

Причины
Омикрон-штамм представляет собой новую линию мутации в S-белке SARS-CoV-2 – В.1.1.529 по классификации Pango, также в нее входят линии ВА.1, ВА.2, ВА.3. Подавляющее большинство выявляемых у пациентов генетических последовательностей вируса относятся к подвиду ВА.1. Однако со второй половины января 2022 года возрастает число мутаций ВА.2. Пока точно не установлено, почему возник штамм омикрон. Существует четыре основных гипотезы:
- Хроническое течениеCOVID-19. Ученые замечают, что пациенты с ВИЧ-инфекцией и другими формами иммунодефицита остаются носителями коронавируса 6 и более месяцев. На фоне этого возможны нетипичные мутации генетического материала возбудителя, которые в результате вызывают образование новых штаммов.
- Заражение от животных. Часть экспертов отмечают, что новый штамм коронавируса мог развиваться у грызунов или других животных, где претерпел нетипичные изменения генома. Затем возбудитель повторно попал к человеку и продолжил свою циркуляцию в популяции.
- Недостаточная изученность вируса. Высказывается мнение, что в странах с недостатком оборудования для выделения и секвенирования вируса могут возникать неконтролируемые штаммы и мутации, которые ускользают от внимания мировой науки.
- Низкий уровень иммунизации. Появление омикрона может быть связано с плохой организацией вакцинации в ряде стран мира. Специалисты в сфере инфектологии говорят, что в организме непривитых людей создаются благоприятные условия для длительной циркуляции и изменения вируса.
Первый случай варианта В.1.1.529 был обнаружен при секвенировании пробы биоматериала 9 ноября 2021 года в ЮАР. В этот период в Южной Африке развивалась третья волна коронавирусной инфекции, возник резкий всплеск заражений. Затем рост штамма В.1.1.529 был выявлен во всех провинциях страны, после чего омикрон начали обнаруживать в других государствах. Большинство экспертов здравоохранения связывают распространение вируса с авиапутешествиями.
Патогенез
В геноме омикрона более 50 видов точечных мутаций, которые изменяют хорошо изученные свойства предыдущих штаммов вируса и вызывают атипичное течение COVID-19. Ключевая особенность патогенеза – высокая контагиозность. Возбудитель распространяется в 2-4 раза быстрее варианта Delta, для инфицирования человека достаточно короткого контакта. Также в 3,2 раза чаще определяются семейные вспышки болезни, если в доме заразился хотя бы один человек.
При этом набирающий силу подвид ВА.2 отличается от классического Омикрон-штамма ВА.1 дополнительными мутациями в спайковом белке. Они помогают возбудителю COVID-19 ускользать от иммунного ответа организма пациента. Также предполагается, что ВА.2 имеет повышенную вирулентность. На сегодня продолжаются изучения обоих типов омикрона и сравнение их основных характеристик.

Симптомы омикрон-штамма COVID-19
Коронавирусная инфекция, спровоцированная новым типом патогена, отличается более мягким и легким течением. Инкубационный период при омикрон-штамме составляет в среднем 2-3 суток. Не исключено появление первых признаков недомогания на следующий день после контакта с больным COVID-19. У многих людей заражение протекает бессимптомно, особенно это касается полностью вакцинированных пациентов с достаточным уровнем иммунитета.
Типичное течение Омикрон-штамма COVID-19 приближено к классической ОРВИ. Сначала пациенты жалуются на умеренные головные боли, слабость, ломоту в теле. При этом температура повышается в пределах 38°С, держится в среднем 2-5 дней. Более 70% случаев инфекции сопровождаются насморком, заложенностью носа и чиханием, однако способность ощущать запахи и вкусы частично или полностью сохранена. До 60% пациентов испытывают першение и боли в горле.
Осложнения
После успешного выздоровления у перенесших омикрон-штамм COVID-19 сохраняется риск постковидного синдрома, который диагностируется в среднем спустя 3 месяца. В механизме его развития участвует эндотелиальная дисфункция, аутоиммунный и неврологический компоненты, из-за чего женщины более подвержены тяжелым остаточным явлениям после коронавируса.
Диагностика
В условиях пандемии все случаи острой респираторной инфекции считаются подозрительными на COVID-19, пока не было доказано обратное. Обследованием пациентов занимаются семейные врачи, педиатры и терапевты. В сложных случаях привлекают инфекционистов, специалистов отделения интенсивной терапии. Для подтверждения омикрон-штамма назначаются следующие виды исследований:
Дифференциальная диагностика
При постановке диагноза эксперты отличают омикрон от других респираторных инфекций, вызванных вирусом гриппа, респираторно-синцитиальным вирусом, риновирусами и метапневмовирусами. При атипичном COVID-19 дифференциация проводится с бактериальным респираторным заболеваниями, обострением туберкулеза, вирусными гастроэнтеритами. Помимо лабораторных анализов, большое значение имеет сбор эпидемиологического анамнеза и факторов риска.

Лечение инфекции, вызванной омикрон-штаммом SARS-CoV-2
Медикаментозная терапия
Программа лечения коронавирусной инфекции, в том числе вызванной омикрон-штаммом, регламентирована документами ВОЗ, на основании которых в каждой стране выпускаются методические рекомендации. Сейчас в России действует 14 версия клинического протокола (от 27 декабря 2021 года), в которой уточнены данные по особенностям омикрона и новейшим вариантам терапии. Ключевой задачей лечения называют предупреждение развития пневмонии, ОРДС, сепсиса.
Большинство пациентов с Омикрон-штаммом COVID-19 проходят лечение дома под контролем семейного врача. Основу терапии составляют немедикаментозные меры, такие как теплое питье, промывание носа, регулярное проветривание и увлажнение воздуха. Пациентам, которые проживают вместе с семьей, рекомендуется по возможности изолироваться в отдельной комнате. При среднетяжелом или тяжелом течении болезни назначаются следующие группы препаратов:
- Этиотропные средства. При терапии омикрон-штамма COVID-19 по показаниям применяются синтетические противовирусные медикаменты. Также используют препараты альфа-интерферона, антиковидную плазму, человеческий иммуноглобулин.
- Патогенетические препараты. В амбулаторных условиях возможен прием ингибиторов янус-киназ, антикоагулянтов, ингаляционных форм ГКС. Для пациентов на стационарном лечении дополнительно применяют ингибиторы интерлейкинов, системные ГКС, антагонисты рецептора ИЛ-6.
- Симптоматические лекарства. С учетом клинических проявлений омикрона назначаются жаропонижающие препараты из группы НПВС, назальные деконгестанты, мукоактивные и бронхолитические средства.
- Инфузионные растворы. Больным с тяжелым течением COVID-19 показано внутривенное вливание солевых и коллоидных растворов под контролем суточного диуреза и динамики артериального давления.
Респираторная поддержка
В случае снижения сатурации менее 92% начинается стандартная оксигенотерапия через назальные канюли или лицевую маску, чтобы достичь уровня SpO2 более 96%. При неэффективности таких мер или у пациентов с хронической бронхолегочной патологией применяется неинвазивная легочная вентиляция в режимах BIPAP, S/T, Pressure Support. Если на фоне лечения гипоксемия сохраняется, переходят на интубацию трахеи для проведения ИВЛ.
Прогноз и профилактика
Несмотря на большое число заражений и продолжающуюся пандемию, в отношении омикрон-штамма COVID-19 есть обнадеживающие мнения экспертов. На фоне дальнейшего ослабления вирулентности возбудитель SARS-CoV-2 может стать одним из привычных патогенов, вызывающих сезонные ОРВИ у населения. Однако не исключено появление новых мутаций коронавируса с нетипичными свойствами, которые приведут к ухудшению эпидемической обстановки.
В ситуации с пандемией COVID-19 и омикрон-штаммом ключевая роль уделяется своевременной, полноценной и тотальной вакцинации как можно большего процента населения, в том числе детей и подростков. Людям, у которых прошло более 6 месяцев с момента двухдозной иммунизации мРНК-вакцинами, рекомендовано сделать бустерную прививку для усиления защиты против омикрона.
Не теряют актуальность базовые противоэпидемические меры, ограничивающие распространение COVID-19. Правильное ношение медицинских масок или респираторов в общественных местах – строгая рекомендация инфекционистов и эпидемиологов. Регулярное мытье рук или обработка их антисептиком, соблюдение дистанции, ограничение посещений мест скоплений людей – меры индивидуальной профилактики, с помощью которых каждый человек снижает свои риски заболеть.
3. Omicron variant of SARS-CoV-2: Genomics, transmissibility, and responses to current COVID-19 vaccines / Araf Y, Akter F, Tang YD, Fatemi R, Parvez MSA, Zheng C, Hossain MG // Med Virol. 2022 Jan 12.
4. Assessment of the further spread and potential impact of the SARS-CoV-2 Omicron variant of concern in the EU/EEA, 19th update. – 2022.
Читайте также:

