Вирусы и геном эукариот
Обновлено: 25.04.2024
Работы генов прокариот и эукариот. Генная и клеточная инженерия
Вирусы
Необходимо запомнить
Ген – это фрагмент молекулы ДНК, содержащий регуляторные элементы и структурную область, и соответствующий одной единице транскрипции, которая определяет возможность синтеза полипептидной цепи или молекулы РНК.
Ген прокариот называется опероном , в его состав входят два основных участка:
- регуляторный (неинформативный),
- структурный (информативный).
У прокариот на долю регуляторных элементов приходится около 10 %, структурных – 90 %.
Структурная область гена прокариот (единицы транскрипции) может быть представлена одним кодирующим участком, который называется цистроном , либо несколькими кодирующими участками ( полицистронная единица транскрипции ). В структурной зоне при помощи генетического кода закодирована информация о последовательности аминокислот белка. Со структурной области считывается иРНК. При наличии у прокариот полицистронной единицы транскрипции на одном структурном участке одновременно может синтезироваться несколько разновидностей иРНК. К регуляторным элементам генов прокариот относятся участки, управляющие работой гена:
- промотор,
- оператор,
- терминатор.
Промотор определяет начало транскрипции (участок инициации). С промотором соединяется фермент РНК-полимераза , осуществляющий синтез мРНК. Другой элемент, управляющий процессом транскрипции, – оператор , который располагается поблизости от промотора или внутри него. Этот участок может быть свободным, тогда РНК-полимераза соединяется с промотором и начинается транскрипция. Если оператор связан с белком-репрессором, РНК-полимераза не может нормально соединиться с промотором, и транскрипция невозможна. Следующий регуляторный элемент – терминатор – находится за структурной областью и содержит сигнальный участок остановки транскрипции.

Механизм функционирования системы регуляции синтеза белка был открыт в 1962 году Жакобом и Моно при исследовании культивирования кишечной палочки в лактозной среде и назван lac-опероном.
Упрощённо этот механизм может быть описан следующим образом. На основе информации гена-регулятора синтезируется белок-репрессор; если он активный, он связывается с геном-оператором, перекрывая путь для РНК-полимеразы – процесс трансляции и последующего синтеза белка выключается (запрещается). Если появляется индуктор (например, лактоза в lac-опероне), он присоединяется к белку-репрессору, приводя его в неактивное состояние. Оператор становится активным и включает процесс считывания информации со структурных генов – разрешает трансляцию. Происходит считывание информации с ДНК, начинается синтез необходимого белка – фермента (например, фермента, расщепляющего лактозу в lac-опероне).
Это только один из возможных механизмов регуляции активности генов у прокариот, который называется запрещающей индукцией.
Строение генов у эукариот намного сложнее. Генетическая система эукариот называется транскриптоном . Транскриптон также состоит из двух частей:
- регуляторной (неинформативной),
- структурной (информативной),
относительная пропорция которых противоположна генам прокариот: на долю регуляторного участка приходится 90 %, структурного – 10 %.
Регуляторный участок представляет собой ряд последовательно расположенных промоторов и операторов и несколько терминаторов. Структурный участок состоит из одной единицы транскрипции и имеет “прерывистое” строение: кодирующие участки ( экзоны ) чередуются с некодирующими ( интронами ). Одномоментно на структурном участке у эукариот может синтезироваться только одна молекула иРНК, однако благодаря наличию альтернативного сплайсинга в разное время (в зависимости от потребности клетки) на одной и той же структурной части могут синтезироваться разные виды иРНК (от одной до нескольких десятков).

Обзор
Человеческая Т-клетка (синий), атакованная ВИЧ (желтый). Вирус ориентирован на Т-клетки, которые играют важную роль в иммунной реакции организма против вторжений, таких как бактерии и вирусы.
Автор
Редакторы

Вопрос о происхождении вирусов
Существует три основные теории возникновения вирусов:
Зарождение жизни. Идея последнего универсального общего предка: каким он мог бы быть и что ему предшествовало?

Рисунок 1. Схема трехдоменной классификации, предложенная Вёзе. В основании этой схемы должен находиться последний универсальный общий предок (англ. last universal common ancestor, LUCA).
Самый сильный аргумент в пользу существования LUCA — сохранившаяся общая система экспрессии генов (передачи наследственной информации от гена с образованием РНК или белков), одинаковая для всех живущих организмов. Все известные клеточные формы жизни используют один и тот же генетический код из 20 универсальных аминокислот и стоп-сигналов, закодированных в 64 кодонах (единицах генетического кода). Трансляция генетической информации в процессе синтеза белков по заданной матрице выполняется рибосомами, состоящими из трех универсальных молекул РНК и примерно 50 белков, из которых 20 так же одинаковы для всех организмов.
В 2010 году американский биохимик Даглас Теобальд математически проверил вероятность существования LUCA [6]. Он выбрал 23 белка, встречающихся у организмов из всех трех доменов, но имеющих разную структуру у различных видов. И исследовал эти белки у 12 различных видов (по четыре из каждого домена), после чего использовал компьютерное моделирование различных эволюционных сценариев, чтобы понять, при каком из них наблюдаемая картина будет наиболее вероятной. Оказалось, что концепция, включающая существование универсального предка, значительно вероятнее концепций, где его нет. Еще более вероятна модель, основанная на существовании общего предка, но допускающая обмен генами между видами [7].
Предположение о том, что LUCA был прокариотической клеткой, похожей на современные, часто принимается по умолчанию. Однако мембраны архей и бактерий имеют разное строение (рис. 2). Получается, что общий предок должен был обладать комбинаторной мембраной. Новая информация о мембранах LUCA появилась в 2012 году, когда несколько групп ученых подробно проанализировали историю генов всех ферментов биосинтеза компонентов липидов у бактерий, архей и эукариот [8].

Рисунок 2. Строение мембранных липидов бактерий (справа) и архей (слева)
Родственными у архей и бактерий оказались ферменты для синтеза терпеновых спиртов и пришивания полярных голов к спиртам. Значит, эти реакции мог проводить и LUCA. Проще всего было предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серина или инозитола). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны обладают высокой подвижностью по сравнению с современными мембранами, хорошо пропускают ионы металлов и малые органические молекулы. Это могло позволять древним протоклеткам поглощать готовую органику из внешней среды даже без транспортных белков.
Реконструкции LUCA методами сравнительной геномики указывают на то, что это должен быть сложный организм без обширного ДНК-генома (геном, состоящий из нескольких сотен РНК-сегментов или ДНК провирусного типа). Но даже если считать возможность существования общего предка доказанной, остается загадкой, в какой среде он мог бы появиться.

Рисунок 3. Сценарий вирусного мира в гипотезе доклеточного происхождения вирусов подпись
Предполагается, что идеальные условия для формирования жизни существовали вблизи термальных геоисточников (морских или наземных) в виде сети неорганических ячеек, обеспечивающих градиенты температуры и рН, способствующих первичным реакциям, и предоставляющих универсальные каталитические поверхности для примитивной биохимии [10].
Эти отсеки могли быть населены разнородной популяцией генетических элементов. Вначале сегментами РНК. Затем более крупными и сложными молекулами РНК (один или несколько белок-кодирующих генов). А позднее и сегментами ДНК, которые постепенно увеличивались (рис. 3).
Такие простейшие генетические системы использовали неорганические соединения из раствора и продукты деятельности других генетических систем. Сначала они должны были подчиняться индивидуальному отбору ввиду большого разнообразия. Но ясно, что важным фактором такого отбора была способность передавать генетическую информацию, то есть, копировать себя. Присутствие одновременно в одной ячейке молекул, способных копировать РНК, кодировать полезные белки и управлять синтезом новых молекул, давало больше шансов выживать в каждой отдельной ячейке. И в такой системе рано или поздно должны были появиться паразитирующие элементы. А если это так, то вирусные элементы стоят у самых истоков эволюции [11].
Возникновение паразитов — неизбежное последствие эволюционного процесса

Рисунок 4. Схематическое представление структуры модели эволюции РНК-подобной системы. На втором этапе цепочки последовательностей начинают соединяться комплементарными связями сами с собой. В результате у двух видов (cat-C и cat-A) возникает вторичная структура молекулы, которая обладает каталитическим свойством. Она ускоряет собственную репликацию (или репликацию несвернувшихся соседей). Два вида при этом приобретают паразитические свойства (par-G и par-U). Пояснения в тексте.
Таким образом, паразитарные репликаторы способствуют эволюции разнообразия, вместо того, чтобы мешать этому разнообразию. Это также делает существующую систему репликатора чрезвычайно стабильной при эволюции паразитов.
Согласно гипотезе Черной Королевы, чтобы поддержать свое существование в постоянно эволюционирующем мире, вид должен реагировать на эти эволюционные изменения и должным образом приспосабливаться к среде. Поэтому, если мы говорим о вирусах как о паразитах, мы обязаны представлять себе взаимоотношения вируса с хозяином. В борьбе с вирусом хозяева развивают новые защитные механизмы, а паразиты отвечают, развивая механизмы для атаки и взлома защиты. Этот процесс может длиться бесконечно либо до вымирания одной из противоборствующих сторон. Так множественные системы защиты составляют существенную часть геномов всех клеточных организмов, а взлом защиты — одна из основных функций генов у вирусов с большими геномами .
Механизмы клеточной защиты против вирусов
Механизмы защиты от вирусов стандартны, поскольку все вирусы уникальны, и приспособиться к каждому не представляется возможным. Это такие механизмы как:
- Деградация РНК (вирусных и клеточных) — РНК-интерференция;
- Угнетение синтеза белков (вирусных и клеточных);
- Ликвидация зараженных клеток — апоптоз (программируемая клеточная смерть);
- Воспаление.
Получается, что клетка борется с вирусом, нарушая собственные обмен веществ и/или структуру. Защитные реакции клетки — это в основном самоповреждающие механизмы.
Вирус заражает конкретную клетку потому, что его механизмы нападения направлены именно против данного типа клеток. Это такие механизмы как:
- Угнетение синтеза клеточной РНК;
- Угнетение синтеза клеточных белков;
- Нарушение клеточной инфраструктуры и транспорта;
- Подавление/включение апоптоза и других видов клеточной смерти.
Схемы защитных приемов клетки и противозащиты вирусов во многом идентичны. Вирусы и клетки применяют одни и те же приемы. Для подавления синтеза вирусных белков клетка использует интерферон, а чтобы подавить образование интерферона, вирус угнетает синтез белков.
Поскольку узнавание вируса неспецифическое, клетка не может знать намерения конкретного вируса. Она может бороться с вирусом лишь стандартными приемами, поэтому ее оборонные действия часто могут быть чрезмерными.
Понятие о вирусном геноме, типы вирусных генов, концепция генов-сигнатур
В исследовании, проведенном вирусологом Евгением Куниным и его коллегами [16], анализ последовательностей вирусных геномов выявил несколько категорий вирусных генов, принципиально отличающихся по происхождению. Можно обсуждать, какая степень дробности классификации оптимальна, но четко различаются пять классов, укладывающихся в две более крупные категории.
Гены с четко опознаваемыми гомологами у клеточных форм жизни:
- Гены, присутствующие у узких групп вирусов (обычно это гены, гомологичные генам хозяев этих вирусов).
- Гены, консервативные среди большой группы вирусов или даже нескольких групп и имеющие относительно отдаленные клеточные гомологи.
Таким образом, отличительные особенности генов-сигнатур:
- Происхождение из первичного пула генов;
- Наличие лишь очень отдаленных гомологов среди генов клеточных форм жизни, из чего можно сделать вывод, что они никогда не входили в геномы клеточных форм;
- Необходимость для репродукции вирусов.
Из всего вышесказанного следует, что эти гены переходили от вируса к вирусу (или к элементу, подобному вирусу) на протяжении четырех миллиардов лет эволюции жизни, а вирусные геномы появились благодаря перемешиванию и подгонке друг к другу генов в гигантской генетической сети, которую представляет собой мир вирусов. Многочисленные гены клеточных форм жизни также пронизывают эту сеть, прежде всего благодаря геномам крупных вирусов, таких как NCDLV и крупным бактериофагам, которые позаимствовали множество генов от своих хозяев на разных этапах эволюции. Однако большинство заимствованных генов сами по себе не критичны для репликации и экспрессии вирусного генома (исключая некоторые случаи возможного неортологичного замещения генов-сигнатур); обычно эти гены участвуют во взаимодействии между вирусом и хозяином. Таким образом, несмотря на интенсивный взаимообмен генами с хозяевами, вирусы всегда происходят от других вирусов.
Вирусы, встроенные в геном, и горизонтальный перенос генов
В процессе эволюции многие вирусы встроились в геномы клеточных форм жизни путем горизонтального переноса генов (ГПГ). Впервые горизонтальный перенос был описан в 1959 году, когда ученые продемонстрировали передачу резистентности к антибиотикам между разными видами бактерий. В 1999 году Рави Джайн, Мария Ривера и Джеймс Лейк в своей статье писали о произошедшей значительной передаче генов между прокариотами [17]. Этот процесс, по-видимому, оказал некоторое влияние также и на одноклеточные эукариоты. В 2004 году Карл Вёзе опубликовал статью, в которой утверждал, что между древними группами живых организмов происходил массивный перенос генетической информации. В древнейшие времена преобладал процесс, который он называет горизонтальным переносом генов. Причем, чем дальше в прошлое, тем это преобладание сильнее [18].
Горизонтальный перенос генов — процесс, в котором организм передаёт генетический материал другому организму, не являющемуся его потомком. Горизонтальная передача генов реализуется через различные каналы генетической коммуникации — процессы конъюгации, трансдукции, трансформации, переноса генов в составе плазмидных векторов, вирусов, мобильных генетических элементов (МГЭ).
Трансдукция — перенос бактериофагом (агентами переноса генов, АПГ) в заражаемую клетку фрагментов генетического материала клетки, исходно содержавшей бактериофаг [19]. Такой бактериофаг обычно переносит лишь небольшой фрагмент ДНК хозяина от одной клетки (донор) к другой (реципиент). В зависимости от типа трансдукции — неспецифической (общей), специфической или абортивной, геном фага или хозяина-бактерии может быть изменен тем или иным образом:
- При неспецифической трансдукции (рис. 5) ДНК клетки-хозяина включаются в частицу фага (дополнительно к его собственному геному или вместо него);
- При специфической трансдукции гены фага замещаются генами хозяина;
- При абортивной трансдукции внесённый фрагмент ДНК донора не встраивается в ДНК хозяина-реципиента, а остаётся в цитоплазме и не реплицируется. Это приводит к тому, что при клеточном делении он передаётся только одной из дочерних клеток и затем теряется в потомстве.

Рисунок 5. Схема общей трансдукции
Наиболее известным примером специфической трансдукции служит трансдукция, осуществляемая фагом λ. Поскольку этот фаг при переходе в состояние профага включается в хромосому бактерий между генами, кодирующими синтез галактозы и биотина, именно эти гены он может переносить при трансдукции.
Вот несколько примеров важных эволюционных событий, связанных с молекулярным одомашниванием:
- Ферменты теломеразы, служащие для восстановления концевых участков хромосом, возможно, ведут свое происхождение от обратных транскриптаз, кодируемых ретровирусами и ретротранспозонами [22];
- Белки RAG, играющие ключевую роль в системе адаптивного иммунитета, по-видимому, происходят от прирученных транспозаз — ферментов, кодируемых транспозонами;
- Ген Peg10, необходимый для развития плаценты, был позаимствован древними млекопитающими у ретротранспозона (рис. 6) [23].

Рисунок 6. Роль гена Peg10 в эмбриональном развитии. Ученые под руководством Рюичи Оно из Токийского медицинского университета Японии показали, что у мышей с выключенным геном Peg10 нарушается развитие плаценты, от чего эмбрион погибает через 10 дней после зачатия [24].
В 2008 году в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENVV1 и ENVV2), которые, по всей видимости, находятся в рабочем состоянии [25]. Это гены белков оболочки ретровируса. Каждый из них входит в состав своего эндогенного ретровируса (ЭРВ), причем все остальные части этих ЭРВ давно не функционируют.
Вирусные гены ENVV1 и ENVV2 у человека и обезьян работают в плаценте и, скорее всего, выполняют следующие функции:
Таким образом, как минимум три полезных применения нашли себе вирусные гены в плаценте приматов. Это показывает, что генетические модификации, которым ретровирусы подвергают организмы, в долгосрочной перспективе могут оказаться полезными или даже определить развитие вида. И с учетом всего вышесказанного древо доменов должно выглядеть как на схеме ниже (рис. 7).

Рисунок 7. Горизонтальный перенос генов в рамках трехдоменного дерева
Заключение
Возникновение паразитов — обязательная черта эволюционирующих систем репликаторов, а соревнование хозяев и паразитов движет эволюцию тех и других. Любой организм является результатом миллионов лет борьбы клеток с невероятно разнообразным миром вирусов. Их действия и их эволюция пронизывают всю историю клеточной эволюции, и сейчас меняется само наше представление о них. Когда-то вирусы считали деградировавшими клетками, но чем больше мы узнаем о вирусах, тем очевиднее, что их роль в общей эволюции значительна. И невероятно много нам еще предстоит узнать.

Обзор
Многообразие мобильных генетических элементов
Автор
Редакторы

Организмы и геномы можно таким образом расценивать как секции биосферы, по которым гены глобально циркулируют с различной интенсивностью, и в которые персональные гены и опероны могут включаться, если они предоставляют достаточные преимущества.
K. Jeon и J. Danielli [1]

Основные сокращения
МГЭ мобильные генетические элементы ГГП горизонтальный генетический перенос ОРС открытая рамка считывания, последовательность нуклеотидов между инициирующим и терминирующим кодонами гена ori T место начала переноса цепи плазмидной ДНК при мобилизации ori V место начала репликации (копирования, воспроизводства) плазмидной ДНК rep ген белка-инициатора репликации многих бактериальных плазмид
Вирусы: суперпаразиты и помощники
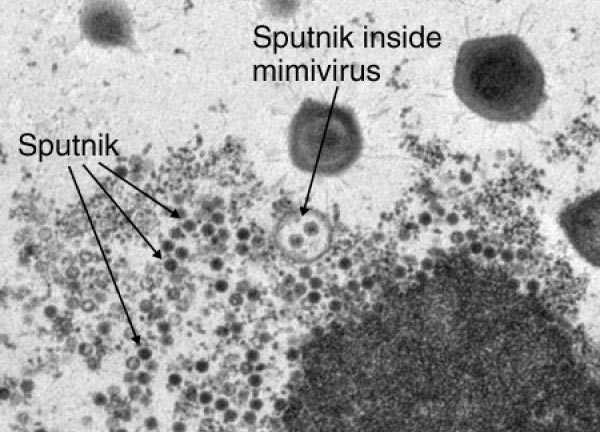
В 2012 году охарактеризовали интегрированную в ДНК мимивирусов форму вирофага и даже новый класс МГЭ — трансповироны, способные встраиваться в ДНК и мимимирусов, и вирофагов [7]. Подобно бактериофагам, переносящим гены от одних бактерий к другим, вирофаги могут играть важную роль в ГГП между разными группами вирусов и их хозяевами.
Многие профаги кодируют факторы вирулентности, трансформируя нетоксигенные бактерии в агентов-убийц: профаг CTXphi из Vibrio cholerae кодирует холерный токсин, а упомянутый выше P22 — ферменты конверсии О-антигена сальмонеллы, позволяя ей уходить от иммунного надзора.
В составе фагов обнаруживают другие МГЭ (например, транспозоны, несущие гены антибиотикорезистентности) и их модули (системы репликации и переноса конъюгативных плазмид). Самый известный пример слияния модулей фагового и плазмидного происхождения — фаг Р1, способный реплицироваться и длительно поддерживаться вне хромосомы, ничем не отличаясь от плазмиды. Профаги разных бактерий детально рассмотрены в обзоре [8].
Плазмиды — маленькие гиганты больших процессов
Плазмиды — внехромосомные двуцепочечные молекулы ДНК, способные к длительному автономному существованию в клетках прокариот и некоторых эукариот. Чаще всего плазмидные ДНК суперскручены и ковалентно замкнуты в кольцо, однако у актиномицетов и спирохет встречаются и линейные формы, что обычно сочетается с линейной организацией хромосом. Размер плазмид обычно варьирует от 0,85 т.п.н. (pRKU1 из Thermotoga petrophila) до 600 т.п.н., но у бруцелл и ризобий описаны мегаплазмиды размером более 1 млн п.н., что иногда делает вопрос их дифференцировки от дополнительных хромосом риторическим [9]. Элиминация мегаплазмид, в отличие от хромосом, обычно не вызывает фатальных для бактериальной клетки последствий, однако вместе с плазмидами могут утратиться такие важные функции, как способность к фиксации азота и формированию симбиотических клубеньков (у ризобий).
На долю плазмидной ДНК может приходиться 1–15% наследственной информации бактериальной клетки, однако известны случаи, когда плазмидами контролируется до 25% (у некоторых Archaea) и даже до 40% информации (2 мегаплазмиды размером около 1,4 и 1,6 млн п.н. у Sinorhizobium meliloti).
Плазмидами часто мобилизуются сосуществующие с ними в одной клетке неконъюгативные МГЭ (но обладающие как минимум сайтом начала переноса oriT, а чаще и генами mob) и даже хромосомы. Мобилизация генов хромосомы возможна в случае интеграции в неё конъюгативной плазмиды. Это возможно, когда в обеих молекулах присутствуют одинаковые инсерционные последовательности (IS-элементы), обеспечивающие гомологичную рекомбинацию (типичный пример — F-фактор E.coli). Однако интеграция может быть и RecA-независимой, если плазмида кодирует тирозиновую интегразу (плазмиды стрептомицетов pSE101, pSAM2 и псевдомонад pKLK106). В этом случае интеграция чаще происходит в гены тРНК, но в некоторых хозяевах эта закономерность нарушается [3].
Транспозоны — универсальные генетические челноки
Транспозоны — МГЭ, перемещающиеся как в пределах одной молекулы ДНК, так и между разными репликонами одного генома (конъюгативные транспозоны — и между геномами). Фланкированы инвертированными повторами, а в центральной части содержат гены, ответственные за перемещение. Транспозоны прокариот подразделяют на IS-элементы, Tn-элементы и Mu-подобные фаги [10].
Интегроны — природные системы клонирования и экспрессии
В процессе перемещения от одного интегрона к другому или от одного сайта в интегроне к другому сайту, генная кассета существует как автономная и неспособная к репликации двунитевая кольцевая молекула ДНК. Кассеты, захватываемые интегронами и суперинтегронами, могут содержать гены факторов патогенности, метаболических путей, детерминанты антибиотико- и дезинфектантоустойчивости или гены рестрикционных ферментов. Интеграза IntI катализирует сайт-специфическую рекомбинацию между сайтами attI и attC, в результате чего происходит интеграция или вырезание кассеты. Множество событий интеграции ведет к образованию мультикассетных рядов, в которых все кассеты фланкированы attC-сайтами. Известны хромосомные суперинтегроны, включающие до 179 генных кассет (у Vibrio cholerae), однако среди клинически значимых бактерий большинство интегронов содержит до 5–8 генных кассет. Наиболее эффективно экспрессируются кассеты, расположенные ближе к промотору, но изменение селективного давления может способствовать перестройкам в составе интегрона.

Рисунок 3. Интегрон — ДНК, улавливающая генные кассеты и распространяемая в составе более высокоорганизованных МГЭ. а — Структура интегрона класса 1. Pint — промотор интегразы, Pant — промотор кассет антибиотикорезистентности. Остальные элементы объяснены в тексте; б — Иерархическая организация МГЭ.
Все интегроны, несущие кассеты антибиотикорезистентности, разделяют на 5 классов на основании гомологии последовательностей кодируемых ими интеграз. Большинство интегронов антибиотикорезистентности относится к классу 1 (часто ассоциированы с Tn21-семейством). Они включают два концевых невариабельных региона, называемых константными последовательностями (constant sequences, CS), и высоковариабельный центральный участок. В одном конце интегрона (5’-CS), обычно находятся intI, attI и промотор, от которого экспрессируются гены кассеты. В другом конце (3’-CS), находится часть гена qacEΔ1, который, будучи интактным, несёт устойчивость к четвертичным аммониевым соединениям. За ним расположен ген sul, определяющий резистентность микроорганизма к сульфаниламидам, и 1–2 гена с неустановленной функцией — orf5 и иногда orf6 (рис. 3, а). Интегроны класса 2 ассоциированы с Tn7-семейством, классов 3 и 5 — с плазмидами, класса 4 — с конъюгативным геномным островом SXT Vibrio cholerae.

Рисунок 4. Схематическое изображение структуры геномного острова в составе бактериальной хромосомы. DR — прямые повторы ДНК хромосомы, фланкирующие ГО; IS — инсерционные элементы.
Геномные острова гонококков (GGI) кодируют систему секреции типа IV (T4SS), родственную плазмидным системам конъюгационного переноса. Посредством T4SS распространяется не только сам элемент и его продукты, но секретируется в окружающую среду и хромосома Neisseria gonorrhoeae, которая затем может трансформировать другие бактерии и участвовать в рекомбинационных событиях.
Главные нарушители границ и их мекка
Из обитателей отстойников, а что самое опасное — из бактерий вод, уже прошедших очистку, — в большом количестве выделяют плазмиды IncP-1-группы несовместимости (в системе классификации плазмид псевдомонад) [12]. Эти относительно небольшие молекулы дарят хозяевам массу селективных преимуществ (от множественной резистентности до биодеградации хлорорганики) и способны распространяться не только среди псевдомонад, но и практически всех грамотрицательных и некоторых грамположительных бактерий. Кроме того, они способны мобилизовать неконъюгативные R-плазмиды (например, IncP-4) к переносу в ещё более широкий спектр бактерий, а также в дрожжи и клеточные линии млекопитающих [17].
Биология плазмид в России и за рубежом. Что же можно возвести на крепком фундаменте?

Обзор
здесь и далее рисунки Андрея Занкевича
Автор
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Напомним, что РНК (рибонуклеиновая кислота) — это такая молекула, представляющая собой одну цепочку нуклеотидов. В составе каждого нуклеотида присутствует остаток моносахарида рибозы. На сегодняшний день известно множество разных типов РНК, которые выполняют совершенно разные функции: от кодирования клеточных белков (мРНК) до противовирусной защиты (некоторые микроРНК) [1–5]. РНК, входящие в состав многих вирусов, могут иметь ряд оригинальных функций, таких как регуляция времени экспрессии различных вирусных генов путем изменения пространственной организации цепи РНК или привлечение клеточных белковых комплексов.
Но бывает ли такое, что в пределах одной молекулы РНК одна ее часть, кодирующая некоторый белковый продукт, имеет положительную полярность, в то время как другая часть цепи представлена участком отрицательной полярности, кодирующим другой белок? Могла ли такая молекула возникнуть в процессе эволюции живых форм?
Ответ — да! И для того, чтобы разобраться, как функционируют такие молекулы, нам предстоит погрузиться в таинственный мир вирусов.
Давным-давно, в далекой-далекой галактике.
Как известно, все формы жизни обладают определенной наследственностью, которая определяет степень генетической идентичности живых объектов. В качестве молекул, ответственных за поддержание такой наследственной идентичности, выступают нуклеиновые кислоты (ДНК и РНК). Клеточные формы жизни для хранения и передачи информации используют только один тип нуклеиновых кислот — дезоксирибонуклеиновую кислоту (ДНК), в то время как вирусы в качестве основной молекулы наследственности могут использовать либо ДНК, либо РНК.
В случае ДНК-содержащих вирусов реализуется, как правило, Центральная догма молекулярной биологии в классическом виде: попав в клетку, ДНК удваивается в процессе репликации вирусного генома, на матрице ДНК в ходе транскрипции синтезируются мРНК, которые затем прочитываются рибосомой, синтезирующей по ним вирусные белки, то есть осуществляется трансляция. Далее вирусные белки ассоциируются с ДНК-геномом вируса в вирусную частицу (вирион), которая способна заражать новые клетки.
Очевидно, что РНК-содержащие вирусы используют иные стратегии размножения и, следовательно, реализации своего генома. Непривычные для большинства биологов молекулярные механизмы, которые используются такими вирусами, вероятно, унаследованы от далеких предков из того самого РНК-мира.
Размножение РНК-вирусов подразумевает использование разных типов РНК:
- геномная РНК находится внутри вириона, в зависимости от конкретного вируса, она может быть представлена (+)РНК, (–)РНК, (±)РНК, либо двухцепочечной РНК;
- комплементарная геномной РНК антигеномная РНК образуется в процессе репликации вирусов с одноцепочечным РНК-геномом и обладает полярностью, противоположной геномной РНК;
- субгеномная РНК (вирусная мРНК) имеет (+)полярность и является продуктом транскрипции геномной или антигеномной РНК. Как и подобает мРНК, субгеномная РНК участвует в процессе трансляционного синтеза белка.
Немного истории
Первым найденным РНК-вирусом стал бактериофаг f2, инфицирующий бактерию кишечную палочку (Escherichia coli) [7]. Выделенная геномная РНК фага f2 имела свойства мРНК, то есть она распознавалась рибосомой и могла транслироваться. На родственном РНК-бактериофаге Qβ была изучена РНК-зависимая РНК-полимераза (RdRp), которая, как оказалось, может синтезировать цепь РНК на матрице другой цепи РНК, то есть осуществлять репликацию вирусного РНК-генома! В ходе работы с РНК-бактериофагами f2 и его родственником Qβ были получены общие представления о биологии таких РНК-вирусов [8].
После РНК-бактериофагов были найдены (+)РНК-вирусы животных, такие, как вирус полиомиелита [9], [10], представитель группы пикорнавирусов. Подобные вирусы не содержат репликативных белков в составе вирусной частицы (вириона).
Встречаются вирусы, геном которых представлен двухцепочечной РНК. Как и в случае (–)РНК-вирусов, у дцРНК-вирусов во время репликации в клетке первым делом происходит синтез (+)цепи. Вирусные частицы этой группы также включают в свой состав RdRp.
Вирусы с двусмысленным РНК-геномом из семейства Bunyaviridae

Рисунок 1. Схематичное изображение структуры вириона флебовирусов
В семействе Bunyaviridae роды Phlebovirus, Tospovirus и Tenuivirus являются вирусами с двусмысленным РНК-геномом и, в отличие от остальных представителей семейства, имеют чуть более длинный S-сегмент генома (РНК S) (±)полярности. Род Tospovirus имеет вдобавок (+)участок на РНК M, который делает и эту РНК амбисенсной.
Флебовирусы
Вирусы рода Phlebovirus выделяют практически по всему миру и относят к нетаксономической группе арбовирусов, распространяющихся в членистоногих переносчиках и в позвоночных, на которых питаются переносчики. Члены этого рода переносятся кровососущими членистоногими. Инфекции не обходят стороной человека: вирусы сицилийской и неаполитанской москитных лихорадок широко распространены по территории Средиземноморья [15]. Среди симптомов таких инфекций — продолжительная сильная лихорадка, тошнота, рвота, диарея и головные боли. Вирус Тосканы, также переносимый москитами, обладает способностью проникать в нервную ткань и, вдобавок к вышеперечисленным симптомам, вызывает асептический менингит и менингоэнцефалит. Флебовирусы, переносимые клещами, например, вирус Бханджа, вирус тяжелой лихорадки с синдромом тромбоцитопении, или вирус Хартленд, вызывают серьезные вспышки инфекций среди людей [16].
Эти вирусы получили свое имя от латинского названия москитов (Phlebotominae), которые являются их основными переносчиками. Вирионы флебовирусов имеют диаметр 100-125 нанометров. Внутри вириона находятся три вирусных рибонуклеопротеина (вРНП), содержащих геномные сегменты, однако для вируса лихорадки долины Рифт (RVFV) было показано [17], что вирионы также могут содержать ещё три дополнительных вРНП, образованных цепочками антигеномных РНК, комплементарных геномным вирусным РНК. Рецептор-распознающий аппарат вирусов представлен гетеродимерами гликопротеинов Gn и Gc, которые организованным способом распределены по мембране вириона.
Структура генома флебовирусов
Геном флебовирусов как и других представителей семейства Bunyaviridae, включает три молекулы РНК: PHК L, РНК M, РНК S, имеющие на 5′- и 3′- концах уникальные для каждого геномного сегмента комплементарные последовательности. РНК L (–)полярности кодирует белок репликазы L. (–)РНК M кодирует предшественник гликопротеинов G1 и G2. (±)РНК S кодирует белок нуклеокапсида N на (–)полярном участке (ближе к 3′) и неструктурный белок NSs на (+)полярном участке (ближе к 5′) (рис. 2).

Рисунок 2. Схема структуры генома флебовирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
NSs выполняет ряд функций, среди которых подавление индукции интерферона, усиление репликации и транскрипции вирусной РНК и определение круга хозяев [18]. NSs через цепочку белковых факторов способен приводить к инактивации противовирусной протеинкиназы R организма-хозяина [19].
Механизмы транскрипции и репликации РНК флебовирусов
Остановка транскрипции (–)участка РНК S определяется межгенным сигналом терминации. Похожие сигналы терминации находятся в 5′-концевой области РНК M и РНК L. В результате синтезируются кэпированные, но неполиаденилированные (и, следовательно, не такие стабильные, как клеточные мРНК) субгеномные РНК [18]. Также было показано [17], что в инфицированных клетках наблюдается ранняя экспрессия белка NSs, к тому же при детальном анализе состава вирионов обнаружили, что в вирусную частицу может упаковываться как три геномных цепи, так и еще три антигеномных цепи. Считается, что антигеномная РНК S присутствует в вирионе для осуществления ранней транскрипции мРНК, кодирующей NSs, поскольку этот неструктурный белок способен регулировать клеточные процессы, и чем раньше он начнёт работать в зараженной клетке, тем интенсивнее будет протекать вирусная инфекция.
Жизненный цикл флебовирусов
Жизненный цикл состоит из следующих стадий (рис. 3):

Рисунок 3. Схема, демонстрирующая основные этапы цикла флебовируса
Тосповирусы и тенуивирусы
Название рода Tospovirus происходит от сокращения названия вируса пятнистого увядания томатов (tomato spotted wilt virus, ТоSWV), впервые выделенного в 1930 году из зараженных растений томата. Этот вирус имеет очень широкий спектр хозяев и важное хозяйственное значение, борьба с ним ведется, в основном, за счет контроля численности трипсов.
Структура генома тосповирусов и тенуивирусов
Представители родов Тospovirus и Tenuivirus (тенуивирусы близки к тосповирусам, но не имеют липидной оболочки) являются единственными известными РНКвирусами растений с двусмысленным геномом [23]. Геном тосповирусов представлен тремя РНК-сегментами: большим, средним и малым (L, M, S). РНК L кодирует репликазу L. РНК S, подобно таковой у флебовирусов, кодирует белок нуклеокапсида N в (–)области и неструктурный белок NSs в (+)области. Эти области не пересекаются, они разделены межгенным некодирующим участком, содержащим сигналы терминации транскрипции. М-сегмент генома имеет принципиально отличную от РНК М флебовирусов структуру, являясь амбисенсной РНК. РНК М тосповирусов имеет область (–)полярности, в которой находится последовательность, кодирующая мРНК GnGc — предшественника поверхностных гликопротеинов, а также участок (+)полярности в 5′-области, кодирующий белок межклеточного транспорта NSm. Эти последовательности также разделены межгенным участком (рис. 4). Механизмы транскрипции и репликации РНК этих вирусов сходны с таковыми у флебовирусов [18].

Рисунок 4. Схема структуры генома тосповирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирной линией обозначен сайт протеолиза белкового продукта.
Отдельного внимания заслуживает неструктурный белок, закодированный в S-сегменте генома тосповирусов — NSs. Основной его функцией является супрессия противовирусного сайленсинга РНК, системы малых интерферирующих РНК [5], [24], распознающих вирусные РНК, что приводит к деградации последних [25]. Логично предположить, что синтез такого белка должен происходить как можно раньше, поэтому, возможно, по аналогии с белком NSs флебовирусов, ранняя транскрипция такой последовательности происходит в результате наличия в вирионе, помимо геномной цепи РНК S, еще и соответствующей ей антигеномной.
Вирусы с двусмысленным РНК-геномом из семейства Arenaviridae
Помимо семейства Bunyaviridae, амбисенсные РНК имеют представители семейства Arenaviridae. Аренавирусы являются таксономической группой вирусов позвоночных с сегментированным двусмысленным РНК-геномом. Вирусы, инфицирующие млекопитающих, определены в род Mammarenavirus, а заражающие рептилий — в роды Reptarenavirus и Hartmanivirus [26].
Вирионы аренавирусов, как и рассмотренных выше буньявирусов, плеоморфны, а их диаметр может варьировать от 40 до 200 нанометров в зависимости от вида, однако и частицы одного вида могут заметно различаться по размерам [27]. Границы вириона представлены липопротеидной оболочкой — производной клеточной мембраны, модифицированной равномерно распределёнными гликопротеиновыми комплексами (гетеродимерный гликопротеин GP1/GP2). Гликопротеины синтезируются в виде предшественника, который разрезается примерно пополам клеточной протеиназой на рецептор-распознающую субъединицу GP1 и трансмембранную субъединицу GP2. Последняя ответственна за слияние мембран при проникновении в цитоплазму [28]. В вирионе гликопротеины ассоциированны с лежащими на внутренней стороне мембраны молекулами матриксного белка Z, выстилающего внутреннюю поверхность мембраны, и белка нуклеокапсида N. Белок N способен связываться с РНК, распознавать кэп и ингибировать интерфероновый ответ. Структурный белок Z в клетке выполняет ряд функций (в том числе ингибирование трансляции клеточных мРНК и подавление апоптоза), являясь фактором созревания вирусных частиц (отвечает за инициацию сборки вирионов и за их отпочковывание).
Во время сборки вирусных частиц при формировании внешней оболочки иногда происходит захват субъединиц клеточных рибосом, по всей видимости, не играющих роли в вирусной инфекции (рис. 5).

Рисунок 5. Схематичное изображение структуры вириона аренавирусов
Значительная часть представителей семейства вызывает хронические и, как правило, бессимптомные инфекции у грызунов. При контакте человека с такими вирусами может развиваться острая и тяжелая инфекция, часто — геморрагическая лихорадка (например, в случае инфекции вирусом лихорадки Ласса, LasV). Вирус лимфоцитарного хориоменингита (LCMV), первый выделенный аренавирус, является нейроинвазивным. Попав в организм человека (например, через выделения грызунов), вирионы с током крови преодолевают гематоэнцефалический барьер центральной нервной системы и вызывают воспаления мозговых оболочек [29].
Структура генома аренавирусов

Рисунок 6. Схема структуры генома аренавирусов. Отмечены участки РНК, обладающие (–)- и (+)полярностью. Пунктирными линиями обозначены сайты протеолиза белковых продуктов.
РНК L на (–)участке несет последовательность, комплементарную гену репликазы L, и рамку матриксного и регуляторного белка Z на (+)участке в 5′-концевой части геномной РНК.
РНК S кодирует белок нуклеокапсида N в области (–)полярности и содержит рамку считывания GP1GP2 — предшественника поверхностных гликопротеинов GP1/GP2 (также в 5′-концевой части геномного сегмента).
Транскрипция и репликация генома аренавирусов
Переключение на репликацию связано с наличием белка N: когда его накапливается такое количество, что он начинает покрывать строящиеся цепи РНК, это, вероятно, влияет на конформацию репликазы и приводит к проскоку сигналов терминации транскрипции в виде межгенных шпилек. РНК S при репликации накапливается в больших количествах, так как нужно много копий белка нуклеокапсида, а также гликопротеинов (для экспрессии последних необходим предварительный синтез антигеномной РНК).
Заключение
Такая необычная организация двусмысленных геномных сегментов является интересным способом представления двух кодирующих последовательностей в одном геномном сегменте. На примере вирусов с двусмысленными РНК-геномами заметно, насколько изобретательной может быть эволюция вирусных РНК. Поскольку вирусы с двусмысленными РНК-геномами до сих пор удерживают определенную нишу, можно утверждать, что такой способ кодирования обладает некоторыми преимуществами по сравнению с более привычным для родственных вирусов способом, использующим только (–)РНК-сегменты.
Как возникли амбисенсные РНК и почему поддержались отбором, до сих пор остается одной из загадок современной вирусологии.
Благодарности от автора
Я благодарю доктора биологических наук, профессора кафедры вирусологии биологического факультета МГУ им. М.В. Ломоносова Аграновского Алексея Анатольевича за интересные и содержательные лекции по молекулярным процессам РНК-вирусов и вдохновение на написание данной статьи. Также выражаю благодарность художнику Андрею Занкевичу, чьи наглядные и яркие иллюстрации украшают данную статью.
Урок посвящен знакомству с механизмами транскрипции и трансляции в клетках эукариот и прокариот. Вы узнаете о современных направлениях молекулярной биологии – генной и клеточной инженерии. А так же познакомитесь с вирусами – неклеточной форме жизни.
4. Глоссарий по теме (перечень терминов и понятий, введенных на данном уроке);
оператор - участок ДНК между промотором и структурными генами в опероне располагается;
репрессор - связан особый белок связанный с оператором при этом РНК-полимераза не может начать синтез иРНК.
Оперон – это группа генов (т.е. участок ДНК), работа которых контролируется одним геном-регулятором. Единица считывания информации у прокариот.
Ген-регулятор – это ген, находящийся обычно на некотором расстоянии от оперона (т.е. он не входит в организацию оперона), постоянно активен и на основе его информации синтезируется особый белок-репрессор
Бактериофаг - вирус, инфицирующий бактерии.
Вирион - вирусная частица.
Капсид - белковая оболочка вирусной частицы.
Клонирование - совокупность процедур, использующихся для получения клонов.
Ретровирусы - группа РНК-содержащих вирусов, содержащих обратную транскриптазу; синтезированная на РНК-матрице двухцепочечная ДНК может встраиваться в хромосому инфицированной этим вирусом клетки.
Генная инженерия – (Gene engineering) – совокупность приемов, методов и технологий, в том числе технологий получения рекомбинантных рибонуклеиновых и дезоксирибонуклеиновых кислот, по выделению единичных или нескольких генов из организма, осуществлению манипуляций с генами и введению их в другие организмы.
Клеточная инженерия – это один из основных разделов современной биотехнологии, основанный на выделении и культивировании тканей и клеток высших многоклеточных организмов
Биотехноло́гия — интеграция естественных и инженерных наук, позволяющая наиболее полно реализовать возможности живых организмов или их производные для создания и модификации продуктов или процессов различного назначения
5. Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц);
1. Общая биология 10-11, дидактические материалы/ авт.-сост С.С. Красновидова, С. А. Павлов, А. Б. Павлов, - М. Просвещение, 2000г., стр.6-42
2. Общая биология 10-11 классы: подготовка к ЕГЭ. Контрольные и самостоятельные работы/ Г. И. Лернер. – М.: Эксмо, 2007.стр 35-45
3. Биология: общая биология. 10-11 классы: учебник/ А. А. Каменский, Е. А. Криксунов, В. В. Пасечник.- М.: Дрофа, 2018. Стр.55-68
6. Открытые электронные ресурсы по теме урока (при наличии);
7. теоретический материал для самостоятельного изучения;
Ген – это фрагмент молекулы ДНК, содержащий регуляторные элементы и структурную область, и соответствующий одной единице транскрипции, которая определяет возможность синтеза полипептидной цепи или молекулы РНК.
Ген прокариот называется опероном, в его состав входят два основных участка:
- регуляторный (неинформативный),
- структурный (информативный).
У прокариот на долю регуляторных элементов приходится около 10 %, структурных – 90 %.
Структурная область генов прокариот (единица транскрипции) может быть представлена одним кодирующим участком, который называется цистроном, либо несколькими кодирующими участками (полицистронная единица транскрипции). В структурной зоне закодирована информация о последовательности аминокислот в виде генетического кода. Со структурной области считывается мРНК. При наличии у прокариот полицистронной единицы транскрипции на одном структурном участке одновременно может синтезироваться несколько разновидностей мРНК.
К регуляторным элементам генов прокариот относятся участки, управляющие работой гена:
- промотор,
- оператор,
- терминатор.
Промотор определяет начало транскрипции (участок инициации). С промотором соединяется фермент РНК-полимераза, осуществляющий синтез мРНК. Другой элемент, управляющий процессом транскрипции, – оператор, который располагается поблизости от промотора или внутри него. Этот участок может быть свободным, тогда РНК-полимераза соединяется с промотором и начинается транскрипция. Если оператор связан с белком-репрессором, РНК-полимераза не может нормально соединиться с промотором, и транскрипция невозможна. Следующий регуляторный элемент – терминатор – находится за структурной областью и содержит сигнальный участок остановки транскрипции.

Механизм функционирования системы регуляции синтеза белка был открыт в 1962 году Жакобом и Моно при исследовании культивирования кишечной палочки в лактозной среде и назван lac-опероном.
Упрощенно этот механизм может быть описан следующим образом. На основе информации гена-регулятора синтезируется белок-репрессор; если он активный, он связывается с геном-оператором, перекрывая путь для РНК-полимеразы – процесс трансляции и последующего синтеза белка выключается (запрещается). Если появляется индуктор (например, лактоза в lac-опероне), он присоединяется с белку-репрессору, приводя его в неактивное состояние. Оператор становится активным и включает процесс считывания информации со структурных генов – разрешает трансляцию. Происходит считывание информации с ДНК, начинается синтез необходимого белка – фермента (например, β-галактозидазы в lac-опероне).
Это только один из возможных механизмов, который называется запрещающей индукцией. Существуют и другие механизмы регуляции синтеза белка: разрешающая индукция, разрешающая и запрещающая репрессия, в которых принимают участие апоиндукторы и корепрессоры.
Строение генов у эукариот намного сложнее. Генетическая система эукариот называется транскриптоном. Транскриптон также состоит из двух частей:
- регуляторной (неинформативной),
- структурной (информативной),
относительная пропорция которых противоположна генам прокариот: на долю регуляторного участка приходится 90 %, структурного – 10 %.
Регуляторный участок представляет собой ряд последовательно расположенных промоторов и операторов и несколько терминаторов. Структурный участок состоит из одной единицы транскрипции и имеет “прерывистое” строение: кодирующие участки (экзоны) чередуются с некодирующими (интронами). Одномоментно на структурном участке у эукариот может синтезироваться только одна молекула мРНК, однако благодаря наличию альтернативного сплайсинга в разнос время (в зависимости от потребности клетки) на одной и той же структурной части могут синтезироваться разные виды мРНК (от одной до нескольких десятков).
Вирус (от лат. virus — яд) — простейшая форма жизни, микроскопическая частица, представляющая собой молекулы нуклеиновых кислот (ДНК или РНК, некоторые, например, мимивирусы, имеют оба типа молекул), заключённые в белковую оболочку и способные инфицировать живые организмы. От других инфекционных агентов вирусы отличает капсид. Вирусы, за редким исключением, содержат только один тип нуклеиновой кислоты: либо ДНК, либо РНК.
Вирусы являются паразитами, так как вирусы не способны размножаться вне клетки. Вне клетки вирусные частицы ведут себя как химические вещества. В настоящее время известны вирусы, размножающиеся в клетках растений, животных, грибов и бактерий (последних обычно называют бактериофагами). Обнаружены также вирусы, поражающие другие вирусы (вирусы-сателлиты).
В наше время существуют три гипотезы происхождения вирусов. виды вирусов в биологии Гипотеза клеточного происхождения сообщает о том, что внеклеточные агенты появились из фрагментов РНК и ДКН, которые смогли высвободиться от организма большего размера. Регрессивная гипотеза показывает, что вирусы были мелкими клетками, ведущими паразитический образ жизни в более крупных видах, но со временем утратили гены, которые нужны для паразитического существования. Гипотеза коэволюции предполагает, что вирусы возникли в то же время, в которое появились живые клетки, то есть уже миллиарды лет назад. И появились в результате построения сложных комплексов нуклеиновых кислот и белков. Кратко о вирусах (по биологии этих организмов база знаний наша, к сожалению, далека от совершенства) вы можете прочитать в данной статье. Каждая из перечисленных выше теорий имеет свои минусы и недоказанные гипотезы. Вирусы как форма жизни. Существует два определения формы жизни вирусов. Согласно первому, внеклеточные агенты - это комплекс органических молекул. Второе определение сообщает о том, что вирусы являются особой формой жизни. Вирусы (биология подразумевает появление многих новых видов вирусов) характеризуются как организмы на границе живого. Они похожи на живые клетки тем, что имеют свой неповторимый набор генов и эволюционируют исходя из метода естественного отбора. Также они могут размножаться, создавая при этом собственные копии. Так как вирусы не имеют клеточного строения, ученые не рассматривают их как живую материю. молекулярная биология вирусов Для того чтобы синтезировать собственные молекулы, внеклеточным агентам нужна клетка-хозяин. Отсутствие собственного обмена веществ не позволяет им размножаться без посторонней помощи.
Цикл вируса состоит из нескольких этапов, которые являются взаимоперекрывающимися. На первом этапе вирус прикрепляется, то есть образовывает специфическую связь между своими белками и рецепторами клетки-хозяина. Далее нужно проникнуть в саму клетку и передать ей свой генетический материал. Некоторые виды переносят еще и белки. После этого происходит потеря капсида, и геномная нуклеиновая кислота высвобождается. После того как паразит попадает внутрь клетки, начинается сборка вирусных частиц и модификация белка. И в итоге вирус выходит из клетки. Даже если он продолжает активно развиваться, то может и не убивать клетку, а продолжать в ней жить. Заболевания человека Вирусы биология интерпретирует как низшее проявление жизни на планете Земля. Одним из самых простых вирусных заболеваний человека является простуда. Однако данные паразиты могут вызывать и очень серьезные заболевания, такие как СПИД или птичий грипп. вирусы и бактерии биология Каждый вирус имеет определенный механизм действия на своего хозяина. Этот процесс включает лизис клеток, который приводит к их смерти. У многоклеточных организмов при отмирании большого количества клеток начинает плохо функционировать весь организм. Во многих случаях вирусы могут и не наносить вреда человеческому здоровью. В медицине это называется латентностью. Примером такого вируса является герпес. Некоторые латентные виды способны приносить пользу. Порой их присутствие вызывает иммунный ответ против бактериальных патогенов.
8. примеры и разбор решения заданий тренировочного модуля (не менее 2 заданий).

Используя конспект урока, найдите и выделите цветом по вертикали и горизонтали в филворде основные понятия втранскрипции и трансляции у прокариот. (надписи на рисунке убрать)

Правильный вариант: репрессор, оперон, субстрат, оператор, промотор.
Вставьте пропущенные слова.
Регуляция генной активности у высших организмов сложнее, чем у _____. У эукариот эти процессы регулируют ________. Они образуются в специальных клетках ______ внутренней секреции. Они регулируют синтез _______ в специальных клетках – мишенях.
Правильный вариант:
Регуляция генной активности у высших организмов сложнее, чем у бактерий. У эукариот эти процессы регулируют гормоны. Они образуются в специальных клетках желёз внутренней секреции. Они регулируют синтез РНК в специальных клетках – мишенях.
Подсказка: Еще раз посмотрите как происходит регуляция транскрипции у эукариот..
Читайте также:

