Вирусы у которых есть обратная транскриптаза
Обновлено: 06.05.2024
Простым способом синтеза двухцепочечной ДНК из обратной транскриптазы, также называемой направленной ДНК/РНК-полимеразой, может быть использование праймера с поли-Т-хвостом, который устанавливает комплементарные основания с поли-А-хвостом РНК, транскрибируемой с цепи, которая должна быть транскрибирована. синтезируются, образуя гибрид РНК/ДНК. Этот гибрид можно было разделить с помощью рибонуклеаз, а затем под действием ДНК-полимеразы и нового праймера достроить двухцепочечную цепь ДНК. [ нужна ссылка ]
В молекулярной биологии и биохимии обратная транскриптаза, также известная как РНК-зависимая ДНК-полимераза, представляет собой фермент ДНК-полимеразы , который расшифровывает с одной цепи РНК одну цепь ДНК. Это также помогает в формировании двойной спирали ДНК после того, как РНК подверглась обратной транскрипции в одноцепочечную кДНК. Обратная транскрипция включает синтез ДНК из РНК.
Обратная транскриптаза была открыта Говардом Теминым в Университете Висконсин-Мэдисон и независимо Дэвидом Балтимором в 1970 году в Массачусетском технологическом институте . Эти двое разделили Нобелевскую премию по физиологии и медицине 1975 года с Ренато Дульбекко за свое открытие. Хорошо изученные обратные транскриптазы включают:
- Обратная транскриптаза вируса иммунодефицита человека ВИЧ-1 (см. Подтипы ВИЧ )
- Обратная транскриптаза M-MLV вируса мышиного лейкоза Молони
- Обратная транскриптаза AMV из вируса миелобластоза птиц , обратная транскриптаза, поддерживающая теломеры эукариотических хромосом
функция вирусов
Фермент кодируется и используется вирусами в обратной транскрипции, они используют фермент в процессе репликации. Обратная транскрипция РНК-вирусов, таких как ретровирусы , использует фермент в их геноме для перехода РНК в ДНК, которая интегрируется в геном хозяина и реплицируется вместе с ним. Обратная транскрипция ДНК-вирусов, таких как гепаднавирус , может позволить РНК служить матрицей при сборке, создавая нити ДНК. ВИЧ заражает людей благодаря этому ферменту. Без обратной транскриптазы вирусный геном не смог бы внедриться в клетку-хозяина из-за неспособности вирусов к саморепликации. В отличие от бактерий ретровирусы используют в качестве праймеров транспортные РНК, закодированные в клетке-хозяине.
Процесс обратной транскрипции
Обратная транскриптаза создает одноцепочечную ДНК из матрицы РНК. Вирусы, у которых отсутствует обратная транскриптаза, синтезируют свою ДНК благодаря кодируемой ДНК δ-полимеразе клетки-хозяина, которая ошибочно принимает вирусную РНК за инициатор и синтезирует двухцепочечную ДНК из-за сходства механизма элиминации праймирования, где вновь синтезированная ДНК вытесняет исходную матричную РНК.
Процесс обратной транскрипции очень подвержен ошибкам, и именно на этом этапе могут происходить мутации. Эти мутации могут вызывать лекарственную устойчивость.
Процесс обратной транскрипции в вирусе класса VI
Вирусы ssRNA-TR класса VI, также называемые ретровирусами , представляют собой РНК-вирусы с обратной транскрипцией с промежуточным ДНК. Его геном состоит из двух молекул одноцепочечной РНК положительного смысла с 5'-кэпом и 3'-полиаденилированным хвостом. Примерами ретровирусов являются вирус иммунодефицита человека ( "ВИЧ" ) и Т-лимфотропный вирус человека ( "HTLV" ). Происходит в цитозоле . [ 2 ] Создание двухцепочечной ДНК происходит в несколько этапов:
Создание двойной спирали ДНК также включает перенос цепи , при котором происходит транслокация короткого ДНК-продукта начального ДНК-зависимого синтеза РНК в акцепторные матричные области на другом конце генома, которые затем достигаются и обрабатываются обратной транскриптазой для их преобразования. ДНК-зависимая активность ДНК. [ 4 ]
Ретровирусная РНК расположена от 5' к 3'-концу. Праймер отжигается вирусной РНК в месте связывания праймера (PBS). 5'-конец РНК называется U5, а 3'-конец РНК называется лидером. Первая образовавшаяся тРНК состояла из 14-22 нуклеотидов и образует дуплекс с парой оснований с вирусной РНК в PBS. Для PBS необычно располагаться вблизи 5'-конца вирусной РНК, потому что обратная транскриптаза синтезирует ДНК с 3'-конца цепи в направлении от 5' к 3'. Следовательно, праймер и обратная транскриптаза должны быть перемещены на 3'-конец вирусной РНК. Для осуществления этой замены существует множество мер и необходимы различные ферменты, такие как ДНК-полимераза, рибонуклеаза Н (РНКаза Н) и простые полинуклеотиды. [ 5 ]
Обратная транскриптаза ВИЧ также обладает рибонуклеазной активностью , то есть расщепляет вирусную РНК в процессе синтеза ДНК, а также ДНК-зависимой ДНК-полимеразной активностью, которая копирует смысловую цепь кДНК в антисмысловую ДНК с образованием двойной спирали промежуточной вирусной ДНК. вДНК). [ 6 ]
у эукариот
Самовоспроизводящиеся участки эукариотического генома , известные как ретротранспозоны, используют обратную транскриптазу для перемещения из одного положения в геноме в другое через промежуточную РНК. Их много в геномах растений и животных. Теломераза — еще одна обратная транскриптаза эукариот, в том числе человека, несущая собственную матрицу РНК , используемую для репликации ДНК . [ 7 ]
У прокариот
Обратные транскриптазы также обнаружены в РНК MSR бактерий Retron, различных последовательностях, которые кодируют обратную транскриптазу, и используются в синтезе мДНК. Для начала синтеза ДНК необходим праймер. У бактерий праймер синтезируется во время репликации. [ 8 ]
Структура
Обратные транскриптазы представляют собой гетеродимеры , включающие РНК-зависимую ДНК-полимеразу и ДНК-зависимую ДНК-полимеразу, которые совместно осуществляют транскрипцию. В дополнение к транскрипционной функции ретровирусные обратные транскриптазы имеют домен, принадлежащий к семейству РНКаз H , который жизненно важен для их репликации.
Точность репликации
В течение жизненного цикла ретровируса существует три различных системы репликации. Сначала обратная транскриптаза синтезирует вирусную ДНК из вирусной РНК, а затем из вновь созданной комплементарной цепи ДНК. Второй процесс клеточной репликации происходит, когда ДНК-полимераза клетки-хозяина реплицирует интегрированную вирусную ДНК. Наконец, РНК-полимераза II транскрибирует провирусную ДНК в РНК, которая помещается в вирионы. Следовательно, мутация может происходить во время одного или всех этих этапов репликации. [ 9 ]
Обратная транскриптаза имеет высокую частоту ошибок при транскрипции РНК в ДНК, потому что, в отличие от ДНК-полимераз, она не способна исправлять ошибки. Эта высокая частота ошибок позволяет мутациям накапливаться с ускоренной скоростью по сравнению с правильными формами репликации. Коммерчески доступная обратная транскриптаза, производимая Promega, имеет частоту ошибок в диапазоне 1 на 17 000 оснований для AMV и 1 на 30 000 оснований для M-MLV. [ 10 ]
Приложения
Молекулярная структура зидовудина (AZT), препарата, используемого для ингибирования обратной транскриптазы вируса иммунодефицита человека ВИЧ .
противовирусные препараты
Поскольку ВИЧ использует обратную транскриптазу для копирования своего генетического материала и создания новых вирусов (часть круга пролиферации ретровирусов), были разработаны специальные лекарства, чтобы прервать этот процесс и, таким образом, подавить его рост. В совокупности эти препараты известны как ингибиторы обратной транскриптазы и включают нуклеозиды и аналоги нуклеозидов зидовудин (торговое название ретровира), ламивудин (эпивир) и тенофовир (виреад), а также ненуклеозидные ингибиторы, такие как невирапин (вирамун) . .
Молекулярная биология
Обратная транскриптаза обычно используется в исследованиях для применения метода полимеразной цепной реакции с обратной транскрипцией (RT-PCR). Классический метод ПЦР можно применять только к цепям ДНК , но с помощью обратной транскриптазы РНК можно транскрибировать в ДНК, что делает возможным ПЦР -анализ молекул РНК. Обратная транскриптаза также используется для создания библиотек кДНК мРНК. Коммерческая доступность обратной транскриптазы значительно улучшила знания в области молекулярной биологии, поскольку наряду с другими ферментами она позволила ученым клонировать, секвенировать и характеризовать ДНК.
История
Идея обратной транскрипции изначально была крайне непопулярна, поскольку противоречила центральной догме молекулярной биологии , которая гласит, что ДНК транскрибируется в РНК, которая транслируется в белок. Однако в 1970 году, когда ученые Ховард Темин и Дэвид Балтимор независимо друг от друга открыли фермент, ответственный за обратную транскрипцию, называемый обратной транскриптазой, возможность того, что генетическая информация может передаваться таким образом, была окончательно признана.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
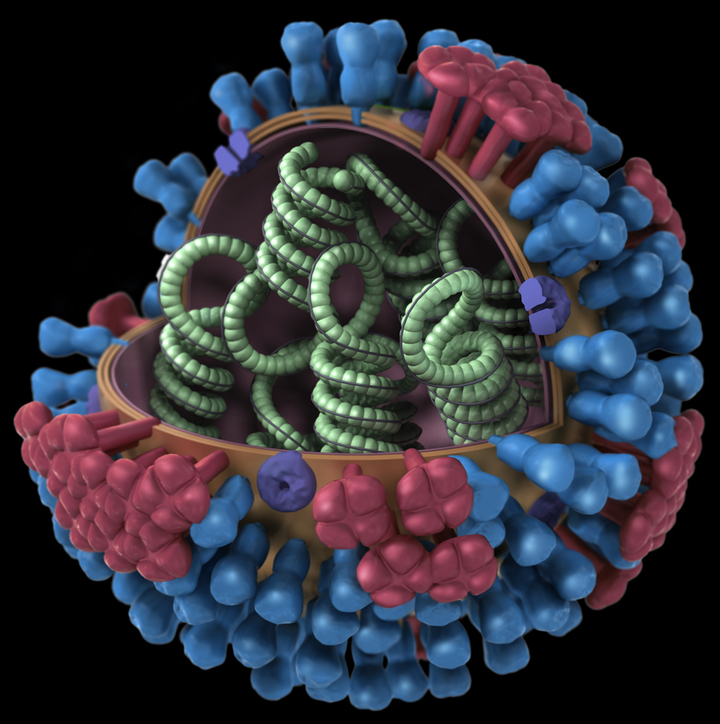
Строение вируса гриппа. Под оболочкой вириома - генетический материал вируса, необходимый для его воспроизводства в клетке.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.

Сравнение жизненных циклов ВИЧ и вируса гриппа. Если первый использует обратную транскрипцию и живет в клетках иммунной стистемы, вирион второго, проникая в эпительные клетки дыхательных путей целиком - а именно там он и обитает - распадается уже внутри клетки, а репликация вирусной РНК происходит в ядре с помощью вирусных полимераз PA, PB1 и PB2 путем комплементарного копирования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.


Нуклеиновые кислоты — носители генетической информации у всех обитателей Земли — представлены молекулами ДНК и РНК. Принцип комплементарности позволяет строить новые цепочки нуклеиновых кислот на матрице уже существующих. В клетках эукариот есть ферменты, которые катализируют синтез цепочек ДНК на матрице ДНК (репликацию) или синтез РНК на матрице ДНК (транскрипцию). У некоторых вирусов, например у ВИЧ, имеются ферменты, катализирующие синтез цепочек ДНК на матрице РНК (обратную транскрипцию). Группа американских ученых выяснила, что такой же способностью обладает и один из ферментов наших собственных клеток — ДНК-полимераза тета. Ранее было известно, что полимераза тета, играющая важную роль в репарации повреждений ДНК, при репликации делает большое количество ошибок, вставляя некомплементарные нуклеотиды. Теперь же выяснилось, что этот фермент охотно строит ДНК на матрице РНК, и к тому же ошибки в ходе такого синтеза появляются гораздо реже. По скорости синтеза ДНК на матрице РНК и по частоте ошибок при таком синтезе полимераза тета оказалась сопоставима с обратной транскриптазой ВИЧ.
ДНК-полимеразы бывают разные. Однако все их можно подразделить на две большие группы — в зависимости от типа субстрата. Существуют ДНК-зависимые ДНК-полимеразы — таковыми являются все ранее известные ферменты, задействованные в репликации и репарации у клеточных организмов. Из названия следует, что эти ферменты строят новые цепочки ДНК на матрице родительских цепочек ДНК. Другую группу составляют РНК-зависимые ДНК-полимеразы (их же часто называют обратными транскриптазами) — они строят цепочки ДНК, используя в качестве матриц цепочки РНК. Такие ферменты есть у некоторых вирусов и у некоторых транспозонов — геномных паразитов, имеющих, предположительно, вирусное происхождение. Вопрос о том, выполняют ли обратные транскриптазы транспозонов какие-либо полезные функции для клетки является предметом дискуссий и мы его здесь касаться не будем, потому что нас в данном случае интересует совершенно родной белок клеток животных, не имеющий признаков вирусного происхождения. Однако кое в чем он оказался схож с полимеразами вирусов, поломав такую стройную картину классификации ДНК-полимераз по субстрату, которую мы только что представили.
Главное отличие между РНК и ДНК состоит в том, что в качестве сахара — обязательного компонента нуклеиновых кислот — в первом случае используется рибоза, во втором — дезоксирибоза. В сущности, вся разница сводится к наличию или отсутствию в молекуле сахара одного атома кислорода. Однако эта разница достаточно существенна, чтобы обеспечивать ферментам высокую специфичность при выборе субстрата при осуществлении матричного синтеза ДНК — это было показано для всех ранее изучавшихся ДНК-полимераз.
Наличие неактивного домена самоконтроля натолкнуло ученых из США на гипотезу, что, возможно, Polθ способна синтезировать ДНК не только на матрице ДНК, но и на матрице РНК. Для проверки этой гипотезы и было затеяно исследование, о котором пойдет речь. Параллельные испытания провели для обратной транскриптазы ВИЧ (синтез ДНК на матрице РНК — основная профессия обратной транскриптазы) и для еще одного человеческого фермента репарации, также склонного к ошибкам, — полимеразе эта (Polη).
В первом испытании ферментам дали наращивать цепочку ДНК на матрице РНК длиной 22 нуклеотида, с которой был связан ДНК-праймер длиной 11 нуклеотидов. Результаты можно видеть на рис. 2. Пятнышки, которые мы видим на фотографии электрофорезной пластинки — это фрагменты нарощенной ДНК. Если к праймеру присоединился один нуклеотид — получаем фрагмент длиной 12, нуклеотидов, если два — длиной 13 и т. д.


Рис. 2. Оценка способности разных полимераз наращивать цепочку ДНК по матрице РНК. А — накопление продуктов реакции полимеризации с течением времени. Показаны фотографии гелей, в которых электрофорезом разделялись продукты реакции. Левое фото — при посредстве обратной транскриптазы ВИЧ HIV RT, среднее — при посредстве полимеразы тета Polθ, правое — при посредстве полимеразы эта Polη. Над фотографиями схематично изображен начальный субстрат — дуплекс из РНК-матрицы (цепочка РНК показана красным цветом) и ДНК-затравки (цепочка ДНК показана черным цветом). Затравка имеет длину 11 нуклеотидов, так что пятна в геле, напротив которых стоит отметка 11 nt — это оставшиеся не удлиненными затравки. Цепочка матрицы имеет длину 22 нуклеотида — и это теоретически максимальная возможная длина продукта матричного синтеза ДНК (в геле видны и продукты несколько большей длины — это следствие способности полимераз добавлять нуклеотид нематричным способом). Цепочки промежуточной длины — это продукты незавершенной реакции полимеризации. Можно убедиться, что эффективный синтез ДНК идет только при работе ферментов HIV RT и Polθ. B доля затравок, удлиненных в течение указанного времени при работе HIV RT и Polθ. Видно, что динамика работы этих двух ферментов очень схожа. Рисунок из обсуждаемой статьи в Science Advances
Как видно, чем больше времени давалось ферменту (до 32 минут в общей сложности), тем больше получалось длинных фрагментов (в этой системе максимально возможными были фрагменты длиной 22 нуклеотида) — причем, только если в качестве фермента выступали Polθ или обратная транскриптаза ВИЧ (HIV RT). А вот фермент Polη в тех же концентрациях и за то же время успевал добавить не больше трех (правда при очень сильном повышении концентрации этого фермента удавалось добиться получения более протяженных фрагментов). Дополнительно ученые показали, что способность синтезировать ДНК на матрице РНК у Polθ (а также и у HIV RT) сохраняется при достаточно широком диапазоне условий (разных значениях pH и концентрации KCl). Полимераза Polη теряла такую способность при малейшем отклонении условий от оптимальных значений. Ни у одной другой ДНК-полимеразы человека (а проверили все восемь имеющихся у человека ДНК-полимераз) этой способности не выявлялось вовсе.
Ученые также показали и субстратную специфичность обратной транскриптазы ВИЧ — она могла эффективно работать только на матрице РНК, но с большим трудом строила фрагменты на матрице ДНК (длинные фрагменты получались только при очень высоких концентрациях фермента). А вот Polθ действительно эффективно работала и на матрице ДНК, и на матрице РНК.
Следующая серия экспериментов показала, что, во-первых, Polθ обладает более высоким сродством к гибридным молекулам ДНК/РНК, чем к ДНК/ДНК, во-вторых, синтез ДНК на матрице РНК идет и быстрее, и точнее, чем на матрице ДНК. Частично результаты этих экспериментов показаны на рис. 3.


Рис. 3. Скорость и точность синтеза полимеразой тета ДНК на матрицах РНК или ДНК. А — варианты субстратов, использованных в экспериментах — дуплексы, образованные ДНК-матрицей с ДНК-затравкой или РНК-матрицей с ДНК-затравкой (последовательности ДНК показаны черным шрифтом, последовательности РНК — красным). B — результаты серии экспериментов по оценке скорости включения нуклеотидов в ходе полимеризации ДНК. В ходе эксперимента в смесь помимо субстрата и фермента добавлялись меченные дезоксинуклеотиды только одного типа из четырех существующих (dCTP, dTTP, dATP или dGTP). Это был нуклеотид, комплементарный следующему за затравкой в матрице. Оценивали, какая доля затравок оказывалась помечена включением нуклеотида (% extension) в течение определенного промежутка времени (измеряемого в минутах, min). На всех графиках черные точки соответствуют экспериментам с ДНК-матрицей, а точки другого цвета — экспериментам с РНК-матрицей. Как можно заметить, скорость включения трех из четырех нуклеотидов была выше при работе на матрице РНК. C — результаты серии экспериментов по оценке точности включения нуклеотидов в ходе полимеризации ДНК. В реакционную смесь добавляли субстрат, фермент и меченные дезоксинуклеотиды единственного типа. Но теперь, наоборот, это был нуклеотид НЕ комплементарный следующему за затравкой в матрице: его включение обозначало ошибочное срабатывание фермента. Более высокой скорость удлинения затравки теперь оказалась для ДНК-матрицы, то есть фермент реже допускает ошибочное включение нуклеотида при работе на матрице РНК. Рисунок из обсуждаемой статьи в Science Advances
Все вышеописанные данные были получены при исследовании свойств белка вне живой системы — in vitro. Конечно, чтобы выводы были вполне убедительными, нужно было убедиться, что Polθ действительно может использовать РНК как матрицу, работая непосредственно в живой клетке в качестве починщика ДНК. Эксперименты оказались вполне успешными. Мы опишем лишь некоторые из них, выполненные на клетках человека.
Первый эксперимент состоял в том, что в клетки родительской линии U2OS с дефектным GFP вносили небольшую цепочку нуклеиновой кислоты, содержащий верную последовательность центральной части гена GFP — без инсерции и с возвращенными семью нуклеотидами. Этот фрагмент должен был служить матрицей для заделывания бреши в гене GFP. Для того, чтобы сделать брешь и запустить механизм репарации, использовали систему CRISPR/Cas, которую натравили на встроенный в ген GFP чужеродный участок.


Присутствие в геномной ДНК участков, образованных гетеродуплексами ДНК/РНК было установлено достаточно давно. Это могут быть единичные встроенные рибонуклеотиды, а могут быть участки с достаточно большой протяженностью. Причины их образования, как и механизмы их устранения, бывают разными — этому вопросу посвящен большой недавний обзор G. M. Nava et al., 2020. One, No One, and One Hundred Thousand: The Many Forms of Ribonucleotides in DNA. Это может быть естественной частью некоторых молекулярно-биологических процессов (рис. 5): транскрипции, репарации, репликации (в частности, из рибонуклеотидов строятся фрагменты Оказаки — затравки для репликации запаздывающей цепи). Вместе с тем рибонуклеотиды достаточно часто ошибочно включаются ферментами в ходе синтеза ДНК при репликации или репарации (приблизительная частота таких ошибок 10 −3 ), несмотря на высокую избирательность в пользу дезоксирибонуклеотидов. Это объясняется тем, что в наших клетках концентрация рибонуклеотидов всегда намного (до 100 раз) выше концентрации дезоксирибонуклеотидов. Впрочем, в клетках есть несколько видов охранных систем, которые настроены на выявление и удаление рибонуклеотидов из ДНК — и это очень важно для поддержания нормальной работы генов, репликации ДНК и сохранения ее в целости и сохранности.

Рис 5. Разнообразные механизмы появления дуплексов типа ДНК/РНК в хромосомном материале клеток. В клетках эукариот имеется обширный арсенал средств для устранения таких временно образующихся гетеродуплексов и восстановления нормальной структуры хромосом в форме двухцепочечной ДНК. Рисунок из обзорной статьи G. M. Nava et al., 2020. One, No One, and One Hundred Thousand: The Many Forms of Ribonucleotides in DNA
Но вот Polθ, исходя из результатов обсуждаемого исследования, обладает способностью использовать непосредственно рибонуклеотиды в качестве матрицы для синтеза ДНК. И эта ее способность пригождается на этапе репарации повреждений ДНК, по-видимому, главным образом тогда, когда по тем или иным причинам забуксовали другие охранные механизмы.
Таким образом, у млекопитающих впервые обнаружили фермент репарации с несколькими уникальными свойствами, включающими особенности структурной пластичности, способность прочно связывать гетеродуплексы ДНК/РНК и способность быстро и сравнительно с высокой точностью осуществлять обратную транскрипцию, выстраивая ДНК на матрице РНК. Это объясняет, каким образом наши клетки справляются с одним из достаточно частых нарушений в структуре ДНК, когда часть цепочки оказывается построена не из дезоксирибонуклеотидов, а из рибонуклеотидов.
Источник: Gurushankar Chandramouly, Jiemin Zhao, Shane McDevitt, Timur Rusanov, Trung Hoang, Nikita Borisonnik, Taylor Treddinick, Felicia Wednesday Lopezcolorado, Tatiana Kent, Labiba A. Siddique, Joseph Mallon, Jacklyn Huhn, Zainab Shoda, Ekaterina Kashkina, Alessandra Brambati, Jeremy M. Stark, Xiaojiang S. Chen and Richard T. Pomerantz. Polθ reverse transcribes RNA and promotes RNA-templated DNA repair // Science Advances. 2021. DOI: 10.1126/sciadv.abf1771.
Читайте также:

