Вирусы возбудители опасных бактерий
Обновлено: 25.04.2024
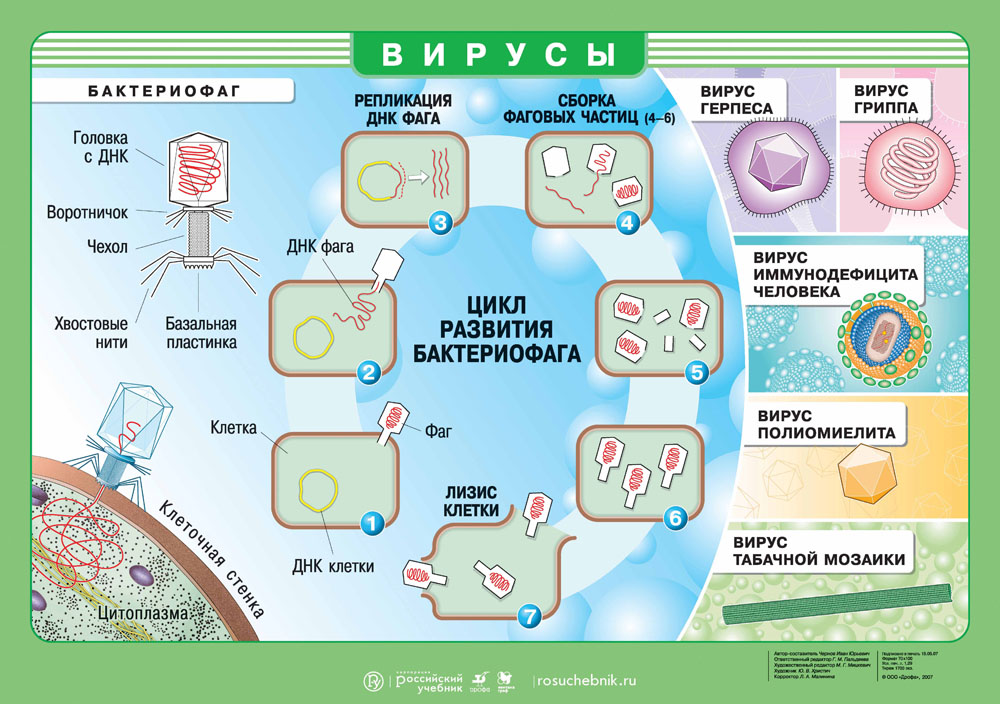
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.

Но и Дженнер не имел представления о том, что является причиной заболевания оспой. В XIX веке все болезнетворные организмы и вещества без разбора называли вирусами. Лишь благодаря опытам отечественного биолога Дмитрия Иосифовича Ивановского прекратилась эта путаница! Он пропускал экстракт заражённых табачной мозаикой 1 растений через бактериальные фильтры, сквозь которые не проходят даже самые мелкие бактерии. Выяснилось, что экстракт оставался по-прежнему заразным для других растений. Значит, возбудителями табачной мозаики были организмы, меньшие по размеру, чем бактерии; их назвали фильтрующимися вирусами. Вскоре бактерии перестали называть вирусами, а сами вирусы выделили в отдельное царство живых организмов. Дмитрий Ивановский же во всём мире по праву считается основателем вирусологии — науки о вирусах.

Рис. 2. Дженнер прививает Джеймса Фиппса от оспы
Но что мы пока поняли про вирусы? Только то, что они меньше бактерий. Чем же вирусы так не похожи на другие организмы? И почему понадобилось вдруг их выделять в отдельное царство? А вот почему. В отличие от других живых организмов, вирусы не имеют клеточного строения, а значит, и всех характерных для клетки структур. А ещё они единственные, кто не умеет самостоятельно производить белок, главный строительный материал всего живого. Поэтому их размножение невозможно вне заражённой клетки. Из-за этого многие учёные не без оснований считают вирусы внутриклеточными паразитами.
Жертвами различных вирусов становятся представители всех без исключения существующих царств живых организмов! Так, есть вирусы растений — вирус табачной мозаики (рис. 3, слева), вирус мозаики костра (это растение изображено на рисунке 3, справа), вирус желтухи свёклы, вызывающий иногда даже эпидемии. Кстати, в растение вирус просто так не проникнет. Заражение происходит при травмах растительных тканей. Типичный пример: тля пьёт сок из стебля и для этого протыкает покровные ткани — а вирус тут как тут.

Рис 3. Слева: листья табака, поражённые вирусом табачной мозаики. Справа: костёр (лат. Brómus) — род многолетних травянистых растений семейства Злаки. Если посмотреть на заросли костра в ветреную погоду, его крупные метёлки, склоняясь под ветром то в одну, то в другую сторону, отсвечивают красноватым светом в солнечных лучах, очень напоминая языки пламени. Отсюда, вероятно, и произошло русское название этого растения
Грибы тоже поражаются вирусами, вызывающими, например, побурение плодовых тел у шампиньонов или изменение окраски у зимнего опёнка. Причиной многих опасных заболеваний животных и человека тоже служат вирусы: вирус гриппа, ВИЧ (вирус иммунодефицита человека), вирус Эбола, вирус бешенства, герпеса, клещевого энцефалита и т. д.
Есть даже вирусы, поражающие бактерии, их называют бактериофагами 2 . Так, в конце XIX века исследователи из Института Пастера заметили, что вода некоторых рек Индии обладает бактерицидным действием, то есть способствует снижению роста бактерий. И достигалось это благодаря присутствию в речной воде бактериофагов.

Рис. 4. Слева: вирус табачной мозаики. В центре: вирус мозаики костра похож на футбольный мяч (справа)

Рис. 5. Слева направо: вирус герпеса, аденовирус А человека, бактериофаг

Рис. 6. Маленькие вирусы-спутники внутри гигантского мимивируса
Но не стоит думать, что вирусы причиняют исключительно вред другим организмам! Так, исследователи из Пенсильванского университета показали, что безвредный для человека вирус AAV2, встречающийся почти у всех людей, убивает самые разные виды раковых клеток. При этом здоровые клетки организма вирус не заражает.
А совсем недавно стало известно, что вирусы тоже болеют. Мимивирус, поражающий амёбу Acanthamoeba polyphaga, сам страдает от другого вируса-спутника (рис. 6). Он, кстати, так и называется — Спутник. Этот вирус-спутник использует механизмы воспроизводства мимивируса для собственного размножения, мешая ему нормально развиваться в клетке амёбы. По аналогии с бактериофагами, он был назван вирофагом, то есть пожирающим вирусы. Можно сказать, что присутствие вируса-спутника в амёбе обеспечивает ей больше шансов на выживание в борьбе с мимивирусом.
Главная задача биологии — это развитие представлений у человека о живых организмах, о многообразии видов, обо всех закономерностях развития живых существ, а также об их взаимодействии с окружающей природой. Предмет основы безопасности жизнедеятельности (ОБЖ) позволяет получить знания и умения, которые помогут сохранить жизнь и здоровье в опасных ситуациях. Эти ситуации всегда возникают неожиданно, но, тем не менее, большинство из них предсказуемы и к ним можно подготовиться заранее. ОБЖ учит нас предвидеть возможные опасности и минимизировать потери от той или иной ситуации. Сегодня мы сталкиваемся с новым видом вирусной опасности COVID-19,о котором поговорим с точки зрения биологии и ОБЖ.
Что такое вирус?
Вирус — это неклеточный инфекционный агент. Сегодня нам известно около 6 тысяч различных вирусов, но их существует несколько миллионов. Вирусы не похожи друг на друга и могут иметь как форму сферы, спирали, так и форму сложного асимметричного сплетения. Размеры вирусов варьируются от 20 нм до 300 нм.
Как устроен вирус?
В центре агента находится генетический материал РНК или ДНК, вокруг которого располагается белковая структура — капсид.
Капсид служит для защиты вируса и помогает при захвате клетки. Некоторые вирусы дополнительно покрыты липидной оболочкой, т.е. жировой структурой, которая защищает их от изменений окружающей среды.
Вирусолог Дэвид Балтимор объединил все вирусы в 8 групп, из которых некоторые группы вирусов содержат 1-2 цепочки ДНК. Другие же содержат 1 цепочку РНК, которая может удваиваться или достраивать на своей матрице ДНК. При этом каждая группа вирусов производит себя в различных органеллах зараженной клетки.
Вирусы имеют определенный диапазон хозяев, т.е. он может быть опасен для одних видов и абсолютно безвреден для других. Например, оспой болеет только человек, а чумкой только некоторые виды плотоядных. Вирус не способен выжить сам по себе, поэтому активируется только в хозяйской клетке, используя ее ресурсы и питательные вещества. Цель вируса — создание множества копий себя, чтобы инфицировать другие клетки!
Как вирус попадает в организм?
- через физические повреждения (например, порезы на коже)
- путём направленного впрыскивания (к примеру, укус комара)
- направленного поражения отдельной поверхности (например, при вдыхании вируса через трахею)
- к эпителию слизистых оболочек (это например вирус гриппа)
- к нервной ткани (вирус простого герпеса)
- к иммунным клеткам (вирус иммунодефицита человека)

Геном вируса встраивается в одну из органелл или цитоплазму и превращает клетку в настоящий вирусный завод. Естественные процессы в клетке нарушаются, и она начинает заниматься производством и сбором белка вируса. Этот процесс называется репликацией. И его основная цель — это захват территории. Во время репликации генетический материал вируса смешивается с генами клетки хозяина — это приводит к активной мутации самого вируса, а также повышает его выживаемость. Когда процесс репликации налажен, вирусная частица отпочковывается и заражает уже новые клетки, в то время как инфицированная ранее клетка продолжает производство.
Выход вируса
Вирус создал множество собственных копий, клетка оказывается изнуренной из-за использования ее ресурсов. Больше вирусу клетка не нужна, поэтому клетка часто погибает и новорожденным вирусам приходится искать нового хозяина. Это и есть заключительная стадию жизненного цикла вируса.
Скорость распространения вирусной инфекции
Размножение вирусов протекает с исключительно высокой скоростью: при попадании в верхние дыхательные пути одной вирусной частицы уже через 8 часов количество инфекционного потомства достигает 10³, а концу первых суток − 10²³.
Вирусная латентность
Как вирус распространяется?
- воздушно-капельный (кашель, чихание)
- с кожи на кожу (при прикосновениях и рукопожатиях)
- с кожи на продукты (при прикосновениях к пище грязными руками вирусы могут попасть в пищеварительную и дыхательную системы)
- через жидкие среды организма (кровь, слюну и другие)
Почему с вирусами так тяжело бороться?
Сегодня людям уже удалось победить некоторые вирусы, а некоторые взять под жесткий контроль. Например, Оспа (она же черная оспа). Болезнь вызывается вирусом натуральной оспы, передается от человека к человеку воздушно-капельным путем. Больные покрываются сыпью, переходящей в язвы, как на коже, так и на слизистых внутренних органов. Смертность, в зависимости от штамма вируса, составляет от 10 до 40 (иногда даже 70%), На сегодняшний день вирус полностью истреблен человечеством.
Кроме того, взяты под контроль такие заболевания, как бешенство, корь и полиомиелит. Но помимо этих вирусов существует масса других, которые требуют разработок или открытия новых вакцин.
Коронавирус
Виновником эпидемии, распространяющейся сегодня по миру, стал коронавирус, вирусная частица в 0,1 микрона. Свое название он получил благодаря наростам на своей структуре, своеобразным шипам. Внутри вируса спрятан яд, с помощью которого он подчиняет себе зараженный организм. Этот вирус воздействует не только на человека, но и на птиц, свиней, собак и летучих мышей. В настоящий момент выделяют от 30 до 39 разновидностей коронавирусной инфекции. Но для человека патогенно всего 6. И как любой другой вирус COVID-19 мутирует.

К наиболее распространенным симптомам COVID-19 относятся повышение температуры тела, сухой кашель и утомляемость. К более редким симптомам относятся боли в суставах и мышцах, заложенность носа, головная боль, конъюнктивит, боль в горле, диарея, потеря вкусовых ощущений или обоняния, сыпь и изменение цвета кожи на пальцах рук и ног. Как правило, эти симптомы развиваются постепенно и носят слабо выраженный характер. У некоторых инфицированных лиц болезнь сопровождается очень легкими симптомами.
Сколько же может жить этот вирус вне организма? Все зависит от типа вируса и от той поверхности, на которую вирусы попали. В качестве примера было рассмотрено 3 вируса, по которым велись исследования. Изучали время, на которое может задерживаться вирус на различных поверхностях. Данные приведены в таблице.

Поскольку пока не изобретено вакцины от COVID-19, в целях защиты от инфекции самым важным для нас является соблюдение гигиены.
Гигиена — раздел медицины, изучающий влияние жизни и труда на здоровье человека и разрабатывающая меры (санитарные нормы и правила), направленные на предупреждение заболеваний, обеспечение оптимальных условий существования, укрепление здоровья и продление жизни.
Сегодня следует соблюдать определенные правила гигиены:
- Соблюдение режима труда и отдыха, не допускающего развития утомления и переутомления.
- Выполнение условий, обеспечивающих здоровый и полноценный сон (свежий воздух, отсутствие шума, удобная постель, оптимальная продолжительность).
- Правильное здоровое питание в соответствии с потребностями организма.
- Комфортный микроклимат в жилище (температура, влажность и подвижность воздуха, естественная и искусственная освещенность помещений).
- Содержание в чистоте тела и тщательный уход за зубами.
- Спокойное и корректное поведение в конфликтных ситуациях.

Причины появления новых инфекционных заболеваний. Механизмы
Эндемическими называют инфекции, свойственные определенной территории (местности). При этом количество заражённых людей может варьировать. Иногда возникают эпидемии — массовое и прогрессирующее распространение инфекционных заболеваний в пределах определённой территории, значительно превышающее обычно регистрируемый уровень заболеваемости на этой территории за аналогичный период времени.
Скорость распространения инфекции зависит от способа её передачи. Например, передача возбудителей воздушно-капельным путём происходит быстрее, нежели половым. Контагиозность возбудителя обусловлена скоростью его распространения. Например, контагиозность кори выше, чем эпидемического паротита.
Количественным показателем заразности той или иной инфекции служит индекс контагиозности — выраженная в процентах доля лиц, заболевающих инфекционной болезнью в клинически выраженной форме, из числа восприимчивых к ней в пределах эпидемического очага. При уменьшении числа лиц, подверженных заболеванию, вследствие увеличения смертности, формирования иммунитета у населения число новых случаев заражения также начинает снижаться.
Для прогнозирования исхода эпидемии, а также для разработки методов профилактики и борьбы с заболеванием применяют математическое моделирование.
Установлено, что врачи-инфекционисты в большей степени подвержены риску заражения неизвестными заболеваниями, так как новые инфекции не всегда можно вовремя обнаружить и диагностировать. В основе их возникновения лежат три основных механизма:
• появление новых возбудителей;
• заселение микроорганизмами новых территорий;
• возникновение новой симптоматики.

Появление новых возбудителей инфекционных заболеваний
Со временем число инфицированных постепенно возрастало, и вирус смог распространиться по всему миру (см. рис. в гл. 44). Другой пример — ранее неизвестный коронавирус, также полученный человеком от животных в Южном Китае и вызывающий тяжёлый острый респираторный синдром.
Медицинское вмешательство или изменение условий окружающей среды может создать благоприятные условия для межвидовой передачи возбудителей. Например, существует предположение, что снижение иммунитета при ксенотрансплантации способствует заражению человека вирусами животных и передаче их другим людям, а вырубка дождевых лесов Южной Америки привела к заражению человека Trypanosoma cruzi.
Заселение новых территорий как причина новых инфекционных заболеваний
Климатические и демографические изменения позволяют микроорганизмам заселять новые территории. Например, вирус лихорадки Западного Нила в настоящее время активно распространяется по территории США. Климатические изменения, в частности глобальное потепление, способствуют распространению микроорганизмов, которым необходима высокая температура среды обитания.
Возникновение инфекций, ранее редко встречающихся
Изменения в программах вакцинации населения могут позволить ранее контролируемым инфекциям вновь возникнуть и поразить разные возрастные категории (например, коклюш и корь в Великобритании).
Изменение сельского хозяйства и пищевой промышленности как причина новых инфекционных заболеваний
Поражение микроорганизмами домашнего скота и птицы (например, штаммами Salmonella enteritidis) приводит к заражению продуктов питания и распространению инфекции. В развитых индустриальных странах широкое употребление в пишу продуктов, приготовленных из полуфабрикатов, привело к повышению риска заражения листериозом, в связи с чем были пересмотрены условия хранения пищевой продукции.
Изменение возбудителей инфекционных заболеваний
Некоторые возбудители, заселяя новые территории обитания, вызывают вспышки заболеваний, вытесняя другие, порой родственные микроорганизмы. Этот факт можно объяснить более слабой вирулентностью или контагиозностью последних. Так, Clostridium difficile (тип 027), продуцирующий сильнейший токсин, вызвал вспышку заболевания в Канаде, США и Великобритании, a Acinetobacter baumanni стал причиной множества внутрибольничных инфекций в Лондоне.
Распространение устойчивого к метициллину золотистого стафилококка типов 15 и 16 в большинстве стран привело к преобладанию этих штаммов над всеми остальными.
Биотерроризм как причина новых инфекционных заболеваний
В последнее время политическая нестабильность в мире всё чаще сочетается с возрастающей террористической опасностью. Это привело к повышению вероятности использования возбудителей различных инфекционных заболеваний в качестве биологического оружия. Акт биотерроризма с использованием спор сибирской язвы в США унёс жизни четырёх человек и продемонстрировал потребность в создании эффективных антитеррористических механизмов.
Возможно использование в качестве биологического оружия возбудителей натуральной оспы, туляремии, чумы, геморрагической лихорадки и др. Именно поэтому специалисты в области здравоохранения должны обладать своевременной и полной информацией о необычных инфекционных заболеваниях и их симптомах, а также для своевременной идентификации новых возбудителей работать во взаимодействии со всеми специализированными учреждениями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

