Антитела к фосфолипидам при сифилисе
Обновлено: 07.05.2024
Медицинский редактор: М. Меркушева, ПСПбГМУ им. акад. Павлова, лечебное дело.
Январь, 2020.
Синонимы: Антитела к фосфолипидам IgM/IgG, антифосфолипидные антитела, anti-Phospholipid antibodies, APL
Антифосфолипидные антитела – это группа антител, наиболее часто встречаются:
-
,
- антикардиолипиновые антитела,
- анти-бета2 гликопротеиновые антитела.
Клиническое значение вышеуказанных антител заключается в их связи с тромбозом; как только у человека диагностируют сосудистый тромбоз и/или осложнения беременности и в крови находят хотя бы одно из этих антител, диагностируется антифосфолипидный синдром. Пациенты, у которых положительный результат на все 3 антитела, имеют самый высокий уровень осложнений, связанных с антифосфолипидным синдромом 1 .
Основные сведения
АФС может быть вторичным при некоторых аутоиммунных заболеваниях, например, быть следствием системной красной волчанки (СКВ), или первичным, т. е. развиваться самостоятельно, без каких-либо сопутствующих патологий. Нередко антитела к фосфолипидам обнаруживаются при ВИЧ-инфекции, отдельных онкологических заболеваниях, а также появляются на фоне приема лекарственных препаратов: новокаинамид, фенотиазины и пр.
Таким образом, диагностика АФ-синдрома должна проводиться комплексно, т. е. включать в себя дополнительные клинические параметры. Анализ крови на АФС – это иммуноферментное исследование, которое позволяет своевременно диагностировать аутоиммунные нарушения, назначать правильное лечение и контролировать его эффективность, а также профилактировать возможные осложнения болезни.
Подготовка к анализу
Строго определенных требований к подготовке нет. Рекомендуется до забора крови из вены выдержать перерыв в приеме пищи не менее чем 4-5 часов. Более подробная информация о подготовительных мерах к иммуноферментному анализу на антитела изложена здесь.
Анализ должен выполняться, когда пациент клинически стабилен, не во время острых тромбоэмболических осложнений, по 2 причинам:
- во-первых, острое заболевание может вызвать продукцию переходных антикардиолипиновых антител;
- во-вторых, острые процессы повышают продукцию белков острой фазы, таких как фибриноген и фактор 8, которые могут повлиять на результаты анализа.
Анализ должен быть выполнены до начала антикоагулянтной терапии или после ее прекращения.
Показания
- Подозрение на АФС – анализ проводится дважды с интервалом в 6 недель; ;
- Повторяющиеся случаи тромбозов, тромбоэмболии, особенно, в молодом возрасте;
- Тромботическая микроангиопатия (клинический синдром, который характеризуется образованием тромбов в мелких кровеносных сосудах почек, головного мозга и др.);
- Системные заболевания (коллагенозы: СКВ, узелковый периартериит);
- Ложноположительный результат анализа крови на сифилис (реакция Вассермана) – реагенты, используемые для этого теста, содержат фосфолипиды. У лиц с антифосфолипидными антителами именно они могут давать некорректные результаты.
Показания при беременности или планировании 2 :
- Неоднократные выкидыши (привычное невынашивание беременности) – дополнительное исследование к анализу на время образования тромбопластина (АЧТВ);
- Преэклампсия в анамнезе у женщины, внутриутробная гибель плода;
- Тяжелый токсикоз в первой половине беременности;
- Многоплодная беременность;
- Беременность, наступившая в результате применения ВРТ.
Выдать направление на анализ может любой специалист. А вот диагностикой и лечением АФ-синдрома занимаются гематологи (гемостазиологи), иммунологи и ревматологи. Беременных и планирующих беременность женщин с АФС ведет тандем специалистов – акушер-гинеколог и гематолог (или ревматолог).
Антитела к фосфолипидам в норме
Важно! Нормы могут различаться в зависимости от реактивов и оборудования, используемого в каждой конкретной лаборатории. Именно поэтому при интерпретации результатов необходимо пользоваться стандартами, принятыми в той лаборатории, где сдавался анализ. Также необходимо обращать внимание на единицы измерения.
Повышение значений
Важно! Интерпретация результатов всегда проводится комплексно. Поставить точный диагноз на основании только одного анализа невозможно.
Незначительное или умеренное превышение допустимых значений (вторичный АФС)
- Возрастные изменения (у здоровых людей в пожилом возрасте частота обнаружения антител к фосфолипидам составляет 2-4%. Это несколько чаще, чем у молодых);
- Наличие какой-либо инфекции в организме (ВИЧ инфекция, вирусный гепатит С), онкологической патологии;
- Системная красная волчанка;
- Прием некоторых медикаментов (пероральные противозачаточные средства, психотропные препараты).
- Сосудистые патологии (или высокая предрасположенность к ним):
- тромбозы;
- тромбофлебит вен нижних конечностей;
- гангрена (некроз, омертвение тканей) конечностей;
- инсульт головного мозга;
- инфаркт миокарда 3 или других внутренних органов;
- повторяющиеся выкидыши в 1-м триместре;
- внутриутробная смерть плода во 2-м и 3-м триместрах;
При обнаружении в крови антител к фосфолипидам, особенно, если исследование проводилось однократно, нельзя с точностью быть уверенным, что у пациента развивается АФС. Для подтверждения диагноза требуется повторное обследование, а также проведение дополнительных лабораторных анализов.
-
Tarek Hammad, MD. Antiphospholipid Antibodies. - Medscape, Aug 2019. Репина М.А., Папаян Л.П. Ведение беременных женщин с риском тромбозов и осложнений беременности на фоне активации системы гемостаза. - Лечащий врач №11/2017. Ученые установили взаимосвязь между уровнем антифосфолипидных антител и острым инфарктом миокарда. - Univadis, 2018.
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
Изучение антифосфолипидного синдрома (АФС) началось в 1907 г. с разработки Васcерманом лабораторного метода диагностики сифилиса. Впервые АФС описал в 1986 году английский ревматолог Hughes G. С этого времени начинается интенсивное изучение патофизиологич
Изучение антифосфолипидного синдрома (АФС) началось в 1907 г. с разработки Васcерманом лабораторного метода диагностики сифилиса. Впервые АФС описал в 1986 году английский ревматолог Hughes G. С этого времени начинается интенсивное изучение патофизиологических и клинических особенностей АФС. Критерии диагностики АФС, которые были сформулированы в октябре 1998 г. на VIII Международном симпозиуме [1], делятся на клинические и лабораторные. Нужно отметить, что эти критерии разработаны для диагностики АФС у взрослых и не учитывают особенностей детского возраста.
АФС — системное аутоиммунное заболевание: с артериальным или венозным тромбозом различной локализации, с невынашиванием беременности (спонтанные аборты, выкидыши, внутриутробная гибель плода) и с высоким титром патогенетически значимых антител к фосфолипидам (ФЛ) — таких как антитела к фосфолипидам (антитела к ФЛ), антитела к кардиолипинам (антитела к КЛ), антитела к волчаночному антикоагулянту (ВА) и антитела к кофакторным белкам (протромбин, протеин С, протеин S, аннексин V, простациклин) и бета2-гликопротеин I (бета2-ГП-I).
Диагноз АФС для ребенка является достоверным при наличии клинического критерия и хотя бы одного лабораторного критерия.
Выделяют несколько клинических вариантов АФС у детей. Первичный антифосфолипидный синдром (ПАФС) — развивается у лиц без аутоиммунных заболеваний. Вторичный антифосфолипидный синдром (ВАФС) развивается у больных с ревматическими и аутоиммунными заболевания, со злокачественными новообразованиями, при применении ряда лекарственных препаратов (гормональных, контрацептивных, психотропных веществ, новокаинамида, высоких доз интерферона альфа), инфекционными заболеваниями (герпетическая инфекция, микоплазмоз). Катастрофический АФС — мультисистемные, преимущественно органные тромбозы на уровне микроциркуляторного русла с высоким титром антител к ФЛ, диссеминированная внутрисосудистая активация с тромбозом в сосудах с небольшим диаметром, полиорганные поражения.
Наиболее распространенными формами АФС у детей являются ПАФС и ВАФС. Диагноз ПАФС правомочен при наблюдении не менее 5 лет с момента выявления первых признаков заболевания, т. к. возможна не только трансформация ПАФС во вторичный, но и начало аутоиммунного заболевания с тромбозами и тромбоцитопенией.
J. C. Pittte и соавторы (1993) разработали ряд критериев, исключающих ПАФС. Это эритема лица (бабочка), дискоидная эритема, изъязвление слизистой рта или глотки, артриты, плевриты (без тромбоэмболии легочной артерии или левожелудочковой недостаточности), перикардит (исключается инфаркт миокарда или уремия), персистирующая протеинурия более чем 0,5 г/сут (наличие иммунокомплексного гломерулонефрита), лимфопения менее 1000 клеток в 1 мкл, антитела к нативной ДНК, антитела к экстрагированным ядерным антигенам, антинуклеарные антитела в высоком титре, прием препаратов, индуцирующих выработку антител к ФЛ.
Клинические признаки АФС разнообразны и зависят от локализации невоспалительной тромботической васкулопатии сосудистого русла.
При венозных тромбозах отмечается поражение глубоких вен нижних конечностей. У некоторых детей может развиться и тромбоз легочной артерии, правда, очень редко. Характерен тромбоз венозных сосудов почек, печени, глаз и мезентеральных сосудов.
Артериальный тромбоз у детей отмечается в церебральных артериях. Клиническая манифестация данной патологии — транзиторная ишемическая атака головного мозга или значительно реже — инсульт. Тромботическая васкулопатия характерна для артерий почек, печени и мезентеральных сосудов.
Локализация артериально-венозных тромбозов определяет разнообразие клинических проявлений АФС.
Высокий титр антифосфолипидных антител обусловливает широкий спектр патологии центральной и периферической нервной системы: транзиторная ишемическая атака головного мозга, окулярная нейропатия, внезапная тугоухость, парциальные судороги, эписиндром, хорея, транзиторная общая амнезия и психоз.
Клинические проявления поражения сердечно-сосудистой системы вариабельны и характеризуются поражением клапанов сердца, миокарда, артериальной гипертензией и внутрисердечными тромбами.
Кожные проявления АФС разнообразны и проявляются в первую очередь сетчатым ливедо — это сосудистая сеточка в виде синеватых пятен на голенях, ступнях, бедрах, кистях, особенно хорошо выявляемая при охлаждении. Возможна поверхностная сыпь в виде точечных геморрагий, напоминающих васкулит, или кровоизлияние в подногтевое ложе, подошвенная и ладонная эритема и кожные узелки. Наиболее тяжелые кожные проявления АФС — это некроз кожи дистальных отделов нижних конечностей и хронические язвы голеней.
Целью настоящего исследования является анализ клинических, лабораторных и иммунологических показателей у детей с АФС.
Методы исследования
Методы иммунологического анализа включали определение гетерогенной группы АФА. Использовались Антифосфолипид скрин (Orgentec, Германия), работающий по принципу непрямого твердофазного ИФА-ELISA. Он разработан для количественного определения аутоантител класса IgG и IgM к фосфолипидам. Ячейки планшета покрыты высокоочищенными человеческими фосфолипидами (кардиолипином, фосфатидил-серином, фосфатидил-инозитолом, фосфатидиловой кислотой). У всех детей определяли анти бета2-ГП-I антитела и проводили исследование системы гемостаза. Комплекс современных стандартизованных тестов, оценивающих состояние всех звеньев системы гемостаза, включал: сосудисто-тромбоцитарный гемостаз, агрегационную функцию тромбоцитов с определением спонтанной агрегации, АДФ — агрегацию с максимальной и субпороговой концентрацией индуцера. О наличии волчаночного антикоагулянта в плазме крови судили по удлинению времени свертывания крови in vitro при проведении фосфолипид-зависимых коагуляционных тестов. Согласно рекомендациям I Международного рабочего совещания, определения ВА осуществляли в три этапа.
Общая характеристика пациентов
Исследуемую группу составил 91 пациент с различными клиническими проявлениями АФС, проходивший стационарное лечение в кардиоревматологическом отделении ДГБ № 2 г. Санкт-Петербурга и педиатрическом отделении № 3 СПбГПМА.
Возраст детей составил от 2 до 18 лет (средний возраст 13,12 года), из них 59 девочек (64,80%) и 32 мальчика (35,20%). Дети в возрасте до 6 лет составили 5,56%, от 6 до 12 — 16,67%, дети старше 12 лет — 77,78%.
Клиническая картина АФС в связи с поражением различных органов и систем разнообразна (рис. 1).
Одним из ведущих клинических признаков АФС у детей является ливедо (сетчатость кожных покровов), которое встречалось одинаково часто как при ВАФС, так и при ПАФС. Нужно отметить, что усиление венозной сети на коже было более характерным для ВАФС (p < 0,05).
Результаты нашего исследования показали, что у детей с ВАФС, имеющих высокие титры аФЛ и анти бета2-ГП-I антитела, достоверно чаще отмечалось поражение легких, сердца, почек, что необходимо учитывать при ведение этих детей с тем, чтобы своевременно выявить пациентов с группой риска венозно-артериального тромбоза (рис. 2).
Характеристика и частота тромботических осложнений у детей с АФС
Наиболее часто отмечался тромбоз мелких сосудов кожи: ладонный и подошвенный тромбоваскулит с очагами поверхностного некроза, трофические язвы и livedo reticularis. У 5 детей (12,5%) была диагностирована почечная тромботическая микроангиопатия с гематурией и протеинурией различной степени выраженности, почечной недостаточностью острого периода и злокачественной артериальной гипертензией. Поражение ЦНС было выявлено у 5 детей, у одного ребенка течение основного заболевания осложнилось инсультом, а у остальных были стойкие проявления ишемической энцефалопатии, в виде нарушения когнитивных функций (памяти, внимания, мышления) и неустойчивого настроения. У двоих детей отмечался судорожный синдром (рис. 3).
Для наглядного представления пациентов с АФС приводим выписки из историй болезни из группы наблюдения.
Мальчик К., 16 лет, дебют заболевания отмечался 4 года назад осенью, когда появились зуд и отечность V пальцев обеих стоп. Через 2 года дефигурация нескольких пальцев кистей рук с зудом кожных покровов, сопровождавшимся нейтрофилезом и ускорением СОЭ до 35 мм/час. На холоде отмечалась отечность мягких тканей в области кистей рук с изменением цвета кожи в виде побледнения, сменяющегося цианозом с реактивной гиперемией и ощущением покалывания в пальцах. В дальнейшем состояние трактовалось как синдром Рейно и на фоне сосудистых препаратов отмечалась положительная динамика. В течение последнего года у мальчика отмечено варикозное расширения вен нижних конечностей, появление на внутренней поверхности правого бедра двух плотных узелков, сопровождающееся болевым синдромом и синюшным цветом кожи над ними. Ребенок также страдает частыми головными болями и кровотечением из носа. Из анамнеза наследственности известно, что у матери ребенка варикозное расширение вен нижних конечностей, частые мигреноподобные головные боли, кровотечение из носа, два выкидыша на 10-й и 12-й неделе беременности неясного генеза, кроме этого — ее сестра скончалась от СКВ.
Девочка М. в возрасте 12 лет госпитализирована экстренно на четвертые сутки болезни с жалобами на боли в животе, повышение температуры. Диагностирован острый аппендицит. Выполнена лапароскопическая аппендектомия. Диагностирован гангренозно-перфоративный аппендицит, оментит, разлитой перитонит. При сборе дополнительного анамнеза стало известно, что в течение последних двух лет до развития заболевания у девочки отмечался субфебрилитет, а весной прошлого года два эпизода немотивированных синкопальных состояний. Наследственность: дядя по линии отца страдает системной красной волчанкой.
На основании отягощенной наследственности, анамнестических данных, клинико-лабораторных, иммунологических, инструментальных показателей, а также дебюта и течения заболевании у девочки диагноз трактовался как системная красная волчанка с полиорганным поражением, АФС, нефрит с нефротическим синдромом, цереброваскулит, миоперикардит, плеврит, пневмонит, поражение сосудов желудочно-кишечного тракта. Ребенок за время госпитализации получал гормональные, цитостатические препараты, антиагреганты, антикоагулянты, несколько курсов антибактериальных препаратов и симптоматические препараты. Был проведен ряд оперативных вмешательств. В итоге девочка в удовлетворительном состоянии (на фоне отрегулированной базисной терапии) находится под наблюдением кардиоревматолога в условиях амбулаторного и периодически стационарного лечения (в целях отслеживании клинико-лабораторных показателей и коррекции терапии).
При обследовании показателей внутрисосудистой активации тромбоцитов выявлено увеличение суммы активных форм тромбоцитов. Диагноз на основании клинико-лабораторных, инструментальных и иммунологических данных трактовался как первичный антифосфолипидный синдром. Получала антиагрегантные, антикоагулянтные и сосудистые препараты. Через два года была госпитализирована с жалобами на боли в животе. В связи с подозрением на кишечное кровотечение (при поступлении отмечался стул с большим количеством крови и слизи) была проведена диагностическая лапароскопия и лапаротомия. В результате обследования был выявлен терминальный илеит. На фоне терапии состояние девочки стабилизировалось. Находится под наблюдением ревматолога, получает терапию, которая корригируется на основании иммунологических и клинико-лабораторных показателей.
Ведение больных АФС представляет серьезную проблему. В основе АФС лежат различные патогенетические механизмы, приводящие к тромбозам. Гетерогенность клинических проявлений АФС, отсутствие общепризнанных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромбозов, существенно усложняет выбор медикаментозной терапии больных с АФС. Например, развитие повторных тромбозов не всегда коррелирует с изменением титров антител к ФЛ и активностью основного заболевания при вторичном АФС.
Лечение больных АФС основывается на назначении непрямых антикоагулянтов и антиагрегантов (низкие дозы аспирина), которые широко используются для профилактики тромбозов, не связанных с АФС. У больных с ВАФС, кроме того, проводится лечение основного заболевания.
Таким образом, изучение АФС остается одной из наиболее актуальных мультидисциплинарных проблем медицины. Для определения адекватной терапии этого заболевания необходимо объединение усилий специалистов различных областей медицины — педиатров, ревматологов, кардиологов, невропатологов, акушеров-гинекологов, иммунологов.
Литература
Wilson W. A., Gharavi A. E, Koike T. et al. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome // Arthr. Rheum. 1999,42, 1309–1311.
Olive D., Andreґ E., Brocard O. et al. Lupus eґ rytheґ mateux disseґ mineґ reveґ leґ par des thrombophleґ bites des membres inferieurs // Arch Fr Pediatr. 1979; 36 (9): 95.
Font J. Lopez-Soto A., Cervera R. et al. The primary antiphospholipid syndrome antiphospholipid antibody patern and clinical features of series of 23 patients autoimmunity. 1991,9, 69–75.
Shi W., Chong B. H., Chesterman C. N. b2-glycoprotein I is a requirement for anticardiolipin antibodybinding to activated platelets: differences with lupus anticoagulants // Blood. 1993,81: 1255–1262.
Arvieux J., Roussel B., Pouzol P., Colomb M. G. Platelet activating properties of murine monoclonalantibodies to beta2-glycoprotein I // Thromb Haemost. 1993, 70: 336–341.
Arvieux J., Jacob M. C., Roussel B., Bensa J. C., Colomb M. G. Neutrophil activation by anti-b2-glycoproteinI monoclonal antibodies via Fcг receptor II // J Leukoc Biol. 1995;57: 387–394.
Font J., Espinosa G., Tassies D. et al. Etteftc of beta2-glycoprotein I and monoclonal anticardiolipin antibodies in platelet interaction with subendothelium under flow conditions //Arthritis Rheum. 2002, 46: 3283–3289.
Lutters B. C., Derksen R. H., Tekelenburg W. L., Lenting W. L., Arout H., de Groot P. G. Dimers of beta2-glycoprotein I increase platelet deposition to collagen via interaction with phospholipids and the apolipoprotein E receptor 2’ // J Biol Chem. 2003, 278: 33831–33838.
Barreirinho S., Ferro A., Santos M. et al. Inherited and acquired risk factors and their combined effects in pediatric stroke // Pediatr. Neurol. 2003, 28, 134–138.
Cardo E., Monros E., Cobome C. et al. Children with stroke: polymorphism of the MTHFR gene, mild hyperhomocysteinemia, and vitamin status // J. Child. Neurol. 2000,15, 295–298.
Kynch J., Han C., Nee L. et al. Prothrombotic factorsin children with stroke or porencephalya // Pediatrics. 2005, 447–453.
Torres J. D., Cardona H., Alvares L. Inherited thrombophilia is associated with deep vein thrombosis in a Colombian population // Am. J. Haematol. 2006, 81 (12), 933–937.
Asherson R. A., Harris E. N. Anticardiolipin antibodies-clinical association // Postgrad. Med. J. 1986. Vol. 62. P. 1081–1087.
Г. А. Новик, доктор медицинских наук, профессор
Н. М. Калинина, доктор медицинских наук, профессор
Л. Н. Аббакумова, кандидат медицинских наук, доцент
К. Г. КикнадзеСпбГПМА, Санкт-Петербург
Иммуноблот при сифилисе на Джи и М антитела — высокочувствительное, специфичное исследование. Позволяет опровергнуть/подтвердить диагноз при получении неопределенных или позитивных данных, полученных при помощи классических тестов. Отличается информативностью и 99-100% достоверностью.
![антитела к сифилису в крови]()
Метод рекомендован как референтный (максимально точный) при необходимости выполнения дифференциальной диагностики, для подтверждения диагноза латентного сифилиса.
Лабораторная диагностика сифилиса
Серологические исследования базируются на иммунных связях, которые наблюдаются в сыворотке крови.
Белковые соединения сливаются с антигенами, в результате этого взаимодействия антигены микробов купируются.
После внедрения возбудителя (Treponema pallidum) в организме начинают вырабатываться защитные антитела.
Они атакуют микробы и предотвращают распространение болезни.
Для анализа берется кровь, добавляется в нее суспензия микробов.
Если реакция не произошла — человек здоров, произошла — болен.
Иммуноглобулины при сифилисе (иммуноглобулины к бледной трепонеме) — белки-защитники, продуцируемые для его нейтрализации.
Они выявляют инфекцию в крови, ее остатки после проведенной терапии.
Каждый из антител к Treponema pallidum имеет конкретный информативный статус, назначение и конфигурацию.
Иммуноглобулины А при сифилисе
Осуществляют контроль за местным иммунным ответом — ранней защитой, реагирующей на попадание инфекционного агента в определенный сегмент организма.
Производятся в значительной концентрации на слизистых кишечника, легких, полости рта, в незначительной — в крови.
Являются маркером активной инфекции, считаются неспецифическими, поскольку дают ответ и на другие бактерии.
Иммуноглобулины М при сифилисе
Курируют общий иммунитет.
Отличаются слабой специфичностью.
Способствуют эвакуации антигенов, предупреждают их фиксацию в тканях и запуск патологических процессов.
Их наличие указывает на активную стадию заболевания, после лечения эти белки пропадают.
![образование иммуноглобулинов при сифилисе]()
Иммуноглобулины G при сифилисе
Основные иммуноглобулины вторичного иммунитета.
Обеспечивают высокую напряженность иммунного ответа в течение длительного срока.
Клетки памяти этих белков организм способен продуцировать несколько лет после приема профильных лекарственных препаратов.
Что такое титры иммуноглобулинов и как они падают
Титры иммуноглобулинов — термин, применяемый для определения концентраций белковых молекул.
На 4-5 сутки после заражения в крови определяются IgA.
Но вследствие того, что данный период инфекционного процесса выраженной клиники не дает, анализы на них проводятся крайне редко.
Через 7-8 суток после инфицирования клетки плазмы начинают синтезировать IgM.
Белки вырабатываются в первичном/вторичном периоде сифилиса, в третичном — ликвидируются.
Контролировать, как падает их концентрация, очень важно для оценки качества лечения.
Если на протяжении 2-3 недель после их титры снижаются медленно, можно говорить о микробиологической неэффективности назначенной терапии.
Иммуноглобулины класса G появляются спустя 35-40 дней после заражения
Через 55-60 суток их уже можно увидеть в обычных скрининговых анализах.
Когда исчезают из крови иммуноглобулины при сифилисе?
IgM продуцируются 3-4 года после подтвержденной клинической ремиссии.
У некоторых пациентов белок способен выделяться на протяжении всей жизни, что не гарантирует 100% защиты от повторного заражения.
Иммуноглобулины при сифилисе: кто назначает, когда проводится анализ
![венеролог Ленкин Сергей Геннадьевич]()
Специфические антитела M появляются через одну-две недели после внедрения возбудителя в организм.
Максимальная концентрация трепонемы фиксируется на 40-60 день, пропадает — спустя 3-5 месяцев после лечебного курса, 12-18 месяцев — без бактериальной терапии.
Выявляются у лиц на первой/второй фазе сифилиса.
Позволяют установить точные сроки заражения.
IgG обнаруживаются на 25-30 сутки патологического процесса.
Их титры постоянно растут, максимальная концентрация отмечается через 2 года после инфицирования.
Особой подготовки тест не требует: перед забором крови пациенту нужно воздержаться от еды и курения 4-5 часов.
От употребления спиртосодержащих напитков — 24 часа.
![запрет на курение и алкоголь]()
Показания:
- наличие явной клинической симптоматики;
- сомнительные/положительные результаты, полученные в ходе предыдущих тестов, особенно на фоне онкологии, туберкулеза, алкоголизма, диабета в анамнезе;
- подозрение на болезнь при приеме антисептических и антибактериальных препаратов;
- врожденная форма;
- половой акт с больным человеком;
- ВИЧ-инфекция;
- выявленные венерические болезни;
- язвенные поражения гениталий; .
Интерпретация результатов иммуноблота при сифилисе
Положительный результат указывает на недавнее заражение.
Повторный (+) при проведении исследования через 1-1,5 месяца служит подтверждением диагноза сифилис.
Обнаружение IgM у новорожденных младенцев говорит о наличии сифилитической инфекции.
Поскольку плацентарная передача материнских IgM невозможна.
Отрицательный результат предполагает 2 варианта событий: инфицирования не было, анализ был проведен до выраженной реакции иммунной системы.
В сомнительных случаях через 7 дней проводится еще одно тестирование.
Критерии положительности иммуноблота:
- (+): для M — 1 четкая полоса, для G — 2 четких полосы;
- (-): для G, M — полосы отсутствуют;
- (-/+): для G — 1 четкая полоса, для M — 1 слабая полоса.
![результат иммуноблота на сифилис]()
Сравнение с другими методами анализов на сифилис
В клинической практике для скринингового (предварительного) обследования на сифилис проводят исследование РМП или улучшенный вариант (РПР).
При положительных данных ставится подтверждающий трепонемный тест — ИФА, РПГА, РИТ (РИБТ), РИФ:
Главное преимущество иммуноблота по сравнению с другими тестами заключается в том, что ответ антиген-антитело не требует дорогих технологий и зависит от массы белка.
![определение иммуноглобулинов при сифилисе]()
Второй плюс — на результат не влияют отсутствие растворимости, нестабильность антигенов.
В анализе есть возможность определить реакцию иммуноглобулинов с несколькими антигенами.
Это имеет большую диагностическую ценность, особенно в сложных случаях.
Тест достаточно прост в исполнении, при необходимости позволяет выявить IgM, IgG изолированно друг от друга.
Ложноположительные и ложноотрицательные анализы на сифилис
Ложные серологические реакции могут быть обусловлены качеством реагентов, погрешностями в ходе выполнения исследования, техническими неточностями.
Ложноотрицательные анализы выдаются при нарушениях сроков хранения приборов для диагностики.
Это влечет за собой снижение чувствительности реакции.
Ложноположительные результаты возникают вследствие ошибок при приготовлении сывороток, неравномерной концентрация антигена, нарушений при заборе крови.
Инфекции/состояния, при которых фиксируются ложноположительные результаты:
- беременность;
- пневмония;
- мононуклеоз;
- ВИЧ;
- гепатит;
- онкологический процесс.
![ложноположительный анализ на сифилис при онкологии]()
Причины ложноотрицательных реакций:
- иммунодефицитные состояния;
- наличие конкуренции между G и M иммуноглобулинами;
- при ИФА ложный результат может быть обусловлен иммунной недостаточностью, ВИЧ (вторичный сифилис), наличием серонегативной фазы (первичный сифилис).
Если тест вызывает сомнения, целесообразно его повторить через 5-10 дней, пройти дополнительные обследования по назначению врача-венеролога.
Для диагностики сифилиса обращайтесь к автору этой статьи – венерологу в Москве с многолетним опытом работы.
Антитела к сифилису в крови образуются у человека, который столкнулся с этой инфекцией достаточно близко.
Суммарные антитела к возбудителю сифилиса это важный диагностический критерий для врача.
Если человек инфицирован сифилисом, антитела формируются спустя 3-4 недели с момента заболевания.
![Антитела в крови]()
Наличие антител означает, что данный человек болел или болен в настоящий момент сифилисом.
Какие бывают антитела к сифилису
Антитела к сифилису можно разделить на две категории это ранние и поздние антитела.
Другое название антител – иммуноглобулины.
Различают три основные категории антител – IgM, IgG и IgA.
К ранним относят: антитела типа А и М.
После заражения, в первую очередь, вырабатываются иммуноглобулины класса А.
Эта разновидность относится к ранним маркерам заболевания.
Они отвечают за формирование местного иммунитета.
Исследование на них, как правило, не проводится.
Возможно определение количества данных элементов в составе комплексной панели.
IgM – еще один вид антител.
Они образуются вскоре после начала заболевания: формирование иммуноглобулинов класса M начинается через 2 недели после заражения.
Исследования могут обнаружить их не раньше, чем через полтора месяца.
Элементы циркулируют в крови на первом и втором этапе болезни.
В стадии третичного сифилиса - практически исчезают.
Обычно после лечения, эти антитела в крови не выявляются.
IgG – самые поздние из антител, они формируются не раньше, чем через месяц после заражения.
Вначале титр IgG очень мал и не определяется анализами.
Обнаружить IgG в крови становится возможным через 2 – 2,5 месяца от начала болезни.
После проведенного лечения, иммуноглобулины класса G остаются в крови в течение нескольких лет.
В некоторых случаях, они могут оставаться в организме навсегда.
Это не является показателем продолжающейся инфекции, а просто свидетельствует о перенесенной болезни.
Важно!
При наличии этих маркеров заболевания в кровяном русле, возможно получение неприятных ложноположительных результатов.
Такой результат требует консультации венеролога.
Какое исследование поможет достоверно поставить диагноз?
Комплексный анализ на антитела к сифилису позволяет определить стадию заболевания.
Скрининговые нетрепонемные тесты тоже основаны на обнаружении антител.
Самый распространенный анализ на сифилис – RPR-тест, современный аналог устаревшей реакции Вассермана.
Он определяет в крови наличие антител к кардиолипину.
Кардиолипин – это липид, который содержится в клетках бледной трепонемы.
Тест становится положительным через неделю, после возникновения первичной сифиломы – твердого шанкра.
Анализ результативен на стадии первичного и вторичного сифилиса.
Минус теста в том, что кардиолипин неспецифичен сифилису, то есть присутствует не только в бледной трепонеме.
Скрининговый тест используется только для предварительно диагностики.
Если результат получен положительный, требуется подтверждение специфическим трепонемным тестом.
Кроме этого, RPR можно использовать для контроля эффективности лечения.
При диагностированном сифилисе, этот анализ показывает снижение уровня кардиолипинов.
Какие антитела к сифилису выявляют чаще?
Поздние антитела называют иммуноглобулинами G.
![Схематическое изображение иммуноглобулина]()
Этот вид антител к сифилису остается в организме на протяжении практически всей человека.
Сифилис: суммарные антитела
Что такое суммарные антитела к сифилису и для чего они нужны?
Суммарные антитела к сифилису показывают наличие и ранних и поздних видов антител.
Данное исследование проводятся для исключения ошибок в диагнозе.
Тестирование на суммарные антитела к сифилису может проводиться и для верификации диагноза.
Реакции иммунной системы организма при заражении сифилисом
![Treponema Pallidum]()
Сифилис - это инфекционное заболевание, вызываемое бледной трепонемой (бактерией Treponema pallidum). Организм человека, заболевшего сифилисом, защищается от возбудителя заболевания с помощью механизмов иммунитета. Проникновение, длительное сохранение в организме (персистенция) и размножение возбудителя заболевания в организме хозяина приводят к выраженным изменениям со стороны иммунной системы.
После попадания бледных трепонем в организм и при их дальнейшем размножении, в организме больного человека происходят иммунные сдвиги. Механизм иммунного ответа при сифилисе исследован не полностью, однако имеются достаточно убедительные данные о том, что в этом процессе участвуют все звенья иммунной системы.
Активируются механизмы как врожденного неспецифического иммунитета, свойственного человеку как биологическуому виду, так и адаптивного, антиген-опосредованного иммунного ответа, вызванного контактом с антигеном. В иммунном ответе организма принимают участие как клеточные (макрофаги, Т-лимфоциты), так и гуморальные механизмы (синтез специфических иммуноглобулинов — антител).
Иммунную реакцию вызывают белки, входящие в состав структур бледной трепонемы; они являются чужеродными веществами для организма человека и относятся к антигенам. Все антигены трепонемы способны стимулировать организм больного вырабатывать антитела соответствующих классов. Вследствие этого, в сыворотке крови больных сифилисом отмечается множественность антител: протеиновых, комплементсвязывающих, полисахаридных реагинов, иммобилизинов, агглютининов.
Классы вырабатываемых антител меняются на разных этапах течения сифилиса — в различных стадиях болезни преобладают то одни, то другие антитела, относящиеся к разным классам иммуноглобулинов. Сила иммунного ответа и спектр антител, выявляемых на разных стадиях развития инфекции, зависит от особенностей организма у данного человека.
Во многих случаях иммунологический ответ не предотвращает поэтапного развития инфекции. Организм хозяина неспособен уничтожить сифилитическую инфекцию, что приводит к дальнейшей эволюции патологического процесса. Болезнь, начавшись с местного процесса, распространяется на весь организм и продолжается много лет.
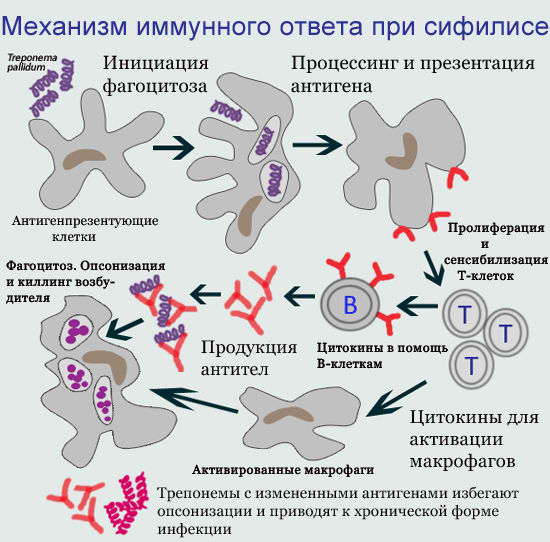
Клеточный и гуморальный иммунный ответ на внедрение бледной трепонемы в организм
В иммунном ответе организма на заражение принимают участие клеточные и гуморальные механизмы иммунитета.
![Иммунный ответ при сифилисе]()
1. Клеточный иммунитет при заражении сифилисом
На клеточном уровне бледной трепонеме противодействуют высокоспециализированные клетки иммунной системы — макрофаги, T-лимфоциты, B-лимфоциты. Происходит изоляция и частичное уничтожение трепонем фагоцитами, в основном макрофагами. Фагоцитоз носит преимущественно незавершенный характер — при поглощении фагоцитом возбудитель не погибает, а остается в клетке, сохраняя свою структуру и способность к размножению. Более того, фагоцит оберегает от антител и воздействия антибиотиков бледную трепонему, которая становится недоступной для защитных сил организма.
Ранний сифилис характеризуется частичным угнетением клеточного иммунитета и развитием состояния иммуносупрессии, постепенно нарастающей активизацией гуморального иммунитета. Клеточное звено страдает в первую очередь, так как Т-лимфоциты более чувствительны к воздействию бактерий T. pallidum.
У больных вторичным, латентным и третичным сифилисом формируется клеточный иммунитет, признаки которого выявляются в реакциях in vivo (кожные пробы) и in vitro (стимуляция Т-лимфоцитов трепонемными антигенами).
2. Гуморальный иммунитет при заражении сифилисе
Гуморальный иммунный ответ заключается в продукции широкого спектра противосифилитических антител. В структуре бледной трепонемы выявлено большое количество соединений, имеющих выраженные антигенные свойства для иммунной системы человека. На начальных этапах развития сифилиса происходит более выраженный синтез антител к антигенам, имеющим высокое содержание в клетке T. pallidum и локализующимся в структуре мембран наружной клеточной стенки или протоплазматического комплекса.
3. Уклонение бледных трепонем от иммунного ответа
Клеточное и гуморальное звенья иммунитета не в состоянии обеспечить полное уничтожение и элиминацию бледных трепонем. Благодаря своему необычному молекулярному строению, T. pallidum обладает замечательной способностью уклоняться от защитной реакции макроорганизма.
Электронно-микроскопические исследования показали, что при сифилисе преобладает незавершенный фагоцитоз трепонем (захват и поглощение трепонем лейкоцитами, макрофагами и другими клетками). При этом трепонемы не погибают, а получают защиту от антибиотиков и антител, и могут даже размножаться в фагоцитирующей клетке. В течение всего инкубационного периода, а также в конце первичного и в начале вторичного периодов сифилиса, возбудители активно размножаются и распространяются по всему организму.
Гуморальный иммунный ответ. Противосифилитические антитела.
![Иммунный ответ при сифилисе]()
1. Неспецифические антитела при сифилисе
Реагиновые антитела у больного сифилисом — это иммуноглобулины класса IgG и IgM. Они являются комплексным ответом на высвобождение липоидных молекулярных фрагментов из поврежденных клеток хозяина, а также на появление липопротеиноподобных структур, сходных с кардиолипином, входящих в состав бактериальной клетки бледной трепонемы.
Липидные антигены cоставляют значительную часть бактериальной клетки T. pallidum. Помимо других антигенов, в клеточной стенке бледной трепонемы содержится фосфолипид кардиолипин; на его долю приходится около 30% сухого вещества клетки спирохеты. В организме человека, больного сифилисом, могут присутствовать липиды, имеющие сходное строение с липоидными структурами клеточной стенки бледной трепонемы. Это аутоантигены, образующиеся в результате разрушения органов и тканей, в основном липиды митохондриальных мембран.
Аутоантигены - это компоненты клеток и тканей собственного организма, которые распознаются при определённых условиях как частично чужеродные. Аутоантитела к кардиолипину – это антитела, направленные организмом против собственного кардиолипина.
Клетки человека, больного сифилисом выделяют в большом количестве липоидный и липопротеиноподобный материал, сходный с кардиолипином. Бледная трепонема приводит к поражению внутренних органов, в частности, к повреждению печени и сердца, освобождая некоторые фрагменты тканей. При интенсивном размножении спирохет в организме больного происходит распад тканей, в результате чего из поврежденных клеток высвобождаются липоидные молекулярные фрагменты.
Иммунная система пациента реагирует, вырабатывая реагиновые антитела на эти фрагменты. Продукты распада клеток — липоидные белки — поступают в кровяное русло. Эти белки являются чужеродными для организма человека, поэтому реакция организма проявляется в виде выработки неспецифических антител (иммуноглобулинов) класса IgM и IgG к липоидному и липопротеиноподобному материалу. Именно эти антитела исторически называются реагинами.
Следует иметь в виду, что реагины с помощью кардиолипиновых тестов могут обнаруживаться в организме людей, никогда не болевших сифилисом, т.к. их количество повышается при различных физиологических и патологических состояниях, не связанных с сифилисом, например у пациентов с аутоиммунными, воспалительными и гематологическими заболеваниями. Эти реагины могут быть причиной так называемых биологических ложноположительных серологических реакций на сифилис.
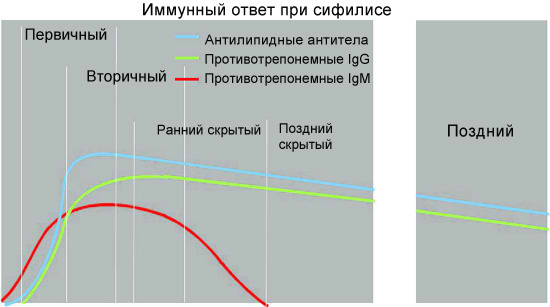
Антилипидные (неспецифические) антитела появляются в организме человека со стадии первичного сифилиса —примерно через 7-14 дней после образования твердого шанкра, через 4-5 недель после заражения.
Антитела против кардиолипина выявляют посредством нетрепонемных серологических тестов. При нетрепонемных методах анализа на сифилис не различают тип антител (IgG, IgM или др.), а определяют суммарный ответ.
2. Специфические антитела при сифилисе
Специфические антитрепонемные антитела направлены против бледной трепонемы. Плазматические клетки организма вырабатывают специфические антитела, направленные против соответствующих антигенов возбудителя заболевания.
На ранних этапах развития сифилиса, как бактериальной инфекции, у заболевшего человека осуществляется выработка специфических антител, относящихся преимущественно к иммуноглобулинам класса M (первичный иммунный ответ). Трепонемоспецифические Ig класса M у больных сифилисом могут регистрироваться даже в период инкубации. Позднее происходит переключение на синтез IgG (вторичный иммунный ответ).
Параметры иммунного ответа могут изменяться в результате проводимого лечения. Адекватное лечение раннего сифилиса приводит к быстрому снижению титров неспецифических антител и специфических IgM.
По мере развития патологического процесса постепенно включаются механизмы образования антител классов G и А. Ведущая роль в гуморальном ответе переходит к специфическим антителам IgG и IgА. При этом специфические IgG обычно сохраняются в сыворотке крови в течение длительного периода времени,а иногда и всю жизнь
Динамика образования специфических антител у больного при сифилисе
По данным современных исследований, гуморальный ответ при сифилисе происходит в соответствии с общими закономерностями для бактериальных инфекций. Вначале вырабатываются иммуноглобулины класса M против наиболее иммуногенных и специфичных антигенов возбудителя. Специфические антитела класса M способны выявляться в крови пациентов, инфицированных T. pallidum, на самых ранних этапах развития инфекции, уже через 1,5-2 недели после заражения, что клинически соответствует скрытому инкубационному периоду заболевания. При первичном и вторичном сифилисе содержание указанных антител в крови больных быстро нарастает и сохраняется на высоком уровне; максимальное их содержание у больных сифилисом приходится на 6—9-ю неделю заболевания.
После успешного лечения антибактериальными препаратами специфические IgM у больных относительно быстро элиминируют из кровотока (через 3—12 месяцев). При лечении раннего сифилиса IgM исчезают через 3-6 месяцев, позднего – через 1 год. Большое диагностическое значение приобретает выявление антитрепонемных антител IgM в крови новорожденных. Так как IgM не проходит через плаценту, выявление антитрепонемных IgM-антител у новорожденного указывает на врожденный сифилис. Точно так же IgM-антитела не проникают через гематоэнцефалический барьер, и их появление в спиномозговой жидкости говорит о нейросифилисе.
Многие лабораторные методики диагностики сифилиса основаны именно на выявлении трепонемоспецифических IgM. Например, иммуноферментный анализ (ИФА) на твердой фазе и линейный иммуноблоттинг (ИБ) на микропористых стрипах с использованием антивидовых конъюгатов на основе моноклональных антител к тяжелой мю-цепи в структуре IgМ человека, а также реакция непрямой иммунофлюоресценции (РИФ) с исследованием 19S-фракции сыворотки крови, содержащей тяжелые IgМ.
Раннее определение специфических IgM также может быть применено для своевременного выявления случаев раннего врождённого сифилиса (определение специфических IgM в крови новорожденных) или случаев реинфекции у пациентов, ранее перенесших сифилис.
Без лечения, по мере развития болезни и разрешения клинических проявлений вторичного периода, уровень специфических IgМ в крови больных сифилисом постепенно понижается и начинает преобладать синтез IgG. Развитие иммунного ответа на антигенную стимуляцию в организме больного сифилисом сопровождается постепенным переключением с синтеза антител класса M на продукцию более мелких молекул иммуноглобулинов класса G.
Специфические иммуноглобулины класса G в кровотоке больных сифилисом появляются более поздно, в конце 3-й или на 4-й неделе после заражения и, как правило, достигают более высоких титров, чем IgM. Уже на 6 неделе после инфицирования уровень IgG преобладает над уровнем IgM и может сохраняться в таком состоянии годы.
Содержание специфических IgG, постепенно увеличиваясь, достигает максимальной выраженности через 1—1,5 года, после чего несколько снижается, подвергаясь волнообразным колебаниям в зависимости от активности инфекционного процесса. Количество специфических IgG в циркулирующей крови после адекватно проведенного лечения снижается медленно. Антитела этого класса могут сохраняться даже после клинического излечения пациента в течение десятков лет или пожизненно.
Кроме перечисленных видов антител, в гуморальном иммунитете при сифилисе принимают участие иммуноглобулины класса А. Антитела IgA вырабатываются в сравнительно небольших количествах. Вопрос о синтезе IgE и IgD в настоящее время изучен недостаточно.
Читайте также: