Болезнь вызванная вич с проявлениями микобактериальной инфекции что это
Обновлено: 25.04.2024
Частое осложнение СПИДа — диссеминированная инфекция, вызванная Mycobacterium avium-intracellulare (Mycobacterium avium complex). Показано, что эта инфекция значительно снижает продолжительность жизни больных СПИДом, а ее лечение приводит к улучшению состояния и повышает выживаемость. Риск инфекции, вызванной Mycobacterium avium-intracellulare, особенно высок при значительном снижении числа лимфоцитов CD4. Это инфекционное осложнение возникает в течение года примерно у 8% больных, число лимфоцитов CD4 у которых ниже 100 мкл –1 . Если число лимфоцитов CD4 более 100 мкл –1 , диссеминированная инфекция, вызванная этим возбудителем, возникает гораздо реже.
Mycobacterium avium-intracellulare — условно-патогенные микроорганизмы, которые обычно обнаруживаются в почве и воде. Наиболее частый источник заражения — загрязненная вода.
Как правило, диссеминированная диссеминированная инфекция, вызванная Mycobacterium avium-intracellulare (Mycobacterium avium complex) не имеет специфической клинической симптоматики. Большинство пациентов предъявляют жалобы на высокую лихорадку (более 40 °С), выраженную потерю массы тела (более 10% массы тела), диарею, боли в животе. При наличии подобной симптоматики у больного с ВИЧинфекцией с количеством CD4-лимфоцитов менее 100 клеток/мкл необходимо исключить микобактериоз. Возможно развитие очаговых поражений в виде лимфаденитов различной локализации (шейные, паховые, брюшные лимфатические узлы), остеомиелита (позвонков), артритов, поражений кожи. При ультразвуковом исследовании часто регистрируют увеличение размеров печени и селезенки.
Подтвердить диагноз микобактериоза можно на основании выделения Mycobacterium avium-intracellulare при посеве крови, пунктата костного мозга, биопсийного материала. Обнаружение микобактерий в кале, мокроте или бронхоальвеолярном лаваже при отсутствии клинической симптоматики может свидетельствовать только о колонизации слизистых. Терапию в таких случаях назначать нецелесообразно.
Пациентам показано назначение комплексной терапии, включающей макролиды (кларитромицин по 500 мг 2 раза в сутки или азитромицин по 600 мг 1 раз в сутки) в сочетании с этамбутолом (1200 мг/сут) и рифабутином (300 мг/сут). Продолжительность терапии, как правило, составляет не менее 6 мес.
При одновременном использовании АРВТ лечение микобактериоза можно прекратить после повышения количества CD4-лимфоцитов (более 100 клеток/мкл). Доза кларитромицина обычно не превышает 500 мг 2 раза в сутки. Вместо кларитромицина можно назначать азитромицин, который меньше влияет на систему цитохрома P-450. В качестве резервных препаратов применяют: амикацин (15 мг/кг в сутки внутривенно), фторхинолоны (левофлоксацин по 500 мг внутрь 1 раз в сутки, ципрофлоксацин по 500-750 мг внутрь 2 раза в сутки).
Существуют лекарственные взаимодействия кларитромицина и ряда АРВП: AUC (площадь под кривой) кларитромицина повышается при одновременном приеме с индинавиром (на 50%), ритонавиром (на 75%), ампренавиром (на 18%), лопинавиром/ритонавиром (на 77%), атазанавиром (на 94%), невирапином (на 26%) и саквинавиром (на 177%). При совместном приеме атазанавира и кларитромицина последний следует использовать в половинной дозе или назначить другой препарат, поскольку повышение концентрации кларитромицина увеличивает риск удлинения интервала Q-T на кардиограмме.
Одновременный прием кларитромицина и указанных выше АРВП не требует коррекции дозы кларитромицина, за исключением сочетания кларитромицина с лопинавиром/ритонавиром или ритонавиром у больных с почечной недостаточностью. Одновременный прием эфавиренза снижает концентрацию кларитромицина на 39%, поэтому целесообразно заменить его азитромицином.
Больным с ВИЧ-инфекцией при количестве CD4-лимфоцитов менее 50 клеток/мкл можно назначить профилактику микобактериозов макролидами (азитромицин по 1200 мг 1 раз в неделю) или рифабутином (ежедневно по 150 мг). При увеличении числа CD4-лимфоцитов более 100 клеток/мкл можно прекратить первичную профилактику (через 3 мес) и поддерживающую терапию (через 6 мес).
Развитие МАС-инфекции как проявление синдрома восстановления иммунитета
Клиническая симптоматика микобактериоза обычно развивается в течение первых 3 мес после начала АРВТ (в раде случаев синдром восстановления иммунитета наблюдают через 6-8 мес) у больных с исходно низким количеством CD4-лимфоцитов (менее 50 клеток/мкл) и хорошим вирусологическим и иммунологическим ответом на лечение (РНК ВИЧ 100 клеток/мкл). Как правило, клинические проявления МАС-инфекции включают лихорадку, увеличение лимфатических узлов шеи, средостения, брыжейки. Возможно развитие перикардита, остеомиелита, кожных абсцессов, бурситов, поражения ЦНС.
Терапевтическая тактика включает: продолжение АРВТ по прежней схеме, терапию МАС-инфекции, применение нестероидных противовоспалительных средств и в ряде случаев стероидов (преднизолон - по 20-40 мг/сут в течение 4-8 нед).
ВИЧ-инфекция и СПИД [Электронный ресурс] : национальное руководство / под ред. акад. РАМН В.В. Покровского. - М. : ГЭОТАР-Медиа, 2013.
Частое осложнение СПИДа — диссеминированная инфекция, вызванная Mycobacterium avium-intracellulare (Mycobacterium avium complex). Показано, что эта инфекция значительно снижает продолжительность жизни больных СПИДом, а ее лечение приводит к улучшению состояния и повышает выживаемость. Риск инфекции, вызванной Mycobacterium avium-intracellulare, особенно высок при значительном снижении числа лимфоцитов CD4. Это инфекционное осложнение возникает в течение года примерно у 8% больных, число лимфоцитов CD4 у которых ниже 100 мкл –1 . Если число лимфоцитов CD4 более 100 мкл –1 , диссеминированная инфекция, вызванная этим возбудителем, возникает гораздо реже.
Mycobacterium avium-intracellulare — условно-патогенные микроорганизмы, которые обычно обнаруживаются в почве и воде. Наиболее частый источник заражения — загрязненная вода.
Как правило, диссеминированная диссеминированная инфекция, вызванная Mycobacterium avium-intracellulare (Mycobacterium avium complex) не имеет специфической клинической симптоматики. Большинство пациентов предъявляют жалобы на высокую лихорадку (более 40 °С), выраженную потерю массы тела (более 10% массы тела), диарею, боли в животе. При наличии подобной симптоматики у больного с ВИЧинфекцией с количеством CD4-лимфоцитов менее 100 клеток/мкл необходимо исключить микобактериоз. Возможно развитие очаговых поражений в виде лимфаденитов различной локализации (шейные, паховые, брюшные лимфатические узлы), остеомиелита (позвонков), артритов, поражений кожи. При ультразвуковом исследовании часто регистрируют увеличение размеров печени и селезенки.
Подтвердить диагноз микобактериоза можно на основании выделения Mycobacterium avium-intracellulare при посеве крови, пунктата костного мозга, биопсийного материала. Обнаружение микобактерий в кале, мокроте или бронхоальвеолярном лаваже при отсутствии клинической симптоматики может свидетельствовать только о колонизации слизистых. Терапию в таких случаях назначать нецелесообразно.
Пациентам показано назначение комплексной терапии, включающей макролиды (кларитромицин по 500 мг 2 раза в сутки или азитромицин по 600 мг 1 раз в сутки) в сочетании с этамбутолом (1200 мг/сут) и рифабутином (300 мг/сут). Продолжительность терапии, как правило, составляет не менее 6 мес.
При одновременном использовании АРВТ лечение микобактериоза можно прекратить после повышения количества CD4-лимфоцитов (более 100 клеток/мкл). Доза кларитромицина обычно не превышает 500 мг 2 раза в сутки. Вместо кларитромицина можно назначать азитромицин, который меньше влияет на систему цитохрома P-450. В качестве резервных препаратов применяют: амикацин (15 мг/кг в сутки внутривенно), фторхинолоны (левофлоксацин по 500 мг внутрь 1 раз в сутки, ципрофлоксацин по 500-750 мг внутрь 2 раза в сутки).
Существуют лекарственные взаимодействия кларитромицина и ряда АРВП: AUC (площадь под кривой) кларитромицина повышается при одновременном приеме с индинавиром (на 50%), ритонавиром (на 75%), ампренавиром (на 18%), лопинавиром/ритонавиром (на 77%), атазанавиром (на 94%), невирапином (на 26%) и саквинавиром (на 177%). При совместном приеме атазанавира и кларитромицина последний следует использовать в половинной дозе или назначить другой препарат, поскольку повышение концентрации кларитромицина увеличивает риск удлинения интервала Q-T на кардиограмме.
Одновременный прием кларитромицина и указанных выше АРВП не требует коррекции дозы кларитромицина, за исключением сочетания кларитромицина с лопинавиром/ритонавиром или ритонавиром у больных с почечной недостаточностью. Одновременный прием эфавиренза снижает концентрацию кларитромицина на 39%, поэтому целесообразно заменить его азитромицином.
Больным с ВИЧ-инфекцией при количестве CD4-лимфоцитов менее 50 клеток/мкл можно назначить профилактику микобактериозов макролидами (азитромицин по 1200 мг 1 раз в неделю) или рифабутином (ежедневно по 150 мг). При увеличении числа CD4-лимфоцитов более 100 клеток/мкл можно прекратить первичную профилактику (через 3 мес) и поддерживающую терапию (через 6 мес).
Развитие МАС-инфекции как проявление синдрома восстановления иммунитета
Клиническая симптоматика микобактериоза обычно развивается в течение первых 3 мес после начала АРВТ (в раде случаев синдром восстановления иммунитета наблюдают через 6-8 мес) у больных с исходно низким количеством CD4-лимфоцитов (менее 50 клеток/мкл) и хорошим вирусологическим и иммунологическим ответом на лечение (РНК ВИЧ 100 клеток/мкл). Как правило, клинические проявления МАС-инфекции включают лихорадку, увеличение лимфатических узлов шеи, средостения, брыжейки. Возможно развитие перикардита, остеомиелита, кожных абсцессов, бурситов, поражения ЦНС.
Терапевтическая тактика включает: продолжение АРВТ по прежней схеме, терапию МАС-инфекции, применение нестероидных противовоспалительных средств и в ряде случаев стероидов (преднизолон - по 20-40 мг/сут в течение 4-8 нед).
ВИЧ-инфекция и СПИД [Электронный ресурс] : национальное руководство / под ред. акад. РАМН В.В. Покровского. - М. : ГЭОТАР-Медиа, 2013.

1. Корнилова З.Х., Луконина И.В., Алексеева Л.П. Туберкулез в сочетании с ВИЧ-инфекцией // Туб. 2010. №3. С.3-9.
2. Оттен Т.Ф. Микобактериоз у больных с ВИЧ-инфекцией / В кн.: Беляков Н.А., Рахманова А.Г.(ред.). Вирус иммунодефицита человека-медицина. Гл.10.2. СПб.: Балтийский медицинский образовательный центр, 2011. С.199-224.
4. Adjemian J., Prevots D. R., Gallagher J. et al. Lack of adherence to evidence based treatment guidelines for nontuberculous mycobacterial lung disease. Ann. Am. Thorac. Soc. 2014. V. 11, № 1. Р. 9-16.
5. Andréjak C., Nielsen R., Thomsen V. et al. Chronic respiratory disease, inhaled corticosteroids and risk of non-tuberculous mycobacteriosis. Thorax. 2013. V. 68, № 3. Р. 256-262.
6. Brode S.K., Daley C.L., Marras T.K. The epidemiologic relationship between tuberculosis and non-tuberculous mycobacterial disease: a systematic review. Int. J. Tuberc. lung Dis. 2014. V. 18, № 11. Р. 1370-1377.
7. Daley C. L., Griffith D. E. Pulmonary non-tuberculous mycobacterial infections. Int. J. Tuberc. Lung. Dis. 2010. V. 14, № 6. Р. 665-671.
8. Griffith D. E., Aksamit T., Brown-Elliott B. A. et al. An official ATS/ IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med. 2007. V. 175, № 4. Р. 367-416.
К клиническим и рентгенологическим критериям для постановки диагноза микобактериоза согласно рекомендациям относятся: имеющиеся респираторные симптомы; обнаружение при рентгенографическом исследовании в легких очаговых или полостных изменений или наличие при компьютерной томографии множественных бронхоэктазов с мелкими очагами, при этом должна быть проведена дифференциальная диагностика в целях исключения других заболеваний, имеющих сходную рентгенологическую картину.
К микробиологическим критериям микобактериоза относятся:
– наличие в двух и более независимо взятых образцах мокроты нетуберкулезных микобактерий;
– не менее одного положительного результата культурального исследования материала, полученного при проведении бронхоскопии (бронхоальвеолярный лаваж [БАЛ] или промывные воды бронхов);
– морфологические изменения в тканях и органах (наличие гранулематозного воспаления или обнаружение кислотоустойчивых бактерий) и наличие роста культуры НТМБ этой ткани или не менее из одного образца БАЛ / промывных вод бронхов или мокроты,
или все вышеперечисленные критерии. В настоящее время этот вопрос является дискуссионным и широко обсуждается.
Цель исследования – изучить особенности клинических проявлений и диагностики микобактериозов у лиц, живущих с ВИЧ-инфекцией.
Результаты исследования и их обсуждение
Клиническое наблюдение 1
Пациентка Ш. (35 лет). Туберкулезом раньше не болела. Наблюдалась в Центре по борьбе со СПИД в течение 10 лет (4В стадия), получала антиретровирусную терапию. В июле 2018 г. перенесла пневмоцистную пневмонию, лечилась в стационаре, выписана с улучшением. В начале ноября состояние вновь ухудшилось, госпитализирована в стационар Центра по борьбе со СПИД. При обследовании на рентгенограмме легких выявлена патология, в мокроте обнаружены кислотоустойчивые микобактерии (КУМ), в связи с чем переведена в противотуберкулезный диспансер (ПТД) для исключения туберкулеза.
При поступлении в ПТД 22.11.2018 жалобы на кашель со слизистой мокротой до 50 мл в сутки, одышку при незначительной физической нагрузке, слабость, повышение температуры тела до 37оС, похудение на 4 кг за последний месяц. Общее состояние средней тяжести, пониженного питания, кожные покровы бледные. Дыхание жесткое с бронхиальным оттенком, гудящие хрипы в нижних отделах легких. ЧДД 24 в минуту. АД 90/55 мм рт. ст. Печень выступает на 7 см из-под подреберья.
Общий анализ крови: гемоглобин – 75 г/л; эритроциты – 2,9х1012/л; цветной показатель – 0,75; лейкоциты – 15,4х109/л; эозинофилы – 1; палочкоядерные – 16; сегментоядерные – 74; лимфоциты – 3; моноциты – 6; СОЭ – 57 мм/ч.
Общий анализ мочи: удельный вес – 1024; белок – 0,3; эритроциты – 1–2; лейкоциты – 5–6; цилиндры – 3–4.
Количество СD4+ лимфоцитов – 42 клетки/мкл.
В мокроте методом люминесцентной микроскопии выявлены кислотоустойчивые микобактерии КУМ (+) от 21.11.2018, 23.11.2018, 27.11.2018.
В мокроте методом ПЦР РВ от 26.11.2010 ДНК МБТ не выявлены; ПЦР Дженэксперт от 23.11.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 23.11.2018, 26.11.2018 НТМБ(+). Иммунохроматографический тест на микобактерии туберкулеза TBAgMRT64 Rapid – отрицательный. Реакция на Диаскинтест отрицательная.
УЗИ органов брюшной полости: УЗ-признаки гепатоспленомегалии, диффузных изменений печени и поджелудочной железы.
Фибробронхоскопия: слева бронхи без особенностей. В просвете среднедолевого бронха (СДБ) справа густая слизисто-гнойная мокрота. По задней стенке СДБ с переходом на латеральную изъязвление, дно которого покрыто густыми массами белого цвета. Вокруг слизистая отечна, гиперемирована. Множество бугорков. За счет этих изменений БС4 сужено почти наполовину. Выше слизистая незначительно отечна. Шпора СДБ острая.
Гистологическое исследование биопсийного материала: в биоптате мелкие кусочки некротического детрита и фрагменты неспецифической грануляционной ткани с диффузной лимфоцитарной и нейтрофильной инфильтрацией, обилие мелких кровеносных сосудов.
При окраске по Цилю–Нильсену КУМ не определяются.
Заключение: морфологическая картина неспецифического воспаления.
На обзорной рентгенограмме органов грудной клетки в прямой и правой боковой проекции определяются массивное неоднородное инфильтративное затенение в средней доле правого легкого с четкой границей по междолевой борозде, неоднородное инфильтративное затенение в проекции 9-го сегмента левого легкого. Корни расширены. Тень средостения смещена влево (рис. 1, 2).
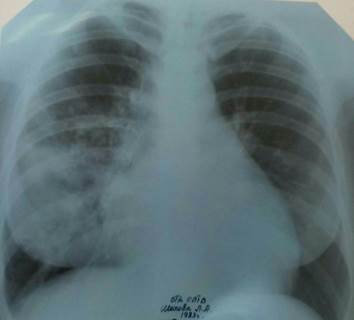
Рис. 1. Обзорная рентгенограмма органов грудной клетки в прямой проекции больной Ш.

Рис. 2. Обзорная рентгенограмма органов грудной клетки в правой боковой проекции больной Ш.
Мультиспиральная компьютерная томография органов грудной полости: в верхних и средних долях правого легкого массивная инфильтрация, участки консолидации в S8 нижней доли. Множественные полиморфные очаги по всем полям, больше справа. Часть из них с деструкцией. Лимфатические узлы гиперплазированы до 12–14 мм. Сердце обычных размеров, в перикарде жидкость, толщина слоя 12 мм. Дегенеративные изменения позвоночника. Костно-деструктивных изменений не выявлено.
Таким образом, у больной были типичные клинические проявления микобактериоза: кашель, одышка, лихорадка, потеря веса, анемия. Имелись рентгенологические изменения в легких в виде фокусов и очагов и поражение внутригрудных лимфатических узлов. Диагноз верифицирован бактериологическим методом исследования мокроты (рост НТМБ в двух анализах мокроты методом ВАСТЕК).
Клиническое наблюдение 2
Пациентка М., 32 года. Из анамнеза известно, что туберкулезом раньше не болела, наблюдается в Центре по борьбе со СПИД с 2008 г. (4В стадия), получает автиретровирусную терапию (АРВТ). В августе 2018 г. перенесла менингоэнцефалит. Состояние ухудшилось в октябре 2018 г., когда стали беспокоить кашель, общая слабость, плохой аппетит. Была госпитализирована в стационар. В легких при рентгенологическом исследовании выявлена патология. Больной была назначена антибактериальная терапия. При исследовании мокроты получили КУМ(+) методом люминесцентной микроскопии. Для исключения туберкулеза пациентка направлена в противотуберкулезный диспансер.
При поступлении в противотуберкулезный диспансер: состояние относительно удовлетворительное. Кожные покровы чистые, бледные. В легких дыхание аускультативно жесткое, хрипы не выслушиваются. ЧДД – 18 в минуту. Тоны сердца ритмичные ЧСС – 78 ударов в минуту, АД 100/65 мм рт. ст. Язык влажный, с белым налетом. Живот мягкий, безболезненный.
Общий анализ крови от 28.11.2018: гемоглобин – 130 г/л; эритроциты – 3,8х10/л; цветной показатель – 1,0; лейкоциты – 8,5х109/л; эозинофилы – 2%; палочкоядерные – 3%; сегментоядерные – 76%; лимфоциты – 8%; моноциты – 11%; СОЭ – 33 мм/ч.
Общий анализ мочи от 28.11.2018: уд. вес – 1020; белок – 0,19 г/л; лейкоциты – 1–3 в поле зрения.
Количество СD4+ лимфоцитов 101 клетка/мкл от 27.11.2018.
В мокроте КУМ (+) от 28.11.2018, 05.12.2018, 06.12.2018, 14.12.2018, 18.12.2018 методом люминесцентной микроскопии.
В мокроте методом ПЦР-РВ от 04.12.2018, 20.12.2018 ДНК МБТ не выявлены.
ПЦР Дженэксперт от 03.12.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 05.12.2018, 06.12.2018 НТМБ(+). Иммунохроматографический тест на МБТ TBAgMRT64 Rapid – отрицательный.
Реакция на Диаскинтест – отрицательная.
Фибробронхоскопия № 1: слева устье нижнедолевого бронха сужено до почти щелевидного за счет бугристой опухоли с густым налетом некроза белого цвета.
Биопсия № 1: в собственном слое слизистой обилие мелких кровеносных сосудов и диффузная воспалительная инфильтрация лимфоидного и нейтрофильного характера, на фоне которого определяются мелкие нечеткие эпителиоидно-клеточные гранулемы. При окраске по Цилю–Нильсену КУМ не определяются.
Фибробронхоскопия № 2: устье верхнедолевого бронха справа полностью стенозировано бугристой опухолью с густым налетом фибрина белого цвета.
Биопсия № 2: в биоптате – мелкие фрагменты слизистой, местами покрытые многослойным плоским эпителием, местами – слоем некротического детрита. В слизистой – диффузная нейтрофильная и лимфоцитарная инфильтрация, на фоне которой местами определяются нечеткие мелкие эпителиоидно-клеточные гранулемы. В центре некоторых гранулем – скопление ядерного детрита. При окраске по Цилю–Нильсену КУМ не обнаружены.
МСКТ ОГК: в верхней доле S1, S2 справа и нижней доле S6 и базальной пирамиде левого легкого определяются очаговые изменения, деструкция четко не видна. Гиперплазированы бронхопульмональные лимфатические узлы. Средостение структурно не смещено.
В представленном случае клинические проявления микобактериоза (кашель, общая слабость, потеря веса) были мало выраженными. Это можно объяснить количеством СД4+ лимфоцитов (101 кл/мкл). Диагноз микобактериоза поставлен своевременно благодаря бактериоскопическому исследованию мокроты больной, консультации фтизиатра и комплексу обследований в противотуберкулезном диспансере.
1. В настоящее время наблюдается рост заболеваемости микобактериозами у лиц, живущих с ВИЧ-инфекцией. Для своевременного выявления микобактериозов у врачей различных специальностей должна быть настороженность.
2. Диагноз микобактериоза следует устанавливать на основании комплексного клинико-рентгенологического и микробиологического обследования. Главными критериями при постановке данного диагноза должны быть выделение культуры НТМБ и гистологическая верификация.
Медицинская микробиология:
Туберкулез и другие микобактериальные инфекции при ВИЧ и СПИД
Увеличение числа пациентов с поздними стадиями ВИЧ-инфекции в РФ приводит к тому, что все у большего числа этих больных, инфицированных микобактериями туберкулеза (МВТ), развивается туберкулез. Только за последние годы число больных с вновь выявленным туберкулезом, сочетанным с ВИЧ-инфекцией, увеличилось с 1407 (2004 г.) до 9253 (2009 г.). При этом туберкулез в 66,5% случаев стал основной непосредственной причиной смерти умерших от ВИЧ-инфекции.
Европейское региональное бюро ВОЗ относит Россию к числу стран с наиболее неблагоприятной ситуацией по туберкулезу, сочетанному с ВИЧ-инфекцией.
Прогноз дальнейшего распространения туберкулеза крайне неблагоприятен. Предпосылкой к этому служат высокая инфицированность населения МВТ, распространение ВИЧ преимущественно среди граждан из групп высокого риска заболевания туберкулезом (наркозависимые, лица, находящиеся в учреждениях СИН). Среди этого контингента также высока распространенность микобактерий с множественной лекарственной устойчивостью к противотуберкулезным препаратам.
У большинства здоровых людей, заразившихся МВТ, не развивается активного заболевания. Но ВИЧ-инфекция, поражая иммунную систему, создает условия для развития туберкулезного процесса и его перехода в активную форму. Чаще всего МВТ поражает легкие, но может вызвать поражения мозговых оболочек, мозга, костей, лимфатической системы и почек. В настоящее время в России среди больных ВИЧ-инфекцией и туберкулезом в 80% случаев регистрируются ранние стадии ВИЧ-инфекции, а в 20% — поздние. Туберкулез является причиной госпитализации более 60% больных на стадии ВИЧ-инфекции. У них чаще регистрируют генерализованный туберкулез (54%); у 35% — легочный, у 11% — внелегочный. При тяжелом угнетении иммунитета даже легочный туберкулез часто протекает атипично (например, реже наблюдается типичная локализация процесса в верхушках легких). Приблизительно у 1/3 больных поражаются лимфатические узлы, чаще шейные, подмышечные, внутригрудные, несколько реже паховые. Шейные лимфатические узлы увеличиваются уже через 2-4 недели от начала заболевания. Развитие туберкулеза у ВИЧ-инфицированных по мере болезни часто сопровождается уменьшением размеров периферических лимфатических узлов (если они были увеличены). Поэтому повторное их увеличение (или первичное увеличение у больных без лимфаденонатии) может указывать на вероятное развитие туберкулеза.
Проявления туберкулеза, когда количество лимфоцитов еще остается достаточно высоким, могут ничем не отличаться от клинической и рентгенологической картины у больных без ВИЧ-инфекции. На этом этапе у больных доминируют обычные проявления легочного туберкулеза: развиваются верхнедолевые инфильтративные и, реже, очаговые процессы, часто с распадом. Специфическая терапия туберкулеза в этой фазе ВИЧ-инфекции достаточно эффективна.
По мере снижения количества CD4-лимфоцитов у ВИЧ-инфицированных лиц наряду с легочными поражениями, вызванными микобактериями, часто обнаруживают внелегочную локализацию туберкулеза. При этом отмечают отрицательные кожные реакции на туберкулин, как проявление анергии, атипичные изменения на рентгенограммах легких и относительную редкость образования каверн. На стадии СПИДа развиваются наиболее тяжелые формы туберкулеза: сочетание легочной и внелегочной локализаций, менингит, генерализованный процесс. Изменения в легких отличаются более частым развитием прикорневой лимфаденопатии, милиарными высыпаниями, наличием преимущественно интерстициальных изменений и образованием плеврального выпота. Верхние отделы легких поражаются реже, характерные для туберкулеза каверны и ателектазы также редки. На рентгенограмме легких выявляют диффузные сливающиеся инфильтративные изменения, протекающие по типу казеозной пневмонии. Развитие генерализованных форм туберкулеза у ряда больных может сопровождаться развитием септического шока. Нарушения обмена, характерные для больных СПИДом, еще более изменяют характер течения и проявления туберкулеза. При этом процесс очень быстро прогрессирует, лечение редко бывает эффективным.
Туберкулез на фоне СПИДа часто сочетается с другими оппортунистическими заболеваниями, такими как пневмоцистная пневмония, цитомегаловирусная пневмония, саркома Калоши и др.
У больных на поздних стадиях ВИЧ-инфекции лечение необходимо сочетать с ВААРТ (обычно начинают противотуберкулезную терапию, а в последующем через 1-3 недели добавляют антиретровирусные препараты).
Инфекции, вызванные другими микобактериями при ВИЧ и СПИД
У больных ВИЧ-инфекцией на стадии СПИДа основными этиологическими факторами развития диссеминированного микобактериального процесса, кроме М. tuberculosis, являются нетуберкулезные микобактерии, которые ранее были известны как возбудители хронических медленно прогрессирующих легочных заболеваний у людей с предшествующими поражениями легких (например, с эмфиземой легких). К ним относятся М. avium, М. intracellulare, М. kansasii, М. fortuitum, М. xenopi и др. Основную часть (до 90%) составляют М. avium и М. intracellularе, которые объединены в группу М. avium-complex (MAC). У больных с ВИЧ-инфекцией диссеминированные процессы, обусловленные М. avium, встречаются значительно чаще, чем вызванные М. intracellulare. Указанные микроорганизмы имеют эндемичное распространение среди водоплавающих птиц и широко распространены в окружающей среде — воде и почве. Эти микобактериозы неконтагиозны. Заражение человека происходит либо аэрогенным путем, либо через желудочно-кишечный тракт или поврежденные кожные покровы. Эти микобактерии менее вирулентны, чем М. tuberculosis, и для развития заболевания требуется значительное подавление иммунной системы. Диссеминированная МАС-инфекция развивается, как правило, уже на поздних стадиях ВИЧ-инфекции (перехода в СПИД), вслед за другими вторичными поражениями.
До начала широкого применения антиретровирусной терапии развитие инфекции, вызванной микобактериями, диагностировали почти у 40% больных ВИЧ-инфекцией на стадии СПИДа. У большинства больных заболевание развивается при содержании CD4-клеток менее 0,5х10 9 /л. Эти поражения протекают обычно в виде диссеминированного заболевания и характеризуются неспецифическими проявлениями генерализованной инфекции — лихорадкой (более 40°С), диареей, увеличением паренхиматозных органов, развитием кахексии, в ряде случаев ночными потами. Возможно развитие очаговых поражений в виде лимфаденитов различной локализации (шейные, паховые, брюшные лимфоузлы), остеомиелита (позвонков), артритов, поражений кожи. При ультразвуковом исследовании часто регистрируют увеличение размеров печени и селезенки. При наличии микобактериозов у пациентов выявляют анемию, лейкоцитопению, тромбоцитопению, обнаруживают повышение активности щелочной фосфатазы (ЩФ). Предположение о микобактериальной этиологии заболевания обычно возникает при исключении других оппортунистических поражений у иммунокомпрометированных больных.
Подтвердить диагноз микобактериоза можно на основании выделения М. aviumintracellulare из крови, пунктата костного мозга, биопсийного материала. Обнаружение микобактерий в кале, мокроте или бронхоальвеолярном лаваже при отсутствии клинической симптоматики может свидетельствовать только о колонизации микобактериями слизистых оболочек.
Пациентам показано назначение комплексной терапии, включающей макролиды (кларитромицин или азитромицин) в сочетании с этамбутолом и рифабутином. Азитромицин предпочтительней, так как меньше влияет на систему цитохрома Р450. В качестве резервных препаратов применяют амикацин, фторхинолоны (левофлоксацин, ципрофлоксацин) и клофазимин. Продолжительность терапии, как правило, составляет не менее 6 месяцев. При одновременном использовании ВААРТ лечение микобактериоза можно прекратить после повышения количества CD4 + -лимфоцитов (более 100 клеток/мкл).
Профилактика микобактериоза проводится у пациентов при числе CD4-лимфоцитов менее 0,05 х 10 9 /л (рифабутин, азитромицин, кларитромицин).

1. Корнилова З.Х., Луконина И.В., Алексеева Л.П. Туберкулез в сочетании с ВИЧ-инфекцией // Туб. 2010. №3. С.3-9.
2. Оттен Т.Ф. Микобактериоз у больных с ВИЧ-инфекцией / В кн.: Беляков Н.А., Рахманова А.Г.(ред.). Вирус иммунодефицита человека-медицина. Гл.10.2. СПб.: Балтийский медицинский образовательный центр, 2011. С.199-224.
4. Adjemian J., Prevots D. R., Gallagher J. et al. Lack of adherence to evidence based treatment guidelines for nontuberculous mycobacterial lung disease. Ann. Am. Thorac. Soc. 2014. V. 11, № 1. Р. 9-16.
5. Andréjak C., Nielsen R., Thomsen V. et al. Chronic respiratory disease, inhaled corticosteroids and risk of non-tuberculous mycobacteriosis. Thorax. 2013. V. 68, № 3. Р. 256-262.
6. Brode S.K., Daley C.L., Marras T.K. The epidemiologic relationship between tuberculosis and non-tuberculous mycobacterial disease: a systematic review. Int. J. Tuberc. lung Dis. 2014. V. 18, № 11. Р. 1370-1377.
7. Daley C. L., Griffith D. E. Pulmonary non-tuberculous mycobacterial infections. Int. J. Tuberc. Lung. Dis. 2010. V. 14, № 6. Р. 665-671.
8. Griffith D. E., Aksamit T., Brown-Elliott B. A. et al. An official ATS/ IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med. 2007. V. 175, № 4. Р. 367-416.
К клиническим и рентгенологическим критериям для постановки диагноза микобактериоза согласно рекомендациям относятся: имеющиеся респираторные симптомы; обнаружение при рентгенографическом исследовании в легких очаговых или полостных изменений или наличие при компьютерной томографии множественных бронхоэктазов с мелкими очагами, при этом должна быть проведена дифференциальная диагностика в целях исключения других заболеваний, имеющих сходную рентгенологическую картину.
К микробиологическим критериям микобактериоза относятся:
– наличие в двух и более независимо взятых образцах мокроты нетуберкулезных микобактерий;
– не менее одного положительного результата культурального исследования материала, полученного при проведении бронхоскопии (бронхоальвеолярный лаваж [БАЛ] или промывные воды бронхов);
– морфологические изменения в тканях и органах (наличие гранулематозного воспаления или обнаружение кислотоустойчивых бактерий) и наличие роста культуры НТМБ этой ткани или не менее из одного образца БАЛ / промывных вод бронхов или мокроты,
или все вышеперечисленные критерии. В настоящее время этот вопрос является дискуссионным и широко обсуждается.
Цель исследования – изучить особенности клинических проявлений и диагностики микобактериозов у лиц, живущих с ВИЧ-инфекцией.
Результаты исследования и их обсуждение
Клиническое наблюдение 1
Пациентка Ш. (35 лет). Туберкулезом раньше не болела. Наблюдалась в Центре по борьбе со СПИД в течение 10 лет (4В стадия), получала антиретровирусную терапию. В июле 2018 г. перенесла пневмоцистную пневмонию, лечилась в стационаре, выписана с улучшением. В начале ноября состояние вновь ухудшилось, госпитализирована в стационар Центра по борьбе со СПИД. При обследовании на рентгенограмме легких выявлена патология, в мокроте обнаружены кислотоустойчивые микобактерии (КУМ), в связи с чем переведена в противотуберкулезный диспансер (ПТД) для исключения туберкулеза.
При поступлении в ПТД 22.11.2018 жалобы на кашель со слизистой мокротой до 50 мл в сутки, одышку при незначительной физической нагрузке, слабость, повышение температуры тела до 37оС, похудение на 4 кг за последний месяц. Общее состояние средней тяжести, пониженного питания, кожные покровы бледные. Дыхание жесткое с бронхиальным оттенком, гудящие хрипы в нижних отделах легких. ЧДД 24 в минуту. АД 90/55 мм рт. ст. Печень выступает на 7 см из-под подреберья.
Общий анализ крови: гемоглобин – 75 г/л; эритроциты – 2,9х1012/л; цветной показатель – 0,75; лейкоциты – 15,4х109/л; эозинофилы – 1; палочкоядерные – 16; сегментоядерные – 74; лимфоциты – 3; моноциты – 6; СОЭ – 57 мм/ч.
Общий анализ мочи: удельный вес – 1024; белок – 0,3; эритроциты – 1–2; лейкоциты – 5–6; цилиндры – 3–4.
Количество СD4+ лимфоцитов – 42 клетки/мкл.
В мокроте методом люминесцентной микроскопии выявлены кислотоустойчивые микобактерии КУМ (+) от 21.11.2018, 23.11.2018, 27.11.2018.
В мокроте методом ПЦР РВ от 26.11.2010 ДНК МБТ не выявлены; ПЦР Дженэксперт от 23.11.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 23.11.2018, 26.11.2018 НТМБ(+). Иммунохроматографический тест на микобактерии туберкулеза TBAgMRT64 Rapid – отрицательный. Реакция на Диаскинтест отрицательная.
УЗИ органов брюшной полости: УЗ-признаки гепатоспленомегалии, диффузных изменений печени и поджелудочной железы.
Фибробронхоскопия: слева бронхи без особенностей. В просвете среднедолевого бронха (СДБ) справа густая слизисто-гнойная мокрота. По задней стенке СДБ с переходом на латеральную изъязвление, дно которого покрыто густыми массами белого цвета. Вокруг слизистая отечна, гиперемирована. Множество бугорков. За счет этих изменений БС4 сужено почти наполовину. Выше слизистая незначительно отечна. Шпора СДБ острая.
Гистологическое исследование биопсийного материала: в биоптате мелкие кусочки некротического детрита и фрагменты неспецифической грануляционной ткани с диффузной лимфоцитарной и нейтрофильной инфильтрацией, обилие мелких кровеносных сосудов.
При окраске по Цилю–Нильсену КУМ не определяются.
Заключение: морфологическая картина неспецифического воспаления.
На обзорной рентгенограмме органов грудной клетки в прямой и правой боковой проекции определяются массивное неоднородное инфильтративное затенение в средней доле правого легкого с четкой границей по междолевой борозде, неоднородное инфильтративное затенение в проекции 9-го сегмента левого легкого. Корни расширены. Тень средостения смещена влево (рис. 1, 2).

Рис. 1. Обзорная рентгенограмма органов грудной клетки в прямой проекции больной Ш.

Рис. 2. Обзорная рентгенограмма органов грудной клетки в правой боковой проекции больной Ш.
Мультиспиральная компьютерная томография органов грудной полости: в верхних и средних долях правого легкого массивная инфильтрация, участки консолидации в S8 нижней доли. Множественные полиморфные очаги по всем полям, больше справа. Часть из них с деструкцией. Лимфатические узлы гиперплазированы до 12–14 мм. Сердце обычных размеров, в перикарде жидкость, толщина слоя 12 мм. Дегенеративные изменения позвоночника. Костно-деструктивных изменений не выявлено.
Таким образом, у больной были типичные клинические проявления микобактериоза: кашель, одышка, лихорадка, потеря веса, анемия. Имелись рентгенологические изменения в легких в виде фокусов и очагов и поражение внутригрудных лимфатических узлов. Диагноз верифицирован бактериологическим методом исследования мокроты (рост НТМБ в двух анализах мокроты методом ВАСТЕК).
Клиническое наблюдение 2
Пациентка М., 32 года. Из анамнеза известно, что туберкулезом раньше не болела, наблюдается в Центре по борьбе со СПИД с 2008 г. (4В стадия), получает автиретровирусную терапию (АРВТ). В августе 2018 г. перенесла менингоэнцефалит. Состояние ухудшилось в октябре 2018 г., когда стали беспокоить кашель, общая слабость, плохой аппетит. Была госпитализирована в стационар. В легких при рентгенологическом исследовании выявлена патология. Больной была назначена антибактериальная терапия. При исследовании мокроты получили КУМ(+) методом люминесцентной микроскопии. Для исключения туберкулеза пациентка направлена в противотуберкулезный диспансер.
При поступлении в противотуберкулезный диспансер: состояние относительно удовлетворительное. Кожные покровы чистые, бледные. В легких дыхание аускультативно жесткое, хрипы не выслушиваются. ЧДД – 18 в минуту. Тоны сердца ритмичные ЧСС – 78 ударов в минуту, АД 100/65 мм рт. ст. Язык влажный, с белым налетом. Живот мягкий, безболезненный.
Общий анализ крови от 28.11.2018: гемоглобин – 130 г/л; эритроциты – 3,8х10/л; цветной показатель – 1,0; лейкоциты – 8,5х109/л; эозинофилы – 2%; палочкоядерные – 3%; сегментоядерные – 76%; лимфоциты – 8%; моноциты – 11%; СОЭ – 33 мм/ч.
Общий анализ мочи от 28.11.2018: уд. вес – 1020; белок – 0,19 г/л; лейкоциты – 1–3 в поле зрения.
Количество СD4+ лимфоцитов 101 клетка/мкл от 27.11.2018.
В мокроте КУМ (+) от 28.11.2018, 05.12.2018, 06.12.2018, 14.12.2018, 18.12.2018 методом люминесцентной микроскопии.
В мокроте методом ПЦР-РВ от 04.12.2018, 20.12.2018 ДНК МБТ не выявлены.
ПЦР Дженэксперт от 03.12.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 05.12.2018, 06.12.2018 НТМБ(+). Иммунохроматографический тест на МБТ TBAgMRT64 Rapid – отрицательный.
Реакция на Диаскинтест – отрицательная.
Фибробронхоскопия № 1: слева устье нижнедолевого бронха сужено до почти щелевидного за счет бугристой опухоли с густым налетом некроза белого цвета.
Биопсия № 1: в собственном слое слизистой обилие мелких кровеносных сосудов и диффузная воспалительная инфильтрация лимфоидного и нейтрофильного характера, на фоне которого определяются мелкие нечеткие эпителиоидно-клеточные гранулемы. При окраске по Цилю–Нильсену КУМ не определяются.
Фибробронхоскопия № 2: устье верхнедолевого бронха справа полностью стенозировано бугристой опухолью с густым налетом фибрина белого цвета.
Биопсия № 2: в биоптате – мелкие фрагменты слизистой, местами покрытые многослойным плоским эпителием, местами – слоем некротического детрита. В слизистой – диффузная нейтрофильная и лимфоцитарная инфильтрация, на фоне которой местами определяются нечеткие мелкие эпителиоидно-клеточные гранулемы. В центре некоторых гранулем – скопление ядерного детрита. При окраске по Цилю–Нильсену КУМ не обнаружены.
МСКТ ОГК: в верхней доле S1, S2 справа и нижней доле S6 и базальной пирамиде левого легкого определяются очаговые изменения, деструкция четко не видна. Гиперплазированы бронхопульмональные лимфатические узлы. Средостение структурно не смещено.
В представленном случае клинические проявления микобактериоза (кашель, общая слабость, потеря веса) были мало выраженными. Это можно объяснить количеством СД4+ лимфоцитов (101 кл/мкл). Диагноз микобактериоза поставлен своевременно благодаря бактериоскопическому исследованию мокроты больной, консультации фтизиатра и комплексу обследований в противотуберкулезном диспансере.
1. В настоящее время наблюдается рост заболеваемости микобактериозами у лиц, живущих с ВИЧ-инфекцией. Для своевременного выявления микобактериозов у врачей различных специальностей должна быть настороженность.
2. Диагноз микобактериоза следует устанавливать на основании комплексного клинико-рентгенологического и микробиологического обследования. Главными критериями при постановке данного диагноза должны быть выделение культуры НТМБ и гистологическая верификация.
Читайте также:

