Цефалоспорин для лечения инфекции дыхательных путей
Обновлено: 14.05.2024
Рассмотрены принципы назначения антибактериальных препаратов при бактериальных инфекциях ЛОР-органов. Показана эффективность применения цефиксима в амбулаторной педиатрической практике в качестве стартового препарата.
Principles of antibacterial preparations prescription in bacterial infections of ENT-organs were considered. The efficiency of cifixim inoutpatient pediatric practice as a start preparation was shown.
Острые воспалительные заболевания ЛОР-органов лидируют по обращаемости за медицинской помощью и назначению антимикробных (в том числе и антибактериальных препаратов). Ведущее место в их структуре занимают риносинусит и острый средний отит (особенно у детей первых лет жизни) [1–4]. Из года в год ведущими бактериальными агентами для этих заболеваний у детей признаются Streptococcus pneumoniae и Haemophilus influenzae, несколько реже встречаются Sreptococcus pyogenes, Moraxella catarrhalis [2–9]. Последние исследования подтверждают ведущую роль Streptococcus pneumoniae и при острых [2, 3, 9, 11], и при рецидивирующих средних отитах [9–11].
Основные принципы назначения антибактериальных препаратов при данной патологии представлены в табл. 1.
Кроме того, в выборе стартового препарата для антибактериальной терапии при острых воспалительных заболеваниях ЛОР-органов следует учитывать региональные данные о спектре и чувствительности бактериальных возбудителей к антибактериальным препаратам и путь введения препарата (на этапе амбулаторного лечения основу терапии должны составлять пероральные препараты с высокой биодоступностью). В противном случае, при нерациональном подходе к подбору антибиотика, велик риск формирования резистентности микроорганизмов и хронизации течения воспалительных процессов ЛОР-органов.
В настоящее время основными препаратами в терапии гнойно-воспалительных заболеваний ЛОР-органов с пероральным путем введения является группа β-лактамов. Наиболее распространены среди них: аминопенициллины и цефалоспорины. При аллергии на β-лактамные антибиотики к применению ранее рекомендовались макролиды (азитромицин, кларитромицин) [3, 5, 11, 12], однако, согласно последней версии рекомендаций Американской академии пародонтологов (American Academy of Periodontology, AAP)/Американской академии семейных врачей (American Academy of Family Physications, AAFP) (2013) [9], пациентам с острым средним отитом (ОСО) рекомендуется при наличии в анамнезе IgE-опосредованных аллергических реакций на пенициллины назначать цефалоспорины, достоинствами которых является высокая избирательность действия на прокариотическую клетку и связанная с этим безопасность применения у новорожденных и беременных, меньший аллергенный потенциал по сравнению с пенициллинами и быстрое бактерицидное действие. Особенно хорошо зарекомендовали себя пероральные цефалоспорины III поколения как препараты с удобным режимом дозирования (1–2 раза в сутки), а также высоким уровнем антибактериальной активности по сравнению с цефалоспоринами предыдущих поколений в отношении пенициллинорезистентных пневмококков, Haemophilus influenzae и Moraxella catarrhalis. Их достоинствами являются особенности фармакокинетики, позволяющие сохранять высокие концентрации действующего вещества в слизистой оболочке околоносовых пазух. Механизм бактерицидного действия цефалоспоринов связан с нарушением процесса образования клеточной стенки бактерий. Мишень их действия, как у всех β-лактамных антибиотиков, — пенициллиносвязывающие белки, которые выполняют важную роль на завершающем этапе синтеза пептидогликана — биополимера, являющегося основным и обязательным компонентом клеточной стенки бактерий. Поэтому почти все микроорганизмы, имеющие клеточную стенку, чувствительны к действию цефалоспоринов [14]. До недавнего времени цефалоспорины были представлены в основом парентеральными формами и получили широкое применение на этапе стационарного лечения. В настоящее время появились препараты этой группы и для перорального применения, одним из которых является цефиксим (Супракс).
Цефиксим разрешен к применению у детей с 6 месяцев, характеризуется широким спектром действия и высокой активностью в отношении основных бактериальных возбудителей ЛОР-патологии (в том числе штаммов Haemophilus influenzae, устойчивых к аминопенициллинам и цефалоспоринам I поколения), а также обладает активностью в отношении бактерий семейства Enterobacteriaceae.
В последнее время все чаще упоминаются возможные взаимодействия между различными патогенами. Так, например, Moraxella catarrhalis способствует усилению адгезии пиогенного стрептококка (β-гемолитического стрептококка группы А (БГСА)) к клеткам эпителия дыхательных путей (ко-адгезия) [15, 16]. Цефиксим элиминирует M. сatarrhalis, тем самым обеспечивая высокую степень эрадикации пиогенного стрептококка (количество (КОЕ) S. pyogenus, адгезированных к эпителию носоглотки, снижается в 10 раз) [15], что позволяет рекомендовать его не только при РС/ОСО, но и при тонзиллофарингитах (ТФ), так и сам цефиксим обладает высокой активностью непосредственно против БГСА. Напомним, что основным показанием к назначению антибактериального препарата при ТФ является выделение БГСА [3, 5]. Этот возбудитель выявляется и как ведущий бактериальный агент при остром среднем гнойном отите у детей, занимая второе место (13,7%) после Streptococcus pneumoniae (47,7%) (О. В. Бугайчук, Е. Ю. Радциг, Е. П. Селькова 2014).
Цефиксим (Супракс) не подавляет рост условно-патогенной микрофлоры (например, альфа-гемолитического стрептококка), в норме присутствующей на слизистой верхних дыхательных путей, предотвращая колонизацию/инфекцию носоглотки истинными патогенами (S. pneumoniae, H. influenzae, S. aureus, пиогенный стрептококк).
Эффективность препарата оценивалась неоднократно [14, 18–22], приведем результаты одного из последних ретроспективных анализов данных по эффективности и безопасности цефиксима у детей с различной ЛОР-патологией, ставившего задачей оценку эффективности и безопасности препарата Супракс (цефиксим) в рутинной педиатрической практике. Критерии включения и исключения представлены в табл. 2.
Под наблюдением находился 61 пациент с различной инфекционной патологией ЛОР-органов, среди них (рис. 1):
- 34 (55,7%) пациентов с различными формами острого среднего отита;
- 21 (34,4%) пациентов с различными формами риносинусита;
- 6 (9,9%) пациентов с различными формами тонзиллита/тонзилофарингита.
Всем пациентам было показано назначение антибактериальной терапии, в качестве стартового препарата был выбран цефиксим (Cупракс), назначенный в соответствии с инструкцией: детям в возрасте от 6 месяцев до 12 лет назначали суспензию в дозе 8 мг/кг/сутки (по цефиксиму: рекомендуемая продолжительность приема препарата — 7 дней (РС/ОСО) — 10 дней (ТФ)).
Оценка применения препарата Супракс (цефиксим) в группе пациентов с различными формами острого среднего отита (34 (55,7%) пациента)
Из 34 пациентов у 11 (32,4%) были различные стадии гнойного среднего отита (перфоративная у 7 пациентов и доперфоративная — у 4). У 23 (67,7%) пациентов диагностирован катаральный средний отит. Возраст пациентов варьировал от 1 до 12 лет, средний возраст составил 5,6 года, преобладали мальчики (22 пациента (64,7%)). Длительность симптоматики до обращения к врачу составила 1–4 дня, в среднем первый визит к врачу состоялся на 2,5 день от появления первых симптомов. Характер течения заболевания был оценен как острый и тяжесть течения заболевания как среднетяжелая у всех 34 пациентов. Выздоровление фиксировалось на 5–8 день от начала лечения. Средняя продолжительность приема препарата цефиксим (Супракс) составила 6,7 дней.
Не было эффекта от проводимого лечения, включающего прием препарата цефиксим (Супракс), у 3 (8,82%) пациентов с неперфоративной формой среднего гнойного отита. Эти пациенты были госпитализированы в стационар, где им был проведен парацентез.
Оценка применения препарата Супракс (цефиксим) в группе пациентов с различными формами острого риносинусита (21 (34,4%) пациент)
В данной группе была выявлена следующая патология:
- двусторонний гайморит — 14 (66,7%);
- двусторонний острый гайморит, левосторонний этмоидит — 1 (4,8%);
- двусторонний острый этмоидит — 1 (4,8%);
- двусторонний острый гаймороэтмоидит — 1 (4,8%);
- двусторонний гайморит, правосторонний фронтит — 1 (4,8%);
- риносинусит (не проводилось рентгенологическое исследование) — 3 (14,3%).
Возраст пациентов варьировал от 3 до 11 лет, средний возраст — 5,6 года. Среди пациентов было 15 (71,4%) мальчиков и 6 (28,6%) девочек. Длительность симптоматики до обращения к врачу колебалась от 1 до 13 дней, в среднем первый визит к врачу состоялся на 7,5 день от появления первых симптомов. Характер течения заболевания был оценен как острый у 21 (100%) пациента; тяжесть течения заболевания как легкая у 7 (33,3%) и среднетяжелая у 14 (66,7%) пациентов. Выздоровление фиксировалось на 5–9 день от начала лечения. Средняя продолжительность приема препарата цефиксим (Супракс) составила 6,9 дня.
Оценка применения препарата Супракс (цефиксим) в группе пациентов с различными формами острого тонзиллита/тонзиллофарингита (6 пациентов (9,8%))
У 3 (50,0%) пациентов был острый тонзиллит, у 1 (16,7%) — острый тонзиллофарингит и у 2 (33,3%) пациентов — обострение хронического тонзиллита. В данной группе было 4 (66,7%) мальчика и 2 (33,3%) девочки в возрасте от 5 до 12 лет, средний возраст составил — 9,1 года. Длительность симптоматики до обращения к врачу колебалась от 1 до 2 дней, в среднем первый визит к врачу состоялся на 1,8 дня от появления первых симптомов. Характер течения заболевания был оценен как острый у 4 (66,7%) и обострение хронического у 2 (33,3%) пациентов. Выздоровление фиксировалось на 7–10 день от начала лечения. Средняя продолжительность приема препарата цефиксим (Супракс) составила 8,4 дня.
Данные о клинической эффективности и переносимости препарата у пациентов всех групп представлены на рис. 2.
Ни у одного пациента (0%) на фоне приема препарата не было отмечено нежелательных лекарственных реакций.
Выводы
Вышеизложенное позволяет рекомендовать препарат цефиксим (Супракс) для использования в амбулаторной педиатрической практике в качестве стартового препарата при бактериальных инфекциях ЛОР-органов.
Литература
Е. Ю. Радциг 1 , доктор медицинских наук, профессор
Н. Д. Пивнева, кандидат медицинских наук
Е. Н. Котова, кандидат медицинских наук
Н. В. Ермилова
М. Р. Богомильский, доктор медицинских наук, профессор, член-корреспондент РАМН
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
Фторхинолоны – это один из самых успешных маркетинговых проектов за всю историю антибактериальной терапии. Причем как для врачей и фармацевтов, так и для пациентов.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Фторхинолоны – это один из самых успешных маркетинговых проектов за всю историю антибактериальной терапии. Причем как для врачей и фармацевтов, так и для пациентов. Что с ходу спрашивают в любой аптеке и по любому поводу? Ципролет! Что назначают врачи не глядя – опять же ципролет! В результате мы, еще немного и мы потеряем один из немногих действительно эффективных и безопасных препаратов для терапии синегнойной инфекции.
Давайте разберемся, когда и какой, из наиболее раскрученных фторхинолонов, мы можем применять и постараемся максимально бережно к ним относиться в последующем.
Итак, фторхинолоны делят на четыре поколения, причем третье и четвертое – откровенно маркетинговый проект, ибо каких-то выдающихся отличий препараты в них включенные не имеют.
- Налидиксовая кислота
- Оксолиновая кислота
- Пипемидовая кислота
Первого поколения хинолонов я даже касаться не буду, так как они практически не встречаются в общеврачебной практике и мы будем рассматривать только фторхинлоны.
Как я уже сказала, фторхинолоны – это успешный коммерческий проект, как расширялись показания к ним, не расширялись ни у одной группы. Начинали с тяжелой госпитальной инфекции и, в итоге, пришли к лечению синуситов моксифлоксацином (авелоксом!), который стоит как… сами подберите эпитет… но очень-очень дорого.
По механизму действия фторхинолоны отличаются ото всех АМП – их активность обеспечивается за счет ингибирования 2-х жизненно-важных ферментов микробной клетки – ДНК-гиразы и топоизомеразы IV, что приводит к нарушению синтеза ДНК и процесса репликации бак. клетки. К тому же надо помнить, что это дозозависимые препараты и именно правильно подобранная доза позволит достичь желаемого эффекта, т.е. сэкономить и ополовинить дозу не получится, так как это мало того, что приведет к неэффективности, но еще и вызовет селекцию устойчивых микроорганизмов.
- стрептококки, в том числе пневмококки
- энтерококки,
- хламидии,
- микоплазмы
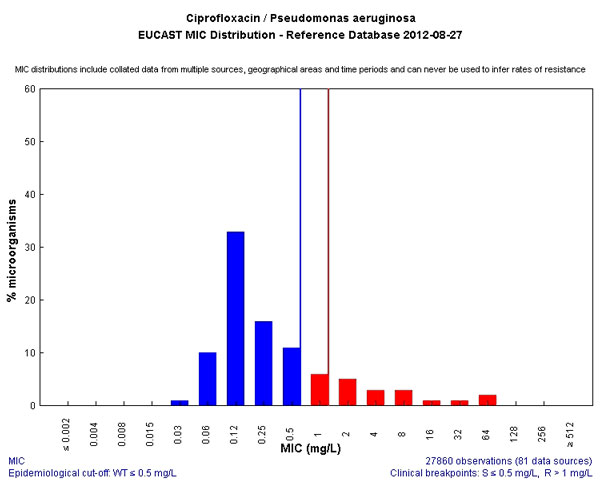
Отдельно хотелось бы сказать о попытках лечения инфекций верхних и нижних дыхательных путей Ципрофлоксацином. Коллеги! Эффективность Ципро против основных возбудителей крайне низкая. Да, я знаю, что вы видите эффект, но это не всегда эффект препарата. Если у вас есть неистребимая потребность назначить фторхтинолон – назначайте Офлоксоцин или его левовращающий изомер Левофлоксацин.
- инфекции верхних дыхательных путей
- инфекции нижних дыхательных путей
Так что применяйте на здоровье в дозе 500 мг один раз в день, благо ценовой диапазон таков, что препарат стал доступен каждому пациенту.
Этот препарат мы будем использовать для терапии мочевыводящих путей, так как в отличие от других фторхинолонов именно там он создает свои максимальные концентрации. Так же высокие концентрации создаются этим препаратом и в ЖКТ. И больше нигде.
- Инфекции мочевыводящих путей
- Простатит
- Кишечные инфекции (шигеллез, сальмонеллез)
- Гонорея
Других фторхинолонов касаться не буду, так как у них либо проблемы с безопасностью, либо им нет места в общеврачебной практике.
Итак, как вы видите, фторхинолоны есть на любой вкус и цвет, главное уметь их правильно использовать, так как это мощнейшее бактерицидное оружие в умелых руках.
Форма выпуска, упаковка и состав препарата Цефалексин
Капсулы желатиновые, размер №2, с корпусом и крышечкой светло-зеленого цвета; содержимое капсул - гранулированный порошок от белого до желтоватого цвета.
| 1 капс. | |
| цефалексина моногидрат | 263 мг, |
| что соответствует содержанию цефалексина | 250 мг |
Вспомогательные вещества: магния стеарат, целлюлоза микрокристаллическая РН 102.
Состав оболочки капсулы: титана диоксид (Е171), краситель железа оксид желтый (Е172), индигокармин (Индиготин I) (Е132), желатин.
8 шт. - блистеры (2) - пачки картонные.
Капсулы желатиновые, размер №0, с крышечкой темно-зеленого цвета и корпусом зеленовато-желтого цвета; содержимое капсул - гранулированный порошок от белого до желтоватого цвета.
| 1 капс. | |
| цефалексина моногидрат | 525.9 мг, |
| что соответствует содержанию цефалексина | 500 мг |
Вспомогательные вещества: магния стеарат, целлюлоза микрокристаллическая РН 102.
Состав оболочки капсулы: титана диоксид (Е171), краситель железа оксид желтый (Е172), краситель железа оксид черный (Е172), индигокармин (Индиготин I) (Е132), желатин.
8 шт. - блистеры (2) - пачки картонные.
Гранулы для приготовления суспензии для приема внутрь желто-оранжевого цвета; при добавлении воды образуется суспензия желто-оранжевого цвета с характерным фруктовым запахом.
| 5 мл готовой сусп. | |
| цефалексин (в форме моногидрата) | 250 мг |
Вспомогательные вещества: натрия сахаринат, лимонной кислоты ангидрид, краситель железа оксид желтый (Е172), камедь гуаровая, натрия бензоат, симетикон S 184, сахароза, ароматизатор клубничный, ароматизатор яблочный, ароматизатор малиновый, ароматизатор "тутти фрутти".
40 г (для приготовления 100 мл суспензии) - флаконы темного стекла (1) в комплекте с мерной ложкой объемом 5 мл и риской для объема 2.5 мл - пачки картонные.
Фармакологическое действие
Цефалоспориновый антибиотик I поколения. Действует бактерицидно, нарушает синтез клеточной стенки микроорганизмов. Устойчив к лактамазам.
Имеет широкий спектр действия. Активен в отношении грамположительных микроорганизмов - Staphylococcus spp., (в т.ч. продуцирующие и непродуцирующие пенициллиназу штаммы Staphylococcus aureus, пенициллин-чувствительные штаммы Staphylococcus epidermidis), Streptococcus spp. (в т.ч. Streptococcus pneumoniae, Streptococcus pyogenes), Corynebacterium diphtheriae; грамотрицательных микроорганизмов - Neisseria meningitidis, Neisseria gonorrhoeae, Shigella spp., Salmonella spp., Escherichia coli, Klebsiella spp. (в т.ч. Klebsiella pneumoniae), Moraxella catarrhalis, Proteus mirabilis; Treponema spp., лучистых грибов.
Неэффективен в отношении Pseudomonas aeruginosa, Proteus spp. (индолположительных штаммов), Morganella morganii, Mycobacterium tuberculosis, Enterococcus faecalis, Haemophilus spp., Enterobacter spp., Serratia spp., Pseudomonas spp., Aeromonas spp., Acinetobacter spp., метициллин-устойчивых штаммов, анаэробных микроорганизмов.
Устойчив к пенициллиназе стафилококков, но разрушается цефалоспориназой грамотрицательных микроорганизмов.
Фармакокинетика
После приема внутрь быстро и хорошо всасывается. Биодоступность - 90-95%, прием пищи замедляет абсорбцию, но не влияет на ее полноту. Время достижения C max после приема внутрь 0.25, 0.5 или 1 г - 1 ч, величина C max - 9, 18 и 32 мкг/мл, соответственно.
Терапевтическая концентрация сохраняется в течение 4-6 ч. Связь с белками плазмы - 10-15%. V d - 0.26 л/кг.
Распределяется относительно равномерно в различных тканях и жидкостях организма: легких, печени, сердце, почках, желчи, желчном пузыре, костях, суставах, дыхательных путях. Плохо проникает через неизмененный ГЭБ. Проходит через плаценту, в небольшом количестве выделяется с грудным молоком, обнаруживается в околоплодной жидкости.
T 1/2 - 0.9-1.2 ч. Общий клиренс - 380 мл/мин. Выводится почками - 70-89% в неизмененном виде (2/3 - клубочковой фильтрацией, 1/3 - канальцевой секрецией); с желчью - 0.5%. Почечный клиренс - 210 мл/мин.
При нарушении выделительной функции почек концентрация в крови увеличивается, а время выведения почками удлиняется, T 1/2 после приема внутрь - 5-30 ч. Умеренно выводится с помощью гемодиализа, хорошо - при помощи перитонеального диализа.
Показания препарата Цефалексин
- инфекции верхних и нижних дыхательных путей (фарингит, средний отит, синусит, ангина, бронхит, острая и обострение хронической пневмонии, бронхопневмония, эмпиема и абсцесс легких);
- инфекции мочеполовой системы (пиелонефрит, цистит, уретрит, простатит, эпидидимит, эндометрит, гонорея, вульвовагинит);
- инфекции кожи и мягких тканей (фурункулез, абсцесс, флегмона, пиодермия, лимфаденит, лимфангит);
- инфекции костей и суставов (в т.ч. остеомиелит).
| Код МКБ-10 | Показание |
| A54 | Гонококковая инфекция |
| H66 | Гнойный и неуточненный средний отит |
| I89.1 | Лимфангит |
| J01 | Острый синусит |
| J02 | Острый фарингит |
| J03 | Острый тонзиллит |
| J04 | Острый ларингит и трахеит |
| J15 | Бактериальная пневмония, не классифицированная в других рубриках |
| J20 | Острый бронхит |
| J31.2 | Хронический фарингит |
| J32 | Хронический синусит |
| J35.0 | Хронический тонзиллит |
| J37 | Хронический ларингит и ларинготрахеит |
| J42 | Хронический бронхит неуточненный |
| J85 | Абсцесс легкого и средостения |
| J86 | Пиоторакс (эмпиема плевры) |
| J90 | Плевральный выпот |
| L01 | Импетиго |
| L02 | Абсцесс кожи, фурункул и карбункул |
| L03 | Флегмона |
| L04 | Острый лимфаденит |
| L08.0 | Пиодермия |
| L08.8 | Другие уточненные местные инфекции кожи и подкожной клетчатки |
| M00 | Пиогенный артрит |
| M86 | Остеомиелит |
| N10 | Острый тубулоинстерстициальный нефрит (острый пиелонефрит) |
| N11 | Хронический тубулоинтерстициальный нефрит (хронический пиелонефрит) |
| N30 | Цистит |
| N34 | Уретрит и уретральный синдром |
| N37.0 | Уретрит при болезнях, классифицированных в других рубриках |
| N41 | Воспалительные болезни предстательной железы |
| N45 | Орхит и эпидидимит |
| N70 | Сальпингит и оофорит |
| N71 | Воспалительная болезнь матки, кроме шейки матки (в т.ч. эндометрит, миометрит, метрит, пиометра, абсцесс матки) |
| N72 | Воспалительная болезнь шейки матки (в т.ч. цервицит, эндоцервицит, экзоцервицит) |
| N73.0 | Острый параметрит и тазовый целлюлит |
| N74.3 | Гонококковые воспалительные болезни женских тазовых органов |
| T79.3 | Посттравматическая раневая инфекция, не классифицированная в других рубриках |
Режим дозирования
Внутрь, за 30-60 мин до еды, запивая водой.
Средняя доза для взрослых и детей старше 10 лет - по 250- 500 мг каждые 6 ч. Суточная доза препарата должна составлять не менее 1-2 г, при необходимости может быть увеличена до 4 г. Продолжительность курса лечения - 7-14 дней. При инфекциях, вызванных бета-гемолитическим стрептококком группы А , минимальная продолжительность лечения составляет 10 дней.
Взрослым пациентам с нарушением функции почек суточную дозу уменьшают с учетом значения КК: при КК 5-20 мл/мин максимальная суточная доза составляет 1.5 г/сут; при КК менее 5 мл/мин - 0.5 г/сут. Суточную дозу делят на 4 приема.
Детям в возрасте до 10 лет препарат рекомендуют назначать в форме суспензии для приема внутрь. При массе тела менее 40 кг средняя суточная доза - 25-100 мг/кг массы тела; кратность приема - 4 раза/сут. При среднем отите - доза 75 мг/кг/сут, кратность приема - 4 раза/сут. При стрептококковом фарингите, инфекциях кожи и мягких тканей кратность приема - 2 раза/сут. При тяжелом течении инфекций суточная доза может быть увеличена до 100 мг/кг массы тела, а кратность приема - до 6 раз/сут.
Приготовление суспензии: во флакон добавить воды до риски и хорошо взболтать. Приготовленная суспензия стабильна при комнатной температуре в течение 14 дней. Перед каждым употреблением суспензию необходимо взбалтывать. 5 мл готовой суспензии содержат 250 мг цефалексина.
Побочное действие
Аллергические реакции: сыпь, крапивница, отек Квинке, эритема, редко -- эозинофилия, токсический эпидермальный некролиз, синдром Стивенса-Джонсона, анафилактический шок.
Со стороны пищеварительной системы: боль в области живота, сухость во рту, анорексия, тошнота, рвота, диарея, токсический гепатит, холестатическая желтуха, повышение активности печеночных трансаминаз и щелочной фосфатазы, кандидоз кишечника, ротовой полости, псевдомембранозный энтероколит.
Со стороны нервной системы: головокружение, слабость, головная боль, возбуждение, галлюцинации, судороги.
Со стороны мочеполовой системы: интерстициальный нефрит, зуд половых органов и заднего прохода, вагинит, выделения из влагалища, кандидоз половых органов.
Со стороны органов кроветворения: лейкопения, нейтропения, тромбоцитопения.
Со стороны опорно-двигательного аппарата: артралгия, артрит.
Лабораторные показатели: увеличение протромбинового времени.
Противопоказания к применению
- детский возраст до 3 лет (для лекарственной формы - капсулы);
- повышенная чувствительность (в т.ч. к другим бета-лактамным антибиотикам).
С осторожностью - почечная недостаточность, псевдомембранозный колит (в анамнезе), беременность, период лактации, грудной возраст (до 6 мес - для суспензии).
Применение при беременности и кормлении грудью
Применение препарата при беременности и в период лактации возможно только в том случае, когда предполагаемая польза для матери превышает потенциальный риск для плода.
При необходимости назначения препарата в период лактации следует прекратить грудное вскармливание.
Применение при нарушениях функции почек
Взрослым пациентам с нарушением функции почек суточную дозу уменьшают с учетом значения КК: при КК 5-20 мл/мин максимальная суточная доза составляет 1.5 г/сут; при КК менее 5 мл/мин - 0.5 г/сут. Суточную дозу делят на 4 приема.
Применение у детей
Противопоказание: детский возраст до 3 лет (для лекарственной формы - капсулы). Детям в возрасте до 10 лет препарат рекомендуют назначать в форме суспензии для приема внутрь.
Особые указания
Пациенты с аллергическими реакциями на пенициллины и карбапенемы в анамнезе могут иметь повышенную чувствительность к цефалоспориновым антибиотикам.
Во время лечения цефалексином возможна положительная прямая реакция Кумбса, а также ложноположительная реакция мочи на глюкозу.
В период лечения не рекомендуется употреблять этанол.
У пациентов с нарушением функции почек возможна кумуляция (требуется коррекция режима дозирования).
При стафилококковой инфекции существует перекрестная резистентность между цефалоспоринами и изоксазолилпенициллинами.
Передозировка
Симптомы: рвота, тошнота, боли в эпигастрии, диарея, гематурия.
Лечение: активированный уголь (эффективнее, чем лаваж), поддержание проходимости дыхательных путей, мониторинг- жизненно важных функций, газов крови, электролитного баланса.
Лекарственное взаимодействие
При одновременном применении с фуросемидом, этакриновой кислотой, нефротоксичными антибиотиками (например, аминогликозидами) повышается риск поражения почек.
Салицилаты и индометацин замедляют выведение цефалексина.
Цефалексин снижает протромбиновый индекс, усиливает действие непрямых антикоагулянтов.
Условия хранения препарата Цефалексин
Список Б. Хранить в сухом, защищенном от света, в недоступном для детей месте при температуре от 15° до 25°С.
Проблема рациональной антибиотикотерапии остается одной из самых сложных в клинической практике. Если ранее врач в вопросе выбора лекарственного препарата ориентировался на его эффективность, переносимость и безопасность, то сегодня этого оказыва
 |
Проблема рациональной антибиотикотерапии остается одной из самых сложных в клинической практике. Если ранее врач в вопросе выбора лекарственного препарата ориентировался на его эффективность, переносимость и безопасность, то сегодня этого оказывается недостаточно. Фактор удобства приема препарата и, что особенно непривычно для нашего понимания, вопросы цены и стоимости лечения в условиях серьезного ограничения финансирования здравоохранения часто могут оказаться определяющими. На приобретение лекарственных средств лечебные учреждения тратят 15–20% своего бюджета, причем 50–60% этих расходов приходится на долю антибактериальных препаратов, что заставляет пересмотреть существующие и искать новые подходы к их применению.
ЦА занимают одно из важных мест в лечении инфекций верхних и нижних дыхательных путей. Наиболее ответственным этапом в антибактериальной терапии данной категории пациентов является выбор первоначального препарата. От адекватности выбора зависит эффективность и безопасность лечения, а также его комфортность, переносимость, стоимость, эпидемиологическая ситуация.
Анализ имеющихся данных об использовании ЦА в России за 1997–1998 гг. позволяет выявить предпочтения врачами того или иного препарата (группы препаратов) и определенных методов его введения. Как видно из рис. 1, при назначении цефалоспориновых антибиотиков подавляющее большинство врачей выбирают парентеральные препараты.
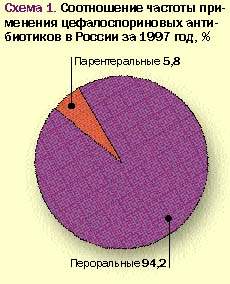 |
Данный факт лишь подтверждает, что в нашей стране пероральные лекарственные средства, и особенно пероральные цефалоспорины, очень мало популярны и практически не используются. Такое отношение к таблетированным формам отражает некоторый консерватизм практических врачей, связанный с тем, что еще 15-20 лет назад существовавшие тогда пероральные средства не выдерживали сравнения с парентеральными препаратами ни по эффективности терапии, ни по ее переносимости. Лишь последние десятилетия с момента создания первого перорального цефалоспорина — цефалексина и появления новых пероральных бактерицидных препаратов эта лекарственная форма несколько укрепила свои позиции не только в амбулаторной, но и в стационарной практике. Однако радикально на положении дел это не сказалось.
Очевидно, что такая форма назначения препаратов имеет безусловные преимущества. Это проявляется и в возможности амбулаторного ведения больного, и в удобстве приема препарата, и в снижении риска постинъекционных осложнений и длительности пребывания в стационаре, и даже в избавлении от психологического дискомфорта, связанного с инъекциями.
Наличие антибактериальных препаратов в двух формах — для парентерального и перорального применения — делает возможным их использование для проведения так называемой ступенчатой терапии. Суть такого лечения состоит в назначении внутривенного или внутримышечного препарата и в последующем, через двое-трое суток после достижения клинического эффекта, переводе на пероральный прием. Возможность проведения ступенчатой терапии одним и тем же препаратом является существенным преимуществом данного лекарственного средства перед его аналогами. Ступенчатая терапия предоставляет клинические и экономические преимущества как пациенту, так и лечебному учреждению.
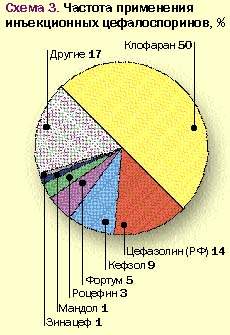
На основании приведенных данных трудно понять логику выбора цефалоспоринового антибиотика того или иного поколения и принципы, которыми руководствуется врач при назначении препарата. Анализ использования цефалоспориновых антибиотиков по поколениям (см. рис. 2 и 3) свидетельствует о предпочтительном назначении препаратов I и III поколений, причем из препаратов III поколения (61%) половина приходится на цефотаксим, а из препаратов I поколения большая часть приходится на цефазолин.
 |
Таким образом, ориентировочная этиология бронхолегочной инфекции служит основанием для выбора среди ЦА конкретного препарата (или поколения препаратов) с соответствующей антимикробной активностью.
При обострениях хронического бронхита особое значение приобретают препараты, высокоустойчивые к действию b-лактамаз, продуцируемых как грамотрицательными, так и грамположительными микроорганизмами (цефуроксим аксетил), и обладающие высокой активностью против Н.influenzae (цефтибутен).
 |
Общие принципы выбора первоначального ЦА сохраняются и у больных пневмонией на фоне тяжелых сопутствующих заболеваний (ХОЗЛ, сердечная недостаточность, сахарный диабет, алкогольная интоксикация и др.) и в возрасте старше 60 лет. Этиологическое значение в данной клинической ситуации приобретают Н.influenzae, S.аureus, некоторые грамотрицательные микроорганизмы (Е.соli, Сlebsiella), возрастает частота бета-лактамазопродуцирующих бактерий. В связи с этим возрастает значение препаратов, активных в отношении названных возбудителей. Известно, что противомикробное действие ЦА при переходе активности от первого поколения к последующим характеризуется снижением противостафилококковой активности и преобладанием активности против некоторых грамотрицательных микроорганизмов. Ценным свойством является устойчивость ЦА II поколения к b-лактамазам. В связи с этим врач должен ориентиро-ваться в данной ситуации на цефалоспорины II или по крайней мере III поколения.
| Цефалоспорины, открытые более 50 лет тому назад, продолжают занимать прочные позиции в лечении различных бактериальных заболеваний, несмотря на появление новых антимикробных средств. Цефалоспориновые антибиотики подразделяются на четыре поколения, отличающиеся по спектру действия, антибактериальной активности, стабильности в присутствии b-лактамаз, фармакокинетическому профилю. Все это наряду с многообразием лекарственных форм и стоимостью определяет их различные показания. Очевидно, что по мере появления новых поколений цефалоспориновых антибиотиков в клинической практике возникает немаловажная проблема дифференцированного назначения препарата с учетом свойств как самого антибиотика, так и особенностей инфекционно- воспалительного процесса у конкретного больного |
Таким образом, рациональный выбор первоначального ЦА для лечения инфекций верхних и нижних дыхательных путей определяется в первую очередь вероятностью этиологической роли того или иного микроорганизма в конкретной клинической ситуации. Такой подход требует от практического врача (а именно от него зависит адекватный выбор препарата) умения выявлять особенности каждого случая пневмонии (эпидемиологическую обстановку, фоновую патологию, факторы риска и др.) и ориентировки в антимикробном спектре назначаемого антибиотика. Однако в клинической практике при выборе ЦА, как, впрочем, и других антибиотиков, приходится наряду с ориентировочной этиологией бронхолегочной инфекции учитывать и другие факторы. Среди последних имеет значение фармакокинетика препарата, наличие разнообразных лекарственных форм, риск развития побочных эффектов, стоимость и др.
В настоящее время не окончательно определено место пероральных препаратов III поколения в клинической практике, так как их сравнительная клиническая и бактериологическая эффективность мало отличается от препаратов II поколения. Более того, как было сказано выше, преимущество цефалоспоринов III поколения состоит в их высокой активности в отношении b-лактамазопродуцирующих бактерий, наиболее часто вызывающих серьезные стационарные инфекции. Но поскольку в этом случае больные находятся в стационаре, то уже более обоснованно получают парентеральную терапию. В то же время ввиду сниженной активности в отношении грамположительных бактерий, часто являющихся причиной именно амбулаторной инфекции, назначение препаратов III поколения имеет меньше преимуществ перед препаратами II поколения.
Цель антибактериальной терапии состоит не только в достижении клинического эффекта, но и в полной эрадикации возбудителя, т. е. бактериологической эффективности. Это в основном определяется адекватным дозированием препарата для достижения необходимой концентрации в очаге инфекции. Высокая степень накопления препарата в тканях является необходимым требованием к лекарственному веществу.
ЦА первого поколения хуже проникают в ткани, что уменьшает степень бактериальной эрадикации.
Данные о биодоступности оральных ЦА следует иметь в виду при дифференцированном назначении их больным с сопутствующей патологией кишечника, связанной с нарушением всасывания, а также при одновременном приеме антисекреторных препаратов, антацидов, с учетом влияния пищи на всасывание ЦА.
Знание путей элиминации ЦА наряду с оценкой функционального состояния печени и почек (возраст, сопутствующая патология) также может определять выбор более адекватного для данной ситуации препарата. Выбирая ЦА для лечения тяжелых госпитальных пневмоний, например, у новорожденных и стариков или у больных с патологией почек, при наличии почечной недостаточности предпочтение следует отдать цефоперазону с учетом его преимущественно билиарной экскреции.
При дифференцированном выборе ЦА необходимо учитывать риск развития побочных эффектов. Наиболее типичны реакции гиперчувствительности (лихорадка, кожная сыпь), гематологические синдромы (цитопения, эозинофилия), нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея), печени (повышение активности трансаминаз), почек (повышение уровня креатинина), ЦНС (головная боль), флебиты при внутривенном введении. Поэтому анамнестические и клинико-лабораторные данные о наличии у больных какой-либо патологии должны влиять на выбор соответствующего препарата.
Флебиты часто возникают при введении цефалотина, цефотаксима, цефепима. Цефуроксим, цефоперазон, цефтибутен могут вызывать анемию (чаще гемолитическую), а при назначении цефалотина, цефамандола, цефотаксима, цефтазидима иногда выявляются фиксированные на эритроцитах антитела. Повышение активности печеночных ферментов возможно на фоне лечения цефоперазоном, цефтриаксоном, цефтазидимом, цефуроксимом. Уровень креатинина может повышаться при лечении цефалексином и цефподоксимом. Оральные цефалоспорины чаще всего вызывают нарушения со стороны желудочно-кишечного тракта (тошнота, рвота, диарея). При лечении парентеральными ЦА отмечено увеличение протромбинового времени, за исключением цефтазидима, не влияющего на синтез факторов протромбинового комплекса и показатели свертываемости крови. Возможны реакции гиперчувствительности (кожная сыпь, лихорадка, эозинофилия) на фоне применения почти всех ЦА III поколения.
Таким образом, дифференцированный выбор ЦА для лечения инфекций верхних и нижних дыхательных путей должен базироваться на учете и адекватной оценке многих факторов, включающих как особенности клинической ситуации, так и антимикробную активность и фармакокинетические характеристики назначаемого препарата.
Читайте также:

