Что такое ренальная инфекция
Обновлено: 13.05.2024
Оценена эффективность медикаментозной реабилитации подростков, перенесших рецидив ренальной инфекции у детей с тубулоинтерстициальным поражением почек (ТИПП). Проведенная оценка эффективности медикаментозной реабилитации пациентов, перенесших обострение р
Evaluation of effectiveness of medical rehabilitation of teenagers with tubulointerstitial renal affection undergoing relapse of urinary tract infection
The effectiveness of medical rehabilitation of teenagers who have had a relapse of urinary tract infection (UTI) in children with tubulointerstitial affection (TIA) was evaluated. The evaluation of effectiveness of medical rehabilitation of patients who have had relapse of UTI justifies possibility of its use at early stages of TIA in teenagers.
Тубулоинтерстициальное поражение почек (ТИПП) — это воспалительное (бактериальное и абактериальное) и невоспалительное повреждение интерстициальной ткани почек с расположенными в ней сосудами (артериальными и венозными), лимфатическими протоками, нервными окончаниями, а также чашечно-лоханочной системы врожденного, наследственного или приобретенного генеза с исходом в нарастание необратимых морфологических изменений (интерстициальный фиброз) параллельно со снижением функциональных возможностей почек, формированием хронической болезни почек [1].
Сведения, полученные в ходе проведенных многочисленных научных исследований как в нашей стране, так и за рубежом, доказывают, что ТИПП определяет тяжесть течения хронического повреждения почки с неуклонным снижением способности к выполнению возложенных на нее функций, то есть прогрессированию болезни с формированием хронической болезни почек (ХБП), исходом в терминальную почечную недостаточность [2–4].
К факторам инициации и прогрессирования ТИПП относят в том числе ренальную инфекцию [5].
Факторами риска развития ТИПП при хроническом пиелонефрите являются: III–V степени почечно-мочеточниковый рефлюкс (ПМР), двусторонний ПМР, интраренальный рефлюкс, сочетание с обструкцией, частые рецидивы ренальной инфекции, поздняя диагностика, невыполнение назначений врача, генетические факторы (DD-фенотип гена АКФ) [6, 7].
Установлена зависимость формирования ТИПП от ПМР: чем меньше степень ПМР, тем большее значение имеет ренальная инфекция в формировании ТИПП [8]. Р. А. Жетищев, проведя прижизненные морфологические исследования ткани почек больных с рефлюкс-нефропатией (РН), установил, что у 15% обследованных детей с хроническим пиелонефритом на фоне ПМР развивается ТИПП, у 10% больных формирование хронического пиелонефрита произошло на фоне дисплазии почечной паренхимы [9].
Повреждение почечной паренхимы наиболее часто отмечается при инфицировании интраренального рефлюкса [10, 11]. Ренальная инфекция является одним из основных факторов, приводящих к инфильтрации почечного интерстиция воспалительными клетками с последующей выработкой ими медиаторов воспаления и фиброгенеза [12].
Большое значение в прогрессировании ТИПП отводят таким патогенным потенциалам микроорганизмов, как биоцины, адгезины, инвазины, импедины, экзотоксины, метаболические особенности микробной клетки. Эти свойства бактерий способствуют формированию антибиотикорезистентности и других факторов агрессии и защиты микроорганизмов, приводящих к постоянно рецидивирующему течению микробно-воспалительного поражения тубулоинтерстициальной ткани почек с исходом в интерстициальный фиброз [12]. С. С. Пауновой установлено, что у детей с часто рецидивирующим течением пиелонефрита увеличивается продукция медиаторов воспаления с развитием нефросклероза [13–15]. Этот факт способствует развитию более выраженных как морфологических, так и функциональных тубулоинтерстициальных изменений почек [16, 17]. Каждое последующее обострение ренальной инфекции расширяет зону ТИПП, способствуя процессам фиброгенеза [18].
Изучение вопросов медикаментозной реабилитации пациентов, перенесших ренальную инфекцию, является перспективным направлением нефрологии детского возраста [19].
Материалы и методы исследования
Целью настоящего исследования было оценить эффективность медикаментозной реабилитации пациентов, перенесших рецидив ренальной инфекции.
Проведено сопоставление комплекса клинических и параклинических данных 40 детей в возрасте от 15 до 18 лет с РН (n = 40) на разных стадиях ТИПП (табл. 1).
Критерии включения больных в исследование:
- добровольное информированное согласие родителей ребенка на участие в клиническом исследовании;
- возраст пациентов от 15 года до 18 лет включительно;
- наличие верифицированного диагноза РН по международным критериям.
Критерии исключения больных из исследования:
- отказ родителей от участия в клиническом исследовании;
- двусторонняя РН.
В результате проведенного обследования были выделены следующие группы клинического наблюдения согласно классификации J. M. Smellie [20]:
1) дети с рефлюкс-нефропатией А (n = 10);
2) дети с рефлюкс-нефропатией В (n = 10);
3) дети с рефлюкс-нефропатией С (n = 10);
4) дети с рефлюкс-нефропатией D (n = 10).
Клинико-параклиническое обследование детей проводилось в ГАУЗ ГКБ № 6 г. Оренбурга.
Нефросцинтиграфия, позволившая верифицировать степень РН, проводилась на базе отделений радиоизотопной диагностики ГБУЗ Оренбургская ОКБ.
Всем детям проведены специальные микробиологические исследования мочи, включающие определение степени бактериурии секторным посевом на кровяной агар и среду Эндо. Видовую идентификацию выделенной урофлоры осуществляли общепринятыми методами. У изолированных штаммов микроорганизмов определяли чувствительность к антимикробным препаратам.
Всем детям проведена оценка функционального состояния почек по пробам Реберга с поправкой по формуле Шварца, Зимницкого, суточной экскреции с мочой титруемых кислот, аммиака.
Статистическая обработка материала произведена путем вычисления средней арифметической (М), ошибки средней (m) с помощью биометрических методов анализа, коэффициента Стьюдента (t) с последующим нахождением уровня достоверности различий (р) по таблицам. Достоверным считали различие при р < 0,05. Оценка эффективности медикаментозной реабилитации пациентов, перенесших рецидив ренальной инфекции, проведена с помощью принципов доказательной медицины с оценкой снижения абсолютного риска (САР).
Результаты исследования
Нами установлены различия частоты обострений ренальной инфекции в зависимости от степени ТИПП у детей с РН. По мере прогрессирования ТИПП у детей с РН установлено снижение частоты обострений ренальной инфекции (рис. 1). Так, у больных с начальными проявлениями ТИПП (РН А и РН В) ренальная инфекция диагностировалась в 100% случаев, у детей с РН С в 83,3%, а с РН D в 67,8% случаев.
При изучении особенностей этиологического фактора ренальной инфекции у больных с РН выявлено, что высев микрофлоры в анамнезе отмечен в 100% случаев (n = 40), из них E. coli изолирована у 80% больных (n = 32), Klebsiella оxytoca — у 15% (n = 6), Staphylococcus aureus — у 2,5% (n = 1), Streptococcus haemolyticus — у 2,5% (n = 1). Достоверных отличий этиологической структуры ренальной инфекции в зависимости от стадии ТИПП нами не выявлено (p > 0,001).
Проведена оценка эффективности медикаментозной реабилитации подростков, перенесших рецидив ренальной инфекции, на разных стадиях ТИПП.
Медикаментозная реабилитация проводилась после купирования обострения ренальной инфекции, включала в себя последовательное использование антибактериальных препаратов, уросептиков, фитопрепарата Фитолизин в стандартных возрастных дозировках в дозе 1 чайная ложка пасты, растворенная в 1/2 стакана теплой сладкой воды, 3 раза в день 4 недели. Клиническими критериями эффективности противорецидивной терапии у больных с РН на разных стадиях прогрессирования ТИПП были приняты: частота обострений ренальной инфекции и их длительность.
Определение показателей, заявленных как критерии эффективности, проводилось нами в динамике 1 года.
Проведя анализ частоты обострений ренальной инфекции после терапии антибактериальными препаратами, уросептиками и Фитолизином в динамике одного года, установлено снижение частоты обострений ренальной инфекции у пациентов начальных стадий ТИПП: РН А 1,71 ± 0,55, РН В 2,33 ± 0,24 раза в год (p < 0,05) (табл. 2). Нами не установлено достоверных различий показателей частоты обострений ренальной инфекции у пациентов с РН С 3,27 ± 0,29 и РН D 3,35 ± 0,44 (p >0,05) (рис. 2).
Проведя анализ длительности обострений ренальной инфекции после получения противорецидивной терапии антибиотиками, уросептиками и Фитолизином в течение одного года, установлено снижение длительности обострений ренальной инфекции у пациентов начальных стадий РН: РН А до 9,27 ± 1,96, РН В до 9,33 ± 1,27 дня (p < 0,05) (табл. 2). Нами не установлено достоверных различий показателей длительности обострений ренальной инфекции у пациентов с РН С 12,49 ± 2,92 и РН D 12,62 ± 2,67 дня (p >0,05) (рис. 3).
Эффективность медикаментозной реабилитации пациентов подросткового возраста, перенесших рецидив ренальной инфекции, подтверждена одним из методов клинической эпидемиологии — снижением абсолютного риска на 27%.
По мере прогрессирования ТИПП происходит постадийное снижение частоты бактериального воспаления тубулоинтерстициальной ткани почек, что доказывает превалирование процесса фиброгенеза над процессом бактериального воспаления по мере прогрессирования ТИПП у детей с РН.
Основными показателями эффективности медикаментозной реабилитации пациентов, перенесших атаку ренальной инфекции, явилось снижение на 27% (р < 0,05) частоты и длительности ее обострений у подростков на начальных стадиях ТИПП (РН А, РН В).
Таким образом, медикаментозная реабилитация пациентов подросткового возраста, перенесших рецидив ренальной инфекции, эффективна лишь у пациентов на ранних (РН А и РН В) стадиях ТИПП, что подтверждается снижением количества и длительности ее атак.
Проведенная оценка эффективности медикаментозной реабилитации пациентов, перенесших обострение ренальной инфекции, обосновывает возможность ее использования на ранних стадиях ТИПП у детей подросткового возраста.
Литература
- Вялкова А. А. Актуальные проблемы тубулоинтерстициального поражения почек у детей // Педиатрия. 2008. Т. 87, № 3. С. 122–127.
- Вялкова A. A. Современные представления о тубулоинтерстициальных нефропатиях и концепция хронической болезни почек в практической нефрологии // Педиатрия. 2008. № 3. С. 129–131.
- Шишкин А. Н. Тубулоинтерстициальные заболевания почек // Новые Санкт-Петербургские врачебные ведомости. 2006. № 1. С. 25–28.
- Lorz C., Justo P., Subira D. et al. Paracetamol-induced renal tubular injury: a role for ER stress // J Am Soc Nephrol. 2004. V. 15 (2). P. 380–389.
- Вялкова А. А., Гриценко В. А. Современные представления об этиологии, патогенезе и ранней диагностике микробно-воспалительных заболеваний органов мочевой системы у детей / Материалы III Конгресса педиатров-нефрологов России. СПб, 2003. С. 21–31.
- Ханно Ф. М. Руководство по клинической урологии. М.: МИА, 2006. С. 516–519.
- Silva J. M., Diniz J. S., Lima E. M. et al. Independent risk factors for renal damage in series of primary vesicoureteral reflux: a multivariate analysis // Nephrology (Carlton). 2009. Vol. 14 (2). P. 198–204.
- Chertin B., Natsheh A., Fridmans A. et al. Renal scarring and urinary tract infection after endoscopic correction of vesicoureteral reflux // J. Urol. 2009. Vol. 182 (4). P. 1706–1707.
- Жетищев Р. А., Мамбетова А. М. Диспластические фенотипы у больных с врожденными аномалиями органов мочевой системы / Материалы I Международного Конгресса по перинатальной медицине, посв. 85-летию академика РАМН В. А. Таболина. Москва, 16–18 июня. 2011. С. 81.
- Бухарин О. В., Вялкова А. А., Гриценко В. А. Клинико-микробиологическое обоснование ранней диагностики пиелонефрита у детей // Российский педиатрический журнал. 2003. № 2. С. 42–47.
- Hagerty J., Maizels M., Kirsch A. et al. Treatment of occult reflux lowers the incidence rate of pediatric febrile urinary tract infection // J. Urol. 2008. Vol. 72 (1). P. 72–78.
- Вялкова А. А., Гриценко В. А. Современные представления об этиологии, патогенезе и ранней диагностике микробно-воспалительных заболеваний органов мочевой системы у детей / Материалы III Конгресса педиатров-нефрологов России. СПб, 2003. С. 21–31.
- Паунова С. С., Кучеренко А. Г., Смирнов И. Е., Ольхова Е. Б. Интерлейкины и фактор некроза опухоли у детей с рефлюкс-нефропатией // Вопросы современной педиатрии. 2003. Т. 2, № 1. С. 267–268.
- Паунова С. С., Кучеренко А. Г., Смирнов И. Е., Ольхова Е. Б., Ревенкова JI. A., Гольцова H. JI. Цитокины в формировании рефлюкс-нефропатии у детей // Нефрология и диализ. 2003. Т. 5, № 3. С. 207–211.
- Паунова С. С., Кучеренко А. Г., Смирнов И. Е., Ольхова Е. Б., Цукерман Л. И., Хворостов И. Н. Факторы роста при рефлюкс-нефропатии у детей // Вопросы современной педиатрии. 2004. Т. 3, № 2. С. 85.
- Baciulis Vytautas, Pauzaite Egle, Juskevicius Kasimieras. Renal scintigraphic changes in children with recurrent or chronic pyelonephritis / The 34 th Annual Meeting of the European Society for Pediatric Nephrology. Helsinki, Finland. 2000. P. 154.
- Moghazi S., Jones E., Schroepple J. et al. Correlation of renal histopathology with sonographic findings // Kidney Int. 2005. Vol. 67. P. l 515-15-20.
- Паунова С. С. Рефлюкс-нефропатии / В кн.: Детская нефрология. Руководство для врачей. М. С. Игнатова (ред.). 3-е издание. М.: МИА. 2011. С. 502–511.
- Захарова И. Н. Клинические и патогенетические аспекты тубулоинтерстициальных заболеваний почек у детей: Автореф. дис. докт. мед. наук. М., 2001. 39 с.
- Smellie J., Normand C. Bacteriuria, reflux and renal scarring // Arch Dis Child. 1975. V. 50. P. 581–583.
И. В. Зорин 1 , доктор медицинских наук
А. А. Вялкова, доктор медицинских наук, профессор
Оценена эффективность профилактики рецидивов ренальной инфекции у детей с тубулоинтерстициальными болезнями почек. Проведено сопоставление комплекса клинических и параклинических данных 45 детей с рефлюкс-нефропатией на разных стадиях тубулоинтерстициал
The aim of the study was to evaluate the effectiveness of antirelapse therapy of ubulointerstitial damage in children with tubulointerstitial diseases. We perfomed comparison of clinical and paraclinical data of 45 children with reflux nephropathy at different stages of tubulointerstitial damage.
Прогрессирование тубулоинтерстициальных болезней почек (ТИБП) у детей с формированием хронической болезни почек (ХБП), терминальной хронической почечной недостаточности, требующей проведения заместительной терапии, а в последующем трансплантации почек, является одной из актуальных проблем нефрологии [1–3].
ТИБП — это гетерогенная группа заболеваний различной этиологии с преимущественным вовлечением в патологический процесс канальцев и интерстициальной ткани [4]. В эту группу включают как воспалительные и иммуновоспалительные поражения почек, так и метаболические, токсические поражения без ведущего воспалительного компонента. В Международной классификации болезней Х пересмотра представлены шифрами N 10.0 — N 16.8 [5].
Острые ТИБП — это острые интерстициальные нефриты, обусловленные приемом лекарств, вирусами, бактериями и иммунными нарушениями. Клинически характеризуются острым началом, лихорадкой, гематурией, полиурией, снижением относительной плотности мочи, часто протекают с острым почечным повреждением (недостаточностью) [6].
К развитию хронических ТИБП приводят: инфекции, пузырно-мочеточниковый рефлюкс (ПМР) и другие обструктивные уропатии, применение некоторых лекарств, метаболические нарушения, интоксикации тяжелыми металлами, иммунные нарушения, злокачественные новообразования [7].
Тубулоинтерстициальное поражение почек (ТИПП) — это воспалительное (бактериальное и абактериальное) и невоспалительное повреждение интерстициальной ткани почек с расположенными в ней сосудами (артериальными и венозными), лимфатическими протоками, нервными окончаниями, а также чашечно-лоханочной системы врожденного, наследственного или приобретенного генеза с исходом в нарастание необратимых морфологических изменений (интерстициальный фиброз) параллельно со снижением функциональных возможностей почек, формированием ХБП [8].
Установлена зависимость прогрессирования ТИПП от ПМР: чем меньше степень ПМР, тем большее значение имеет ренальная инфекция в прогрессировании ТИБП [13, 14]. Р. А. Жетищев, проведя прижизненные морфологические исследования ткани почек больных с РН, установил, что у 15% обследованных детей с хроническим пиелонефритом на фоне ПМР развивается ТИПП [15].
Повреждение почечной паренхимы наиболее часто отмечается при инфицировании интраренального рефлюкса [16, 17]. Ренальная инфекция является одним из основных факторов, приводящих к инфильтрации почечного интерстиция воспалительными клетками с последующей выработкой ими медиаторов воспаления и фиброгенеза [18].
Установлено, что при ПМР высокой степени происходит нарушение внутрипочечной гемодинамики путем снижения артериального кровотока вследствие повышения внутрилоханочного и внутриканальцевого давления [19]. Таким образом, у больных с нарушениями уродинамики возникает не только микробно-воспалительное поражение почек, но и нарушение внутриорганной гемодинамики, приводящие к формированию стойкой ишемии почки с активацией ренин-ангиотензин-альдостероновой системы (РААС), приводящие к развитию артериальной гипертензии ренального генеза. Установлено, что ангиотензин II, продукт активации РААС, является медиатором оксидативного стресса, стимулирует высвобождение просклеротических цитокинов и факторов роста, стимулирует активацию фибробластов [20]. Таким образом, замыкается патологический механизм прогрессирования ТИБП, состоящий из оксидативного стресса, воспаления и эндотелиальной дисфункции [21].
Большое значение в прогрессировании ТИПП отводят патогенным потенциалам микроорганизмов: биоцинам, адгезинам, инвазинам, импединам, экзотоксинам, метаболическим особенностям микробной клетки. Эти свойства бактерий способствуют формированию антибиотикорезистентности и других факторов агрессии и защиты микроорганизмов, приводящих к постоянно рецидивирующему течению микробно-воспалительного поражения тубулоинтерстициальной ткани почек с исходом в ТИПП [22]. С. С. Пауновой установлено, что у детей с часто рецидивирующим течением пиелонефрита увеличивается продукция медиаторов воспаления с развитием ТИПП [23]. Этот факт способствует развитию более выраженных как морфологических, так и функциональных тубулоинтерстициальных изменений почек [24–26]. Каждое последующее обострение ренальной инфекции расширяет зону ТИПП, способствуя процессам фиброгенеза [27].
По современным представлениям, прогрессирование ТИПП проходит в несколько стадий: альтерация (бактериальная, иммунная), приводящая к развитию воспаления; инфильтрация воспалительными клетками почечного интерстиция, выделение провоспалительных цитокинов и факторов роста, активация фиброгенеза; склерозирование интерстиция, нарушение ремодулирования соединительной ткани в интерстиции [28, 29].
Изучение вопросов участия ренальной инфекции в прогрессировании ТИБП, ее профилактики является перспективным направлением нефрологии детского возраста [30, 31].
Материалы и методы исследования
Целью данного исследования было оценить эффективность профилактики рецидивов ренальной инфекции у детей с ТИБП.
Проведено сопоставление комплекса клинических и параклинических данных 45 детей в возрасте от 15 до 18 лет с РН (n = 45) на разных стадиях ТИПП (табл. 1).
Критерии включения больных в исследование:
- добровольное информированное согласие родителей ребенка на участие в клиническом исследовании;
- возраст пациентов от 15 года до 18 лет включительно;
- наличие верифицированного диагноза РН по международным критериям;
- отсутствие клинико-лабораторных признаков обострения заболевания в течение последних 3 месяцев.
Критерии исключения больных из исследования:
- отказ родителей от участия в клиническом исследовании;
- двусторонняя РН.
В результате проведенного обследования были выделены следующие группы клинического наблюдения согласно классификации J. M. Smellie [32]:
1) дети с рефлюкс-нефропатией А (n = 13);
2) дети с рефлюкс-нефропатией В (n = 12);
3) дети с рефлюкс-нефропатией С (n = 10);
3) дети с рефлюкс-нефропатией D (n = 10).
Всем детям проведены специальные микробиологические исследования мочи, включающие определение степени бактериурии секторным посевом на кровяной агар и среду Эндо. Видовую идентификацию выделенной урофлоры осуществляли общепринятыми методами. У изолированных штаммов микроорганизмов определяли чувствительность к антимикробным препаратам.
Всем детям проведена оценка функционального состояния почек по пробам Реберга с поправкой по формуле Шварца, Зимницкого, суточной экскреции с мочой титруемых кислот, аммиака.
Противорецидивная терапия проводилась после окончания обострения ренальной инфекции и включала в себя последовательное использование уросептиков (препараты фуранового ряда — нитрофурантоин, нифурател, нифуроксазид, фуразидин, фуразолидон) на протяжении 14 дней, фитопрепарата Фитолизин по 1 ч.л. 3 раза в сут в течение 4 недель. Включение Фитолизина в схему лечения было обусловлено наличием у препарата комплексного фармакологического действия (диуретическое, спазмолитическое, противовоспалительное, иммуномодулирующее), способствующего предотвращению осложнений при инфекциях мочевыводящих путей и рецидивов заболевания (табл. 2).
Результаты
Проведена оценка эффективности профилактики рецидивов ренальной инфекции у пациентов с РН. Клиническими критериями эффективности противорецидивной терапии у больных с РН на разных стадиях прогрессирования ТИПП были приняты: частота обострений ренальной инфекции и их длительность.
Определение показателей, заявленных как критерии эффективности, проводилось нами в динамике одного года.
Проведя анализ частоты обострений ренальной инфекции после терапии уросептиками и Фитолизином в динамике одного года, установлено снижение частоты обострений ренальной инфекции у пациентов начальных стадий ТИПП: РН А 1,71 ± 0,55, РН В 2,33 ± 0,24 раза в год (p < 0,05). Нами не установлено достоверных различий показателей частоты обострений ренальной инфекции у пациентов с РН С 3,27 ± 0,29 и РН D 3,35 ± 0,44 (p >0,05) (рис. 1).
Проведя анализ длительности обострений ренальной инфекции после получения противорецидивной терапии уросептиками и Фитолизином в течение одного года, установлено снижение длительности обострений ренальной инфекции у пациентов начальных стадий РН: РН А до 9,27 ± 1,96, РН В до 9,33 ± 1,27 дня (p < 0,05). Нами не установлено достоверных различий показателей длительности обострений ренальной инфекции у пациентов с РН С 12,49 ± 2,92 и РН D 12,62 ± 2,67 дня (p >0,05) (рис. 2).
Эффективность противорецидивной терапии подтверждена методами доказательной медицины с определением снижения относительного риска (СОР), снижения абсолютного риска (САР), числа больных, нуждающихся в лечении (ЧБНЛ) (табл. 3).
Основными показателями эффективности проведенной противорецидивной терапии явилось снижение на 27% (р < 0,05) частоты и длительности обострений ренальной инфекции у детей на начальных стадиях ТИПП (РН А, РН В).
Таким образом, противорецидивная терапия ренальной инфекции как мера профилактики прогрессирования ТИПП эффективна лишь у пациентов на ранних (РН А и РН В) стадиях ТИБП, что подтверждается снижением количества и длительности обострений ренальной инфекции.
Проведенная оценка эффективности противорецидивной терапии ренальной инфекции обосновывает возможность использования данного медикаментозного подхода к профилактике прогрессирования ТИПП у пациентов на ранних стадиях ТИБП.
Проведенные исследования обосновывают необходимость профилактики прогрессирования ТИПП у детей с ТИБП и поиск новых методов профилактики рецидивов ренальной инфекции у детей.
Литература
И. В. Зорин 1 , кандидат медицинских наук
А. А. Вялкова, доктор медицинских наук, профессор
Установлено стадийное снижение частоты бактериального воспаления тубулоинтерстициальной ткани почек у детей с тубулоинтерстициальным поражением почек (ТИПП), значение ренальной инфекции среди предикторов формирования (38,05%) и прогрессирования (27,3%) ТИ
We established decrease of attacks of urinary tract infection in children with reflux nephropathy in renal affection. We established role of urinary tract infection as a predictor of formation (38,05%) and progression (27,3%) of renal affection.
Проблема тубулоинтерстициального поражения почек (ТИПП) остается актуальной в педиатрической нефрологии в связи с многообразием причин ее развития, прогрессированием с развитием хронической болезни почек (ХБП), множественностью причин, обусловливающих инициацию и прогрессирование ТИПП [1–3].
Тубулоинтерстициальное поражение почек — это воспалительное (бактериальное и абактериальное) и невоспалительное повреждение интерстициальной ткани почек с расположенными в ней сосудами (артериальными и венозными), лимфатическими протоками, нервными окончаниями, а также чашечно-лоханочной системы врожденного, наследственного или приобретенного генеза с исходом в нарастание необратимых морфологических изменений (интерстициальный фиброз) параллельно со снижением функциональных возможностей почек, формированием хронической болезни почек [4].
Установлена зависимость формирования ТИПП от ПМР: чем меньше степень ПМР, тем большее значение имеет ренальная инфекция в формировании ТИПП [15]. Р. А. Жетищев, проведя прижизненные морфологические исследования ткани почек больных с рефлюкс-нефропатией (РН), установил, что у 15% обследованных детей с ТИПП на фоне ПМР развивается интерстициальный фиброз [16].
Большое значение в прогрессировании ТИПП также отводят бактериальному компоненту, в том числе таким патогенным потенциалам микроорганизмов, как биоцины, адгезины, инвазины, импедины, экзотоксины, метаболические особенности микробной клетки. Эти свойства бактерий способствуют формированию антибиотикорезистентности и других факторов агрессии и защиты микроорганизмов, приводящих к постоянно рецидивирующему течению микробно-воспалительного поражения тубулоинтерстициальной ткани почек с исходом в интерстициальный фиброз [21]. С. С. Пауновой установлено, что у детей с часто рецидивирующим течением ренальной инфекции увеличивается продукция медиаторов воспаления с развитием нефросклероза [22]. Этот факт способствует развитию более выраженных как морфологических, так и функциональных тубулоинтерстициальных изменений почек [23]. Каждое последующее обострение ренальной инфекции расширяет зону ТИПП, способствуя процессам фиброгенеза [22].
Материалы и методы исследования
Цель исследования — установить значение ренальной инфекции у детей с пузырно-мочеточниковым рефлюксом в формировании и прогрессировании ТИПП.
Проведено обследование 188 детей, в том числе 118 детей с РН на разных стадиях ТИПП; 40 пациентов с ПМР без признаков ТИПП, 30 детей контрольной группы (табл.).
Критерии включения пациентов в клиническое обследование:
- добровольное информированное согласие родителей ребенка на участие в клиническом обследовании;
- возраст пациентов от 1 года до 17 лет включительно;
- наличие верифицированных диагнозов по международным критериям: ПМР (комитет по интернациональному изучению ПМР, 1981), РН [24].
Критерии исключения больных из исследования:
- отказ родителей от участия в клиническом обследовании;
- двусторонняя РН;
- двусторонний ПМР;
- ХБП III–V (С3-С5).
В результате проведенного обследования выделены следующие группы клинического наблюдения:
1) дети с ПМР без признаков ТИПП (n = 40);
2) дети с РН А (n = 30);
3) дети с РН В (n = 30);
4) дети с РН С (n = 30);
5) дети с РН D (n = 28).
Контрольную группу составили условно здоровые дети (n = 30).
При постановке диагноза РН использована классификация, предложенная J. M. Smellie, основанная на степени нефросклероза, верифицированной по результатам нефросцинтиграфии:
- А — наличие не более 2 очагов нефросклероза;
- В — выявление более 2 очагов нефросклероза с сохранением участков неизмененной паренхимы;
- С — генерализованные изменения почечной паренхимы, уменьшение почки в размерах;
- D — конечная стадия сморщивания почки, с сохранением менее 10% функционирующей паренхимы [24].
Диагноз ПМР верифицировался на основании критериев, разработанных Комитетом по интернациональному изучению пузырно-мочеточникового рефлюкса в 1981 г. по степени заброса рентгеноконтрастного вещества и дилатации чашечно-лоханочной системы почек [24].
Всем детям проведена оценка функционального состояния почек по пробам Реберга с поправкой по формуле Шварца, Зимницкого, суточной экскреции с мочой титруемых кислот, аммиака. Верификация ХБП проводилась на основании критериев NKF/КDOQI (National Kidney Foundation/Kidney Disease Outcomes Quality Initiative) [25].
Микробиологическое исследование мочи на определение характера и степени бактериурии проводилось всем детям классическим бактериологическим методом, основанным на посеве исследуемого материала в соответствующую питательную среду.
Результаты исследования
Нами проведено клиническое обследование пациентов с ПМР (n = 40) и РН (n = 118) на разных стадиях формирования и прогрессирования ТИПП.
Дебют ТИПП у детей наблюдаемых групп выявлен в следующие возрастные периоды: до 3-летнего возраста — 16,1% (n = 19), от 4 до 7 лет — 15,3% (n = 18), от 8 до 12 лет — 30,5% (n = 36), старше 13 лет — 38,1% (n = 45). Присоединение симптомов ренальной инфекции зафиксировано в возрасте от 1 года до 5 лет (66,9%, n = 79). Среди клинических проявлений ТИПП на долю ренальной инфекции приходилось 88,1% (n = 104). Клиническая картина ренальной инфекции отличалась у больных различных возрастных групп. Дети в возрасте до 7 лет предъявляли жалобы на ночное (70,3%, n = 26) и дневное (29,7%, n = 11) недержание мочи, интоксикацию (45,9%, n = 17), нарушение уродинамики (37,8%, n = 14). У больных в возрасте от 8 до 12 лет преобладали признаки нарушения уродинамики (69,4%, n = 25), абдоминальный синдром (52,7%, n = 19). У пациентов в возрасте от 13 до 17 лет преобладали: признаки нарушения уродинамики (35,5%, n = 16), люмбалгия (46,6%, n = 21), интоксикация (75,5%, n = 34). Отсутствие субъективных жалоб было характерно для детей в возрасте старше 13 лет.
Нами проведен анализ частоты и характера течения ренальной инфекции у больных с ТИПП. Рецидивирующее течение ренальной инфекции в анамнезе выявлено у 88,1% (n = 104) детей с РН. Нами установлены различия частоты ренальной инфекции в зависимости от степени склеротических изменений при ТИПП у детей с РН. По мере прогрессирования ТИПП у детей с РН установлено снижение частоты ренальной инфекции. Так, у больных с начальными проявлениями ТИПП (РН А и РН В) ренальная инфекция диагностировалась в 100% случаев, у детей с РН С в 83,3%, а с РН D в 67,8% случаев (рис. 1).
При изучении особенностей этиологического фактора ренальной инфекции у больных с РН выявлено, что высев микрофлоры в анамнезе отмечен в 62,7% случаев (n = 74), из них E. coli изолирована у 79,7% больных (n = 59), Klebsiella оxytoci — у 17,5% (n = 13), Staphylococci aureus — у 1,4% (n = 1); Streptococcus haemolyticus — у 1,4% (n = 1). Высев микрофлоры отмечался как в виде монокультуры, так и в виде их ассоциаций. Достоверных отличий этиологической структуры ренальной инфекции в зависимости от стадии ТИПП нами не выявлено (p > 0,001) (рис. 2).
В результате исследования функционального состояния почек у детей с ПМР и РН на разных стадиях ТИПП установлено стадийное снижение скорости клубочковой фильтрации (СКФ) и канальцевых функций почек.
На основании результатов корреляционного анализа нами установлено, что на долю ренальной инфекции приходится 18,06% среди предикторов формирования ТИПП. Результаты корреляционного анализа подтверждены данными факторного анализа, установившего значение ренальной инфекции среди предикторов формирования ТИПП (38,05%). Результаты проведенного нами дисперсионного анализа установили, что на долю ренальной инфекции приходится 17,83% среди предикторов прогрессирования ТИПП, что также было подтверждено результатами факторного анализа (27,3%).
Нами установлены корреляционные связи СКФ и частоты ренальной инфекции (r = 0,8). По мере прогрессирования ТИПП отмечается снижение СКФ и частоты бактериального воспаления в тубулоинтерстициальной ткани почек. Нами установлены корреляционные связи показателей нарушения уродинамики и бактериальных факторов (частота ренальной инфекции) при формировании ТИПП (r = 0,9), но не установлены корреляционные связи показателей нарушения уродинамики с частотой атак ренальной инфекции при прогрессировании ТИПП (r = 0,1).
Нами установлено, что по мере прогрессирования ТИПП происходит стадийное снижение частоты бактериального воспаления тубулоинтерстициальной ткани почек, что доказывает превалирование процесса фиброгенеза над процессом бактериального воспаления по мере прогрессирования интерстициального фиброза у детей с РН.
Нарушение уродинамики является одним из факторов инициации интерстициального повреждения, влияет на активность бактериального воспаления тубулоинтерстициальной ткани почек при формировании ТИПП, но не влияет на активность бактериального воспаления в тубулоинтерстициальной ткани почек при прогрессировании ТИПП.
Ренальная инфекция является значимым предиктором формирования (38,05%) ТИПП у детей с ПМР, прогрессирования ТИПП (27,3%) у пациентов с РН.
Проведенное исследование обусловливает необходимость ранней диагностики, своевременной рациональной терапии и профилактики рецидивов ренальной инфекции у детей с ТИПП [27].
Литература
И. В. Зорин 1 , доктор медицинских наук, профессор
А. А. Вялкова, доктор медицинских наук, профессор
С. В. Плотникова
С. А. Чеснокова
Е. В. Гунькова
Острая почечная недостаточность – это потенциально обратимое, внезапно наступившее выраженное нарушение или прекращение функции почек. Характерно нарушение всех почечных функций (секреторной, выделительной и фильтрационной), выраженные изменения водно-электролитного баланса, быстро нарастающая азотемия. Диагностика осуществляется по данным клинических и биохимических анализов крови и мочи, а также инструментальных исследований мочевыделительной системы. Лечение зависит от стадии ОПН, включает симптоматическую терапию, методы экстракорпоральной гемокоррекции, поддержание оптимального артериального давления и диуреза.
МКБ-10
Общие сведения
Острая почечная недостаточность – внезапно развивающееся полиэтиологическое состояние, которое характеризуется серьезными нарушениями функции почек и представляет угрозу для жизни пациента. Патология может провоцироваться заболеваниями мочевыделительной системы, нарушениями со стороны сердечно-сосудистой системы, эндогенными и экзогенными токсическими воздействиями, другими факторами. Распространенность патологии составляет 150-200 случаев на 1 млн. населения. Пожилые люди страдают в 5 раз чаще лиц молодого и среднего возраста. В половине случаев ОПН требуется гемодиализ.

Причины
Преренальная (гемодинамическая) острая почечная недостаточность возникает вследствие острого нарушения гемодинамики, может развиваться при состояниях, которые сопровождаются снижением сердечного выброса (при тромбоэмболии легочной артерии, сердечной недостаточности, аритмии, тампонаде сердца, кардиогенном шоке). Нередко причиной становится уменьшение количества внеклеточной жидкости (при диарее, дегидратации, острой кровопотере, ожогах, асците, вызванном циррозом печени). Может формироваться вследствие выраженной вазодилатации при бактериотоксическом или анафилактическом шоке.
Ренальная (паренхиматозная) ОПН провоцируется токсическим или ишемическим поражением почечной паренхимы, реже - воспалительным процессом в почках. Возникает при воздействии на почечную паренхиму удобрений, ядовитых грибов, солей меди, кадмия, урана и ртути. Развивается при бесконтрольном приеме нефротоксичных медикаментов (противоопухолевые препараты, ряд антибиотиков и сульфаниламидов). Рентгенконстрастные вещества и перечисленные препараты, назначенные в обычной дозировке, могут стать причиной ренальной ОПН у больных с нарушением функции почек.
Кроме того, данная форма ОПН наблюдается при циркуляции в крови большого количества миоглобина и гемоглобина (при выраженной макрогемаглобинурии, переливании несовместимой крови, длительном сдавлении тканей при травме, наркотической и алкогольной коме). Реже развитие ренальной ОПН обусловлено воспалительным заболеванием почек.
Постренальная (обструктивная) ОПН формируется при остро возникшей обструкции мочевыводящих путей. Наблюдается при механическом нарушении пассажа мочи при двухсторонней обтурации мочеточников камнями. Реже возникает при опухолях предстательной железы, мочевого пузыря и мочеточников, туберкулезном поражении, уретритах и периуретритах, дистрофических поражениях забрюшинной клетчатки.
При тяжелых сочетанных травмах и обширных хирургических вмешательствах патология вызывается несколькими факторами (шок, сепсис, переливание крови, лечение нефротоксичными препаратами).
Симптомы ОПН
Выделяют четыре фазы острой почечной недостаточности:начальная, олигоанурическая, диуретическая, выздоровления. На начальной стадии состояние пациента определяется основным заболеванием. Клинически эта фаза обычно не выявляется из-за отсутствия характерных симптомов. Циркуляторный коллапс имеет очень малую продолжительность, поэтому проходит незамеченным. Неспецифичные симптомы ОПН (сонливость, тошнота, отсутствие аппетита, слабость) замаскированы проявлениями основного заболевания, травмы или отравления.
На олигоанурической стадии анурия возникает редко. Количество отделяемой мочи - менее 500 мл в сутки. Характерна выраженная протеинурия, азотемия, гиперфосфатемия, гиперкалиемия, гипернатиемия, метаболический ацидоз. Отмечается понос, тошнота, рвота. При отеке легкого вследствие гипергидратации появляется одышка и влажные хрипы. Больной заторможен, сонлив, может впасть в кому. Нередко развивается перикардит, уремический гастроэнтероколит, осложняющийся кровотечениями. Пациент подвержен инфекции вследствие снижения иммунитета. Возможен панкреатит, стоматит паротит, пневмония, сепсис.
Олигоанурическая фаза ОПН развивается в течение первых трех суток после воздействия, обычно длится 10-14 дней. Позднее развитие олигоанурической фазы считается прогностически неблагоприятным признаком. Период олигурии может укорачиваться до нескольких часов или удлиняться до 6-8 недель. Продолжительная олигурия чаще возникает у пожилых пациентов с сопутствующей сосудистой патологией. При продолжительности фазы более месяца необходимо провести дифференциальную диагностику для исключения прогрессирующего гломерулонефрита, почечного васкулита, окклюзии почечной артерии, диффузного некроза коры почек.
Длительность диуретической фазы составляет около двух недель. Суточный диурез постепенно увеличивается и достигает 2-5 литров. Отмечается постепенное восстановление водно-электролитного баланса. Возможна гипокалиемия вследствие значительных потерь калия с мочой. В фазе восстановления происходит дальнейшая нормализация почечных функций, занимающая от 6 месяцев до 1 года.
Осложнения
Выраженность нарушений, характерных для почечной недостаточности (задержка жидкости, азотемия, нарушение водно-электролитного баланса) зависит от состояния катаболизма и наличия олигурии. При тяжелой олигурии отмечается снижение уровня клубочковой фильтрации, существенно уменьшается выделение электролитов, воды и продуктов азотного обмена, что приводит к более выраженным изменениям состава крови.
При олигурии увеличивается риск развития водной и солевой сверхнагрузки. Гиперкалиемия вызвана недостаточным выведением калия при сохраняющемся уровне его высвобождения из тканей. У больных, не страдающих олигурией, уровень калия составляет 0,3-0,5 ммоль/сут. Более выраженная гиперкалиемия у таких пациентов может говорить об экзогенной (переливание крови, лекарственные препараты, наличие в рационе продуктов, богатых калием) или энодгенной (гемолиз, деструкция тканей) калиевой нагрузке.
Первые симптомы гиперкалиемии появляются, когда уровень калия превышает 6,0-6,5 ммоль/л. Больные жалуются на мышечную слабость. В некоторых случаях развивается вялый тетрапарез. Отмечаются изменения ЭКГ. Снижается амплитуда зубцов P, увеличивается интервал P-R, развивается брадикардия. Значительное повышение концентрации калия может вызвать остановку сердца. На первых двух стадиях ОПН наблюдаются гипокальциемия, гиперфосфатемия, слабо выраженная гипермагниемия.
Следствием выраженной азотемии является угнетение эритропоэза. Развивается нормоцитарная нормохромная анемия. Угнетение иммунитета способствует возникновению инфекционных заболеваний у 30-70% пациентов с острой почечной недостаточностью. Присоединение инфекции утяжеляет течение заболевания и нередко становится причиной смерти больного. Выявляется воспаление в области послеоперационных ран, страдает полость рта, дыхательная система, мочевыводящие пути. Частым осложнением ОПН является сепсис.
Отмечается сонливость, спутанность сознания, дезориентация, заторможенность, чередующаяся с периодами возбуждения. Периферическая нейропатия чаще возникает у пожилых пациентов. При ОПН может развиться застойная сердечная недостаточность, аритмия, перикардит, артериальная гипертензия. Больных беспокоит ощущение дискомфорта в брюшной полости, тошнота, рвота, потеря аппетита. В тяжелых случаях наблюдается уремический гастроэнтероколит, часто осложняющийся кровотечениями.
Диагностика
Основным маркером острой почечной недостаточности является повышение калия и азотистых соединений в крови на фоне значительного уменьшения количества выделяемой организмом мочи вплоть до состояния анурии. Количество суточной мочи и концентрационную способность почек оценивают по результатам пробы Зимницкого. Важное значение имеет мониторинг таких показателей биохимии крови, как мочевина, креатинин и электролиты, что позволяет судить о тяжести ОПН и эффективности проводимых лечебных мероприятий.
Главной задачей в диагностике ОПН является определение ее формы. Для этого проводится УЗИ почек и сонография мочевого пузыря, которые дают возможность выявить или же исключить обструкцию мочевыводящих путей. В некоторых случаях выполняется двусторонняя катетеризация лоханок. Если при этом оба катетера свободно прошли в лоханки, но выделение мочи по ним не наблюдается, можно с уверенностью исключить постренальную форму ОПН. При необходимости оценить почечный кровоток проводят УЗДГ сосудов почек. Подозрение на канальцевый некроз, острый гломерулонефрит или системное заболевание является показанием для биопсии почки.
Лечение ОПН
В начальной фазе терапия направлена, прежде всего, на устранение причины, которая вызвала нарушение функции почек. При шоке необходимо восполнить объем циркулирующей крови и нормализовать артериальное давление. При отравлении нефротоксинами больным промывают желудок и кишечник. Применение в практической урологии таких современных методов лечения как экстракорпоральная гемокоррекция позволяет быстро очистить организм от токсинов, которые стали причиной развития ОПН. С этой целью проводят гемосорбцию и плазмаферез. При наличии обструкции восстанавливают нормальный пассаж мочи. Для этого осуществляют удаление камней из почек и мочеточников, оперативное устранение стриктур мочеточников и удаление опухолей.
В фазе олигурии для стимуляции диуреза больному назначают фуросемид и осмотические диуретики. Для уменьшения вазоконстрикции почечных сосудов вводят допамин. Определяя объем вводимой жидкости, кроме потерь при мочеиспускании, рвоте и опорожнении кишечника, необходимо учитывать потери при потоотделении и дыхании. Пациента переводят на безбелковую диету, ограничивают поступление калия с пищей. Проводится дренирование ран, удаление участков некроза. При выборе дозы антибиотиков следует учитывать тяжесть поражения почек.
Гемодиализ назначается при повышении уровня мочевины до 24 ммоль/л, калия – до 7 ммоль/л. Показанием к гемодиализу являются симптомы уремии, ацидоз и гипергидратация. В настоящее время для предупреждения осложнений, возникающих вследствие нарушений метаболизма, врачи-нефрологи все чаще проводят ранний и профилактический гемодиализ.
Прогноз и профилактика
Летальность в первую очередь зависит от тяжести патологического состояния, ставшего причиной развития ОПН. На исход заболевания влияет возраст больного, степень нарушения функции почек, наличие осложнений. У выживших пациентов почечные функции восстанавливаются полностью в 35-40% случаев, частично – в 10-15% случаев. 1-3% больных необходим постоянный гемодиализ. Профилактика заключается в своевременном лечении заболеваний и предупреждении состояний, которые могут спровоцировать ОПН.
Что такое хронический пиелонефрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лычагин А. С., уролога со стажем в 17 лет.
Над статьей доктора Лычагин А. С. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
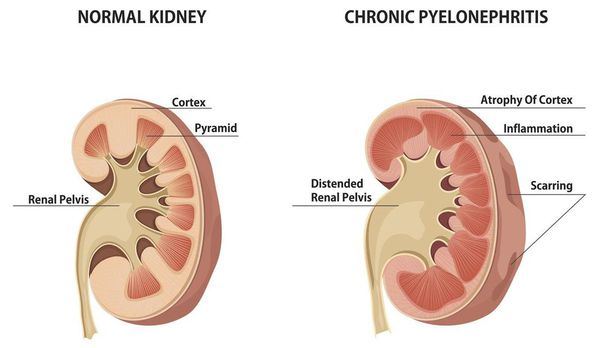
Хронический пиелонефрит — почечная патология, характеризующаяся длительно протекающим воспалительным процессом в почках. Вызывается воспаление разными видами бактерий, процесс затрагивает как чашечно-лоханочные структуры, так и интерстиций (соединительную ткань) почек. [1] [3]
Эпидемиология хронического пиелонефрита такова, что на его долю приходится до 65% всех воспалительных заболеваний мочеполового тракта. Примерно в трети случаев описываемому заболеванию предшествует острый пиелонефрит. Отчетливо отмечено гендерное различие в частоте заболеваемости — преимущественно болеет женский пол (в 3-5 раз чаще). Объясняется этот факт особенностями анатомии женской мочевыделительной системы: короткая уретра, которая облегчает инвазию микроорганизмов в мочевыводящую систему.
Средняя заболеваемость составляет 18 случаев на 1000 населения. [2] [3]
Ведущий этиологический фактор, провоцирующий развитие хронического пиелонефрита — бактериальная флора. Хронический пиелонефрит вызывается как одним видом микроорганизмов, так и микробными ассоциациями, когда при бактериологическом исследовании выделяется сразу несколько видов микроорганизмов. [4] [7] Среди возбудителей выделяют:
- Escherichia coli (высевается у 75-95% пациентов);
- Staphylococcus saprophyticus (определяется в 5-10% случаев);
- Klebsiella pneumoniae
- прочие энтеробактерии (род Enterobacteriaceae);
- Proteus mirabilis;
- грибки;
- стафилококки;
- синегнойная палочка.
Особую роль в патогенезе хронического пиелонефрита играют так называемые L-формы возбудителей. Они отличаются высокой резистентностью к химиопрепаратам и возникают под действием нерациональной антибиотикотерапии. Именно их активизация в определённых условиях вызывает очередное обострение пиелонефрита. [4] [7]
Хронизации процесса в большинстве случаев предшествует острая атака пиелонефрита. Этому способствуют разнообразные факторы (большинство из них вызывают значимые нарушения уродинамики):
-
;
- переохлаждение; (опущение почки); ;
- стриктуры мочеточников;
- уретрит;
- пузырно-мочеточниковый рефлюкс (обратный заброс мочи из пузыря в мочеточники).
Вялотекущий воспалительный процесс любой другой локализации (тонзиллит, отит, абсцесс, стоматит, гастроэнтерит) способен длительное время поддерживать и провоцировать обострение хронического пиелонефрита. Хронические интоксикации (алкогольная, наркотическая и другие), иммунодефициты, соматические заболевания (сахарный диабет, метаболический синдром) также способствуют формированию хронического пиелонефрита.
У девушек в качестве провоцирующего фактора нередко выступает половая жизнь, а у женщин — беременность и роды.
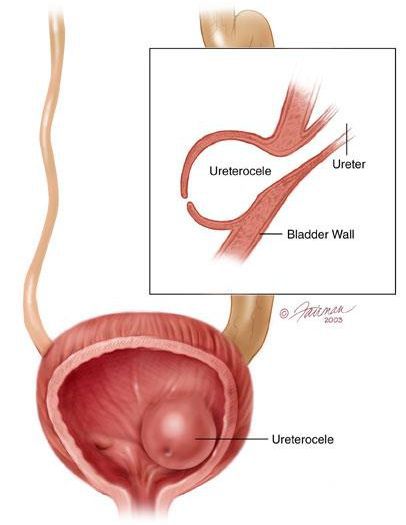
В детском возрасте развитие данной патологии связано с аномалиями развития мочеполовой системы, например, с уретероцеле.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы хронического пиелонефрита
Клинические проявления пиелонефрита зависят от активности воспалительного процесса.
Для латентной фазы характерна скудная симптоматика. Больных беспокоит незначительное повышение температуры, отмечается повышенная утомляемость, периодические головные боли. Патологические проявления со стороны почек и других органов отсутствуют либо выражены в минимальной форме. Часть пациентов жалуются на полиурию и повышение артериального давления. В анализе мочи выявляется незначительная протеинурия, бактериурия, периодически появляются лейкоциты. [1] [3] [7]
Фаза активного воспаления проявляется следующими симптомами:
- чувство тяжести и боли в пояснице (в области почек) ноющего характера;
- дизурические явления в виде учащённого мочеиспускания;
- анемический синдром;
- стойкая гипертония;
- в анализе мочи определяется большое количество белка, лейкоцитов и бактерий, в тяжёлых случаях возникает гематурия (попадание крови в мочу).
При выраженном повышении артериального давления говорят о гипертоническом варианте хронического пиелонефрита, при этом гипертония носит злокачественный характер и с трудом поддаётся коррекции.
Хроническое поражение почек зачастую сопровождается гипохромной анемией. Это свидетельствует о развитии анемического варианта патологии.
В стадии стойкой ремиссии какие-либо значимые симптомы отсутствуют.
Для более наглядного восприятия симптомы разных фаз хронического пиелонефрита отображены в табличном виде. [4]
Читайте также:

