Для лечения лепры применяют
Обновлено: 25.04.2024
Лекарства для лечения туберкулеза и лепры
За последние 100 лет благодаря достижениям в гигиене значительно снизилась заболеваемость туберкулезом в развитых странах. Инфекцию, вызванную Mycobacterium tuberculosis, в большинстве случаев можно устранить с помощью системной длительной терапии (6-12 мес.) эффективными химиопрепаратами.
Тем не менее во всем мире туберкулез остается одним из самых опасных заболеваний. В развивающихся странах долговременная комбинированная терапия врядли осуществима.
Успеху лечения препятствует слабая медицинская инфраструктура, отсутствие финансирования и низкая приверженность пациентов к лечению. В результате миллионы человек умирают ежегодно из-за туберкулезной инфекции. Недостаточное лечение влечет за собой дополнительное отрицательное последствие: у все большего числа штаммов микобактерий развивается резистентность, возрастающая до нескольких препаратов одновременно (туберкулез с чрезвычайной лекарственной резистентностью), в силу чего невозможно провести адекватное лечение. У пациентов с иммунодефицитом заболевание, вызванное инфекцией М. tuberculosis, протекает тяжелее.
Противотуберкулезные препараты
Препаратами выбора являются изониазид, рифампицин и этамбутол, вместе со стрептомицином и пиразинамидом. Сочетания двух или трех препаратов используются в первые месяцы лечения.
а) Изониазид обладает бактерицидным свойством в отношении М. tuberculosis. Внутри бактерии он превращается каталазой/пероксидазой в изоникотиновую кислоту, накапливающуюся в клетке, где она ингибирует синтез миколовых кислот. Обычно эти кислоты образуют слой, охраняющий микроб от защитных иммунных механизмов хозяина. Миколовые кислоты связаны полисахаридом арабиногалактаном, который связывается с муреином клеточной стенки.
Изониазид быстро всасывается после введения внутрь. В печени он активируется путем ацетилирования. К значимым побочным эффектам относятся периферическая нейропатия, неврит зрительного нерва, который можно предупредить введением витамина В6 (пиридоксин), и повреждение печени.
б) Рифампин. Источник заболевания, антибактериальная активность и пути введения описаны в отдельной статье на сайте. Несмотря нехорошую в основном переносимость, данный препарат может вызывать ряд побочных эффектов, в т. ч. повреждение печени, гиперчувствительность с гриппоподобными симптомами, неприятное, но безобидное изменение цвета жидкостей организма на красный/оранжевый и индукцию ферментов (которая проявляется, например, неэффективностью пероральных контрацептивов и т. п.).
О рифабутине полдробно расписано в отдельной статье на сайте.
в) Пиразинамид тоже ингибирует синтез миколовой кислоты через активный метаболит. Он вводится внутрь. Препарат нарушает функцию печени и вызывает гиперурикемию за счет подавления выведения уратов почками.
г) Стрептомицин должен вводится в/в, как и другие аминогликозидные антибиотики. Он повреждает внутреннее ухо и лабиринт. У него сравнительно низкая нефротоксичность.
д) Этамбутол ингибирует синтез арабиногалактана. Этамбутол вводится внутрь. Обычно хорошо переносится, но может вызывать дозозависимые необратимые нарушения зрения (красно-зеленая цветовая слепота, дефекты полей зрения).
Противолепрозные препараты
Рифампицин часто применяется в сочетании с одним или двумя препаратами, указанными ниже.
а) Дапсон является сульфоном, который как и сульфаниламиды, ингибирует синтез ДГФ. Он обладает бактерицидным свойством против чувствительных к нему штаммов М. leprae. Дапсон вводится внутрь. Наиболее частой нежелательной реакцией является метгемоглобинемия с ускоренным разрушением эритроцитов (гемолиз).
б) Клофазимин — краситель с бактерицидной активностью в отношении M. leprae и противовоспалительными свойствами. Он вводится внутрь, но всасывается не полностью. Из-за высокой липофильности препарат накапливается в жировой и других тканях и достаточно медленно покидает организм (t1/2 70 дней). Красно-коричневая пигментация кожи является нежелательной реакцией, особенно у пациентов со светлой кожей.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В статье отражены современные представления о лепре, представлены современные данные литературы, посвященные вопросам эпидемиологии заболевания, особенностям клинической картины, диагностики, дифференциальной диагностики и лечения дерматоза.
The article summarizes information about the disease leprosy. Data of the literature on epidemiology of the disease, the features of the clinical picture, diagnosis, differential diagnosis and treatment of the dermatosis are presented.
Лепра (проказа, болезнь Хансена) — хроническое инфекционное заболевание из группы микобактериозов, характеризующееся продолжительным инкубационным периодом и рецидивирующим течением. Заболевание носит системный характер и поражает производные эктодермы — кожные покровы, слизистые оболочки и периферическую нервную систему. В настоящее время, несмотря на применение эффективной схемы антибиотикотерапии и устранение угрозы эпидемии лепры, по всему миру продолжают ежегодно выявляться новые случаи заболевания, поэтому перспектива полной ликвидации болезни ставится под сомнение [1–3].
Распространенность лепры в мире стабильно снижается из года в год. Согласно данным ВОЗ, количество новых случаев, каждый год выявляемых во всем мире, уменьшилось с 763 000 в 2001 г. до 249 000 в 2008 г. [1]. В 2013 г. было выявлено 215 656 новых случаев заболевания, в 2014 г. — 213 899, в 2015 г. — 211 973 [2, 3].
Глобальная статистика свидетельствует о том, что 96% (203 600 человек) новых случаев заражения лепрой были выявлены в 22 государствах (таких как Индия, Бразилия, Ангола, Конго, Судан, Эфиопия и др.). На долю других стран приходятся оставшиеся 4% [3].
Одной из шести стран мира с наиболее высокой распространенностью лепры является Бразилия, где ежегодно диагностируется более 30 000 новых случаев заболевания. В 2014 г. распространенность лепры в Бразилии составила 1,27 случая на 10 000 жителей. Уровень распространенности дерматоза по стране неравномерен: помимо эндемичных по лепре регионов существуют и такие, в которых отмечается низкий уровень распространенности лепры [4].
В России эндемичным регионом по лепре является Астраханская область. За последние десятилетия больные лепрой были выявлены и в других субъектах Российской Федерации: в Сибири, на Северном Кавказе и Дальнем Востоке [9, 10]. Однако стоит отметить, что, благодаря внедрению в практику целого комплекса противолепрозных мероприятий, заболеваемость лепрой в России носит устойчивый спорадический характер. В 2015 г. на учете состояло 240 больных, из них в Астраханской области — 135 [10].
Возбудителями лепры являются Mycobacterium leprae (M. leprae) и Mycobacterium lepromatosis (M. lepromatosis). M. leprae была впервые открыта норвежским врачом Герхардом Хансеном в 1873 г. [11]. Данный микроорганизм относится к семейству Mycobacteriaceae и является кислото- и спиртоустойчивой бактерией, которая представляет из себя грамположительную прямую или изогнутую палочку длиной 1–7 мкм и диаметром 0,2–0,5 мкм [12]. M. leprae может длительное время сохранять жизнеспособность при низких температурах и высушивании. Данному микроорганизму свойственен крайне медленный рост, который зачастую не характерен для бактерий (одно деление продолжается приблизительно 12 суток) [12]. Возбудитель заболевания является облигатным внутриклеточным паразитом. M. leprae способна продолжительно персистировать в макрофагах человека, что обеспечивается взаимодействием различных механизмов (антигенная изменчивость и пр.). Именно поэтому пациенты, выписанные из лепрозориев на амбулаторное лечение с персистирующими формами лепры, могут быть источником заражения [9].
В 2008 г. был открыт второй возбудитель лепры — M. lepromatosis, который, в отличие от M. leprae, является некислотоустойчивой бактерией и вызывает преимущественно тяжелый диффузный лепроматозный тип лепры [13, 14].
От других инфекционных заболеваний лепру отличает длительный инкубационный период, который варьирует от 2–3 месяцев до 50 лет (в среднем составляя 4–6 лет) [11].
Общепризнан воздушно-капельный путь передачи инфекционных агентов, однако не исключаются другие пути заражения — через укусы кровососущих насекомых и поврежденные кожные покровы. Лепра является малоконтагиозным заболеванием. Заражение микобактериями лепры происходит в результате длительного тесного общения с больным, не получающим лечения, вследствие сенсибилизации, нарастающей при повторяющихся контактах, снижения сопротивляемости организма (в результате неполноценного питания, тяжелых физических нагрузок, частых простудных заболеваний, алкоголизма и других интоксикаций) и иммуногенетической восприимчивости [11].
На восприимчивость к лепре оказывают влияние различные наборы генов, в том числе системы антигена лейкоцитов человека (HLA). В настоящее время изучаются изменения в генах-кандидатах, участвующих в ответной реакции организма хозяина на инфекционный агент. Исследования геномного сканирования выявили связывающие пики для лепры в областях хромосом 6p21, 17q22, 20p13 и 10p13 [15, 17].
Устойчивость к заражению M. leprae обеспечивается, с одной стороны, низкой вирулентностью M. leprae, с другой — индивидуальными особенностями врожденного иммунитета. Важную роль в поддержании врожденного иммунитета играет целостность эпителия, секрет желез и поверхностный иммуноглобулин A (IgA). Кроме того, уничтожать микобактерии, независимо от активации адаптивного иммунитета, могут NK-клетки, цитотоксические Т-лимфоциты и активированные макрофаги. При заражении регулирование воспалительных цитокинов и хемокинов приводит к пролиферации либо Т-хелперов 1-го типа (Th1), либо Т-хелперов 2-го (Th2) типа, что способствует активации клеточного или гуморального звена иммунитета, что определяет клиническую форму заболевания [16, 17].
Клеточный иммунитет неэффективен в отношении предотвращения развития заболевания у лиц с туберкулоидной формой лепры. Гуморальный иммунитет у лиц с лепроматозной формой заболевания, ответственный за продуцирование IgM против PGL-1 (фенольный гликолипид-1), не обеспечивает защиту и не предотвращает диссеминацию бактерий [17].
Высокий уровень ФНО-α в сыворотке крови у пациентов с туберкулоидной формой лепры свидетельствует об участии данного цитокина в деструкции M. leprae и образовании гранулемы. ФНО-α участвует в иммунной защите посредством активации макрофагов, однако гиперпродукция ФНО-α и его взаимодействие с ИФН-γ способствуют повреждению тканей и формированию узловатой лепрозной эритемы (ENL) [17].
При лепроматозной форме лепры наблюдается повышенный уровень трансформирующего фактора роста бета (ТФР-β), отсутствующего при туберкулоидной форме и проявляющегося в небольшом количестве при пограничной форме лепры. ТФР-β подавляет активацию макрофагов, что ингибирует продуцирование ФНО-α и ИФН-γ, способствуя персистенции инфекции [17].
О механизмах трансмиссии лепры известно, что микобактерии проникают в клетки эндотелия и оседают в Шванновских клетках нервов кожи, к которым имеют тропизм, где в дальнейшем происходит долговременный период их адаптации и размножения. Остается неизвестным, как колонизация Шванновских клеток микобактериями лепры приводит к распространению инфекции в другие ткани [18]. Нейронный тропизм M. leprae обусловлен его связыванием с областью G на мостике молекулы ламинина альфа-2, а альфа-дистрогликан служит рецептором для M. leprae на Шванновских клетках [18].
В работе Masaki и соавт. (2013), в исследовании in vitro и in vivo с использованием мышей, определялось взаимодействие M. leprae со Шванновскими клетками. Исследование показало, что M. leprae изменяют дифференцировку Шванновских клеток до клеток-предшественников [19]. Клеточная перестройка приводит к снижению регуляции Шванновской клеточной линии Sox10 [19]. Таким образом, M. leprae способствуют распространению инфекционного процесса через два механизма: прямая дифференцировка Шванновских клеток в мезенхимальные ткани и образование гранулемаподобных структур, которые выделяют бактерионесущие макрофаги [19]. Исследование расширяет понимание о пластичности зрелых клеток и демонстрирует свойства M. leprae, приводящих к перестройке взрослых клеток в стволовые [18]. Распространение инфекции путем дифференцировки Шванновских клеток возможно при их инфицировании большим количеством M. leprae. Методология, используемая на мышах, у которых нет Т-клеток, упрощает воспалительное микроокружение в преимущественно макрофаги [19]. Данная работа описывает перспективную in vitro модель для объяснения патогенеза M. leprae, но необходимы подробные исследования, прежде чем экстраполировать выводы на течение инфекционного процесса в организме человека [18].
Существует две классификации лепры: мадридская классификация, принятая в 1953 г., а также ее последующая модификация, предложенная Д. С. Ридли и В. Джоплингом в 1973 г. [11].
Согласно мадридской классификации выделяют два полярных типа лепры: туберкулоидный и лепроматозный и два промежуточных типа: недифференцированный и пограничный (диморфный) [11].
В классификации Ридли–Джоплинга выделяют три типа лепры — недифференцированный (I — Indeterminate), туберкулоидный (Tuberculoidtype — TT) и лепроматозный (Lepromatoustype — LL). Лепроматозный и туберкулоидный типы являются полярными. Кроме того, различают субполярные и пограничные группы заболевания. Классификация Ридли–Джоплинга не нашла широкого применения ввиду сложности, поэтому в практической деятельности различают лепроматозный и туберкулоидный тип лепры, а также пограничный тип, который в дальнейшем может трансформироваться в одну из первых двух форм [20].
При лепроматозном типе лепры поражается как периферическая, так и центральная нервная система с развитием невротических расстройств, реже — психозов и поражений по типу невритов и полиневритов. В большинстве случаев поражаются лучевые, малоберцовые и большие ушные нервы: они утолщаются и становятся доступными для пальпации. В последующем развиваются двигательные и трофические расстройства, а также нарушения чувствительности. Больным свойственны невралгии, гиперестезии, парестезии, неадекватное или замедленное реагирование на раздражение, аналгезия. На фоне трофических нарушений развивается процесс мутиляции кистей и стоп. Поражение внутренних органов характеризуется неспецифическими изменениями в печени, легких, селезенке и нарушением функции некоторых желез внутренней секреции [11].
При недифференцированной форме лепры специфические высыпания отсутствуют. Для данной формы характерно появление небольшого количества бледных пятен различной величины с нечеткими границами, а также поражение периферической нервной системы по типу полиневрита. Как правило, выявить возбудителя у этой категории лиц удается крайне редко [11].
При развитии обострений лепрозного процесса форма заболевания может меняться. Несмотря на множество клинических проявлений лепры, окончательная постановка диагноза не всегда является простой задачей, так как отсутствуют патогномоничные клинические признаки заболевания [25].
При диагностике лепры учитывают данные эпидемиологического анамнеза (пребывание в эндемичном регионе, контакты с больными лепрой), объективного осмотра (обращают внимание на характер и длительность существования высыпаний, наличие признаков нарушений периферической иннервации).
Общепринятым лабораторным методом диагностики лепры считается бактериоскопическое исследование. Соскобы для исследования берут с очагов поражения на коже и слизистой оболочке носа путем легкого поскабливания. Мазок помещают на предметное стекло и окрашивают по Цилю–Нильсену. Также исследуют пунктат из бедренных или паховых лимфатических узлов. Однако бактериоскопическое исследование имеет очень низкую чувствительность, особенно у больных с промежуточной или туберкулоидной формой поражения [26].
Лепроминовая реакция (проба Митсуды) является показателем способности хозяина поддерживать в своем организме клеточный иммунитет к M. leprae. Проба Митсуды не всегда является достоверной, так как у 10% здоровых по лепре людей может наблюдаться отрицательная реакция. Ограничивают применение лепроминового теста и технические трудности, связанные с получением лепромина и его внутрикожным введением [11].
Наиболее чувствительным методом диагностики, позволяющим определять M. leprae, является полимеразная цепная реакция (ПЦР). ПЦР на данный момент считается наиболее перспективной из прямых диагностических методик и применяется для диагностики любого типа лепры [10, 18]. Преимуществом ПЦР являются неинвазивность и простота получения клинического материала, что предоставляет возможность проведения скрининга большого количества образцов при обследовании пациентов в высокоэндемичных по этому заболеванию регионах. Применение ПЦР позволяет усовершенствовать диагностику лепры и выявлять заболевание на ранней стадии [26].
Используемые в настоящее время традиционные методы диагностики, такие как лепроминовая проба и бактериоскопическое исследование, не всегда позволяют подтвердить диагноз лепры на ранних стадиях заболевания. При этом эффективность лечебных и профилактических мероприятий определяется возможностью ранней диагностики заболевания. В мире постоянно регистрируются новые случаи лепры, поэтому актуальным вопросом остается разработка и внедрение новых, более точных, методов диагностики, которые стали бы доступными для широкого использования и позволили с высокой степенью достоверности диагностировать лепру на ранних стадиях развития заболевания.
Лечение заболевания стандартизовано ВОЗ в 1981 г. [28]. Комбинированная лекарственная терапия включает в себя использование трех основных препаратов: дапсон, рифампицин и клофазимин [28].
Дапсон — бактериостатический препарат, действующий как конкурентный ингибитор ферментов дигидрофолатсинтетазы и дигидрофолатредуктазы, которые являются ключевыми ферментами путей биосинтеза фолатов в микобактериях лепры [28].
Рифампицин — оказывает в отношении M. leprae бактерицидное действие. Является селективным ингибитором ДНК-зависимой РНК-полимеразы и блокирует синтез РНК [29].
Клофазимин — жирорастворимый кристаллический краситель красноватого цвета с бактериостатическим и противовоспалительным свойствами. Механизм антибактериального действия клофазимина изучен недостаточно. Вероятно, он связан с блокировкой матричной функции ДНК, повышением фагоцитарной активности макрофагов и синтеза лизосомальных ферментов [28]. Клофазимин и рифампицин обладают эффективностью в отношении дапсонрезистентных микроорганизмов.
В 1997 г. ВОЗ была установлена продолжительность курса лечения: 6 месяцев для мультибациллярных форм лепры и 12 месяцев для олигобациллярных. Дапсон назначается в дозировке 100 мг для взрослых один раз в день, рифампицин в дозировке 600 мг один раз в месяц, клофазимин в дозировке 300 мг один раз в месяц. Для лечения детей применяются более низкие дозы препаратов [28]. В случае невозможности применения одного или двух препаратов из вышеперечисленных существуют схемы лечения с применением фторхинолонов, которые также показали свою эффективность в отношении M. leprae [30].
Своевременная диагностика лепры, профилактика распространения лепры беженцами и вынужденными переселенцами, особенно из высокоэндемичных государств (Бангладеш, Филиппинские острова, Индия, Ангола, Бразилия, Шри-Ланка и др.), являются серьезной и актуальной проблемой для мирового здравоохранения, одной из приоритетных задач при осуществлении контроля над здоровьем иностранных граждан и лиц без гражданства, въезжающих на территорию страны. В Российской Федерации, в соответствии с существующим порядком, установленным на законодательном уровне, для контроля над распространением заболеваний среди населения, нерезидентам Российской Федерации необходимо пройти медицинское освидетельствование в медицинских организациях. Однако данная процедура освидетельствования осложнена отсутствием комплексной методологической платформы.
Таким образом, несмотря на снижение распространенности лепры, представляется актуальным усиление контроля за обязательным обследованием на лепру прибывающих в страну иностранных граждан, разработка отечественных аналогов лекарственных препаратов и поиск новых схем лечения больных лепрой.
Литература
А. А. Кубанов*, доктор медицинских наук, профессор, член-корреспондент РАН
Т. В. Абрамова**, кандидат медицинских наук
Е. К. Мураховская* , 1 , кандидат медицинских наук
В. А. Ласачко*
* ФГБОУ ДПО РМАНПО МЗ РФ, Москва
** ФГБУ ГНЦДК МЗ РФ, Москва
Лепра - это системный инфекционный процесс с хроническим течением, вызываемый микобактериями лепры и сопровождающийся эпидермальными, висцеральными проявлениями, а также признаками поражения нервной системы. Выделяют 4 клинические формы лепры: лепроматозную, туберкулоидную, недифференцированную и пограничную. Типичными признаками лепры служат кожные проявления (эритематозно-пигментные пятна, узелки, бугорки), полиневриты, резкая деформация и обезображивание лица, конечностей и др. Установлению диагноза лепры способствует проведение лепроминовой пробы, бактериоскопии и патогистологического исследования биоптата из пораженных очагов. Лечение лепры проводится длительно, повторными курсами противолепрозных препаратов.
МКБ-10
Общие сведения

Причины лепры
Открытие возбудителя лепры - Mycobacterium leprae, принадлежит норвежскому врачу А. Хансен (1874 г.). Микобактерия лепры представляет собой грамположительную палочковидную бактерию длиной 1-7 мкм и диаметром 0,2-0,5 мкм, по своей морфологии и свойствам близкую к микобактериям туберкулеза. Бацилла Хансена является облигатным внутриклеточным паразитом, поражающим тканевые макрофаги и обладающим выраженным тропизмом к коже и нервной ткани.
Источниками лепрозной инфекции выступают больные люди, которые выделяют возбудителей с носовой слизью, слюной, грудным молоком, семенной жидкостью, мочой, каловыми массами, отделяемым изъязвившихся лепром кожи. Также естественным резервуарами инфекции могут являться животные - броненосцы и обезьяны. Инфицирование микобактериями лепры происходит преимущественно воздушно-капельным путем, реже - при повреждении кожного покрова или укусах кровососущих насекомых. Описаны случаи заражения при нанесении татуировок.
Лепра считается малоконтагиозной болезнью; обычно инфицированию предшествует регулярный и длительный контакт с больным. Здоровые люди обладают высокой естественной резистентностью к лепре. В большей степени к лепрозной инфекции восприимчивы дети, а также лица, страдающие хроническими интеркуррентными заболеваниями, алкоголизмом, наркоманией. Достоверная продолжительность инкубационного периода не установлена; по данным различных авторов, она может составлять от 2-3 месяцев до 20 и более лет (в среднем 3-7 лет).
Классификация
Согласно общепринятой классификации, выделяют 4 основных клинических типа лепры: лепроматозный, туберкулоидный, недифференцированный и пограничный (диморфный). Недифференцированная лепра считается ранним проявлением заболевания, из которого в дальнейшем развиваются два полярных клинико-иммунологических варианта – лепроматозный или туберкулоидный. Для наиболее злокачественного типа - лепроматозной лепры характерно присутствие больших количеств микобактерий в организме и отрицательный характер лепроминовой пробы. При сравнительно благоприятном, туберкулоидном типе лепры, напротив, имеет место небольшое количество возбудителя и положительная лепроминовая реакция.
В течении каждого из вариантов лепры отмечаются стационарная, прогрессирующая, регрессивная и резидуальная стадия. Первые две стадии характеризуются лепрозными реакциями – обострением очагов заболевания, несмотря на проводимую терапию.
Симптомы лепры
Лепроматозная лепра
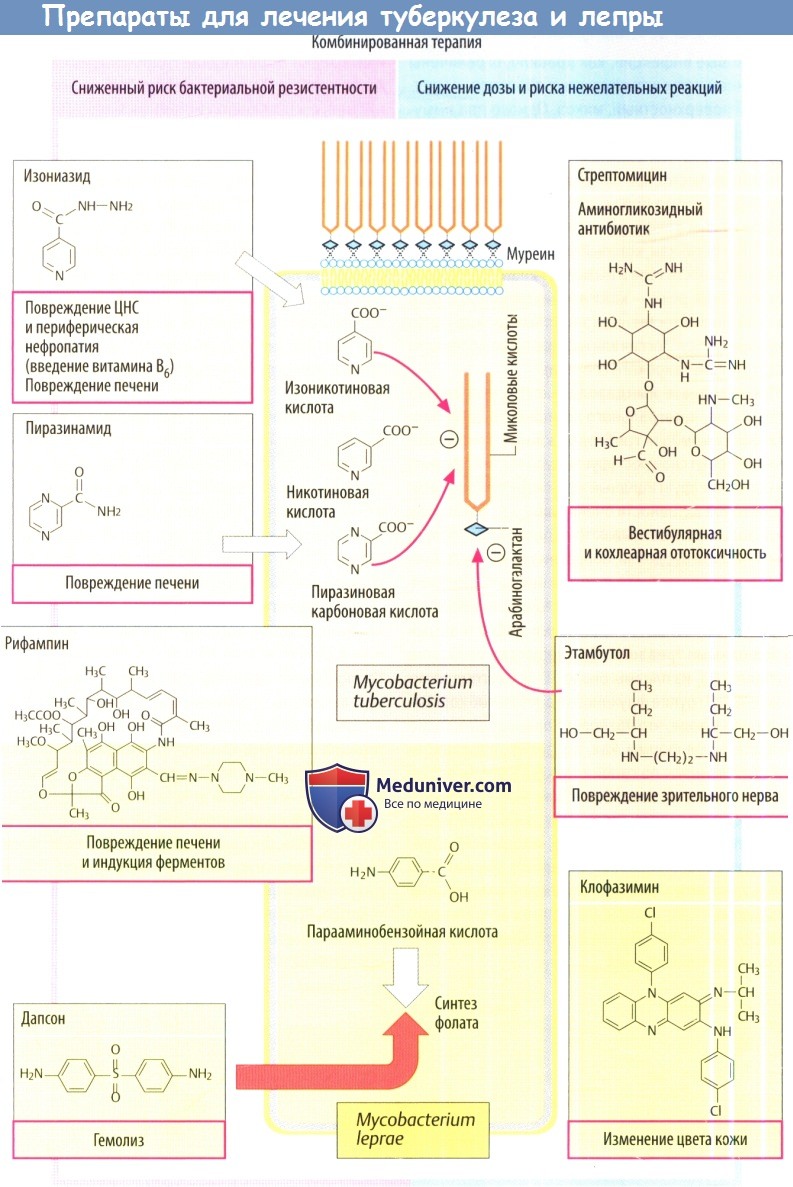
Самый неблагоприятный клинический вариант лепры, протекающий с генерализованным поражением кожи, слизистых оболочек, глаз, периферических нервов, лимфоузлов, внутренних органов. Кожный синдром характеризуется наличием симметричных эритематозных пятен на лице, кистях, предплечьях, голенях, ягодицах. Вначале они имеют красный цвет, округлую или овальную форму, гладкую блестящую поверхность, однако со временем приобретают буро-ржавый цвет. Спустя месяцы и даже годы кожа в области этих высыпаний уплотняется, а сами элементы превращаются в инфильтраты и бугорки (лепромы).
На гладкой лоснящейся поверхности лепром могут определяться участки шелушения кожи, телеангиэктазии. При отсутствии лечения лепромы изъязвляются; заживление язв происходит длительно с образованием келоидного рубца. Кожа подмышечных впадин, локтевых, подколенных, паховых областей, волосистой части головы не поражается.
При лепроматозной лепре в патологический процесс часто вовлекаются глаза с развитием конъюнктивита, эписклерита, кератита, иридоциклита. Типична заинтересованность слизистой оболочки полости рта, гортани, языка, красной каймы губ и особенно слизистой оболочки носа. В последнем случае возникают носовые кровотечения, ринит; в дальнейшем – инфильтрация и лепромы. При развитии лепром в области хрящевой перегородки носа может произойти ее перфорация и возникнуть деформация носа. Поражение гортани и трахеи при лепроматозном типе лепры приводит к нарушению голоса вплоть до афонии, стенозу голосовой щели. Висцеральные поражения представлены хроническим гепатитом, простатитом, уретритом, орхитом и орхиэпидидимитом, нефритом. Вовлечение в специфический процесс периферической нервной системы протекает по типу симметричного полиневрита. При лепре развиваются расстройств чувствительности, трофические и двигательные нарушения (парез мимической мускулатуры, контрактуры, трофические язвы, мутиляции, атрофия потовых и сальных желез).
Течению лепроматозной лепры свойственны периодические обострения (лепроматозные реакции), во время которых происходит увеличение и изъязвление лепром, образование новых элементов, возникает лихорадка, полилимфаденит.
Туберкулоидная лепра
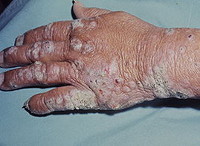
Туберкулоидный тип лепры протекает более доброкачественно с поражением кожи и периферических нервов. Дерматологические признаки характеризуются возникновением гипохромных или эритематозных пятен с четкими контурами на коже лица, туловища, верхних конечностей. По периферии пятен появляются плоские плотные папулы красновато-фиолетового оттенка, напоминающие красный плоский лишай. Сливаясь между собой, папулы образуют бляшки кольцевидной конфигурации (фигурный туберкулоид), в центре которых появляется участок депигментации и атрофии. На пораженных участках кожи снижаются функций потовых и сальных желез, развивается сухость и гиперкератоз, происходит выпадение пушковых волос. При туберкулоидной лепре часто поражаются ногти, которые становятся тускло-серыми, утолщенными, деформированными, ломкими.
Недифференцированная и пограничная лепра
При недифференцированном типе лепры типичные дерматологические проявления отсутствуют. Вместе с тем, на коже у больных данной формой лепры возникают асимметричные участки гипо- или гиперпигментации, сопровождающиеся снижением кожной чувствительности и ангидрозом. Поражение нервов протекает по типу полиневритов с параличами, деформацией и трофическим изъязвлениями конечностей.
Кожные проявления пограничной лепры представлены асимметричными пигментными пятнами, отдельными узлами или выступающими бляшками застойно-красного цвета. Обычно высыпания локализуются на нижних конечностях. Неврологические проявления включают асимметричные невриты. В дальнейшем недифференцированная и пограничная лепра может трансформироваться как в лепроматозную, так и в туберкулоидную форму.
Диагностика
Лепра - не такое уж забытое заболевание, и вероятность столкнуться с ним в клинической практике имеют врачи различных специальностей: инфекционисты, дерматологи, неврологи и др. Поэтому следует проявлять настороженность и исключать лепрозный процесс у пациентов с длительно не регрессирующими кожными высыпаниями (эритемой, пигментными пятнами, папулами, инфильтратами, бугорками, узлами), нарушением различных видов чувствительности на отдельных участках кожи, утолщением нервных стволов и другими типичными проявлениями. Более точную диагностику позволяет провести бактериоскопическое выявление микобактерий лепры в соскобах слизистой оболочки носа и пораженных участков кожи, гистологических препаратах лепрозных бугорков и лимфоузлов.
Результаты реакции на лепромин позволяют дифференцировать тип лепры. Так, туберкулоидная форма лепры дает резко положительный лепроминовый тест; лепроматозная форма – отрицательный. При недифференцированной лепре реакция на лепроматозный антиген слабоположительная или отрицательная; при пограничной лепре - отрицательная. Меньшей специфичностью обладают функциональные пробы с никотиновой кислотой, гистамином, горчичником, проба Минора.
Лепру следует дифференцировать с целым рядом заболеваний кожи и периферической нервной системы. Среди дерматологических проявлений сходством с лепрой обладают высыпания в третичном периоде сифилиса, многоформная экссудативная эритема, токсикодермия, туберкулез и саркоидоз кожи, красный плоский лишай, лейшманиоз, узловатая эритема и др. Из поражений нервной системы необходимо исключить сирингомиелию, невриты травматического генеза, невральную амиотрофию Шарко-Мари-Тута и пр.
Лечение лепры
В настоящее время лепра является излечимым заболеванием. При распространенных кожных проявлениях, положительных результатах микроскопии или рецидивах лепры больные госпитализируются в специальные противолепрозные учреждения. В остальных случаях пациенты получают терапию амбулаторно по месту жительства.
Лечение лепры проводится длительно и комплексно, курсовым методом. Одновременно назначают 2-3 противолепрозных средства, основными из которых служат препараты сульфонового ряда (диаминодифенилсульфон, сульфаметрол и др.). Во избежание развития лекарственной резистентности препараты и их сочетание меняют каждые 2 курса лечения. Продолжительность курса специфического лечения лепры составляет несколько лет. Также применяются антибиотики (рифампицин, офлоксацин), иммунокорректоры, витамины, адаптогены, гепатопротекторы, препараты железа. С целью повышения иммунореактивности больным лепрой показана вакцинация БЦЖ.
Для предупреждения инвалидизации с самого начала лечения больным лепрой назначается массаж, ЛФК, механотерапия, физиотерапевтическое лечение, ношение ортопедических пособий. Важными составляющими комплексной реабилитации выступают психотерапия, профессиональная переориентация, трудоустройство, преодоление лепрофобии в обществе.
Прогноз и профилактика
Прогноз лепры зависит от клинической формы патологии и сроков начала терапии. Ранняя диагностика и начало лечения (в течение года от момента развития симптомов лепры) позволяют избежать инвалидизирующих последствий. В случае более позднего выявления лепры сохраняются нарушения чувствительности, парезы, обезображивающие деформации. При отсутствии лечения гибель пациентов может наступить от лепрозной кахексии, асфиксии, амилоидоза, интеркуррентных заболеваний.
Система профилактики лепры предусматривает обязательную регистрацию и учет больных, госпитализацию впервые выявленных пациентов, диспансерное наблюдение за членами семьи и контактными лицами. Общие профилактические мероприятия направлены на улучшения условий и качества жизни, укрепление иммунитета. Лица, переболевшие лепрой, не допускаются к работе в пищевой и коммунальной сферах, детских и медицинских учреждениях; не могут менять страну проживания.
Лечение лепры. Методы терапии лепры
Больным лепрой проводят комплексную и длительную терапию, направленную на супрессию возбудителя, купирование реактивных состояний, профилактику и лечение осложнений и коррекцию функциональных нарушений с учетом формы и периода болезни.
В рамках GSEL ВОЗ рекомендует проводить противолепрозную терапию комплексом антибактериальных препаратов - больным с МВ-лепрой (LL-, BL-, ВВ- и ВТ-лепрой) на протяжении 12 мес перорально назначают рифампицин (Rifampicine, Rifadine, Rimactan, Benemycine) no 600 мг 1 раз в мес+ + дапсон (Diaphenylsulphonum, Dapsone, Diphenason, DDS) по 100 мг ежедневно+ + клофазимин (Clofazimine, Lampren, B-663) 300 мг 1 раз в мес и по 50 мг ежедневно:
- больным РВ-лепрой (7Т-лепрой) в течение 6 мес перорально назначают рифампицин (Rifampicine, Rifadine) 600 мг 1 раз в мес + дапсон (Dapsone) 100 мг ежедневно;
- больным SSL-лепрой однократно перорально назначают RОМ-терапию — рифампицин (Rifampicine, Rimactan) 600 мг + офлоксацин (Ofloxacin, Oflocet, Tarivid) 400 мг + +миноциклин (Minocycline, Mynocine) 100 мг. Для Бангладеш, Индии, Непала и Бразилии ВОЗ выпускает готовые упаковки ROM.
При использовании дапсона в ряде случаев наблюдаются токсические эффекты в виде психозов, гемолитической анемии, дерматитов; препарат противопоказан лицам с повышенной чувствительностью к сульфаниламидным производным. Клофазимин может вызывать сухость и гиперпигментацию кожи. На фоне приема рифампицина наблюдается преходящее потемнение мочи.
В случае непереносимости пациентом с МВ-лепрой дапсона или клофазимина может быть использована ROM (рифампицин 0,6 + офлоксацин 0,4 + миноциклин 0,1) с ежемесячным однократным приемом препаратов в течение 24 мес (24 дозы на курс лечения). (The 7-th WHO Expert Committee on Leprosy).
Контроль эффективности лечения проводят наряду с клиническими данными по динамике количества мишбактерий (BI, LIB) и их морфологии (уменьшение соотношения нормальных и инволютивных М. leprae в процессе лечения) в препаратах из очагов поражения, а также по динамике гистологических показателей (МГ) и изменениям лепроминового теста.
Существуют схемы более длительного проведения MDT при МВ-лепре (LL-, BL-, BB-лепра) в течение 2 лет с последующим клинико-лабораторным наблюдением в течение 5 лет. При сохранении негативного лепроминового теста и высоких показателей BI лечение продолжается до достижения эффекта (10 лет и более). При ТТ-, и BT-лепре лечение может осуществляться в течение 1 года с последующим наблюдением в течение 2 лет. При негативном лепроминовом тесте и медленном снижении BI терапия продолжается до достижения эффекта (5-10 лет).
Для купирования реакций 1 типа в легких случаях используют ацетилсалициловую кислоту (Aspirin) по 0,6 г 4 раза в день, в более тяжелых случаях применяют глюкокортикоиды (преднизолон по 40-80 мг/сут) с постепенным уменьшением дозы в течение 3-6 мес у больных TТ-и TБ-лепрой и 6-9 мес при BL-лепре.
Купирование реакций 2-го типа у больных LL-лепрой в легких случаях проводится аспирином, как и реакций 1-го типа, а в более тяжелых случаях применяют талидомид (Thalidomide) по 100 мг 4 раза в день с постепенным уменьшением дозы в течение нескольких недель или месяцев. В связи с возможностью тератогенного эффекта талидомид не назначают женщинам детородного возраста. Альтернативой талидомиду служит преднизолон, используемый по 20-40 мг/сут с медленным снижением дозы в течение 1-6 мес. Курс лечения преднизолоном сокращается в случаях увеличения суточной дозы клофазимина до 300 мг на протяжении нескольких недель. Одновременно проводят местное лечение ирита и иридоциклита (1% раствор атропина сульфата и 1% раствор гидрокортизона) и терапию невритов.
Наряду с этиотропной терапией больным лепрой проводят иммуномодулирующую терапию, профилактику и лечение бактериальных осложнений, им показаны физиотерапия, лечебный массаж и гимнастика, полноценное питание. Больные с кожной анестезией должны соблюдать осторожность для предотвращения бытовых травм. Важное значение для социальной адаптации больных имеют психотерапевтические приемы и ортопедические средства.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекции вызванные микобактериями (Mycobacterium tuberculosis, leprae, avium и т.д.): диагностика, лечение, профилактика
Насыщенная липидами клеточная стенка микобактерии обусловливает их кислотоустойчивость. Существует более пятидесяти видов микобактерии, большинство из которых присутствует в окружающей среде и не представляет опасности для человека.
Эпидемиология и патогенез туберкулеза (Mycobacterium tuberculosis)
Основной путь передачи туберкулёза — воздушно-капельный. Лёгкие являются первым органом, поражаемом при туберкулёзе. В месте проникновения возбудителя формируется воспалительный очаг (первичный комплекс), из которого инфекция может распространиться по всему организму (милиарное распространение). Заболевание может неожиданно разрешиться либо перейти в локализованный процесс (например, менингит).
Устойчивость к туберкулёзу обеспечивает Т-клеточное звено иммунитета. При его нарушении болезнь может рецидивировать (предполагаемый риск составляет 10%). Яркую клиническую картину заболевания чаще обнаруживают у пациентов со сниженным иммунитетом (например, у больных с ВИЧ-инфекцией).
Mycobacterium tuberculosis фагоцитируются макрофагами, но не инактивируются фаголизосомами, а размножаются в цитоплазме клеток. Выраженный иммунный ответ приводит к локальному разрушению тканей (образование полостей в лёгких — каверн) и возникновению симптомов, обусловленных цитокин-индуцированной системной воспалительной реакцией (лихорадка, потеря массы тела).
В качестве факторов вирулентности выступает большое количество антигенов, в том числе липоарабиноманнан (стимулятор цитокинов) и супероксиддисмутаза (обеспечивает выживаемость внутри макрофагов).
Клинические признаки туберкулеза
Возбудитель может поражать любой орган: он имитирует как воспалительные заболевания, так и злокачественные новообразования. Симптомы туберкулёза лёгких — хронический кашель, кровохаркание, лихорадка, потеря массы тела, рецидивирующая бактериальная пневмония. При отсутствии лечения болезнь переходит в хроническую форму, характеризующуюся постепенным ухудшением состояния.
При туберкулёзном менингите отмечают повышение температуры, помутнение сознания, при поражении почек — лихорадку, потерю массы тела, а также признаки локальной инфекции, осложнённой фиброзом мочеточников и гидронефрозом. Прогрессирование туберкулёза костей, обычно поражающего пояснично-крестцовый отдел позвоночника, характеризуется признаками вертебрального коллапса и сдавления нервов.
Кроме того, гной из очага инфекции может проникать под оболочку поясничной мышцы, в результате чего возникает паховый абсцесс. Поражение крупных суставов приводит к артриту и разрушению суставной ткани. При абдоминальной инфекции наблюдают брыжеечную лимфаденопатию, хронический перитонит, а также лихорадку, потерю массы тела, асцит, признаки нарушения всасывания в кишечнике. Диссеминированная (милиарная) инфекция может протекать без симптомов поражения лёгких.
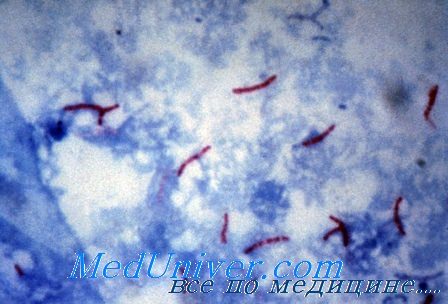
Микобактерии туберкулеза
Лабораторная диагностика туберкулеза (Mycobacterium tuberculosis)
• Культивирование на средах, обогащенных липидами (яичные среды), или с добавлением малахитового зелёного (среда Левенштейна—Йенсена) для подавления роста других бактерий. Препарат окрашивают по методу Циля—Нильсена.
• Определение чувствительности штаммов на скошенной питательной среде Левенштейна—Йенсена.
• Молекулярно-генетические методы (помогает уточнить наличие гена ргоВ, идентифицировать туберкулёзный антигенный комплекс и определить устойчивость к рифампицину).
• Типирование Mycobacterium tuberculosis с помощью анализа полиморфизма длины рестрикционных фрагментов.
• Измерение уровня цитокинов периферической крови, продуцируемых моноцитами (для диагностики остроты процесса).
Лечение и профилактика туберкулеза
Для лечения туберкулёза лёгких применяют этамбутол в комплексе с пиразинамидом (в первые 2 мес) и рифампицин и изониазид (на протяжении 6 мес). При поражении других органов используют такую же схему лечения, основанную на способности лекарственного препарата проникать в различные ткани (например, в спинномозговую жидкость). В последнее время всё чаще выделяют мультирезистентные штаммы возбудителя туберкулёза.
Вероятность их обнаружения зависит от числа случаев неполного излечения, уровня жизни и др. В этом случае для лечения используют препараты второй линии: аминогликозиды, фторхинолоны, этионамид или циклосерин (после обязательного определения чувствительности возбудителя к антибиотикам).
Вакцинация аттенуированными (ослабленными) штаммами (вакцина для профилактики туберкулёза, синоним — вакцина Кальметт—Герена, БЦЖ) позволяет избежать милиарного распространения инфекции, но клинические исследования в некоторых странах не подтвердили её эффективности. Пациентам с высоким риском развития туберкулёза назначают профилактическое лечение рифампицином и изониазидом, а лицам с ВИЧ-инфекцией рекомендован приём рифабутина или кларитромицина в течение длительного времени.
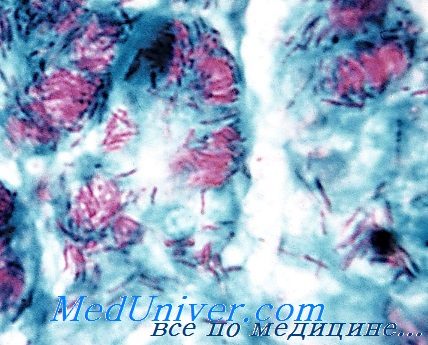
Микобактерии лепры
Инфекция вызванная Mycobacterium leprae - Лепра
Возбудителя лепры (проказы) до настоящего времени не удалось культивировать на искусственных питательных средах.
Mycobacterium leprae вызывает поражение периферических нервов, сопровождаемое нарушением болевой чувствительности. Разрушение и деформация суставов и фаланг пальцев делают пациентов физически недееспособными. Итог заболевания индивидуален и зависит от иммунного ответа. В настоящее время выделяют три типа иммунного ответа при лепре:
• туберкулоидный (превалирует Thl-ответ);
• лепроматозный (преобладает Тh2-ответ);
• пограничный.
При туберкулоидном типе инфекции у пациентов развивается стойкий клеточный иммунитет, возникает большое количество гранулём, трофические поражения нервов. В тканях обнаруживают небольшое количество бактерий. Для лепроматозного типа характерен слабый клеточный иммунитет, отсутствие гранулём и генерализованная инфекция (леонтиаз, депигментация и нарушение чувствительности).
Диагноз основан на результатах микроскопического исследования препаратов поражённой кожи (окраска по Цилю-Нильсену) и биоптатов кожных покровов гистологического исследования. Для лечения применяют рифампицин, дапсон и клофазимин, эффективные на ранних стадиях заболевания, но неспособные препятствовать повреждению нервов и деформации конечностей, при возникновении которых необходимо хирургическое вмешательство.
Микобактерии не вызывающие туберкулез
Различные виды микобактерий могут вызывать локализованные или диссеминированные заболевания у лиц со сниженным иммунитетом. Некоторые из них могут инфицировать имплантируемые ткани.
Mycobacterium avium. В состав комплекса входят Mycobacterium avium, M. intracellular и М. scrofulaceum. Некоторые из них поражают птиц, других животных, являясь санрофитами окружающей среды. Их считают наиболее распространённой причиной микобактериального лимфаденита у детей, остеомиелита у пациентов со сниженным иммунитетом и пневмонии у лиц пожилого возраста. При прогрессирующей ВИЧ-инфекции эти микроорганизмы способны вызывать диссеминированные инфекции и бактериемию.
Возбудители из авиум-внутриклеточного комплекса устойчивы к действию большинства противотуберкулёзных препаратов, поэтому для лечения инфекций, вызванных ими, применяют методы комплексной терапии с использованием рифабутина, кларитромицина и этамбутола. При развитии лимфаденита иногда требуется хирургическое вмешательство.
Mycobacterium kansasi, M. Malmoense, M. Xenopi. Вызывают вялотекущую инфекцию лёгких, похожую на туберкулёз, у пациентов с хроническими заболеваниями лёгких (бронхоэктазией, силикозом, хронической обструктивной болезнью лёгких). Начальную терапию осуществляют с помощью стандартных препаратов после определения чувствительности микроорганизмов к антибиотикам.
Mycobacterium marinum, М. ulcerans. Mycobacterium marinum вызывают хронические гранулематозные инфекции кожи. Возбудитель обитает в реках, запущенных бассейнах и неухоженных садках для рыбы. Заболеванию свойственно возникновение множественных гнойничковых очагов, покрытых твёрдой коркой. Инфекции, вызванные М. ulcerans, распространены в сельскохозяйственных зонах Африки и Австралии. Бактерии обычно поражают нижние конечности, при этом обнаруживают папулёзные очаги, сопровождаемые изъязвлением и глубоким повреждением тканей (включая костную).
Видео диагностика и лечение микобактериоза. Д.м.н., профессор В.Н. Зимина
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

