Эндоцервицит с уреаплазменной инфекцией
Обновлено: 25.04.2024
Уреаплазмоз у женщин — инфекционное воспалительное заболевание мочеполовых органов, вызванное патологической активностью уреаплазм. В 70-80% случаев заболевание протекает в форме бессимптомного носительства. Может проявляться неспецифическими дизурическими симптомами, увеличением количества прозрачных влагалищных выделений, тянущими болями в нижней части живота и нарушением репродуктивной функции. Для постановки диагноза используют бактериальный посев, ПЦР, ИФА, ПИФ. Этиотропное лечение предполагает назначение антибактериальных препаратов — макролидов, тетрациклинов и фторхинолонов.
Общие сведения
Впервые уреаплазма была выделена у пациента негонококковым уретритом в 1954 году. На сегодняшний день возбудитель считается условно-патогенным микроорганизмом, проявляющим патологическую активность только при наличии определённых факторов. Носительницами бактерий являются 40-50% сексуально активных здоровых женщин. Микроорганизм выявляется на половых органах у каждой третьей новорожденной девочки и у 5-22% школьниц, которые не живут половой жизнью. Хотя по результатам различных исследований уреаплазмы были единственными микроорганизмами, обнаруженными у части пациенток с бесплодием и хроническими заболеваниями урогенитальной сферы, уреаплазмоз не внесен как самостоятельное заболевание в действующую Международную Классификацию Болезней.

Причины уреаплазмоза у женщин
Возбудителем заболевания является уреаплазма — внутриклеточная бактерия без собственной клеточной мембраны, обладающая тропностью к цилиндрическому эпителию мочеполовых органов. Из 6 существующих видов уреаплазм патогенная активность выявлена у двух — Ureaplasma urealyticum и Ureaplasma parvum. Заражение происходит при незащищённом половом контакте или во время родов. Убедительных доказательств о контактно-бытовом способе передачи уреаплазмоза на сегодняшний день не существует.
В большинстве случаев носительство уреаплазм является бессимптомным. Основными факторами, способствующими развитию воспалительного процесса, являются:
- Дисгормональные состояния. Возбудитель может проявлять патогенную активность во время беременности, при нарушении эндокринной функции яичников.
- Снижение иммунитета. Воспаление урогенитального тракта чаще возникает у женщин при заболеваниях, снижающих иммунитет, и на фоне приёма иммуносупрессивных препаратов (при лечении онкопатологии).
- Вагинальный дисбактериоз. Нарушение нормальной микрофлоры влагалища при нерациональной антибактериальной терапии и гормональном дисбалансе активирует условно-патогенные микроорганизмы, в том числе уреаплазмы.
- Инвазивные вмешательства. Пусковым моментом для развития уреаплазмоза в ряде случаев становятся аборты, инструментальные лечебно-диагностические процедуры (гистероскопия, уретро- и цистоскопия, хирургические методы лечения эрозии шейки матки и др.).
- Частая смена половых партнёров. Бактерия активируется в ассоциации с другими возбудителями ИППП, проникающими в половые органы женщины во время незащищённого секса со случайными партнёрами.
Патогенез
Патогенез уроплазмоза у женщин основан на адгезивно-инвазивных и ферментообразующих свойствах микроорганизма. При попадании на слизистую мочеполовых органов бактерия прикрепляется к оболочке клетки цилиндрического эпителия, сливается с ней и проникает в цитоплазму, где и происходит её размножение. Микроорганизм продуцирует особый фермент, который расщепляет иммуноглобулин А, снижая таким образом иммунный ответ на инфекцию. При бессимптомном течении местные воспалительные и деструктивные изменения выражены слабо. Повышение патогенной активности возбудителя под действием провоцирующих факторов приводит к развитию воспаления — сосудистой реакции, повышению тканевой проницаемости, разрушению эпителиальных клеток.
Классификация
Основными критериями выделения клинических форм уреаплазмоза у женщин являются характер течения и степень выраженности патологических проявлений. В частности, специалисты в области гинекологии различают:
- Носительство уреаплазм. У большинства женщин, при обследовании которых выявляется этот микроорганизм, никаких признаков воспалительных процессов нет.
- Острый уреаплазмоз. Наблюдается крайне редко, сопровождается клинически выраженными признаками поражения мочеполовых органов и общей интоксикацией.
- Хронический уреаплазмоз. Признаки острого воспаления отсутствуют или проявляются периодически при наличии провоцирующих факторов, возможны нарушения репродуктивной функции и хроническое воспаление органов урогенительного тракта.
Симптомы уреаплазмоза у женщин
В 70-80% случаев какие-либо клинические проявления, свидетельствующие об инфицировании организма уреаплазмами, отсутствуют. Заболевание не имеет специфических симптомов и в периоды обострений проявляется признаками, характерными для воспалительных процессов в мочеполовой системе. Женщина может жаловаться дискомфорт, рези, жжение, болезненные ощущения при мочеиспускании. Несколько увеличивается объём прозрачных влагалищных выделений. При восходящем развитии инфекции с поражением внутренних репродуктивных органов могут беспокоить ноющие или тянущие боли в нижней части живота. При остром течении и в периоды обострений температура повышается до субфебрильных цифр, пациентка отмечает слабость, утомляемость, снижение работоспособности. О хроническом уреаплазмозе могут свидетельствовать стойкие к лечению уретриты, вагиниты, эндоцервициты, аднекситы, невозможность забеременеть, самопроизвольное прерывание или патологическое течение беременности.
Осложнения
При длительном течении уреаплазмоз у женщин осложняется хроническими воспалительными процессами в матке и придатках, которые приводят к бесплодию, выкидышам и преждевременным родам. Ситуация усугубляется инфицированием партнёра, у которого на фоне заболевания может развиться мужское бесплодие. В некоторых случаях воспаление, сосудистые и аутоиммунные процессы в эндометрии становятся причиной первичной плацентарной и вторичной фетоплацентарной недостаточности с нарушением нормального развития плода, риском возникновения аномалий и повышением перинатальной заболеваемости. Поскольку беременность является провоцирующим фактором для активации микроорганизма, а лечение инфекционного заболевания предусматривает назначение препаратов, способных влиять на плод, при репродуктивном планировании важно своевременно выявить возбудителя.
Диагностика
Данные влагалищного осмотра, бимануального обследования и клиническая картина заболевания неспецифичны и, как правило, свидетельствуют о наличии воспалительного процесса. Поэтому ключевую роль в диагностике уреаплазмоза у женщин играют специальные методы исследования, позволяющие обнаружить возбудителя:
- Бак. посев на уреаплазму. При посеве биоматериала (выделений, мазков) на питательную среду выявляются колонии уреаплазм, после чего определяется их чувствительность к антибактериальным препаратам.
- ПЦР. С помощью полимеразной цепной реакции в биоматериале пациентки в течение суток можно обнаружить генетический материал возбудителя.
- Серологическое исследование. В ходе иммунофлюоресцентного анализа (ИФА) и при прямой флюоресценции (ПИФ) в крови женщины обнаруживаются антитела к бактерии, определяется их титр.
При дифференциальной диагностике необходимо исключить инфицирование другими возбудителями — хламидиями, трихомонадами, гонококками, микоплазмами и т.п. Основанием для постановки диагноза уреаплазмоза является наличие воспалительных процессов в мочеполовых органах женщины при отсутствии каких-либо других возбудителей ИППП, кроме уреаплазм. Наряду с гинекологом, к консультированию пациентки привлекают уролога.
Лечение уреаплазмоза у женщин
Ключевыми задачами терапии при уреаплазменной инфекции являются уменьшение воспаления, восстановление иммунитета и нормальной влагалищной микрофлоры. Пациенткам с клиническими признаками уреаплазмоза рекомендованы:
- Этиотропная антибиотикотерапия. При выборе препарата необходимо учитывать чувствительность возбудителя. Обычно назначают 1-2-недельный курс тетрациклинов, макролидов, фторхинолонов.
- Санация влагалища. Введение свечей с антибиотиком и противогрибковым препаратом дополняет антибактериальное лечение.
- Иммунотерапия. Для восстановления иммунитета показаны иммуномодулирующие и иммуностимулирующие средства, в том числе растительного происхождения.
- Нормализация микробиоценоза влагалища. Применение пробиотиков местно и внутрь позволяет восстановить вагинальную микрофлору, которая угнетает патологическую активность уреаплазм.
- Ферментные препараты. Энзимы оказывают противовоспалительный эффект и усиливают процессы регенерации тканей.
- Витаминотерапия. С общеукрепляющей целью в комплексном лечении уреаплазмоза у женщин используют мультивитаминные и витаминно-минеральные комплексы.
Важно отметить, что показания для назначения этиотропного противоуреаплазменного лечения ограничены. Как правило, антибиотики применяют при обнаружении уреаплазм у пациенток с устойчивыми к лечению хроническими воспалительными процессами и нарушениями репродуктивной функции при отсутствии других возбудителей ИППП. Также антибактериальный курс рекомендован носительницам уреаплазмы, которые планируют беременность.
Прогноз и профилактика
Прогноз уреаплазмоза у женщин благоприятный. Этиотропное лечение позволяет полностью избавиться от бактерии, однако из-за отсутствия пассивного иммунитета и высокой распространённости возбудителя возможно повторное заражение. Поскольку уреаплазма является условно-патогенным микроорганизмом, для профилактики воспаления важны рациональный режим сна и отдыха, сезонное поддержание иммунитета, обоснованное назначение инвазивных методов диагностики и лечения заболеваний женской половой сферы, использование барьерной контрацепции. Для предупреждения патологической активации возбудителя во время планируемой беременности женщинам с носительством уреаплазм рекомендована профилактическая антибиотикотерапия.
Хронический эндоцервицит — это инфекционное воспалительное заболевание слизистой цервикального канала, длящееся от двух месяцев и более. Отличается скудной клинической симптоматикой: увеличением количества слизистых влагалищных выделений с появлением в них примеси гноя и тянущими болями внизу живота. Для диагностики эндоцервицита применяют осмотр в зеркалах, расширенную кольпоскопию, трансвагинальное УЗИ, лабораторные исследования. При лечении назначают этиотропные противомикробные средства, эубиотики, иммунокорректоры, физиотерапию. По показаниям проводят малоинвазивные хирургические вмешательства, трахелопластику и радиоконизацию.
МКБ-10
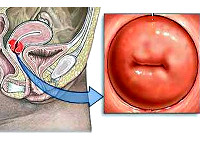
Общие сведения
Хронические цервициты — одни из самых частых гинекологических заболеваний. Из-за бессимптомного течения их истинную распространенность установить крайне сложно. Обычно воспаление эндоцервикса выявляют при плановых профосмотрах или при обращении по поводу других болезней репродуктивной сферы.
Наиболее подвержены заболеванию женщины детородного возраста (до 70% пациенток с установленным диагнозом), несколько реже цервицит встречается в перименопаузе и в исключительных случаях — у девочек до наступления менархе. Важность своевременной диагностики и лечения хронической воспалительной болезни шейки матки обусловлена повышенным риском распространения воспаления на матку с придатками и злокачественного перерождения пораженного эндоцервикса.

Причины
Заболевание развивается на фоне недолеченного или недиагностированного острого воспалительного процесса и вызывается различными микроорганизмами или их ассоциациями. Воспаление в эндоцервиксе возникает при участии следующих инфекционных агентов:
- Возбудители ИППП. По результатам исследований, хронический воспалительный процесс в цервикальном канале у половины пациенток вызван возбудителями хламидиоза. Причиной болезни также могут быть вирусы простого герпеса, папилломы человека (ВПЧ), гонококки, уреаплазмы, микоплазмы, бледные спирохеты.
- Условно-патогенная флора. Неспецифическое воспаление чаще возникает при патологической активации грамотрицательных аэробов (энтерококков, эшерихий, клебсиелл, протея) и неклостридильных анаэробов (бактероидов и пептококков). Из очага инфекции также высеивают стафилококков, стрептококков, клостридий, гарднерелл.
Факторы риска
Важную роль в переходе заболевания из острой в хроническую фазу играют предрасполагающие факторы. Хронизацию процесса провоцирует:
- ослабление иммунитета при длительных физических нагрузках, стрессах, переохлаждениях, различных заболеваниях и приеме иммуносупрессоров;
- гипоэстрогенемия;
- травмы шейки матки при инвазивных процедурах;
- постоянное раздражение внутриматочной спиралью, контрацептивными колпачками и диафрагмами; химическими агентами (кислыми растворами для спринцевания, спермицидами, некачественным латексом).
Группу риска составляют женщины с опущением шейки матки и влагалища, а также пациентки, ведущие беспорядочную сексуальную жизнь без барьерной контрацепции.
Патогенез
При хроническом течении эндоцервицита в очаге инфекции постоянно поддерживается вялотекущее воспаление, проникающее в парабазальный и базальный слой эпителия. При этом непосредственная повреждающая роль микроорганизмов уменьшается, а ведущими становятся снижение местного иммунитета и метапластические процессы. Это приводит к развитию сложной сосудисто-мезенхимальной реакции, замещению части цилиндрического эпителия плоским, инфильтрации и уплотнению мышечной и соединительной ткани.
Секреторная активность эпителиальных клеток остается повышенной, что при перекрытии устьев цервикальных желез способствует формированию наботовых кист. Отмечается ускоренное обновление эпителиоцитов с замедлением их дифференцировки, прогрессивным снижением апоптоза и нарастанием атипии. У некоторых пациенток процесс носит рецидивирующий характер с периодическим обострением.
Классификация
Формы хронического эндоцервицита являются такими же, как и при остром воспалительном процессе. Основными критериями классификации являются:
- Тип инфекционного агента. Воспалительный процесс может быть специфическим, возникшим в результате заражения ИППП, и неспецифическим, вызванным естественной микрофлорой при ее патологической активации.
- Распространенность воспаления. При очаговом (макулезном) эндоцервиците поражаются отдельные участки эндоцервикса, при диффузном — в процесс вовлекается весь эпителий. Хронический эндоцервицит обычно является диффузным.
Симптомы хронического эндоцервицита
Клиническая картина заболевания отличается крайне скудной симптоматикой. В большинстве случаев хронически протекающий эндоцервицит становится случайной находкой при плановом или внеплановом гинекологическом обследовании. Обычно пациентки отмечают незначительное увеличение объема влагалищных выделений и изменение их характера. Бели становятся мутными, густыми, иногда они имеют неприятный запах или в них появляются прожилки крови.
При обострении воспаления женщину могут беспокоить тупые, тянущие, ноющие боли в нижней части живота, зуд и жжение в области наружных половых органов. Иногда единственным признаком длительно существующего воспаления в шеечном канале становится бесплодие или привычный выкидыш.
Осложнения
Из-за снижения защитных свойств слизистой пробки и наличия постоянного очага воспаления повышается риск развития эндометрита, сальпингита, аднексита с отдаленными последствиями в виде бесплодия и невынашивания беременности. В двух третях случаев хронический эндоцервицит сопровождается эктопией шейки матки. По мнению специалистов в сфере гинекологии, при этом заболевании существенно возрастает вероятность малигнизации тканей. Воспаление эндоцервикса играет роль в развитии акушерской патологии с внутриутробным инфицированием плода и его оболочек, преждевременным излитием околоплодных вод, послеродовыми гнойно-септическими осложнениями.
Диагностика
Из-за неспецифичности симптоматики при постановке диагноза основное значение имеют данные физикальных, инструментальных и лабораторных исследований. Пациентке с подозрением на хронический эндоцервицит проводится:
- Осмотр на кресле. При исследовании в зеркалах наружный зев цервикального канала гиперемирован, шейка матки отечна. Могут выявляться участки повышенной кровоточивости, слизистые и гнойно-слизистые выделения.
- Расширенная кольпоскопия. Сосуды эпителиального слоя шейки матки расширены, выявляются очаги с сосудистыми петлями. Слизистая оболочка выглядит отечной. Могут определяться другие патологические процессы (псевдоэрозия, эрозия и др.).
- Лабораторные исследования. Для определения возбудителя заболевания проводят микроскопию и посев мазка (с антибиотикограммой), ПЦР-диагностику, специальные серологические методы (РИФ, ИФА).
- Цитология мазка из цервикального канала. Позволяет оценить степень вовлеченности в воспаление клеток эндоцервикса. Анализ эффективен для раннего выявления дистрофических, диспластических процессов, атипии и возможного озлокачествления.
- УЗИ шейки матки. Шейка матки увеличена в размерах, утолщена. В ее структуре присутствуют гипоэхогенные включения (наботовы кисты). Метод позволяет исключить или своевременно выявить сочетанный рак шейки матки.
Дифференциальная диагностика производится с эктопией и раком шейки матки, туберкулезным поражением. В сложных случаях назначают консультации онкогинеколога, фтизиатра.
Лечение хронического эндоцервицита
Медикаментозная терапия
При подтвержденном диагнозе хронического воспаления эндоцервикса рекомендован комплексный этиопатогенетический подход. Предпочтительна консервативная терапия, основными задачами которой являются:
- Ликвидация очага инфекции. С учетом чувствительности возбудителя заболевания назначают антибиотики, противогрибковые, противотрихомонадные, противохламидийные и другие средства. Обычно пероральный прием препаратов и их парентеральное введение дополняют местным воздействием (вагинальными свечами и т. п.).
- Восстановление влагалищного биоценоза. Вследствие хронического воспаления и использования антимикробных средств в вагине нарушается нормальный баланс микроорганизмов. Своевременное назначение эубиотических препаратов позволяет предупредить рецидивы эндоцервицита и активацию условно-патогенной флоры.
- Иммуннокоригирующая терапия. Поскольку фоном для развития заболевания часто становится иммунодефицит, пациенткам показаны витамино-минеральные комплексы и стимуляторы иммунитета. Их применение позволяет повысить общую и местную сопротивляемость инфекционным агентам, а также нормализовать иммунный ответ.
Физиотерапия
При лечении хронического эндоцервицита эффективно сочетание медикаментозной и физиотерапии. Физиотерапевтические методики усиливают противовоспалительный эффект антибактериальных средств и ускоряют процессы репарации. Пациенткам назначают:
- низкочастотную и высокочастотную магнитотерапию;
- электрофорез магния в маточной зоне;
- диадинамические токи;
- ДМВ;
- вагинальную лазеротерапию;
- дарсонвализацию через влагалищный электрод;
- грязевые тампоны.
Хирургическое лечение
В некоторых случаях консервативное лечение эндоцервицита дополняют хирургическими методами. При обнаружении большого количества наботовых кист, в которых может персистировать возбудитель, выполняют диатермопунктуру. При упорном течении показаны криодеструкция, лазерная вапоризация, радиокоагуляция. Если хроническое воспаление сочетается с деформацией шейки, дисплазией эпителия или элонгацией, возможно проведение радиоконизации и трахелопластики.
Прогноз и профилактика
Несмотря на необходимость длительного лечения, прогноз при хроническом эндоцервиците благоприятный. Рецидив заболевания возможен только при стойком снижении иммунитета и наличии воспаления в других отделах женской половой сферы. Для профилактики рекомендованы своевременное адекватное лечение острого эндоцервицита, регулярные осмотры у гинеколога, упорядоченная сексуальная жизнь, барьерные методы контрацепции (особенно при частой смене половых партнеров). Целями вторичной профилактики является предупреждение осложнений заболевания, в первую очередь — развития злокачественных неоплазий и бесплодия.

Уреаплазмоз – причины возникновения этого заболевания до сих пор точно неизвестны, да и не доказана роль этого возбудителя в бесплодии и различных хронических воспалительных заболеваниях женской половой сферы. Тем не менее, связь уреаплазмы и невынашивания беременности есть, поэтому разберёмся с этим вопросом подробнее.
Уреаплазма – внутриклеточный возбудитель, не имеющий собственной мембраны, а поэтому паразитирующий за счёт клетки-хозяина. При наличии воспалительного процесса мочеполовой сферы этот возбудитель обнаруживается достаточно часто.
Опасность уреаплазмоза в том, что он может длительное время протекать абсолютно бессимптомно или маскироваться под безобидные проблемы. Когда же женщина наконец обращает внимание на скудные симптомы заболевания, уреаплазма успевает поразить матку, трубы и яичники, а также распространиться по мочевым путям в сторону почек.
Какие же пути проникновения в организм уреаплазмоза, причины возникновения этого заболевания? Уреаплазмы попадают в половые пути человека при половом контакте с заражённым партнёром или носителем. В последующем больная уралпазмозом женщина может передать эту инфекцию своему ребёнку во время беременности или при родах. При этом у новорождённых мальчиков данный возбудитель обнаруживается реже, чем у девочек. Кроме того, мальчики имеют способность спонтанного выздоровления от уреаплазмоза, у девочек этого практически никогда не происходит.
Организм женщины довольно хорошо защищён от проникновения инфекции в половые пути. Для того, чтобы у здоровой женщины развился уреаплазмоз, причины возникновения этой инфекции должны сопровождаться провоцирующими факторами:
- Раннее начало половой жизни
- Частая смена и неразборчивость в выборе половых партнёров
- Отказ от использования барьерных контрацептивов
- Травматичные манипуляции на половых органах: аборты, выскабливания, гистероскопия и другие
- Переохлаждение, стрессы, иммунные нарушения
Как видно, для того, чтобы развился уреаплазмоз, причины возникновения инфекции – заражённого полового партнёра – недостаточно, нужны ещё дополнительные факторы, снижающие защитные силы организма.
Для того, чтобы воспрепятствовать проникновению инфекции в матку и придатки, в организме существует целая система барьеров. Начинается она во влагалище (кислая среда, местный иммунитет), шейка матки также осуществляет барьерную функцию – это и шеечная слизь, и выработка шеечными железами большого количества специальных защитных веществ. Коварство уреаплазмоза, причины возникновения бесплодия, заключается в том, что этот возбудитель находится внутри клеток организма, где иммунитет имеет очень ограниченные возможности.
Именно поэтому следующим после вагинита этапом распространения уреплазмоза является эндоцервицит. Причины возникновения воспалительного процесса в шейке матки такие же, как и у любой инфекции – ослабление местного и общего иммунитета. Возбудитель проникает в клетки шейки матки, вызывает в них воспалительный процесс и разрушение. При этом женщина испытывает дискомфорт внизу живота, появляются скудные выделения. При обращении к гинекологу будет установлен диагноз эндоцервицит, причины его возникновения станут понятны только после дообследования.
Назначается мазок на флору, кольпоскопия, ПЦР и другие анализы, способные подтвердить диагноз эндоцервицит, причины возникновения воспалительного процесса. Если диагноз уреаплазмоза подтвердится, лечебная тактика будет подобрана с учётом общей ситуации – клиники, желания иметь детей.
Если у женщины диагностирован уреаплазменный эндоцервицит, причины возникновения бесплодия в этой ситуации кроются в изменениях в шейке матки. Во-первых, изменнение состава шеечной слизи, воспалительный процесс в шейке будут препятствовать проникновению сперматозоидов в матку, а затем в яичники. Кроме того, воспалительный процесс редко бывает изолированным, поэтому уреаплазма может поразить и влагалище, и матку, что ещё больше снизит шансы на беременность. Если же оплодотворение всё же произойдёт, то воспалительный процесс в половых органах будет препятствовать прикреплению и нормальному развитию зародыша.
Помимо того, развивишийся эндоцервицит, причины возникновения которого кроются в поражении уреаплазмой, может приводить к структурным изменениям в шейке, вызывая образование эррозии, полипов и других образований. Всё это несёт большую угрозу жизни женщины, поэтому уреаплазмоз требует тщательного контроля и лечения.
Если при распространении уреаплазмы по половым путям женщины не возникает явной клиники, и лечение не начато вовремя, то следующим этапом будет проникновение инфекции в полость матки, а из неё – в маточные трубы. Воспалительный процесс в маточных трубах – наиболее частая причина, по которой женщина не может забеременеть.
Заболевание, из-за которого женщины страдают бесплодием при поражении уреаплазмой – сальпингит и развивающийся в последующем гидросальпинкс. Причины возникновения гидросальпинкса – это выраженный воспалительный процесс в маточных трубах. Стенка маточной трубы весьма нежная и тонкая структура, поэтому при малейших признаках воспаления в ней могут образовываться спайки.
Как же образуется гидросальпинкс? Причины возникновения этого состояния кроются в строении труб. При образовании в них спаек в маточной трубе образуется одна или несколько полостей, в которых скапливается воспалительный экссудат. Из-за постоянного наличия экссудата в полости трубы в её стенках наступают необратимые изменения, и если гидросальпинкс, причины возникновения которого могут быть не только уреаплазменной этиологии, вовремя не вылечить, то такие трубы в будущем приходится удалять, ибо они не в состоянии выполнять свою функцию, а только поддерживают воспаление.
Конечно же, через трубу, заполненную воспалительной жидкостью или гноем, сперматозоиды не в состоянии добраться до яйцеклетки, а значит у женщины развивается бесплодие. Следует отметить, что гидросальпинкс, причины возникновения которого заключены в поражении уреаплазмой, может иметь длительное волнообразное течение. При этом жидкость из труб может дренироваться как в полость матки и влагалище (тогда появляются жидкие выделения), так и в брюшную полость (возникают боли внизу живота). После дренирования гидросальпинкса он может быть не виден на УЗИ, поэтому наиболее точным методом диагностики воспалительного процесса и гидросальпинкса является лапароскопия.
Если женщине выставляется диагноз бесплодие, а при обследовании обнаруживается гидросальпинкс, причины возникновения которого неясны – в первую очередь необходимо назначить обследование на инфекции, в том числе и на уреаплазмоз.
После точного установления диагноза производится определение чувствительности уреаплазмы к антибиотикам, проводится антибактериальная и общеукрепляющая терапия. Если лечение начато вовремя, то шансы на полное выздоровление и наступление беременности весьма велики. Но даже в запущенных случаях уреаплазмоза тщательно соблюдение всех рекомендаций, адекватное лечение дают шанс на восстановление репродуктивной функции или рождение ребёнка с помощью ЭКО.
В настоящее время в отечественной и зарубежной литературе отмечается повышение внимания практикующих врачей и ученых к вопросам патологии шейки матки в связи с высокой актуальностью и социальной значимостью данной проблемы.
В настоящее время в отечественной и зарубежной литературе отмечается повышение внимания практикующих врачей и ученых к вопросам патологии шейки матки в связи с высокой актуальностью и социальной значимостью данной проблемы. Поскольку слизистая оболочка шейки матки является пограничным барьером между верхним этажом генитального тракта и внешней средой, она постоянно подвергается воздействию повреждающих факторов, среди которых наиболее агрессивное влияние оказывают различные инфекции, передаваемые половым путем (А. И. Новиков, А. В. Кононов, И. Г. Ваганова, 2002).

По данным разных авторов, в настоящее время отмечена высокая частота колонизации мочеполовых органов уреаплазмами: у мужчин — 25%, у женщин — до 80%, частота бессимптомного носительства — до 45,8%. Широкое распространение уреа- и микоплазм, частое их выявление при различных заболеваниях урогенитального тракта, бессимптомное носительство, недостаточное количество знаний в отношении эпидемиологии, неоднозначное мнение ученых о степени значимости данных микроорганизмов в генезе патологических состояний урогенитального тракта — все это поддерживает интерес исследователей к данной проблеме.
Так, в популяции уреаплазмы выявляются у 5–15% населения мира. По данным статистики, уреаплазмами инфицировано 174 млн человек (ВОЗ, 1999; Donovan B. Lancet, 2004). Согласно данным собственных исследований на базе научно-поликлинического отделения НЦАГиП, у пациенток репродуктивного возраста частота встречаемости уреаплазм составляет 22,3%. При этом в качестве моноинфекции уреаплазмоз отмечен в 37,5% случаев, при смешанном инфицировании — в 62,5% (В. Н. Прилепская, О. В. Быковская, 2003).
Уреаплазмы относятся к классу Mollicutes, в который входят также микоплазмы, ахолеплазмы, спироплазмы, анаэроплазмы. В настоящее время считают, что имеется два самостоятельных вида уреаплазм: Ureaplasma parvum и Ureaplasma urealyticum — их клиническая значимость находится в стадии изучения.
Важной для клинической практики морфологической особенностью уреаплазм является их выраженный тропизм к эпителиальным клеткам, а именно к слизистым оболочкам урогенитального тракта, и способность длительно персистировать в эпителиальных клетках. Учитывая тот факт, что первичным очагом поражения являются нижние отделы мочеполовых путей, в них, и в частности в шейке матки, развиваются под влиянием уреаплазм различные патологические процессы.
В структуре патологических изменений шейки матки, обусловленных или ассоциированных с уреаплазмами, ведущее место занимают воспалительные процессы (экзо- и эндоцервициты) — 92,2%. Среди них преобладают эндоцервициты — 46,6%, на втором месте — сочетанные воспалительные процессы (экзо- и эндоцервициты) — 26,6%. Важно отметить, что высокая частота (10–15%) эктопий шейки матки у девушек-подростков и молодых женщин, по-видимому, является предрасполагающим фоном для развития воспаления. Так, нами отмечено развитие воспалительных изменений шейки матки на фоне эктопии в 30% случаев. Вероятно, инфицирование уреаплазмами нарушает процесс замещения цилиндрического эпителия на многослойный плоский при эктопии шейки матки и способствует развитию различных патологических ее состояний.
Для воспалительных процессов уреаплазменной этиологии характерна длительная персистенция, часто — латентное бессимптомное развитие, в результате — поздняя диагностика, хроническое рецидивирующее течение. Клинические проявления могут быть более выражены в пред- и постменструальном периодах. У девочек течение уреаплазмоза бывает более выражено: в виде острых и подострых форм вульвовагинита с частым вовлечением в воспалительный процесс шейки матки и уретры.
Основными жалобами при уреаплазмозе являются: зуд, жжение в области наружных половых органов, белесоватые слизисто-гнойные выделения из влагалища, дизурические расстройства (дискомфорт при мочеиспускании, рези, боли или учащение мочеиспускания, ощущение переполненности мочевого пузыря). Для урогенитального уреаплазмоза вообще характерно частое поражение мочевыделительной системы, причем воспалительный процесс нередко начинается именно с уретральных симптомов и соответствующих жалоб, что требует особого внимания клиницистов [1, 2, 5].
Цервициты при уреаплазмозе не имеют каких-либо патогномоничных кольпоскопических особенностей. Кольпоскопическая картина характеризуется повышенным количеством секрета, гиперемией наружного покрова шейки матки и области входа в цервикальный канал, отечностью слизистой оболочки с неравномерным ее окрашиванием при пробе Шиллера, с характерной крапчатостью за счет чередования мелкоточечных йоднегативных и йодпозитивных участков.
Как правило, при уреаплазмозе цитограммы подтверждают преимущественно воспалительный характер изменений эпителия шейки матки. Согласно классификации по Папаниколау, в большинстве случаев цитограммы при уреаплазменной инфекции относятся к 2-му и 3-му классу. При этом важной особенностью цитологической характеристики шейки матки является преобладание в мазках, взятых с экзо- и эндоцервикса дистрофических изменений в клетках многослойного плоского и цилиндрического эпителия, высокая частота обнаружения клеток с псевдодискариозом, большое количество лимфоцитов, гистиоцитов.
Особое значение имеет и требует соответствующего внимания клиницистов высокая частота выявления аномальных кольпоскопических картин на фоне воспалительных изменений шейки матки, особенно при хронической уреаплазменной инфекции (табл. 1).
На основании приведенных данных можно предположить, что хроническое течение воспалительного процесса шейки матки при уреаплазмозе способствует избыточной пролиферации эпителиальных клеток и развитию полипов цервикального канала, а также, возможно, является одной из причин возникновения лейкоплакии шейки матки и фактором, усугубляющим клинику папилломавирусной инфекции.
При подозрении на наличие уреаплазмоза обследованию подлежат:
- женщины с воспалительными процессами гениталий и их половые партнеры;
- пациентки с хроническими, рецидивирующими воспалительными процессами органов системы мочевыделения;
- женщины с отягощенным акушерско-гинекологическим анамнезом;
- беременные женщины (в любом сроке беременности, по показаниям);
- пациентки с бесплодием.
Как известно, абсолютная патогенность генитальных уреа- и микоплазм (кроме Mycoplasma genitalium) не доказана до настоящего времени. Уреаплазмы скорее относят к условно-патогенным микроорганизмам, однако известно, что различные воспалительные заболевания урогенитального тракта уреаплазменной этиологии могут возникать (и в литературе описан целый ряд нозологий) в результате активации размножения уреаплазм при ослаблении или изменении иммунного и гормонального статуса, присоединении других инфекций, стрессах, изменении гомеостаза, переохлаждении и т. д. Тактика ведения больных зависит от данных комплексного обследования, которое, помимо общеклинических и гинекологического анализов, должно включать лабораторные методы исследования (бактериоскопия, полимеразная цепная реакция, культуральное исследование), при подозрении на наличие патологии шейки матки — расширенную кольпоскопию, цитологическое исследование мазков-отпечатков с экзо- и эндоцервикса и/или биопсию шейки матки с последующим гистологическим исследованием биоптатов.
По общепринятому мнению, уреаплазмы могут считаться этиологическим фактором развития воспалительного процесса при обнаружении их в большом количестве, т. е. при высоком уровне обсемененности. В связи с этим важное практическое значение имеет культуральный метод исследования. Культуральное исследование позволяет провести идентификацию возбудителя, определить его количество в исследуемом материале и оценить чувствительность выделенных штаммов возбудителя к антимикробным препаратам, следовательно, метод помогает сформировать дальнейшую тактику ведения пациента.
Критериями назначения этиотропной терапии при воспалительных заболеваниях уреаплазменной этиологии являются:
- клинические и лабораторные признаки воспалительного процесса органов мочеполовой системы;
- результаты комплексного микробиологического обследования с количественным обнаружением уреаплазм в титрах более 104 КОЕ/мл при культуральном исследовании;
- предстоящие оперативные или другие инвазивные процедуры на органах мочеполовой системы;
- бесплодие (когда исключены другие причины);
- отягощенный акушерско-гинекологический анамнез, осложненное течение беременности.
Основными принципами лечения являются следующие.
Терапия должна проводиться обоим половым партнерам во избежание реинфекции; на весь период лечения и до получения после лечения отрицательных контрольных результатов у обоих половых партнеров целесообразно рекомендовать применение барьерных методов контрацепции (презерватив).
Лечение патологии шейки матки в сочетании с уреаплазменной инфекцией или вследствие ее должно быть двухэтапным. Первый этап заключается в этиотропной терапии и включает в себя использование антибактериальных препаратов, ферментов, антимикотиков (для профилактики кандидоза). В частности, из комплексных ферментных препаратов целесообразно применение Вобэнзима за 5 дней до начала антибактериальной терапии и в течение всего курса антибиотиков по 3–5 драже за 30 мин до еды.
В таблице 2 приведены основные группы препаратов, применяемых для лечения уреаплазмоза, а именно тетрациклины, макролиды, фторхинолоны, аминогликозиды, азалиды. Как известно, уреаплазмы резистентны к антибактериальным препаратам (пенициллин и его производные, цефалоспорины и др.), подавляющим синтез клеточной стенки ввиду отсутствия таковой.
По мнению большинства авторов и как подтверждает собственный опыт, эффективность антибактериальной терапии существенно выше при ее назначении с учетом чувствительности выделенных штаммов уреаплазм к антибиотикам, т. е. при индивидуальном подходе в лечении пациенток.
Длительность лечения подбирается врачом индивидуально в зависимости от тяжести воспалительного процесса и длительности инфицирования.
Хотелось бы отметить, что в настоящее время максимальная чувствительность уреаплазм определена к приведенным выше антибактериальным препаратам: доксициклину (97,2%), джозамицину (96,7%), что подтверждено результатами исследований разных авторов в нашей стране и за рубежом.
Доксициклин является одним из препаратов, назначение которых предпочтительно при уреаплазмозе (Федеральное руководство для врачей по использованию лекарственных средств, 1998). Доксициклин используется в виде двух солей. В капсулированных формах применяется доксициклина гидрохлорид. Рядом исследователей отмечено выраженное воздействие доксициклина гидрохлорида на слизистую желудочно-кишечного тракта, в частности возникновение в более чем 40% случаев повреждения тканей с последующим развитием язв пищевода [4, 6, 9]. В последнее время предложена новая форма известного препарата — моногидрат доксициклина (Юнидокс Солютаб). Доксициклина моногидрат имеет целый ряд преимуществ. Во-первых, данная форма препарата отличается более высокой биодоступностью, сравнимой с внутривенным введением. Во-вторых, запатентованная лекарственная форма Солютаб позволяет пациенту выбрать предпочтительный для себя режим приема препарата, таблетку можно проглотить целиком, разжевать или растворить — в любом случае гарантировано равномерное высвобождение микрочастиц лекарственного вещества.
В-третьих, это важно подчеркнуть, для данной формы доксициклина характерен минимальный риск возникновения нежелательных влияний на слизистую оболочку желудочно-кишечного тракта по сравнению с другими лекарственными формами препарата.
Джозамицин (Вильпрафен) является среди антибактериальных препаратов группы макролидов препаратом выбора в силу ряда причин. Прежде всего это обусловлено, по данным ряда авторов за последние годы, чувствительностью уреаплазм к антибиотикам. Для джозамицина характерна высокая активность по отношению к внутриклеточным микроорганизмам, таким как уреаплазмы, микоплазмы, хламидии, легионеллы, чем объясняется его высокая клиническая эффективность при урогенитальных моно- и микст-инфекциях (особенно при сочетании с хламидиями). Подобно другим препаратам группы макролидов, джозамицин оказывает бактериостатическое действие, а в больших дозах становится бактерицидным. В отличие от других макролидов, в последние годы не наблюдался рост устойчивости уреаплазм к джозамицину. В России и за рубежом джозамицин в течение многих лет применяется во время беременности, при этом не было отмечено каких-либо неблагоприятных последствий для плода. Препарат разрешен к применению во II и III триместрах беременности. Применение джозамицина для лечения урогенитальных инфекций рекомендовано в информационном письме Российского общества акушеров-гинекологов (В. Н. Серов, 2005). Для данного препарата характерна редкость развития побочных эффектов, хорошая переносимость пациентами с патологией желудочно-кишечного тракта, что имеет существенное значение при назначении лечения больным с сопутствующими заболеваниями данной локализации.
При хроническом рецидивирующем течении воспалительного процесса уреаплазменной этиологии, неудачных предшествующих курсах антибактериальной терапии, при хронических воспалительных процессах смешанной этиологии в результате снижения общего и местного иммунитета, иммунологической реактивности происходит нарушение репаративной регенерации тканей. В таких ситуациях применение препаратов, модулирующих реакции общего и местного иммунитета у больных с хроническим воспалением слизистых оболочек, позволяет добиться возможности корригирующего влияния на регенераторный процесс. Назначение иммуномодулирующих препаратов целесообразно осуществлять с учетом данных интерферонового статуса с подбором по чувствительности интерферонпродуцирующих клеток пациента к иммуномодулирующим препаратам. В настоящее время на отечественном фармацевтическом рынке представлен широкий спектр иммуномодулирующих препаратов: Иммуномакс, Циклоферон, Ликопид, Неовир, Галавит, Панавир, Имунофан, Ридостин, Гепон и др. Местно применяются иммуномодулирующие препараты в виде суппозиториев (Кипферон, Виферон, Генферон, Галавит), дозы и схемы применения которых подбираются врачом индивидуально.
При уреаплазмозе во время беременности в I триместре при наличии показаний возможно применение терапии иммуноглобулинами для внутривенного введения, хороший терапевтический эффект дает использование озонотерапии. Во II и III триместрах из антибактериальных препаратов применяются джозамицин (Вильпрафен), эритромицин, спирамицин (Ровамицин) по стандартным схемам.
После завершения рекомендованного курса лечения контроль излеченности проводится обоим половым партнерам через 14–21 день после окончания терапии, далее — в течение трех менструальных циклов через 2–3 дня после менструации. При этом критериями излеченности уреаплазменной инфекции являются отрицательный результат бактериологического исследования на уреаплазмы и отсутствие клинических проявлений воспалительного процесса. В случае выявления после лечения уреаплазм в количестве менее чем 10 4 КОЕ/мл (носительство уреаплазм) и отсутствия клинических симптомов дальнейшее лечение не требуется.
Второй этап лечения патологии шейки матки в сочетании с уреаплазменной инфекцией или вследствие ее предусматривает локальное воздействие на шейку матки и определяется характером патологического процесса (раздельное диагностическое выскабливание — при полипах цервикального канала, лазерокоагуляция шейки матки, криодеструкция, радиоволновая хирургия — по показаниям с учетом данных гистологического исследования биоптатов).
Дальнейшее наблюдение пациенток после комплексного лечения осуществляется в соответствии с определенной международными критериями тактикой ведения больных с патологией шейки матки: в течение 1 года после применения деструктивных методов лечения — контрольное обследование состояния шейки матки (расширенная кольпоскопия, цитологическое исследование) 1 раз в 6 мес; в последующем — профилактический осмотр 1 раз в год (расширенная кольпоскопия, тест Папаниколау).
Литература
В. Н. Прилепская, доктор медицинских наук, профессор
О. В. Быковская, кандидат медицинских наук
НЦАГиП Росмедтехнологии, Москва
Читайте также:

