Грамотрицательных грамположительных бактерий аденовирусов
Обновлено: 25.04.2024
Похожие темы научных работ по клинической медицине , автор научной работы — Новиков Юрий Константинович
Антибактериальная терапия инфекций нижних дыхательных путей в амбулаторной практике с позиций доказательной медицины
Антибактериальная терапия инфекционных поражений нижних дыхательных путей – место современных макролидов
Роль грамотрицательных бактерий в патологии нижних дыхательных путей
Грамотрицательные микроорганизмы, несмотря на принадлежность к условно-патогенной флоре, вызывают тяжелое воспаление в бронхолегочной системе с частой резистентностью к антибактериальным препаратам (АБП) и высокой смертностью.
Смертность при пневмониях в зависимости от возбудителя:
синегнойная палочка 51,1%
кишечная палочка 35,3%
стафилококк золотистый 31,8%
смешанная флора 23,6%
стрептококки А и B 16,7%
хламидия (C. pneumoniae) 9,5%
гемофильная палочка 7,4%
микоплазма (M. pneumoniae) 1,4%
При внебольничных пневмониях (ВБП) наиболее частыми возбудителями являются:
Streptococcus pneumoniae 20-60%
Haemophilus influenzae 3-10%
Mycoplasma pneumoniae 1-6%
вирусы гриппа 2-15%
Chlamydia pneumoniae 4-6%
Legionella spp. 2-8%
Staphylococcus aureus 3-5%
грамотрицательная флора 3-10%
В 20-30% наблюдений этиология пневмоний не устанавливается. Таким образом, грамотрицательные микроорганизмы не являются доминирующими при ВБП, но вы-
Юрий Константинович Новиков - профессор, зав. кафедрой пульмонологии ФУВ РГМУ.
зываемые ими пневмонии протекают, как правило, тяжело, в 50-70% сопровождаясь осложнениями.
Легионеллез может проявляться в виде двух основных форм: болезни легионеров (пневмония, вызванная легио-неллой) и понтиакской лихорадки. Смертность при легио-неллезной ВБП в отсутствие лечения или при назначении неэффективных АБП достигает 16-30%, а при госпитальной пневмонии (ГП) - 50%.
Для болезни легионеров характерны: присутствие желудочно-кишечных симптомов (особенно диареи), гипона-триемия, отсутствие эффекта от р-лактамов и аминоглико-зидов. При рентгенологическом исследовании в легких обнаруживают инфильтративные тени со склонностью к слиянию, усиление легочного рисунка, экссудативный плеврит. Рентгенологические изменения появляются к 3-му дню болезни, а их обратное развитие несколько отстает от динамики клинической картины (полная нормализация происходит не ранее, чем через 1 мес).
Редко, но встречаются внелегочные проявления: эндокардит, миокардит, перикардит, синуситы, панкреатит, перитонит, пиелонефрит, парапроктит, особенно у больных с иммунодефицитом.
Понтиакская лихорадка протекает без локальных симптомов (характерны головная боль, повышение температуры тела, недомогание) и проходит без лечения.
В клиническом анализе крови обнаруживаются лейкоцитоз со сдвигом формулы влево, относительная лимфопе-ния, тромбоцитопения, повышение СОЭ; в анализе мочи -гематурия, протеинурия. В мокроте, окрашенной по Граму, определяются грамотрицательные палочки.
Для подтверждения легионеллезной инфекции используются:
• посев на селективные среды (чувствительность метода до 80%);
• определение антигена в моче иммуноферментным методом (чувствительность около 70%, специфичность до 100%);
• реакция иммунофлюоресценции для определения антигена в мокроте (чувствительность 50-70%);
• определение антител к легионелле в крови - значение имеет исходное увеличение титров в 2 раза, их 4-кратный прирост ко 2-й неделе болезни или одновременное
повышение титров иммуноглобулинов М и G (чувствительность около 70%);
• полимеразная цепная реакция (пока широко не распространена).
При легионеллезной пневмонии наиболее эффективны АБП, создающие высокую внутриклеточную концентрацию: макролиды, тетрациклины, фторхинолоны (офлокса-цин, а также “новые” фторхинолоны - левофлоксацин, ге-мифлоксацин), рифампицин. Современные макролиды (азитромицин, кларитромицин) являются антибиотиками выбора, так как они создают высокую внутриклеточную концентрацию, накапливаясь в ткани легкого, фагоцитах и альвеолярных макрофагах, удобны в применении (однократный или двукратный прием в сутки), малотоксичны по отношению к желудочно-кишечному тракту. При необходимости монотерапия макролидами может быть усилена рифампи-цином. Длительность лечения составляет 10-14 дней (для азитромицина - 7-10 дней), у пациентов с иммунодефицитом - до 21 дня.
При проведении эмпирической терапии тяжелой ВБП при неизвестном возбудителе (с учетом возможности легионеллеза) используются комбинации р-лактамов и мак-ролидов, а также монотерапия “новыми” фторхинолонами, которые обладают широким спектром противомикробной активности, включающим кокковую флору, грамотрица-тельные и атипичные возбудители.
Пневмонии, вызванные клебсиеллой, достаточно хорошо изучены. Основой для предположительного этиологического диагноза являются клинические симптомы:
• кашель с мокротой типа “малинового желе”;
• часто скудная аускультативная симптоматика (отсутствие крепитации) при долевом поражении, что связано с обтурацией бронхиол вязкой слизью;
• выраженные воспалительные изменения в крови (лейкоцитоз со сдвигом формулы влево, повышение СОЭ);
• долевое поражение легкого при рентгенологическом исследовании, формирование которого отличается от долевой пневмококковой пневмонии (происходит слияние нескольких пневмонических фокусов);
• неэффективность терапии пенициллинами.
В посеве мокроты определяются грамотрицательные палочки, не образующие капсулы. Таким образом, диагноз пневмонии, вызванной клебсиеллой, основан на несоответствии скудной аускультативной картины долевому поражению и на микробиологической идентификации возбудителя.
Эффективна антибактериальная терапия цефалоспо-ринами, аминогликозидами и фторхинолонами (в том числе офлоксацином).
ГП - это пневмония, развившаяся не ранее чем через 48 ч после госпитализации пациента (за исключением
инфекционных заболеваний с поражением легких, находившихся к моменту госпитализации в инкубационном периоде).
ГП занимают первое место среди причин смертности от внутрибольничных инфекций, которая достигает 70% (непосредственной причиной гибели больного ГП является в 30-50% случаев).
Сложности, с которыми встречается врач в практической работе, начинаются с эпидемиологии: ГП не относится к заболеваниям, требующим обязательной регистрации, и поэтому нет точной статистики. Предполагается, что ГП возникает у 5-10 больных на 1000 госпитализированных и у 30-100 человек на 1000 - при проведении искусственной вентиляции легких (ИВЛ). Каждый день пребывания пациента в отделении интенсивной терапии при проведении ИВЛ увеличивает риск развития ГП на 1-3%. Сложность проблемы ГП находит свое отражение и в классификации пневмоний, когда один из ведущих патогенетических механизмов - аспирация (рассматриваемая как при госпитальных, так и при внебольничных пневмониях в разделах патогенеза) выносится в название отдельной рубрикой “аспирационные пневмонии”.
Дифференциальная диагностика ГП сложна, она в первую очередь проводится с неинфекционными поражениями легких, среди которых тромбозы и эмболии легочной артерии, респираторный дистресс-синдром, ателектаз легкого, застойная сердечная недостаточность, лекарственные пневмопатии. Терапевтические проблемы связаны с трудностями этиологической диагностики и возрастающей частотой полирезистентности штаммов госпитальных инфекций.
Спектр возбудителей ГП разнообразен и включает как грамположительную, так и грамотрицательную флору, в том числе анаэробную. Выделяют флору, характерную для ранних (возникших до 5 сут с момента госпитализации) и поздних (после 5 сут) ГП. В первом случае возбудители те же, что и при ВБП, а во втором флора меняется на внутрибольничную. Таким образом, заболевшие в стационаре в ранние сроки госпитализации лечатся как пациенты с ВБП.
К возбудителям ранних ГП из грамположительной флоры относится пневмококк (5-20% случаев ГП). Его источником могут быть другие пациенты при воздушно-капельном пути передачи инфекции или сам пациент с наличием пневмококка в верхних дыхательных путях. Грамотри-цательная гемофильная палочка также вызывает ранние ГП, встречаясь у курильщиков и больных хроническим бронхитом.
Поздние ГП, вызываемые грамотрицательными микроорганизмами, встречаются в 20-60% случаев ГП и составляют основные трудности при лечении. Возбудителями служат синегнойная палочка, кишечная палочка, протей, клебсиелла, энтеробактер, а из грамположительных бактерий - золотистый стафилококк, частота встречаемо-
Таблица 1. Эмпирическое назначение АБП при ГП в зависимости от тяжести, сроков начала и наличия дополнительных факторов риска
Характеристики ГП Основные микроорганизмы и характерные факторы риска Основные АБП
Ранняя и поздняя ГП легкой и средней тяжести без дополнительных факторов риска; тяжелая ранняя ГП без дополнительных факторов риска Ранняя и поздняя ГП легкой и средней тяжести при наличии дополнительных факторов риска* Тяжелая ранняя ГП при наличии факторов риска; тяжелая поздняя ГП Кишечная грамотрицательная флора (не относящиеся к Pseudomonas виды -Enterobacter, E. coli, Klebsiella) Proteus spp., Serratia marcescens, H. influenzaе, метициллинчувствительный S. aureus, S. pneumoniae Анаэробы (недавние хирургические абдоминальные вмешательства, документированная аспирация) S. aureus (кома, черепно-мозговая травма, сахарный диабет, почечная недостаточность) Legionella (лечение высокими дозами глюкокортикостероидов) Pseudomonas aeruginosa (длительное пребывание в палате интенсивной терапии, использование глюкокортикостероидов, антибиотиков, хронические заболевания легких или нагноения) P. aeruginosa; Acinetobacter spp.; предполагаемый метициллинрезистентный S. aureus Цефалоспорины II-III генерации, не обладающие антисинегнойной активностью Р-лактамы с ингибиторами р-лактамаз; при аллергии к пенициллинам - фторхинолон или клиндамицин + азтреонам Клиндамицин или р-лактам с ингибитором Р-лактамаз Ванкомицин (до элиминации метициллинрезистентного S. aureus) Макролид (возможно, в сочетании с рифампицином**) Как при тяжелой ГП (см. ниже) Аминогликозиды или фторхинолоны + один из следующих препаратов: антисинегнойный пенициллин, р-лактам с ингибитором Р-лактамазы, цефепим, цефтазидим, цефоперазон, имипенем/циластатин, азтреонам*** (± рифампицин)
* За исключением иммунодефицита (эта категория больных здесь не рассматривается).
** Рифампицин может быть добавлен при документальном подтверждении легионеллезной инфекции.
*** Эффективность азтреонама ограничивается кишечной грамотрицательной флорой, его не следует сочетать с аминогликозидами, если имеется грамположительная флора или H. influenzae.
сти которого достигает 20-40%. В нижние дыхательные пути эти микроорганизмы попадают из эндогенных источников или от других пациентов и медицинского персонала при интубации трахеи, постановке назогастральных катетеров, через медицинский инструментарий и приборы.
Флора, встречающаяся при ранних и поздних ГП, представлена анаэробами (до 35% случаев) и L. pneumophila (до 10%) из эндогенных источников, водопроводной воды, кондиционеров. M. tuberculosis встречается менее чем в 1% случаев (реактивация эндогенной инфекции или передача от бацилловыделителя). Из многочисленных вирусов для развития ГП имеют значение вирусы гриппа и респираторно-синцитиальный вирус (<1%), заражение происходит от других пациентов и персонала. Аспергиллы и кандиды встречаются менее чем в 1% случаев, заражение происходит эндогенно или от других людей; то же относится и к пневмоцистам.
Приведенные данные не являются абсолютными, и в каждом конкретном случае врач решает вопрос о вероятной этиологии и эмпирической терапии ГП, ориентируясь на местные микробиологические данные, сроки развития, тяжесть заболевания и наличие факторов риска, выявленных при сборе анамнеза и осмотре больного.
• Периплазматическое пространство у грамотрицательных бактерий находится между цитоплазматической и наружной мембранами
• Белки, которые выходят через наружную мембрану, часто взаимодействуют в периплазматическом пространстве с молекулярными шаперонами
• Наружная мембрана представляет собой липидный бислой, препятствующий разупорядочению большинства молекул
• Липополисахариды являются компонентами ближайшего к поверхности слоя наружной мембраны
• При инфицировании грамотрицательными бактериями липополисахариды активируют воспалительную реакцию
В отличие от грамположительных бактерий, у грамотрицательных присутствует наружная мембрана. Промежуток между цитоплазматической и наружной мембранами называется у них периплазматическое пространство или периплазма.
В данной статье мы рассмотрим компоненты периплазмы и наружной мембраны, а также процессы, которые происходят в периплазме.

Электронная микрофотография тонкого среза клеточной оболочки E. coli К-12.
Периплазматическое пространство во многом напоминает эндоплазматический ретикулум в клетках эукариот, поскольку там также существует окислительная среда и происходит созревание белков. В периплазме находится много белков, которые функционируют как молекулярные шапероны. Шапе-роны осуществляют несколько функций: они могут препятствовать формированию у белков нативной структуры, а также способны предотвращать их протеолиз или нежелательные взаимодействия с другими белками, приводящие к агрегации.
Например, многие белки содержат свободные цистеиновые остатки, которые в условиях восстановительной среды цитоплазмы не могут образовывать дисульфидные связи. Образование дисульфидных связей служит критическим шагом в формировании нативной струткуры и в стабилизации многих периплазматических и внеклеточных белков. Процесс катализируется дисульфидизомеразой, находящейся в периплазме. На формирование нативной структуры периплазматических белков также влияет цис-транс изомеризация пролиновых остатков.
В белках, которые не приобрели нативную структуру, пролиновые остатки в основном находятся в транс-конфигурации, однако у нативных белков они существуют как в транс, так и в цис-форме. У Е. coli идентифицировано несколько пролил изомераз. Эти ферменты ускоряют медленно протекающий процесс цис-транс изомеризации пролиновых остатков.
Еще одним примером шаперонов служит белок DegP, который помогает стабилизировать белки, потерявшие в периплазме нативную структуру. Гомологи этого белка существуют в большинстве клеток прокариот и в некоторых эукариотических клетках. Белок DegP представляет собой распространенный шаперон, активный по отношению к белкам многих типов. Другие шапероны, содержащиеся в периплазме, например PapD, участвующий в биогенезе Р-пилий, проявляют специфичность к одному типу субстрата.
PapD связывается с субъединицами пилий, по мере их выхода в периплазму, и препятствует их взаимодействию друг с другом (что непродуктивно) или с другими субъединицами. Однако предотвращение несвоевременного взаимодействия субъединиц между собой отражает лишь одну сторону действия этого шаперона. Он также необходим для формирования правильной нативной структуры субъединиц пилий. Если этого не происходит, то субъединицы агрегируют и подвергаются протеолизу.
Несмотря на присутствие шаперонов, в периплазме еще может происходить агрегация белка, и при этом активируется система Срх. Как показано на рисунке ниже, система Срх состоит по крайней мере из трех белков. Предполагается, что периплазматический белок СрхР присоединяется к агрегировавшему или неправильно уложенному белку, находящемуся в периплазме, что приводит к активации белка СрхА, который присутствует в цитоплазматической мембране. При активации происходит фосфорилирование цитоплазматического домена СрхА, и затем эта фосфатная группа переносится на ДНК-связывающий белок, CpxR. Фосфорилированный CpxR индуцирует экспрессию многих генов, включая те, которые кодируют протеазы периплазмы.
Последние деградируют агрегированные или неправильно собранные белки. К числу прочих белков, индуцируемых при участии Срх, относятся белки, способствующие сборке нативных белковых структур, например дисульфид оксидаза DsbA, и пептидилпролилизомеразы PpiA и PpiD.
Наружная мембрана асимметрична. Внутренний ее слой, так же как и во внутренней мембране, состоит из фосфолипидов, а наружный из липополисахаридов (LPS). Состав LPS меняется в зависимости от организма. У большинства организмов, однако LPS содержат О-полисахарид, коровый полисахарид и остаток липида А. Последний содержит такие жирные кислоты, как капроновая, лауриновая, миристиновая, пальмитиновая и различные стеариновые кислоты. Липид А связан с О-полисахаридом через амидоэфирные связи к коровой области. Обычно О-полисахарид состоит из повторяющихся остатков галактозы, глюкозы, рамнозы и маннозы.
Эти сахара расположены в виде разветвленных повторяющихся 4-5-звенных последовательностей, которые образуют длинный О-полисахарид. Сердцевинный полисахарид состоит из N-ацетилглюкозамина, глюкозамина, фосфата, гептозы и кетодезоксиоктоната. Эта структура связана с пептидогликановым слоем через встроенные в мембрану липопротеины.
К числу важнейших биологических свойств LPS относится их токсичность для млекопитающих. Поэтому этот фактор является ведущим в возникновении заболеваний, распространяемых грамотрицательными патогенными микроорганизмами. Липид А представляет собой токсический участок LPS и обычно рассматривается как эндотоксин. У человека и животных лимфоциты и клетки эпителия обладают рецепторами, которые узнают LPS и активируют воспалительную реакцию. При этом наблюдается подъем температуры, падение числа лимфоцитов, других лейкоцитов и тромбоцитов и развивается общее воспаление.
Клеточная оболочка у грамотрицательных бактерий состоит из цитоплазматической (внутренней) и наружной мембран,
разделенных периплазмой, и клеточной стенки, состоящей из пептидогликана.
Обе мембраны существенно различаются по составу. В экстремальных условиях, вызывающих неправильную сборку и укладку мембранных белков,
у грамотрицательных бактерий активируется сигнальная система Cpx белка.
Активация этой системы приводит к усилению экспрессии генов,
участвующих в формировании нативной структуры белков, а также в их деградации. Структура липополисахарида Salmonella typhimurium.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Виды бактерий. Классификация
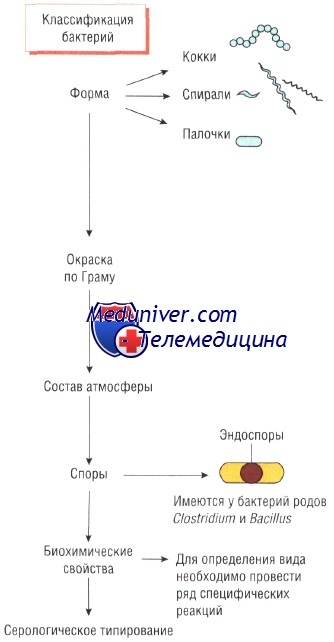
Цель классификации микроорганизмов — определение их патогенности. Например, вероятность развития заболевания при обнаружении в крови Staphylococcus aureus намного выше, чем при наличии Staphylococcus epidermidis. Некоторые бактерии (например, Corynebacterium diphtheriae и Vibrio cholerae) вызывают серьёзные заболевания и обладают способностью к эпидемическому распространению. В основе методов идентификации бактерий лежат их физико-иммунологические или молекулярные свойства.
• Окраска по Граму: чувствительность грамположительных и грамотрицательных бактерий к действию антибиотиков различается. Для идентификации некоторых других микроорганизмов (например, микобактерий) необходимы иные методы окраски.
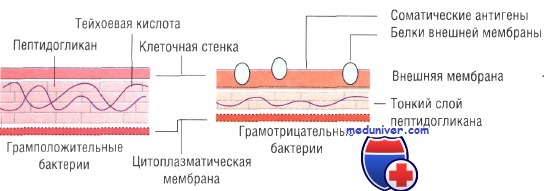
Классификация бактерий по окраске по Граму
• Форма: кокки, палочки или спирали.
• Эндоспоры, их наличие и расположение в бактериальной клетке (терминальные, субтерминальные или центральные).
• Отношение к кислороду: для существования аэробных микроорганизмов необходим кислород, в то время как анаэробные бактерии способны выживать в среде с малым его содержанием или полным отсутствием. Факультативные анаэробы могут жить как в присутствии кислорода, так и без него. Микроаэрофилы быстро размножаются при низком парциальном давлении кислорода, а капнофилы — в среде с высоким содержанием СО2.
• Требовательность: для роста некоторых бактерий необходимы особые условия культивирования.
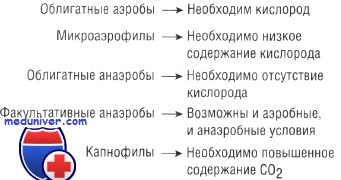
Классификация бактерий по отношению к кислороду
• Эссенциальные ферменты (ферментативная активность): например, недостаток лактозы в среде указывает на присутствие сальмонелл, а уреазный тест помогает определить Helicobacter.
• Серологические реакции возникают при взаимодействии антител с поверхностными структурами бактерий (некоторые виды сальмонелл, Haemophilus, менингококки и др.).
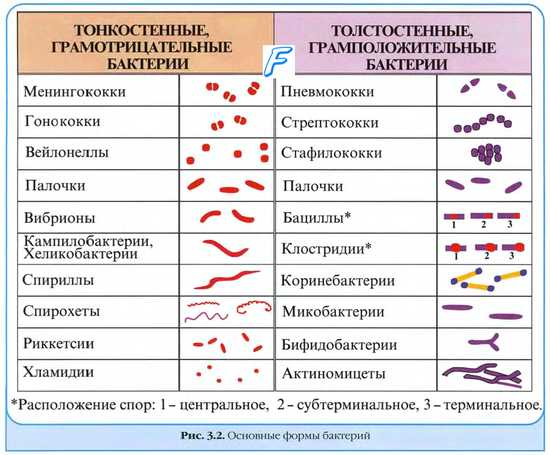
Значимвые в медицине виды бактерий
• Грамположительные кокки:
- стафилококки (каталазоположительные): Staphylococcus aureus и др.;
- стрептококки (каталазоотрицательные): Streptococcus pyogenes, вызывающий ангину, фарингит и ревматическую лихорадку; Streptococcus agalactiae, вызывающий менингит и пневмонию у новорождённых.
• Грамотрицательные кокки: Neisseria meningitidis (возбудитель менингита и септицемии) и N. Gonorrhoeae [возбудитель уретрита (гонореи)].
• Грамотрицательные коккобациллы: возбудители респираторных заболеваний (род Haemophilus и Bordetella), а также зоонозов (рода Brucella и Pasteurella).
• Грамположительные бациллы разделяют на спорообразующие и неспорообразующие бактерии. Спорообразующие бактерии подразделяют на аэробные (род Bacillus, например, Bacillus anthracis, вызывающая сибирскую язву) и анаэробные (Clostridium spp., с ними связаны такие заболевания, как газовая гангрена, псевдомембранозный колит и ботулизм). Неспорообразующие бактерии включают роды Listeria и Corynebacterium.
• Грамотрицательные палочки: факультативные анаэробы семейства энтеробактерий (условно-патогенные представители нормальной микрофлоры человека и животных, а также микроорганизмы, часто встречающиеся в окружающей среде). Наиболее известные представители группы — бактерии родов Salmonella, Shigella, Escherichia, Proteus и Yersinia. В последнее время в качестве возбудителей внутрибольничных инфекций всё чаще выступают антибиотикорезистентные штаммы рода Pseudomonas (сапрофиты, широко распространённые в окружающей среде). При определённых условиях патогенной для человека может стать Legionella, обитающая в водной среде.
• Спиралевидные бактерии:
- мелкие микроорганизмы рода Helicobacter, поражающие желудочно-кишечный тракт человека и вызывающие гастрит, язвенную болезнь желудка и двенадцатиперстной кишки (в некоторых случаях — рак желудка);
- возбудители острой диареи;
- бактерии рода Borrelia, вызывающие эпидемический возвратный тиф (В. duttoni, B. recurrentis); хронические заболевания кожи, суставов и ЦНС; лаймскую болезнь (В. burgdorferi);
- микроорганизмы рода Leptospira, относящиеся к зоонозам, вызывающие острый менингит, сопровождающийся гепатитом и почечной недостаточностью;
- род Treponema (возбудитель сифилиса Т. pallidum).
• Rickettsia, Chlamydia и Mycoplasma. Использование искусственных питательных сред возможно только для выращивания бактерий рода Mycoplasma, в то время как для выделения микроорганизмов родов Rickettsia и Chlamydia необходимо использовать культуру клеток или специальные молекулярные и серологические методы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Периплазматическое пространство у грамотрицательных бактерий находится между цитоплазматической и наружной мембранами
• Белки, которые выходят через наружную мембрану, часто взаимодействуют в периплазматическом пространстве с молекулярными шаперонами
• Наружная мембрана представляет собой липидный бислой, препятствующий разупорядочению большинства молекул
• Липополисахариды являются компонентами ближайшего к поверхности слоя наружной мембраны
• При инфицировании грамотрицательными бактериями липополисахариды активируют воспалительную реакцию
В отличие от грамположительных бактерий, у грамотрицательных присутствует наружная мембрана. Промежуток между цитоплазматической и наружной мембранами называется у них периплазматическое пространство или периплазма.
В данной статье мы рассмотрим компоненты периплазмы и наружной мембраны, а также процессы, которые происходят в периплазме.

Электронная микрофотография тонкого среза клеточной оболочки E. coli К-12.
Периплазматическое пространство во многом напоминает эндоплазматический ретикулум в клетках эукариот, поскольку там также существует окислительная среда и происходит созревание белков. В периплазме находится много белков, которые функционируют как молекулярные шапероны. Шапе-роны осуществляют несколько функций: они могут препятствовать формированию у белков нативной структуры, а также способны предотвращать их протеолиз или нежелательные взаимодействия с другими белками, приводящие к агрегации.
Например, многие белки содержат свободные цистеиновые остатки, которые в условиях восстановительной среды цитоплазмы не могут образовывать дисульфидные связи. Образование дисульфидных связей служит критическим шагом в формировании нативной струткуры и в стабилизации многих периплазматических и внеклеточных белков. Процесс катализируется дисульфидизомеразой, находящейся в периплазме. На формирование нативной структуры периплазматических белков также влияет цис-транс изомеризация пролиновых остатков.
В белках, которые не приобрели нативную структуру, пролиновые остатки в основном находятся в транс-конфигурации, однако у нативных белков они существуют как в транс, так и в цис-форме. У Е. coli идентифицировано несколько пролил изомераз. Эти ферменты ускоряют медленно протекающий процесс цис-транс изомеризации пролиновых остатков.
Еще одним примером шаперонов служит белок DegP, который помогает стабилизировать белки, потерявшие в периплазме нативную структуру. Гомологи этого белка существуют в большинстве клеток прокариот и в некоторых эукариотических клетках. Белок DegP представляет собой распространенный шаперон, активный по отношению к белкам многих типов. Другие шапероны, содержащиеся в периплазме, например PapD, участвующий в биогенезе Р-пилий, проявляют специфичность к одному типу субстрата.
PapD связывается с субъединицами пилий, по мере их выхода в периплазму, и препятствует их взаимодействию друг с другом (что непродуктивно) или с другими субъединицами. Однако предотвращение несвоевременного взаимодействия субъединиц между собой отражает лишь одну сторону действия этого шаперона. Он также необходим для формирования правильной нативной структуры субъединиц пилий. Если этого не происходит, то субъединицы агрегируют и подвергаются протеолизу.
Несмотря на присутствие шаперонов, в периплазме еще может происходить агрегация белка, и при этом активируется система Срх. Как показано на рисунке ниже, система Срх состоит по крайней мере из трех белков. Предполагается, что периплазматический белок СрхР присоединяется к агрегировавшему или неправильно уложенному белку, находящемуся в периплазме, что приводит к активации белка СрхА, который присутствует в цитоплазматической мембране. При активации происходит фосфорилирование цитоплазматического домена СрхА, и затем эта фосфатная группа переносится на ДНК-связывающий белок, CpxR. Фосфорилированный CpxR индуцирует экспрессию многих генов, включая те, которые кодируют протеазы периплазмы.
Последние деградируют агрегированные или неправильно собранные белки. К числу прочих белков, индуцируемых при участии Срх, относятся белки, способствующие сборке нативных белковых структур, например дисульфид оксидаза DsbA, и пептидилпролилизомеразы PpiA и PpiD.
Наружная мембрана асимметрична. Внутренний ее слой, так же как и во внутренней мембране, состоит из фосфолипидов, а наружный из липополисахаридов (LPS). Состав LPS меняется в зависимости от организма. У большинства организмов, однако LPS содержат О-полисахарид, коровый полисахарид и остаток липида А. Последний содержит такие жирные кислоты, как капроновая, лауриновая, миристиновая, пальмитиновая и различные стеариновые кислоты. Липид А связан с О-полисахаридом через амидоэфирные связи к коровой области. Обычно О-полисахарид состоит из повторяющихся остатков галактозы, глюкозы, рамнозы и маннозы.
Эти сахара расположены в виде разветвленных повторяющихся 4-5-звенных последовательностей, которые образуют длинный О-полисахарид. Сердцевинный полисахарид состоит из N-ацетилглюкозамина, глюкозамина, фосфата, гептозы и кетодезоксиоктоната. Эта структура связана с пептидогликановым слоем через встроенные в мембрану липопротеины.
К числу важнейших биологических свойств LPS относится их токсичность для млекопитающих. Поэтому этот фактор является ведущим в возникновении заболеваний, распространяемых грамотрицательными патогенными микроорганизмами. Липид А представляет собой токсический участок LPS и обычно рассматривается как эндотоксин. У человека и животных лимфоциты и клетки эпителия обладают рецепторами, которые узнают LPS и активируют воспалительную реакцию. При этом наблюдается подъем температуры, падение числа лимфоцитов, других лейкоцитов и тромбоцитов и развивается общее воспаление.
Клеточная оболочка у грамотрицательных бактерий состоит из цитоплазматической (внутренней) и наружной мембран,
разделенных периплазмой, и клеточной стенки, состоящей из пептидогликана.
Обе мембраны существенно различаются по составу. В экстремальных условиях, вызывающих неправильную сборку и укладку мембранных белков,
у грамотрицательных бактерий активируется сигнальная система Cpx белка.
Активация этой системы приводит к усилению экспрессии генов,
участвующих в формировании нативной структуры белков, а также в их деградации. Структура липополисахарида Salmonella typhimurium.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

