Грибковый сепсис у новорожденных после энтерола
Обновлено: 25.04.2024
Бактериофаг представляет собой прозрачную жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Биологические свойства
Пиобактериофаг поливалентный обладает способностью специфически лизировать бактерии стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек.
Состав
В 1 мл препарата содержится:
Действующее вещество.
Стерильные очищенные фильтраты фаголизатов бактерий Staphylococcus spp., Streptococcus spp., Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, Klebsiella pneumoniae, энтеропатогенных Escherichia coli (с активностью по Аппельману - не менее 10 -5 ) - до 1,0 мл.
Вспомогательное вещество.
Фармакотерапевтическая группа
Прочие терапевтические средства.
Классификация по ICTV: Caudovirales.
Код АТХ: V03А.
Фармакологические свойства
Специфическая активность. Препарат должен лизировать бактерии Staphylococcus, Streptococcus, Proteus vulgaris, Proteus mirabilis, Kl. pneumoniae, Ps. aeruginosa, E. coli в разведении не менее 10 -5 по методу Аппельмана.
Фармакодинамика. Активность бактериофага при наличии фагочувствительности бактериального штамма проявляется в виде проникновения, внутриклеточного размножения, разрушения бактериальной клетки и выхода фаговых частиц, готовых к заражению новых бактериальных клеток.
После перорального однократного приема бактериофага, фаговые частицы обнаруживаются через 1 час в образцах крови, через 1-1,5 часа на поверхности ожоговых ран и в бронхиальном содержимом, через 2 часа в ликворе и моче. В каловых массах выявлялось фаговых частиц в 3 раза больше, чем в моче.
По данным литературы, клиническая эффективность фаготерапии сопоставима с результатами лечения у пациентов, получающих антибиотикотерапию.
Фармакокинетика. Исследования по фармакокинетике, проведенные на лабораторных животных доказали, что бактериофаг, введенный любым способом, поступает в общий ток крови, но обычно в крови не задерживается, а адсорбируется различными тканями, оседая в первую очередь в лимфатических узлах, в печени и селезенке. Выведение из организма происходит через кишечник и почки.
По литературным данным длительность пребывания бактериофагов и уровень выхода фагов зависят от присутствия гомологичного фагочувствительного штамма-возбудителя инфекции в организме. При отсутствии гомологичного возбудителя через 2 часа после однократного приема наблюдается массивное выделение фагов с мочой, снижающееся до единичных к концу первых суток. Однако низкий уровень выхода фагов может поддерживаться до 6 суток. Высокое содержание фаговых частиц в образцах и длительное его выделение свидетельствует о происходящем в организме процессе размножения бактериофагов в очаге инфекции.
Гематоэнцефалический барьер у здорового животного является барьером для проникновения фагов в центральную нервную систему. Нарушение центрального барьера даже в слабой степени влечет за собой поступление бактериофага из кровяного русла в ликвор.
Показания к применению
Лечение и профилактика гнойно-воспалительных и энтеральных заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками:
- заболевания уха, горла, носа, дыхательных путей и легких - воспаления пазух носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит;
- хирургические инфекции - нагноение ран, ожоги, абсцесс, флегмона, фурункулы, карбункулы, гидроаденит, панариции, парапроктит, мастит, бурсит, остеомиелит;
- урогенитальные инфекции - уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит;
- посттравматические конъюктивиты, кератоконъюктивиты, гнойные язвы роговицы и иридоциклиты;
- энтеральные инфекции - гастроэнтероколит, холецистит, дисбактериоз;
- генерализованные септические заболевания;
- гнойно-воспалительные заболевания новорожденных - омфалит, пиодермия, конъюктивит, гастроэнтероколит, сепсис и др.;
- другие заболевания, вызванные бактериями стафилококков, стрептококков (в том числе энтерококков), протея, клебсиелл пневмонии, синегнойной и кишечной палочек.
При тяжелых проявлениях инфекций, вызванных стафилококками, стрептококками, протеем, клебсиеллой пневмонии, синегнойной и кишечной палочками, препарат назначается в составе комплексной терапии.
С профилактической целью препарат используют для обработки операционных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Способ применения и дозировка
Перед использованием флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь в течение 7-20 дней (по клиническим показаниям).
В зависимости от характера очага инфекции бактериофаг применяют:
1. Местно в виде орошения, примочек и тампонирования жидким фагом в количестве до 200 мл в зависимости от размеров пораженного участка. При абсцессах бактериофаг вводят в полость очага после удаления гноя с помощью пункции. Количество вводимого препарата должно быть несколько меньше объема удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
2. Введение в полости - плевральную, суставную и другие ограниченные полости до 100 мл бактериофага, после чего оставляют капиллярный дренаж, через который в течение нескольких дней повторно вводят бактериофаг.
3. При циститах, пиелонефритах, уретритах препарат принимают внутрь. В случае, если полость мочевого пузыря или почечной лоханки дренированы, бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку.
4. При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины, матки в дозе 5-10 мл ежедневно однократно.
5. При гнойно-воспалительных заболеваниях уха, горла, носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания, промывания, закапывания, введения смоченных турунд (оставляя их на 1 час).
6. При конъюктивитах и кератоконъюктивитах препарат закапывают по 2-3 капли 4-5 раз в день, при гнойной язве роговицы - по 4-5 капель, при гнойных иридоциклитах препарат применяют по 6-8 капель каждые 3 часа в сочетании с приемом внутрь.
7. При лечении стоматитов и хронических генерализованных пародонтитов препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в пародонтальные карманы турунд, пропитанных пиобактериофагом, на 5-10 минут.
8. При кишечных формах заболевания, заболеваниях внутренних органов, дисбактериозе бактериофаг применяют через рот и в виде клизм в течение 7-20 дней. Через рот бактериофаг дают 3 раза в сутки натощак за 1 час до еды. В виде клизм назначают 1 раз в день вместо одного приема через рот.
Рекомендуемые дозировки препарата
| Возраст пациента | Доза на 1 прием (мл) | |
| Внутрь | В клизме | |
| 0-6 мес. | 5 | 10 |
| 6-12 мес. | 10 | 20 |
| От 1 года до 3 лет | 15 | 20-30 |
| От 3- до 8 лет | 20 | 30-40 |
| От 8 лет и старше | 20-30 | 40-50 |
В случае, если до применения бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0,9% раствором натрия хлорида.
Применение бактериофага у детей (до 6 месяцев). При сепсисе, энтероколите новорожденных, включая недоношенных детей, бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки (см. табл.). При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в клизмах) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалитов, пиодермий, инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или на пораженный участок кожи).
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
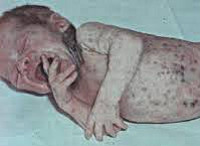
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Сепсис новорожденных - генерализованная форма гнойно-воспалительной инфекции, вызванной условно-патогенной бактериальной микрофлорой, патогенез которой связан с дисфункцией иммунной системы (преимущественно фагоцитарной) с развитием неадекватной системной воспалительной реакции (СВР) в ответ на первичный септический очаг.
Системная воспалительная реакция - общебиологическая неспецифическая иммуноцитологическая реакция организма в ответ на действие повреждающего эндогенного или экзогенного фактора. В случае развития инфекции СВР возникает в ответ на первичный гнойно-воспалительный очаг. Для СВР характерно бурное нарастание продукции провоспалительных (в большей степени) и противовоспалительных (в меньшей степени) цитокинов, неадекватное действию повреждающего фактора, что индуцирует апоптоз и некроз, обусловливая повреждающее действие СВР на организм.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Код по МКБ-10
Эпидемиология сепсиса новорожденных
В отечественной литературе нет достоверных данных о частоте инфекции среди новорождённых, что в значительной степени связано с отсутствием общепринятых диагностических критериев диагноза. По зарубежным данным, частота септических состояний среди новорождённых составляет 0,1-0,8%. Особый контингент больных - дети, находящиеся в отделениях реанимации и интенсивной терапии (ОРИТ), а также недоношенные новорождённые, среди них частота развития данного заболевания в среднем составляет 14%.
В структуре неонатальной смертности септические состояния составляет в среднем 4-5 на 1000 живорождённых. Показатели летальности от инфекции крови также довольно стабильны и составляют 30-40%.

[11], [12], [13], [14], [15]
Чем вызывается сепсис новорожденных?
Септическое состояние обусловлен исключительно условно-патогенной микрофлорой. В ряде случаев, например при иммунодефиците новорождённого, инфекция крови может быть составной частью генерализованной смешанной инфекции - вирусно-бактериальной, бактериальногрибковой и т.д.
Причиной данного заболевания у детей могут стать свыше 40 условно-патогенных микроорганизмов, но чаще всего инфекция крови обусловлен стрептококками, стафилококками, кишечной палочкой, клебсиеллой и другими грамотрицательными бактериями и анаэробами.
Этиологическая структура сепсиса новорождённых зависит от времени инфицирования плода и новорождённого.
Ранний (врождённый) неонатальное септическое состояние чаще всего обусловлен грамположительными кокками S. agalacticae относящимися к стрептококкам группы В. Данный возбудитель может быть причиной антенатального и интранального инфицирования плода;
Наиболее вероятная этиология раннего сепсиса новорождённых в зависимости от времени инфицирования плода и новорождённого
S. agalacticae
E. coli (редко)
S. agalacticae
E. coli
S. aureus
S. aureus et epidermidis
E. coli
Klebsiella spp.
S. pyogenes
E. coli и другие представители семейства кишечных грамотрицательных бацилл вызывают инфицирование плода значительно реже.
Поздний неонатальный сепсис новорожденных обычно возникает вследствие постнатального инфицирования. Основные возбудители - E. coli, S. aureus и Klebsiella pneumoniae; стрептококки группы В встречаются редко. Возрастает значение стрептококков группы А, псевдомонад и энтерококков.
В структуре грамотрицательных возбудителей данного заболевания, составляющих около 40%, в течение последних 10 лет произошли некоторые изменения. Возросла роль Pseudomonas spp. Klebsiella spp. и Enterobacter spp. Как правило, эти возбудители вызывают инфекцию крови у пациентов ОРИТ, находящихся на искусственной вентиляции лёгких (ИВЛ) и парентеральном питании, хирургических больных.
На этиологическую структуру постнатальной заболеваемости существенное влияние оказывает локализация первичного септического очага. Например, в этиологии пупочного вида инфекции ведущую роль играют стафилококки и E. coli, а в этиологии кожного и риноконъюнктивального септического состояния - стафилококки и ß-гемолитические стрептококки группы А. Также спектр возбудителей госпитальной инфекции зависит от входных ворот инфекции. Например, при катетеризационном септическом состоянии преобладающую роль играют стафилококки или смешанная генерализованная инфекция, обусловленная ассоциацией стафилококков с грибами рода Candida. При абдоминальном госпитальной инфекции часто выделяют энтеробактерии, анаэробы.
Наиболее вероятные возбудители сепсиса новорождённых в зависимости от локализации первичного очага инфекции
Локализация первичного очага
Наиболее вероятные возбудители
S. aureus et epidermidis
E. coli
K. pneumoniae
S. aureus et epidermidis Ps. aeruginosa (при ИВЛ)
Acinetobacter spp. (при ИВЛ)
Enterobacteriaceae spp.
Enterobacter spp.
Брюшная полость (после хирургических вмешательств)
Enterobacteriaceae spp.
Enterococcus spp.
Ps. aeruginosa
Анаэробы
Кожа, риноконъюнктивальная область
S. epidermidis et aureus
S. pyogenes et viridans
Ротоглотка и носоглотка, среднее ухо
S. epidermidis et aureus
S. pyogenes et viridans E. coli
E. coli и другие виды семейства Enterobacteriaceae Enterococcus spp.
Венозное русло (после применения внутривенного катетера)
S. aureus et epidermidis
Этиология генерализованных инфекций у иммунокопрометированных пациентов (в том числе у глубоко незрелых новорождённых) также имеет ряд особенностей и зависит от характера иммуносупрессии (приобретённые дисфункции иммунной системы, вторичная иммунная недостаточность, медикаментозная иммуносупрессия, врождённая, наследственная или приобретённая нейтропения, первичные иммунодефициты и ВИЧ-инфекция). Далеко не всегда инфекцией, развивающейся на таком фоне, бывает именно сепсис новорождённых.
Патогенез сепсиса новорожденных
Пусковой момент заболевания - наличие первичного гнойного очага на фоне изначальной несостоятельности противоинфекционной защиты. В этой ситуации массивное микробное обсеменение, превосходящее возможности противомикробной защиты, приводит к прорыву инфекционного начала в системный кровоток больного (бактериемия).
Наиболее вероятные возбудители генерализованных инфекций при иммунодефицитах у младенцев
Наиболее вероятные возбудители
Вторичные иммунные дисфункции, включая дисфункции при гестационной незрелости
Enterobacteriaceae spp.
Staphylococcus spp.
S. pyogenes
Грибы рода Candida
Цитомегаловирус
Enterobacteriaceae spp.
S. Aureus
Грибы рода Aspergillus et Candida
S. aureus E. coli
Грибы рода Candida
Оппортунистическая микрофлора (грибы, микобактерии, цитомегаловирус и т.д.)
Enterobacterioceae spp.
S. aureus et epidermidis Гемолитические стрептококки группы А
Помимо описанного выше, нейтрофилы играют роль фагоцитов. Значимость фагоцитоза, осуществляемого нейтрофилами и макрофагами, существенно различается - истинный фагоцитоз осуществляют именно макрофаги. Нейтрофильный фагоцитоз, хотя и протекает более интенсивно, чем у мононуклеаров, обусловлен другими биохимическими процессами, потому что задача у них иная. Основная функция нейтрофилов - инициация воспалительной реакции. Биологически активные вещества, секретируемые нейтрофильными гранулоцитами, имеют провоспалительную направленность; среди них различают цитокины, работающие в очагах острого воспаления (ИЛ-8, ИЛ-1, фактор некроза опухоли, гранулоцитарно-макрофагальный колониестимулирующий фактор и гранулоцитарный колониестимулирующий фактор) и участвующие в регуляции хронического воспаления (ИЛ-6, у-интерферон, трансформирующий фактор роста). Нейтрофилы синтезируют широкий спектр поверхностных адгезивных молекул, с помощью которых они взаимодействуют с клетками эндотелия сосудов, иммунной системы, тканей и органов. В результате адгезии изменяется чувствительность самих нейтрофилов к цитокинам и другим медиаторам, что позволяет им адекватно реагировать на изменения в тканях и органах. Цитотоксичность нейтрофилов значительно выше, чем у киллерных лимфоидных клеток (Т-лимфоцитов) и натуральных киллеров (NК-клеток). Факторы цитотоксичности нейтрофилов нацелены на ядерные структуры клеток-мишеней, структурные элементы генетического аппарата поглощённого объекта, разрушение генома с использованием факторов, индуцирующих апоптоз (ФИА). Клетки, подвергающиеся апоптозу, становятся объектами фагоцитоза и быстро разрушаются.
Нейтрофилы активно фагоцитируют микроорганизмы, не заботясь об истинном их переваривании, выбрасывают в межклеточное пространство значительные количества ФИА, чтобы как можно быстрее вызвать повреждения генетического аппарата патогенных микроорганизмов. Влияние высвобождения содержимого нейтрофильных гранул на процессы воспаления огромно. Содержимое нейтрофильных гранул индуцирует агрегацию тромбоцитов, выход гистамина, серотонина, протеаз, производных арахидоновой кислоты, активаторов свёртывания крови, системы комплемента, кинин-каллекреиновой системы и др. ФИА нейтрофилов губительны для любых клеток, так как вызывают разрушение нуклеопротеиновых комплексов генома.
Таким образом, в условиях инфекционного процесса нейтрофилы инициируют СВР, участвуют в презентации антигена возбудителя для активации специфического иммунного ответа организма. При чрезмерной активации нейтрофилов их цитотоксическое действие не ограничивается чужеродными клетками, реализуясь в отношении собственных клеток и тканей организма.
Чрезмерная СВР лежит в основе гиперактивации гипоталамо-гипофизарно-надпочечниковой системы, в норме обеспечивающей адекватную реакцию организма на стресс. Активация этой системы приводит к выбросу АКТГ и повышению содержания кортизола в крови. Чрезмерная активация гипоталамо-гипофизарно-надпочечниковой системы при септическом шоке, молниеносном течении данного заболевания приводит к неадекватной реакции на выброс АКТГ. Наряду с этим значительно снижается функциональная активность щитовидной железы, с чем связано замедление окислительного метаболизма, ограничивающее адаптивные возможности организма новорождённого. При тяжёлом септическом состоянии (молниеносное течение, септический шок) у ряда больных падает содержание соматотропного гормона (СТГ). Низкое содержание СТГ в условиях базальной гиперкортизолемии способствует бурному развитию некротических процессов (СТГ тормозит воспалительный процесс).
Другое проявление неадекватной СВР - неуправляемая активация свёртывающей системы крови, в условиях нарастающей депрессии фибринолиза неизбежно приводящая к тромбоцитопатии и коагулопатии потребления.
Таким образом, СВР, индуцированная чрезмерной активацией нейтрофилов периферической крови, активацией гипоталамо-гипофизарно-надпочечниковой системы и системы гемостаза, лежит в основе формирования полиорганной недостаточности, приводящей к глубоким расстройствам гомеостаза, иногда несовместимым с жизнью.
Для мононуклеаров нейтрофилы - клетки-помощники. Основная роль моноцитов и макрофагов - истинный фагоцитоз с дальнейшим тщательным перевариванием полуразрушенных нейтрофилами частиц клеток-мишеней, самих нейтрофилов и воспалительного клеточного дендрита. Фагоцитоз, осуществляемый макрофагами, способствует стиханию процессов воспаления и заживлению повреждённых тканей.
Формирование медиаторного ответа на бактериальную инфекцию, лежащего в основе синдрома СВР, - генетически контролируемый процесс, в котором участвуют рецепторы клеток, распознающие различные структуры микробного происхождения и индуцирующие экспрессию факторов неспецифической резистентности.
Синдром СВР лежит в основе прогрессирующей органной дисфункции, в ряде случаев достигающей степени органной недостаточности. Для патогенеза септического состояния характерно стремительное развитие полиорганной недостаточности и глубокие расстройства гомеостаза. Один из признаков нарушения гомеостаза при инфекции крови - выраженная пролиферация условно-патогенной микрофлоры, создающая предпосылки для возникновения новых инфекционных очагов и дополнительной транслокации инфекционного начала в системный кровоток. В настоящее время популярна концепция, согласно которой нарушения гомеостаза связаны с попаданием в кровь эндотоксина или липополисахаридного комплекса эндотоксина грамотрицательных бактерий, бурно колонизирующих верхние отделы тонкого кишечника в условиях тканевой гипоксии. Эндотоксин значительно усиливает СВР, провоцирует нарушения гомеостаза, рефрактерную к лечению гипотензию. Поступление в кровоток антигенов приводит к дезорганизации СВР - медиаторному хаосу. Антигенная перегрузка - причина выраженной иммуносупрессии в условиях бактериемии и нарушения микроциркуляции, способствующая формированию метастатических гнойных очагов, поддерживающих СВР, токсинемию и антигенемию. Дезорганизация СВР - основа развития септического шока.
Симптомы сепсиса новорождённых
Симптомы сепсиса новорожденных, независимо от формы (септицемия или септикопиемия), характеризуются тяжесть общего состояния новорождённого. Выражены нарушения терморегуляции (у доношенных морфофункционально зрелых новорождённых - лихорадка, у недоношенных, маловесных детей, на отягощённом преморбидном фоне - прогрессирующая гипотермия), нарушено функциональное состояние ЦНС (прогрессирующее угнетение). Характерен грязновато-бледный или сероватый оттенок кожных покровов с желтушностью и геморрагиями, участками склеремы. Выражена мраморность кожи, возможен акроцианоз. Рано возникает и быстро нарастает желтуха. Нередко развивается общий отёчный синдром. Характерна склонность к спонтанной кровоточивости. Черты лица нередко заострены.
Дыхательная недостаточность развивается без воспалительных изменений на рентгенограмме, часто происходит повреждение сердца по типу токсической кардиопатии, сопровождающееся развитием острой сердечной недостаточности. Характерно увеличение размеров селезёнки и печени, вздутие живота, выражена венозная сеть на передней брюшной стенке, часто наблюдаются срыгивания, рвота и анорексия, дисфункция желудочно-кишечного тракта вплоть до пареза кишечника. Типично отсутствие прибавки массы тела, формирование гипотрофии.
Для недоношенных детей типично подострое течение данного заболевания в виде синдрома дыхательных расстройств (одышка с периодами брадипноэ или апноэ), брадикардии, нарушения сосательного рефлекса, тенденции к гипотермии. Перечисленные симптомы сепсиса новорожденных отражают различные степени развития полиорганной недостаточности. Наиболее типичные синдромы полиорганной недостаточности при инфекции крови, а также характерные для них изменения, обнаруживаемые при лабораторных и инструментальных методах обследования, отражены в таблице.
Первичный септический очаг
Как было отмечено выше, изучая клиническую картину заболевания при позднем сепсисе новорождённых, в большинстве случаев можно обнаружить первичный септический очаг.
После внедрения первичной хирургической обработки пуповинного остатка произошло снижение частоты возникновения омфалита; в настоящее время эти заболевания встречаются не более чем в трети случаев. На этом фоне значительно возросла частота развития лёгочного (до 20-25%) и кишечного септического состояния (не менее 20%). Другие локализации первичного очага встречаются значительно реже и не превышают 2-6%. В отдельных случаях входные ворота инфекции установить не удаётся. Это особенно характерно для детей с малым гестационным возрастом, у которых слабо выражены процессы альтерации.
Клинические и лабораторные критерии органной недостаточности при септическом состоянии (Балк Р. и др., 2001, в модификации)
Под неонатальным сепсисом новорождённых понимают инвазивный вид инфекции, которая чаще всего имеет бактериальную природу. Она развивается у ребёнка в периоде после родов. Диагноз ставят на основе клинического течения сепсиса, а также результатов обследований и анализов. При лечении применяют антибактериальную терапию и симптоматические препараты.
Частота выявления неонатального сепсиса составляет от 0,5 до 0,8 на 1000 детей. Риск его развития высок, если у ребёнка:
- при рождении слишком низкая масса тела;
- низкие баллы по Апгару;
- ранний разрыв оболочек плода.
Последний фактор относят к сфере материнского перинатального риска.
Причины сепсиса новорожденных
В зависимости от характера и начала течения различают следующие виды сепсиса новорождённых:
- ранний (развивается спустя три дня после рождения);
- поздний (появляется позже трёх дней после рождения ребёнка).
Причиной сепсиса, имеющего раннее начало, являются патогенные микроорганизмы, которые могут попасть в организм ребёнка в родах. У большинства младенцев симптоматика развивается спустя шесть часов после того, как они рождаются, а большинство инфекций вызваны В-стрептококками и кишечной палочкой. Именно их выявляют при проведении культурального исследования мазков, взятых у 35% женщин.
Кроме В-стрептококка и кишечной палочки, сепсис новорождённых также могут вызывать:
- клебсиеллы;
- энтерококки;
- листерии;
- D-стрептококки и т.д.
Если сепсис имеет позднее начало, это означает, что попадание возбудителя в организм ребёнка происходит из внешней среды — в частности, по причине внутрибольничной инфекции. От 30 до 60% клинических случаев сепсиса обусловлены стафилококками, которые проникают через внутрисосудистые устройства. Чаще всего речь идёт о центральном сосудистом катетере. Кишечная палочка также может стать причиной позднего сепсиса, особенно если ребёнок рождается с критически низкими показателями массы тела.
Отдельно следует выделить грибковые инфекции, которые являются одной из возможных причин развития позднего сепсиса. Сепсис новорождённых грибковой этиологии возникает у 12-18% детей, имеющих низкую массу тела.
Бесплатная консультация по вопросам обучения
Наши консультанты всегда готовы рассказать о всех деталях!
Патофизиология и факторы риска
Есть ряд перинатальных и акушерских факторов, увеличивающих риск возникновения сепсиса новорождённых. Это преждевременный разрыв околоплодных оболочек (или ПРПО), симптомы которого проявляются примерно за 17-18 часов до рождения ребёнка. Также к факторам риска относят и хориоамнионит у матери. Он может начаться как в процессе родов, так и незадолго до них - с симптоматикой материнского лейкоцитоза, болезненностью матки, выделениями с неприятным запахом и тахикардией. При колонизации В-стафилококками риск возникновения сепсиса повышается в несколько раз.
Известно, что у матерей, имеющих низкую плотность колонизации стафилококками группы В, часто рождаются дети, колонизация у которых, наоборот, имеет высокую плотность. В околоплодных водах содержатся меконий и смазка. Их среда провоцирует интенсивный рост и развитие микроорганизмов (в частности, разных видов стрептококков). Если происходит преждевременный разрыв оболочек плода, патогенная микрофлора начинает усиленно размножаться. Аспирация способствует её попаданию в кровоток ребёнка, в результате чего быстро развивается бактериемия.
При позднем начале сепсиса новорождённых в качестве основного фактора риска следует отметить роды, начавшиеся преждевременно. К другим фактором относят использование внутрисосудистых катетеров, наличие ассоциированных патологий, действие некоторых антибактериальных препаратов и длительное нахождение в условиях стационара.
Грамположительные виды стафилококков попадают в организм ребёнка из внешней среды либо с кожных покровов. Грамотрицательная кишечная палочка, как правило, находится в эндогенной микрофлоре и начинает проявлять себя в условиях изменения внутренней среды организма: например, микрофлора может меняться при приёме антибиотиков или попадании резистентных бактерий. Резистентные бактерии могут оказаться внутри организма ребёнка, как минимум, двумя путями:
- через контаминированное медицинское оборудование;
- через руки медицинского персонала при некачественной обработке.
Грибковая флора, способствующая развитию сепсиса, попадает в кровь при длительном применении катетеров центрального типа, а также при регулярном перекармливании и применении некоторых антибиотиков цефалоспориновой группы.

Симптомы сепсиса новорожденных
Первые симптомы сепсиса являются практически одинаковыми и не зависят от того, какой вид возбудителя их вызывает:
- ребёнок плохо сосёт;
- плохо ест;
- у него снижена частота сердечных сокращений;
- проблемы с дыханием вплоть до остановок;
- температура тела может колебаться от гипотермии до высоких цифр.
Возникновение лихорадочного состояния наблюдают в 10-15% клинических случаев. Если лихорадка держится в течение длительного времени (час и более), инфицирование, скорее всего, очевидно. К другим ранним проявлениям сепсиса, которые должны побудить врачей к принятию экстренных мер, относят судорожные состояния, желтушность кожных покровов, рвоту, расстройства кишечника.
Ранний сепсис, вызванный В-стрептококком, часто проявляется у новорождённых быстротечными формами воспаления лёгких. При позднем начале сепсиса (период может составлять до 12 недель), частота возникновения менингита очень высока.
Диагностика сепсиса новорожденных
Если у ребёнка имеются клинические симптомы сепсиса, ему необходимо провести:
- общий анализ крови;
- дифференциальную диагностику (мазок);
- бактериологический посев мочи и крови (при раннем сепсисе назначать не нужно);
- люмбальную пункцию, если возможно;
- рентген грудной клетки.
В любом случае, необходимо интенсивное лечение антибактериальными препаратами.
Бесплатная консультация по вопросам обучения
Наши консультанты всегда готовы рассказать о всех деталях!
Лечение сепсиса новорожденных
В качестве лечения используют:
- антибиотики;
- симптоматическую (поддерживающую) терапию.
Сепсис опасен для жизни ребёнка, так как быстро разрушает его организм, поэтому лечение антибактериальными препаратами следует начинать как можно быстрее, с последующей корректировкой в соответствии с чувствительностью микроорганизмов к ним. Бывает так, что причина инфекции остаётся невыясненной, ребёнок внешне здоров, а анализы показывают отрицательные результаты бакпосевов. В таких случаях антибиотики вводят согласно установленным схемам в течение 48 часов, после чего лечение можно прекратить. Если масса тела ребёнка низкая, длительность лечения должна составлять 72 часа.
Обычно стартовую терапию лечения сепсиса начинают с аминогликозида и ампициллина, применяемых совместно. Иногда целесообразно добавление цефотаксима или его полная замена аминогликозидами в случае подозрения менингита, вызываемого грамотрицательными микроорганизмами. Замену антибиотиков, если она необходима, проводят после точного выявления возбудителя инфекции.
Здоровым детям из группы новорождённых, где находился больной ребёнок, тоже назначают антибиотики в виде комбинации гентамицина с ампициллином либо ампициллина с цефотаксимом. Если речь идёт о позднем варианте внутрибольничного сепсиса, в рамках стартовой терапии детям назначают ванкомицин.
Если ребёнок раньше уже прошёл курс лечения аминогликозидами от 7 дней до 2-х недель и нуждается в повторной терапии, нужно рассматривать другие антибактериальные препараты, относящиеся к аминогликозидам или цефалоспоринам третьего поколения.
При применении постоянных венозных катетеров есть риск инфицирования коагулазонегативным стафилококком. В данной ситуации стартовую терапию сепсиса следует начинать с ванкомицина, но если обнаружена чувствительность микроорганизма к нафциллину, препарат заменяют нафциллином либо цефазолином. Безусловно, катетер необходимо удалить. Также следует учитывать то, что при взятии анализа на бакпосев грибковые структуры проявляют себя в течение двух-трёх дней. Нужно быстро начать эмпирическое лечение амфотерицином В ещё до того как будет получен результат анализа, так как именно это может спасти жизнь новорождённого.
Прогноз и профилактика сепсиса новорожденных
Если ребёнок рождается недоношенным и у него низкая масса тела, уровень летальности при сепсисе составляет от 2 до 4 раз выше, чем у доношенных детей. При этом показатель общей летальности при раннем сепсисе — от 3 до 40%, при позднем — от 2 до 20%.
Количество летальных исходов при позднем сепсисе зависит от причины возникновения инфекции. Если сепсис вызван грамотрицательными микроорганизмами или грибком, летальность составляет от 32 до 36%.
При критически низкой массе тела дети с бактериальным сепсисом или кандидозом могут получить серьёзные осложнения в виде неврологических заболеваний.
Профилактические меры, помогающие минимизировать и предотвратить развитие сепсиса у новорождённых, заключаются:
- в предупреждении внутрибольничных инфекций;
- в регулярной грамотной обработке рук медицинского персонала (как до контакта с пациентами, так и после контакта с ними);
- применение одноразового инвентаря медицинского назначения;
- профилактические курсы антибактериальных препаратов женщинам, находящимся в родах;
- профилактические курсы противогрибковых средств;
- минимальные инвазии;
- сокращение времени использования венозных катетеров;
- как можно более ранний переход на грудное вскармливание;
- регулярная проверка знаний медицинского персонала по инфекционному контролю;
- обучение женщин основным правилам антисептики и уходу за детьми.
Безусловно, в целях борьбы с внутрибольничными инфекциями важны регулярные мероприятия, способствующие их выявлению и предупреждению.
Сепсис новорожденных (неонатальный) относится к опаснейшим заболеваниям младенцев, только появившихся на свет, так как он очень часто приводит к летальному исходу. Для него характерно распространение инфекции из локального очага ко всем органам и тканям с током лимфы или крови. В результате очень быстро может развиться полиорганная недостаточность. Сепсис у новорожденных вызывается инвазивной бактериальной инфекцией и развивается сразу после рождения малыша. Заболевание выявляют в основном у младенцев, имеющих при рождении пониженный индекс массы тела и низкий балл по шкале Апгар.

Виды сепсиса у новорожденных детей
Сепсис у младенцев может развиться сразу после рождения — в таком случае он считается ранним, или через трое суток, тогда он называется поздним.
Доминирующее место среди возбудителей заражения крови принадлежит грамположительным бактериям (гемолитические стрептококки группы А, стафилококки). Второе место занимают грамотрицательные возбудители (клебсиелла, кишечная и синегнойная палочки). Очень редко заболевание вызывается смешанной флорой.
Ранний неонатальный сепсис вызывается микроорганизмами, которыми ребенок заразился внутриутробно или при прохождении по родовым путям матери. Большинство клинических проявлений в этом случае наблюдаются уже спустя 6 часов после появления младенца на свет. В большинстве случаев развитию сепсиса с ранним началом способствуют грамотрицательные кишечные микроорганизмы и стрептококки группы В. В 35% случаев дети с неонатальным сепсисом рождаются от матерей, у которых перед родами или на последнем месяце беременности в мазке из влагалища или ануса обнаружены стрептококки группы В. У недоношенных младенцев частой причиной развития раннего сепсиса является нетипичный Haemophilus influenzae. В других случаях ребенок заражается энтерококками, грамотрицательными кишечными бактериями, гонококками, альфа-гемолитическими стрептококками и стафилококками.
Неонатальный сепсис с поздним началом развивается в случае попадания инфекции из внешней среды агрессивной среды. В 30–60% его вызывают стафилококки.
К основным факторам риска развития позднего сепсиса являются:
- действия медицинского персонала во время родов, сопряженные с недостаточной стерильностью одежды, перчаток, инструментов;
- инфекционные заболевания беременной;
- внутриутробная асфиксия, гипоксия плода;
- ранний выход околоплодных вод.
Сепсис с поздним началом может развиться из-за повреждений кожи и слизистых младенца, наличии гнойного мастита у матери, эпидемий инфекционных заболеваний младенцев в родовом отделении (отит, цистит, дисбактериоз). Любая инфекция, попавшая через поврежденные слизистые и кожу малыша, даже через незаживший пупок, может вызвать заражение крови.
Сепсис, развившийся после третьих суток жизни ребенка, часто возникает из-за неправильно проведенных жизненно важных процедур, которые необходимо проводить недоношенным детям. Это интубация для подключения ребенка к системе вентиляции легких, вставление катетера в вену или пупочную артерию, вставка трубки для парентерального питания, инфузионной терапии.
Причины, увеличивающие риск развития раннего неонатального сепсиса
Сепсис у новорожденных возникает чаще всего под воздействием микробов и намного реже причинами становятся грибки. Возбудителями могут стать синегнойная палочка, клебсиелла, стафилококк, кишечная палочка, стрептококк, протей.
Новорожденные попадают в группу риска, так как их иммунитет еще не сформировался. Но наибольшую опасность заражение крови несет следующим группам младенцев:
- недоношенные;
- с врожденным иммунодефицитом или диагностированным ВИЧ-статусом;
- с массой тела меньше 2 кг;
- имеющие пороки развития.
Частота заболеваемости среди новорожденных мальчиков выше, чем у девочек.
Клинические проявления
Признаки сепсиса у новорожденных очень тяжелые. Малыш сначала становится гипервозбужденным или наоборот, вялым. Он плохо берет грудь, часто срыгивает, не набирает вес. Постепенно кожные покровы становятся бледно серыми или желтоватыми. На них появляется сыпь. Наблюдается учащенное дыхание, нарушение со стороны сердечного ритма (учащение или урежение), отечность, сильное повышение или понижение температуры тела.
Сепсис у новорожденных может быть:
- Легким. Для него характерно повышение температуры, учащение дыхания и частоты сердечных сокращений.
- Средним. Характеризуется появлением осложнений, таких как перитонит, воспаление легких, менингит.
- Тяжелым. Выражено пониженное кровяное давление, возникает дисфункция пораженных инфекцией внутренних органов.
- Септический шок. Самое опасное для жизни новорожденного состояние. В половине случаев возможна смерть.
Неонатальный сепсис всегда проявляется всеми признаками интоксикации. Это вялость, частое срыгивание, нарушение отхождения мочи и кала.
Диагностика
У новорожденных сепсис выявляют врачи-неонатологи или педиатры, которые регулярно обследуют младенцев. В родильном доме это происходит ежедневно.
Если ребенок уже находится дома, то для родителей настораживающими признаками должны стать ненормальный цвет кожи (желтушный или землистый), высокая температура, понижение давления, вялость малыша. Сразу же необходимо вызвать детскую реанимацию и срочно госпитализировать ребенка.
Основной анализ, который проводят для определения сепсиса — это посев венозной крови на микрофлору. Он позволит выявить бактерию и определить ее чувствительность к антибактериальным средствам.
Общий анализ крови при сепсисе показывает снижение нейтрофилов и лейкоцитов или их повышение до критического уровня, увеличение С-реактивного белка. Проводится бакпосев мочи, анализ кала, берут мазки из конъюнктивы глаза и из зева.
Терапия
Для лечения новорожденных применяются антибактериальные препараты из группы карбапенемы, цефалоспоринов, аминогликозидов, макролидов, аминопенициллинов. Через каждые 10 дней антибиотики меняют, чтобы действующее вещество было другим.
Регулярно проводят санацию гнойных очагов с промыванием их антибактериальными растворами.
С целью предотвращения обезвоживания младенцу вливают глюкозно-натриевые растворы. Если малыш отказывается от материнской груди, ему дают сцеженное молоко через зонд.
Проводят заместительную терапию для поднятия иммунитета малыша. Применяют интерфероны, иммуноглобулины.
Дополняют лечение физиотерапевтическими процедурами. Среди них плазмоферез, гемосорбция, УВЧ, электрофорез.
Во время лечения регулярно педиатр или неонатолог мониторит основные жизненные показатели новорожденного. Обязательно проводится измерение пульса, давления. В анализах крови выявляют количество глюкозы электролитов, газов, креатинина. Все это позволяет вовремя оказать новорожденному экстренную помощь.
К сожалению, смертность у младенцев от сепсиса чрезвычайно высока (от 30 до 70%). Особенно плохой прогноз при заражении стафилококками из группы В, которые провоцируют быстрое развитие сепсиса. В других случаях сепсис провоцирует развитие флегмоны, абсцессов. После перенесенного заболевания ребенок часто более ОРИ, циститом, пиелонефритом. Будущей маме не стоит пропускать во время беременности анализы, осмотры, нормально питаться, укреплять свой иммунитет. Важно, чтобы в роддоме также была стерильность.
Читайте также:

