Хламидийная пневмония у кошек
Обновлено: 25.04.2024
Исследования показывают высокую эффективность и благоприятный профиль безопасности азитромицина при лечении кишечных инфекций, хронических инфекций дыхательных путей, кашля и коклюша у детей, хламидийной инфекции новорожденных, угревой болезни у подростко
Studies show high efficiency and favorable profile of safety of azitromicin during the treatment of intestinal infections, chronic infections of the respiratory tract, cough and whooping cough in children, with khlamidya infection of newborns, acne disease in adolescents and persons of young age.
Азитромицин (Сумамед®) — первый представитель группы полусинтетических 15-членных макролидных антибиотиков (азалидов) — применяется в клинической практике с 1991 г. и является одним из наиболее часто назначаемых препаратов во многих странах мира. Так, по данным информационно-аналитической компании IMS Health (2009) в США было выписано 53,8 млн рецептов на азитромицин (5-е место среди всех лекарственных средств) [1]. В настоящее время азитромицин одобрен Администрацией США по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration — FDA) для использования у взрослых и детей старше 6 месяцев для лечения инфекций, вызванных чувствительными к нему возбудителями, в том числе инфекций дыхательных путей (ИДП) [2]. Азитромицин обладает высокой активностью в отношении как типичных, так и атипичных бактериальных возбудителей ИДП, а его фармакокинетические особенности позволяют создавать максимальные концентрации в инфицированных тканях. Основными показаниями к использованию препарата являются острый средний отит, острый бактериальный риносинусит, внебольничная пневмония и острый стрептококковый тонзиллит/фарингит, скарлатина, инфекции кожи и мягких тканей (рожа, импетиго, вторично инфицированные дерматозы). К настоящему времени проведен ряд клинических исследований, подтверждающих эффективность азитромицина при других нозологических формах, о которых и пойдет речь в данном обзоре.
Рецидивирующие инфекции дыхательных путей
Длительный кашель и коклюш
Длительный кашель — одна из частых причин обращений к врачам-педиатрам, наиболее вероятной причиной которого может быть коклюш. Заболеваемость коклюшем остается на высоком уровне, несмотря на наличие эффективной и безопасной вакцины. Серологически подтвержденная инфекция Bordetella pertussis выявляется в 37% случаев кашля, продолжающегося более 2 недель после перенесенного ОРЗ [12]. Еще у 12,9% детей с длительным кашлем была выявлена инфекция M. pneumoniae [12]. Таким образом, примерно в половине случаев длительного кашля, обусловленного инфекционными причинами, имеются показания для назначения антибактериальных препаратов (АБП) из группы макролидов.
Препаратом выбора при лечении и постэкспозиционной профилактике коклюша считается эритромицин, который назначается на протяжении 14 дней [13]. Тем не менее, несмотря на эффективность терапии эритромицином, необходимость применения 4 раза в сутки и достаточно высокая частота возникновения нежелательных лекарственных реакций со стороны желудочно-кишечного тракта являлись причиной низкой комплаентности рекомендованного 14-дневного курса [14]. В последние десятилетия в исследованиях in vitro была продемонстрирована активность азитромицина в отношении B. pertussis, а в клинических исследованиях подтверждена эффективность данного препарата (таблица).
Согласно результатам Кокрановского систематического обзора по применению АБП для лечения и профилактики коклюша, включавшего 12 рандомизированных контролируемых исследований (общее число участников 1720), 3-дневный курс терапии азитромицином не уступал по эффективности 14-дневному курсу лечения эритромицином по клинической и микробиологической эффективности, а также частоте возникновения микробиологических рецидивов инфекции [13]. В настоящее время азитромицин включен в рекомендации Центров по контролю и профилактике заболеваний США (англ. Centers for Disease Control and Prevention, CDC) по лечению коклюша. Его необходимо назначать детям до 6 месяцев в дозе 10 мг/кг один раз в сутки в течение 5 дней; детям старше 6 месяцев — 10 мг/кг в первый день (но не более 500 мг), далее по 5 мг/кг (2–5-й дни терапии) [14].
Болезнь кошачьей царапины
Болезнь кошачьей царапины впервые была описана в 1931 г., однако ее возбудитель, Bartonella henselae, был идентифицирован только в 1983 г., что связано со значительными трудностями при культивировании данного патогена [15]. Заболевание распространено повсеместно и чаще всего поражает детей и молодых лиц, однако может встречаться и у взрослых пациентов. Типичные проявления у лиц без иммунодефицита включают возникновение через 3–10 дней на месте повреждения, нанесенного животным, красно-коричневой безболезненной папулы. Спустя 1–3 недели развивается односторонняя регионарная лимфаденопатия. Заболевание медленно прогрессирует. Состояние пациентов, как правило, удовлетворительное, наблюдаются легкие неспецифические проявления, такие как общее недомогание, потеря аппетита, боли в животе, а также мышечные или суставные боли. В 25% случае заболевание протекает бессимптомно. Диагноз устанавливается на основании данных анамнеза (контакт с кошками и наличие царапин) и серологического исследования — определение антител класса IgG к B. henselae в титре более 1:256. Длительность инфекционного процесса обычно не превышает 6 месяцев [15].
Несмотря на то, что болезнь кошачьей царапины у людей с сохраненным иммунитетом склонна к самоизлечению и без терапии выздоровление наступает через 2–3 месяца, было показано ускоренное разрешение лимфаденопатии (в течение 1 месяца) при лечении коротким курсом азитромицина [16–18]. У детей азитромицин назначается в течение 5 дней в дозе 10 мг/кг в первый день, а в последующие 4 дня по 5 мг/кг [18, 19].
Необходимо отметить, что к числу других антибактериальных препаратов, потенциально активных в отношении B. henselae, относятся рифампицин, доксициклин, гентамицин, ко-тримоксазол и ципрофлоксацин (монотерапия или комбинация двух препаратов) [15, 20]. Часть из них не разрешена для применения в педиатрии, другие характеризуются неблагоприятным профилем безопасности, поэтому при лечении детей целесообразно отдавать предпочтение азитромицину [21].
Кишечные инфекции
Ограниченные возможности антибактериальной терапии кишечных инфекций у детей и рост резистентности возбудителей к АБП диктуют необходимость поиска новых подходов к терапии шигеллезов у детей [22]. Одним из новых направлений является изучение эффективности азитромицина при данной нозологической форме, что базируется на фармакокинетических и фармакодинамических данных и клиническом опыте применения азитромицина у взрослых [23, 24]. Проведены и первые успешные клинические исследования его эффективности при шигеллезах у детей.
Во время вспышки шигеллеза в Израиле в 2003 г. было инфицировано 73 человека, среди которых 83% составили дети в возрасте от 6 месяцев до 18 лет. Всем детям с шигеллезом, подтвержденным положительной фекальной культурой, назначалась налидиксовая кислота в дозе 55 мг/кг/сутки в 4 приема внутрь в течение 5 дней. Поскольку к моменту завершения курса ее применения у 25 детей сохранялась диарея, было принято решение о замене налидиксовой кислоты азитромицином, который назначался внутрь в дозе 10 мг/кг/сутки в течение 3 дней. У всех (100%) детей, принимавших азитромицин, диарея купировалась через 48 ч после начала терапии, в то время как в группе, получавшей только налидиксовую кислоту, купирование диареи произошло лишь у 65% детей [25].
Таким образом, результаты описанных исследований демонстрируют клиническую и микробиологическую эффективность азитромицина при шигеллезах у детей. Простой режим дозирования, быстрые темпы клинического улучшения и достаточный уровень эрадикации шигелл, наиболее вероятно обусловленный высокими внутриклеточными концентрациями азитромицина, являются основанием к проведению дальнейших исследований, направленных на подтверждение правильности данной терапевтической стратегии.
Хламидийная инфекция у новорожденных
Chlamydia trachomatis является самым распространенным в США возбудителем микробных инфекций, передающихся половым путем. Перинатальная передача C. trachomatis происходит обычно при естественных родах, но инфекция может иметь и вторичный характер, возникая в результате повреждения оболочек плода, прямой контаминации носоглотки и легких новорожденного. Описаны случаи хламидийной инфекции у новорожденных после кесарева сечения. У 35–50% новорожденных, матери которых инфицированы хламидиями, развивается конъюнктивит и у 11–20% — пневмония. Хламидийная инфекция представляет собой наиболее частую причину неонатального конъюнктивита, развивающегося между 5-м и 12-м днями жизни.
Поскольку хламидии распространяются по слезному протоку и в носоглотку, по меньшей мере, у 33% новорожденных развивается хламидийная пневмония. В тех случаях, когда признаки конъюнктивита отсутствуют, пневмония развивается у 11–20% новорожденных от инфицированных и не получавших лечение матерей [27]. C. trachomatis, может также вызывать подострую афебрильную пневмонию у детей в возрасте 1–3 месяцев.
Центрами по контролю и профилактике заболеваний США (CDC) для терапии хламидийного конъюнктивита и пневмонии у новорожденных рекомендуется применение эритромицина основание или этилсукцинат в дозе 50 мг/кг/сутки внутрь в 4 приема в течение 14 дней. Однако при этом обращается внимание на возможность возникновения у детей до 6 недель серьезного нежелательного эффекта эритромицина — гипертрофического пилоростеноза, который встречается в 8 раз чаще у детей, получающих эритромицин внутрь (но не местно), между 3-м и 13-м днями жизни [28–30]. В основе этого феномена, предположительно, лежат широко известные прокинетические свойства эритромицина. Риск развития пилоростеноза при применении других макролидов (азитромицина, кларитромицина) не установлен. Несмотря на то, что данные, касающиеся использования азитромицина при лечении хламидийной инфекции новорожденных, ограничены, существует подтверждение эффективности короткого курса азитромицина в дозе 20 мг/кг/сутки 1 раз в день внутрь в течение 3 дней для лечения хламидийной инфекции у новорожденных, то есть он может являться более безопасной альтернативой эритромицину [31, 32]. Следует отметить, что ни один другой макролидный антибиотик (кроме упомянутого выше эритромицина с сомнительным профилем безопасности у данной категории пациентов) не имеет официального одобрения для использования у новорожденных и детей первых месяцев жизни для лечения хламидийной инфекции.
Угревая болезнь
Угревая болезнь является наиболее распространенной дерматологической проблемой у подростков и молодых людей. В течение последних десятилетий было доказано, что системное применение АБП играет основную роль в лечении пациентов с угревой болезнью, у которых имеются воспалительные элементы. В ряде случаев системная антибактериальная терапия приводит к возникновению побочных эффектов, что вносит свой вклад в снижение комплаентности пациентов. Учитывая тот факт, что обычно назначаемыми системными антибиотиками при угревой болезни являются тетрациклины, а данная группа АБП характеризуется не вполне благоприятным профилем безопасности, целесообразным, особенно у подростков, является поиск более безопасных для применения альтернативных АБП. Азитромицин обладает противовоспалительными свойствами и предотвращает рост Propionibacterium acnes — основного патогена, вовлеченного в патогенез воспалительного процесса при угревой болезни [33].
По данным открытого многоцентрового несравнительного исследования, выполненного у пациентов со II степенью воспалительных форм acne vulgaris, применение азитромицина в дозе 500 мг в сутки в течение 3 последовательных дней в месяц на протяжении 3 месяцев привело к статистически достоверному уменьшению количества воспалительных элементов на различных участках лица [33].
В ходе еще одного рандомизированного двойного слепого контролируемого клинического исследования, проведенного в Иране, сравнивалась эффективность и безопасность азитромицина и доксициклина в лечении угревой болезни средней степени тяжести и изучалось влияние возраста пациента на исходы лечения [36]. В исследовании приняли участие 100 пациентов с умеренными формами acne vulgaris, которые обратились за амбулаторной помощью в дерматологическую клинику. Пациенты были рандомизированы на 2 группы А и D: группа А получала азитромицин в дозе 500 мг в сутки 4 последовательных дня в месяц на протяжении 3 последовательных месяцев; пациенты группы D принимали доксициклин в дозе 100 мг в сутки в течение 3 последовательных месяцев. Как оказалось, оба АБП были сопоставимы по клинической эффективности и безопасности при умеренно выраженных формах акне, однако доксициклин был статистически достоверно более эффективен у пациентов в возрасте старше 18 лет [36].
Таким образом, азитромицин по данным целого ряда клинических исследований продемонстрировал высокую эффективность и благоприятный профиль безопасности при лечении угревой болезни у подростков и лиц молодого возраста.
Заключение: Таким образом, Сумамед® (азитромицин), обладает высокой активностью в отношении как типичных, так и атипичных бактериальных возбудителей дыхательных путей, а его фармакокинетические особенности, позволяют создавать максимальные концентрации в инфицированных тканях. Это один из эффективных и наиболее удобных АБП, применяемых в амбулаторной практике. На основании представленных данных можно сделать вывод о том, что наряду с хорошо известными традиционными показаниями к применению азитромицина, существует еще целый ряд перспективных областей для его клинического использования в педиатрии, включающих достаточно широкий перечень дополнительных клинических состояний, при которых уже получены достоверные данные об эффективности и безопасности азитромицина. Все это открывает новые возможности его использования в респираторной медицине при рецидивирующих ИДП, длительном кашле, хламидийной инфекции у новорожденных, а также угревой болезни, болезни кошачьей царапины, кишечных инфекциях.
Литература
И. В. Андреева, кандидат медицинских наук
О. У. Стецюк, кандидат медицинских наук
НИИ антимикробной химиотерапии ГБОУ ВПО СГМА Минздравсоцразвития России, Смоленск
Пневмония (Pneumonia) — воспаление легкого. По характеру распространения патологического процесса в легких пневмонии подразделяются на лобарные (очаговые, долевые) и лобулярные (очажковые, дольковые). Для лобарной пневмонии характерно относительно быстрое распространение воспалительного процесса с вовлечением в воспалительный процесс всего легкого или отдельных его долей. Лобарное воспаление легких бывает крупозного характера и инфекционного .
Лобулярное воспаление легких у кошек протекает в виде:
В зависимости от характера течения пневмонии у кошек бывают острые и хронические.
Причины пневмонии
1. Пневмонии вызванные инфекцией в верхних дыхательных путях.
- Бактериального происхождения (микоплазмоз).
- Вирусного происхождения (инфекционный ринотрахеит, кальцевирусная инфекция кошек, хламидиоз кошек).
- Грибкового происхождения (криптококкоз)
2. Первичные заболевания легких, осложненные пневмонией.
-
и хронический катаральный бронхит. .
- Тромбоэмболия.
- Ушиб легкого.
3. Болезни зубов и придаточных полостей черепа.
4. Ателектаз легких.
5. Аспирация легких инородными предметами.
6. Вирусный перитонит кошек.
7. Хроническая сердечная недостаточность, отек легких.
8. Онкологические заболевания легких.
Патогенез. Пневмонию необходимо рассматривать не как местный процесс, а как заболевание всего организма. В зависимости от причины и состояния центральной нервной системы в легких развивается комплекс патологических нервно – гуморальных реакций, которые в конечном счете в одних случаях вызывают гиперемию и отек, в других – кровоизлияния, ателектаз, в третьих – экссудацию, пролиферацию и даже некроз. У большинства больных кошек на фоне воспаления легких снижается обмен веществ, понижаются окислительные процессы в тканях, приводящие к расстройству трофики. Развитие воспалительного процесса и бурное размножение микрофлоры в дыхательных путях сопровождается отрицательным воздействием на легочную ткань образовавшихся токсинов. Все это приводит к расстройству крово- и лимфообращения, к извращению нормальной функции бронхов и легочных альвеол. В начальных стадиях болезни возникает серозное, серозно-катаральное или катаральное воспаление. В просвет бронхов и альвеол выпотевает экссудат, состоящий из муцина, клеток крови и эпителия. В дальнейшем может произойти организация экссудата с развитием локальной индурации. В результате всасывания из очагов воспаления в кровь и лимфу токсинов и продуктов распада у кошки наблюдается отравление организма. В результате уменьшения дыхательной поверхности легких у больной кошки расстраивается газообмен. При этом в начале болезни дефицит газообмена компенсируется усилением и учащением дыхательных движений, в дальнейшем у больного животного заметно сокращается потребление кислорода, снижается степень насыщения кислородом органов и тканей. На фоне интоксикации и уменьшения газообмена в организме происходит нарушение белкового, углеводного, жирового и витаминно-минерального обменов, которые приводят к функциональным и морфологическим изменениям в сердечной мышце, у кошки развивается сердечно- сосудистая недостаточность.
Признаки пневмонии у кошек
В зависимости от причины вызвавшей пневмонию, присоединения вторичной инфекции и общего состояния организма у кошек могут наблюдаться совершенно разные клинические признаки.
Воспаление легких у кошек сопровождается лихорадкой, при которой температура тела повышается на 1-2 градуса ( в норме 37,5-39°С). Больная кошка становится вялой, апатичной, у нее отмечаем повышенную утомляемость. Присоединяется кашель, который на ранних стадиях болезни бывает редкий и сухой, в дальнейшем переходит во влажный с мокротой. Появляется хриплое или свистящее дыхание. Дыхание становиться затрудненным и учащенным. Видимые слизистые оболочки синюшные. Появляются истечения из носа и глаз.
При появлении вышеуказанных симптомов владельцы животного в срочном порядке должны обратиться в ветеринарную клинику.
Диагноз наличия у кошки пневмонии возможно поставить только в условиях ветеринарной клиники. Где ветеринарный врач проведет полный клинических осмотр больной кошки, проведет аускультацию легких ( мелко, средне и крупнопузырчатые хрипы). Кошке сделают рентген органов грудной клетки. Для подбора антибиотика – в ветеринарной лаборатории проведут исследование мокроты на чувствительность к антибиотикам. Одновременно будет проведен общий анализ крови, исследование крови на биохимические показатели. Возьмут анализы на вирусные инфекции (ринотрахеит, кальцивироз, хламидиоз). Для исключения сердечной недостаточности будет проведена электрокардиограмма.
После постановки диагноза необходимо немедленно перейти к лечению больного животного.
Лечение пневмонии у кошек
Обычно лечение пневмонии владельцы проводят в домашних условиях при патронаже ветеринарного врача.
При лечение пневмонии у кошки применяют антибиотики широкого спектра действия, в том числе цефалоспоринового ряда. Применяются сульфаниламидных препаратов (норсульфазол, сульфадимезин, сульфален и др.). Назначаются бронхолитики (препараты эфедрина, эуфиллина). Отхаркивающие препараты. Противоаллергические препараты (супрастин, пипольфен, тавегил). Препараты повышающие иммунитет, витамины (гамавит). В качестве мочегонных препаратов используют отвары почек, листа толокнянки, семян петрушки. При лихорадке – проводят жаропонижающие инъекции, препаратами не содержащих парацетамола. При сильном упадке сил – внутривенно глюконат кальция или глюкоза. При сильном обезвоживании организма – внутривенно капельницы с физраствором.
Во время лечения больной кошки, она должна находиться в теплом и сухом помещении, на мягкой подстилке. Пища у больной кошки должна быть легко усвояемой и сбалансированной по питательным веществам.
Профилактика. Профилактика пневмонии у кошки должна быть направлена на устранение сквозняков, сырости, вредных газов, паров кислот, щелочей и т.д. Профилактика пневмоний вирусного происхождения строиться на вакцинации против данных заболеваний.
Cреди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией. По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет
Cреди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией. По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет 3,9%. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, а в старшей возрастной группе достигает 25–44% [11, 13].
Наиболее распространенной причиной внебольничных пневмоний является Streptococcus pneumoniae (30–50%) [5, 11, 13]. Однако все большее значение среди этиологических факторов внебольничной пневмонии в последние годы придается так называемым атипичным микроорганизмам, прежде всего Mycoplasma pneumoniae и Chlamydophila (Chlamidia) pneumoniae, на долю которых приходится от 8 до 25% случаев заболевания [5, 9, 12].
Mycoplasma pneumoniae в структуре внебольничных пневмоний варьирует в пределах 5–50% [7, 11, 13]. Наиболее часто микоплазменная пневмония диагностируется у детей старше 5 лет и лиц молодого возраста (до 25 лет) [3, 4, 7, 10]. Каждые 3–5 лет наблюдаются эпидемиологические подъемы заболеваемости, которые длятся несколько месяцев. Вспышки заболевания характерны для изолированных и полуизолированных групп населения (военнослужащие, студенты, школьники и др., семейные вспышки) [10, 11]. Признается наличие сезонных колебаний, а именно большая распространенность инфекции в осенне-зимний период [6, 10, 13]. Источником инфекции являются как больные, так и носители. Механизм передачи инфекции — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период длится 2–3 нед. Летальность при микоплазменной пневмонии составляет 1,4% [4, 11].
Mycoplasma pneumoniae занимает промежуточное положение между вирусами, бактериями и простейшими и является мембрано-ассоциированным (но может быть и внутриклеточным) анаэробом, имеет трехслойную цитоплазматическую мембрану вместо клеточной стенки, что обусловливает резистентность к различным агентам, подавляющим синтез клеточной стенки, прежде всего к пенициллину и другим β-лактамам [6, 10]. С помощью терминальной структуры микоплазма прикрепляется к клеткам хозяина (эритроцитам, клеткам реснитчатого эпителия бронхов и др.) [6]. Микоплазма также обладает механизмом мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя и вызывает образование аутоантител и развитие аутоиммунных процессов при микоплазменной инфекции [6, 10]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae-инфекции.
Считается, что от 5 до 15% внебольничных пневмоний вызываются хламидиями, а в период эпидемии эти показатели могут увеличиваться до 25% [4, 5, 10]. Наиболее часто хламидийная пневмония встречается у взрослых, особенно у лиц среднего и пожилого возраста [2, 10]. Описаны эпидемиологические вспышки в изолированных и полуизолированных коллективах, случаи внутрисемейной передачи хламидийной инфекции [7, 10, 13]. Сезонной закономерности распространения этой инфекции не выявлено. Единственным известным резервуаром инфекции является человек. Механизм передачи — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период составляет 2–4 нед. Летальность при хламидийных пневмониях достигает 9,8% [4, 5, 13].
Chlamydophila pneumoniae — это патогенные облигатные внутриклеточные грамотрицательные бактерии, способные к латентному существованию или персистенции в организме хозяина. Характеризуются двухфазным циклом развития, состоящим из чередования функционально и морфологически различных форм — элементарных и ретикулярных телец [2, 4, 7, 10].
Клинические проявления микоплазменнойи хламидийной пневмоний
У 30–40% пациентов, заболевших микоплазменной и/или хламидийной пневмонией, диагноз ставится лишь в конце первой недели болезни; первоначально у них чаще всего ошибочно диагностируются бронхит, трахеит или ОРЗ. Это связано с тем, что, в отличие от бактериальных пневмоний, микоплазменная и хламидийная не имеют отчетливых физикальных и рентгенологических признаков инфильтрации, а культуральная диагностика их невозможна, так как микоплазмы и хламидии являются внутриклеточными возбудителями. Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается серологически или с помощью полимеразно-цепной реакции (ПЦР).
Обычно микоплазменная и хламидийная пневмонии начинаются с респираторного синдрома, проявляющегося трахеобронхитом, назофарингитом, ларингитом; протекают с субфебрильной температурой, малопродуктивным, мучительным кашлем, скудными аускультативными данными; характеризуются наличием внелегочных проявлений — кожных, суставных, гематологических, гастроэнтерологических, неврологических и других, а также нетипичными лабораторными показателями — отсутствием лейкоцитоза и нейтрофильного сдвига в периферической крови [3, 4, 7, 10, 11]. Рентгенологические изменения в легких отмечаются усилением легочного рисунка, перибронхиальной или субсегментарной инфильтрацией [5, 10, 11, 13].
Нами были обследованы 60 пациентов: 44 — с микоплазменной пневмонией и 16 — с хламидийной пневмонией. Анализ клинического материала показал, что начало заболевания при микоплазменной и хламидийной пневмониях может быть как острым, так и постепенным (табл. 1). При подостром течении пневмония начинается с поражения верхних дыхательных путей, ухудшения общего состояния и познабливания. Температура тела может быть нормальной или субфебрильной в течение 6–10 дней и лишь потом повышается до 38–39,9°С при микоплазменной и до 38–38,9°С при хламидийной пневмонии. При остром начале симптомы интоксикации появляются уже в первый день и достигают максимума к 3-му дню болезни. У пациентов с постепенным началом болезни интоксикация наиболее выражена на 7–12-й день от начала заболевания. Характерными признаками интоксикации для микоплазменной и хламидийной пневмоний являются умеренная головная боль, миалгия, общая слабость.
Одним из постоянных признаков микоплазменной и хламидийной пневмоний, по нашим данным, является кашель, который возникает одновременно с лихорадкой. У больных микоплазменной пневмонией, в отличие от хламидийной, наблюдается частый, преимущественно непродуктивный, навязчивый, мучительный, приступообразный кашель (см. табл. 1). Наряду с кашлем, у пациентов с хламидийной и микоплазменной пневмониями наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Ринит чаще всего встречается у больных хламидийной пневмонией (75,0 ± 10,8%, р < 0,001) и проявляется заложенностью носа и нарушением носового дыхания, у части больных наблюдаются небольшие либо умеренные слизисто-серозные или слизисто-гнойные выделения из носа. У пациентов же с микоплазменной пневмонией чаще регистрируются явления фарингита и ларингита, проявляющиеся гиперемией ротоглотки и осиплостью голоса (77,3 ± 6,3%, р < 0,05).
Из внелегочных проявлений при микоплазменной пневмонии чаще отмечались миалгия (63,6%), макуло-папулезная сыпь (22,7%), явления желудочно-кишечного дискомфорта (25%), при хламидийной — артралгия (18,8%) и миалгия (31,3%).
Изменения в легких, характерные для уплотнения легочной ткани, при физикальном обследовании пациентов с пневмониями, вызванными атипичными возбудителями (в отличие от больных с бактериальными пневмониями), определялись не всегда. В частности, укорочение перкуторного звука у больных микоплазменной и хламидийной пневмониями наблюдалось в 68,2 и 68,8% случаев соответственно (табл. 1). Этот признак всегда выявлялся у больных с сегментарной, полисегментарной, долевой пневмонией и лишь у 1/3 пациентов с перибронхиальной инфильтрацией. У больных микоплазменной пневмонией над зоной поражения чаще выслушивались ослабленное дыхание (40,9%), сухие и влажные хрипы (47,7%), у пациентов с хламидийной пневмонией — как ослабленное (37,5%), так и бронхиальное дыхание (31,2%) и влажные хрипы (62,5%).
При рентгенографии органов грудной клетки у больных микоплазменной и хламидийной пневмониями выявлялись и типичные пневмонические инфильтрации и интерстициальные изменения. При микоплазменной пневмонии чаще наблюдается двустороннее поражение легких (40,9%) с усилением легочного рисунка (22,7%) и перибронхиальной инфильтрацией (50%), при хламидийной пневмонии — наоборот, чаще полисегментарная инфильтрация (43,7%) и реже интерстициальные изменения (31,3%).
В общем анализе крови у больных микоплазменной и хламидийной пневмониями чаще отмечается нормальное количество лейкоцитов и умеренное повышение СОЭ (в среднем 37,1 ± 1,9 мм/ч).
По нашим наблюдениям, для микоплазменной и хламидийной пневмоний характерно затяжное рецидивирующее течение.
Таким образом, согласно клинико-рентгенологическим данным и с учетом эпидемиологической ситуации, из общего числа пациентов с внебольничными пневмониями можно выделить больных с микоплазменной и/или хламидийной пневмониями. В нашем исследовании таких больных оказалось 80, из них у 60 (75%) в дальнейшем лабораторным методом была установлена микоплазменная или хламидийная этиология пневмонии.
Диагностика микоплазменной и хламидийной пневмоний
Решающая роль в выявлении микоплазменной и хламидийной инфекции отводится лабораторной диагностике.
Также в последнее время для этиологической диагностики микоплазменной и хламидийной инфекции используется ПЦР, основанная на определении ДНК возбудителя с применением метода генных зондов [3, 4, 5, 7, 10]. С помощью ПЦР возможна быстрая диагностика микоплазменной и хламидийной инфекции, но этот метод не позволяет отличить активную инфекцию от персистирующей [1, 7, 10, 11].
Таким образом, для достоверной этиологической идентификации микоплазменной и хламидийной пневмоний необходимо проведение серологических тестов в комплексе с методами, основанными на выявлении ДНК микроорганизма.
Лечение микоплазменной и хламидийной пневмоний
Рассмотренные выше микробиологические особенности Mycoplasma pneumoniae и Chlamydophila pneumoniae (главным образом внутриклеточный цикл развития) объясняют неэффективность широко используемых в клинической практике β-лактамных антибиотиков (пенициллины и цефалоспорины) и обусловливают необходимость применения антимикробных препаратов, способных проникать и накапливаться в пораженных клетках, а также блокировать внутриклеточный синтез белка. Такими свойствами обладают макролиды, фторхинолоны и тетрациклины, которые и являются средствами эрадикационной терапии при Mycoplasma pneumoniae- и Chlamydophila pneumoniae-инфекции [3, 4, 7, 10, 11].
В России макролиды представлены широким спектром препаратов (см. табл. 3). Среди них наиболее активным в отношении Mycoplasma pneumoniae признан азитромицин, имеющий ряд преимуществ перед эритромицином и кларитромицином [4, 10, 11]. В отношении Chlamydophila pneumoniae наиболее активным средством признается кларитромицин [10]. Также эффективны в отношении этих внутриклеточных патогенов и некоторые другие представители макролидов: джозамицин, спирамицин. Старый антимикробный препарат из этой группы — эритромицин — также обладает антимикоплазменной и антихламидийной активностью, но, несомненно, уступает в этом отношении вышеперечисленным антибиотикам, обладая при этом целым рядом побочных эффектов [5, 10, 11].
Значительной активностью по отношению к Mycoplasma pneumoniae и Chlamydophila pneumoniae обладают фторхинолоны — офлоксацин (заноцин, таривид, офло), ципрофлоксацин (ципробай, ципролет, цифран, сифлокс, медоциприн, цифлоксинал), в связи с чем эти антимикробные препараты рассматриваются в качестве альтернативы макролидам при данной инфекции. Высокую активность проявляют новые фторхинолоны — левофлоксацин (таваник) и моксифлоксацин (авелокс). Моксифлоксацин и левофлоксацин успешно подавляют практически любую флору, вызывающую пневмонии.
При лечении микоплазменных и хламидийных пневмоний эффективны и тетрациклины, однако антибиотики этой группы не применяются при беременности, а также печеночной недостаточности. Вероятность проявления побочных эффектов при их применении может быть выше. Из тетрациклинов активны в отношении атипичных микроорганизмов доксициклин и моноциклин (см. табл. 3).
Продолжительность антимикробной терапии неосложненных бактериальных внебольничных пневмоний составляет 5–10 дней. Для лечения микоплазменной и хламидийной пневмоний рекомендуется применять антимикробные средства не менее 2–3 нед [4, 5, 10, 11]. Сокращение сроков лечения чревато развитием рецидива инфекции [4, 10].
При нетяжелом течении микоплазменной и хламидийной пневмоний антимикробные препараты назначаются внутрь в среднетерапевтических дозах. Естественно, при тяжелых пневмониях предпочтение следует отдавать внутривенному применению антибиотика. Эритромицин фосфат назначается до 1–2 г/сут в 2–3 введения (максимально по 1 г каждые 6 ч). Спирамицин используется внутривенно по 1,5 млн МЕ 3 раза в сутки, а кларитромицин — по 250 мг 2 раза в сутки с равными интервалами. Для разведения спирамицина и кларитромицина следует применять 5%-ный раствор глюкозы.
Стоимость внутривенного лечения антибиотиками (в частности, макролидами) весьма высока, поэтому используют ступенчатую терапию, при которой лечение начинается с внутривенного применения антибиотиков, а по достижении клинического эффекта (обычно через 2–3 дня) пациент переводится на пероральную терапию тем же препаратом или другим макролидом. Ступенчатая монотерапия макролидами может проводиться эритромицином, кларитромицином, спирамицином, т. е. препаратами, которые выпускаются в двух формах: для внутривенного введения и для приема внутрь.
Несмотря на большой спектр противомикробных препаратов, эффективное лечение микоплазменных и хламидийных пневмоний представляет до настоящего времени большую проблему [2, 6, 10, 11]. Это связано с тем, что их развитие, как правило, происходит на фоне снижения антиинфекционной резистентности организма, обусловленного угнетением иммунитета [8, 9, 10, 12]. Проведенное нами исследование показателей иммунограммы у пациентов с внебольничной пневмонией микоплазменной и хламидийной этиологии выявило снижение абсолютного числа лимфоцитов, зрелых Т-лимфоцитов (CD3+), Т-хелперов (CD4+), абсолютного числа Т-супрессоров (CD8+), угнетение функциональной активности Т-системы, проявляющееся снижением плотности рецепторов к IL-2 (CD25+), способности к бласттрансформации (CD71+ — лимфоциты) и апоптозу (CD95+), а также активацию гуморального иммунитета, что проявлялось повышением числа В-лимфоцитов (CD20+), уровня IgM и ЦИК.
Микоплазмы и хламидии на разных стадиях развития располагаются как внутриклеточно, так и внеклеточно, что требует для их элиминации участия гуморальных и клеточных механизмов иммунитета [8, 9, 10, 12]. Большинство антимикробных средств действует преимущественно на внеклеточную форму возбудителей. Это приводит к персистенции возбудителей, диссеминации ее в организме, хронизации процесса, формированию осложнений. Применение лишь антимикробных средств означает лишь временное подавление возбудителей, так как на фоне такой терапии происходит сохранение и даже усугубление иммунологических расстройств, что повышает риск рецидива заболеваний [14]. Так, по результатам наших исследований, к концу курса традиционной терапии происходило усугубление Т-клеточной депрессии: снижалось относительное и абсолютное количество Т-лимфоцитов (CD3+), Т-хелперов (CD4+), Т-супрессоров (CD8+) на фоне повышения уровня IgG, ЦИК, фагоцитарного индекса и уменьшения IgA.
В связи с этим хотелось бы подчеркнуть, что терапия микоплазменной и хламидийной пневмоний должна быть комплексной и включать, помимо антимикробных средств, препараты, действие которых направлено на коррекцию иммунного ответа.
С этой целью у больных микоплазменной и хламидийной пневмониями нами применяются иммуномодуляторы (ронколейкин, ликопид, тималин, тимоген).
Включение иммуномодуляторов в комплексное лечение микоплазменных и хламидийных пневмоний позволяет добиться ярко выраженного иммунологического эффекта. Последний сочетается с выраженным клиническим воздействием, проявляющимся сокращением сроков достижения клинико-лабораторной ремиссии в среднем на 3 койко-дня, уменьшением интоксикационных симптомов через 1–3 сут после начала лечения, сокращением лихорадочного периода в 2 раза, четкой положительной рентгенологической динамикой к 12-му дню лечения у 76,7% больных; значительным уменьшением вероятности развития повторных рецидивов и хронизации процесса.
Литература
- Бочкарев Е. Г. Лабораторная диагностика хламидийной инфекции // Иммунопатология, аллергология, инфектология. — 2000. — № 4. — С. 65–72.
- Гранитов В. М. Хламидиозы. — М., 2000. — 48 с.
- Новиков Ю. К. Атипичные пневмонии // Русский медицинский журнал. — 2002. — Т. 10. — № 20. — С. 915–918.
- Ноников В. Е. Диагностика и лечение атипичных пневмоний // CONSILIUM medicum. — 2001. — T. 3. — № 12. — C. 569–574.
- Проект практических рекомендаций МЗ РФ. Внебольничная пневмония у взрослых: диагностика, лечение, профилактика. — М., 2002. — 51 с.
- Прозоровский С. В., Раковская И. В., Вульфович Ю. В. Медицинская микоплазмология. — М.: Медицина, 1995. — 285 с.
- Синопальников А. И. Атипичная пневмония // Русский медицинский журнал. — 2002. — Т. 10. — № 23. — С. 1080–1085.
- Справочник по иммунотерапии для практического врача / Под ред. А. С. Симбирцева. — СПб.: Диалог, 2002. — 480 с.
- Хаитов Р. М., Игнатьева Г. А., Сидорович И. Г. Иммунология. — М.: Медицина, 2000. — 432 с.
- Хаитов Р. Ф., Пальмова Л. Ю. Mycoplasma pneumoniae и Chlamydophila pneumoniae инфекции в пульмонологии: актуальные вопросы клиники, диагностики и лечения. — Казань, 2001. — 64 с.
- Чучалин А. Г., Синопальников А. И, Чернеховская Н. Е. Пневмония. — М.: Экономика и информатика, 2002. — 480 с.
- Boym A. Separation of leucocytes from blood und bone marrow // Scand J Clin. Lad. Jnvest. — 1968. — V. 21. — Suppl. 87. — P. 77–82.
- Guidelines for management of adult community-acquired lower respiratory tract infections. European Study in Community-acquired Pneumonia (ESOCAP) Committee // Eur Resp J. — 1998. — № 11. — Р. 986–991.
- Kawamoto M., Oshita Y., Yoshida H. et al. Two cases hypoxemic acute broncholitis due to Mycoplasma pneumoniae // Kansenshogaku Zasshi. — 2000. — V. 74. — № 3. — P. 259–263.
Г. Г. Мусалимова, кандидат медицинских наук
В. Н. Саперов, доктор медицинских наук, профессор
Т. А. Никонорова
Чувашский ГМУ, г. Чебоксары
Хламидийная пневмония – это инфекционно-воспалительный процесс в легких, вызванный облигатными внутриклеточными бактериями рода Chlamydia и Chlamydophila. Для хламидийной пневмонии характерны респираторные проявления (ринит, трахеобронхит), малопродуктивный кашель, субфебрильная и фебрильная температура, внелегочные симптомы (артралгия, миалгия). При постановке диагноза учитываются аускультативные и рентгенологические данные, однако решающая роль принадлежит лабораторной диагностике (ИФА, МИФ, ПЦР и др.). Для терапии хламидийной пневмонии применяются антимикробные средства (макролиды, тетрациклины, фторхинолоны), иммуномодуляторы, физиопроцедуры.
МКБ-10
Общие сведения
Хламидийная пневмония – этиологическая разновидность атипичной пневмонии, возникающая при инфицировании дыхательных путей различными видами хламидий - Ch. рneumoniae, Ch. psittaci и Ch. trachomatis. Считается, что ежегодно среди внебольничных пневмоний от 5 до 15% случаев вызываются хламидиями; во время эпидемических вспышек этот показатель может составлять 25%. Чаще всего заболевают взрослые, случаи хламидийной пневмонии у новорожденных связаны с заражением от матерей, больных урогенитальным хламидиозом.
Бессимптомное носительство хламидий в носоглотке определяется более чем у половины взрослых и 5-7% детей, поэтому вероятность передачи инфекции с респираторными секретами очень высока. Описаны внутрисемейные вспышки хламидийной пневмонии, а также случаи массовой заболеваемости в изолированных коллективах.

Причины
Характеристика возбудителя
Из всего многообразия представителей семейства Chlamydiaceae в этиологическом отношении практический интерес для пульмонологии представляют три типа хламидий: Chlamydophila pneumoniae, Сhlamydia trachomatis и Chlamydophila psittaci.
- Ch. pneumoniae служит самым частым возбудителем респираторных хламидиозов (в том числе хламидийного фарингита, синусита, бронхита, пневмонии) у пациентов всех возрастов.
- С Сh. trachomatis связана заболеваемость трахомой, мочеполовым хламидиозом, венерической лимфогранулемой, а также хламидийной пневмонией среди новорожденных и грудничков до 6 месяцев. Также с этим типом хламидий ассоциированы пневмонии у иммунокомпрометированных лиц и сотрудников лабораторий.
- Ch. psittaci рассматривается как возбудитель орнитоза (пситтакоза), часто протекающего в форме тяжелой интерстициальной пневмонии.
Механизм передачи
Пути заражения каждой разновидностью хламидий отличаются, однако все типы могут распространяться гематогенным путем. Передача Ch. pneumoniae от человека к человеку осуществляется преимущественно воздушно-капельным и контактно-бытовым путями. Инфицирование штаммом Ch. psittaci происходит воздушно-пылевым или фекально-оральным путем при вдыхании пыли или употреблении пищи, содержащей биологические секреты птиц-переносчиков инфекции (попугаев, канареек, кур, уток, голубей, воробьев и др.).
Инфицирование новорожденных Ch. trachomatis происходит в процессе родов от матерей с урогенитальной хламидийной инфекцией. При интранатальном заражении у 15-25% младенцев возникает хламидийный назофарингит и конъюнктивит, которые часто осложняются пневмонией.
Патогенез
Все хламидии являются облигатными грамотрицательными микроорганизмами, паразитирующими внутри клеток хозяина. В макроорганизме хламидии могут существовать в инфекционной форме (элементарные тельца) и вегетативной форме (ретикулярные тельца). Элементарные тельца проникают внутрь клетки путем стимуляции эндоцитоза, где преобразуются в ретикулярные тельца. Последние обладают высокой метаболической активностью и способностью к внутриклеточному бинарному делению.
Цикл размножения длится около 48 часов, после чего ретикулярные тельца вновь превращаются в элементарные, происходит разрыв мембраны клетки хозяина с выходом элементарных телец новой генерации во внеклеточную среду. Далее цикл инфицирования новых клеток повторяется.
Симптомы хламидийной пневмонии
Пневмония, вызванная Chlamydophila pneumoniae
Хламидийной пневмонией, вызванной Ch. pneumoniae, чаще болеют дети и молодые люди в возрасте от 5 до 35 лет. Среди причин внебольничной пневмонии в этой возрастной группе хламидии уступают только Mycoplasma pneumoniae.
Начало болезни острое или постепенное. В первом случае симптомы интоксикации и поражения дыхательных путей достигают максимальной выраженности уже на 3-и сутки. При подостром течении хламидийная пневмония манифестирует с респираторного синдрома (ринита, назофарингита, ларингита), познабливания, субфебрилитета, в связи с чем в первую неделю болезни у пациентов ошибочно диагностируется ОРЗ. Главным образом, больных беспокоит заложенность носа, нарушением носового дыхания, умеренные слизистые выделения из носа, осиплость голоса.
Пневмония, вызванная Сhlamydia trachomatis
Начало часто постепенное; у детей хламидийной пневмонии нередко предшествует конъюнктивит, острый средний отит или бронхит этой же этиологии. Ранним признаком становится сухой кашель, который, усиливаясь, приобретает приступообразный характер. На фоне кашлевых приступов у ребенка возникает тахипноэ, цианоз и рвота, однако репризы отсутствуют. Постепенно отмечается усугубление одышки, увеличение ЧД до 50-70 в минуту, дыхание становится кряхтящим. Вместе с тем, общее состояние обычно остается удовлетворительным, симптомы интоксикации и дыхательная недостаточность выражены слабо.
Аускультативная и рентгенологическая картина двусторонней хламидийной пневмонии разворачивается к исходу первой – в начале второй недели. В разгар заболевания могут появиться симптомы энтероколита, гепатоспленомегалия. Выздоровление часто затягивается на многие недели и месяцы. При тяжелых формах хламидийной пневмонии может возникать пневмоторакс, плеврит, абсцедирование. Из внелегочных осложнений встречаются миокардиты, эндокардиты, менингоэнцефалиты. Дети, перенесшие хламидийную пневмонию, вызванную Ch. trachomatis, в дальнейшем чаще страдают бронхиальной астмой и другими хроническими обструктивными заболеваниями легких.
Пневмония, вызванная Chlamydophila psittaci (Орнитоз)
Варианты клинического течения орнитоза различны – от бессимптомного до тяжелого. Самым ярким симптомом выступает высокая (до 39,5-40°С и выше) температура тела, сопровождающаяся ознобами и сильнейшей интоксикацией (резкой слабостью, головной болью, артралгиями, миалгиями). В отсутствие других симптомов данное состояние нередко расценивается как лихорадка неясного генеза.
В дальнейшем более чем в половине случаев возникает малопродуктивный кашель, боль в груди, увеличение печени и селезенки. Характерными признаками, указывающими на хламидийную этиологию пневмонии, служат признаки нейротоксикоза, пятнистая сыпь на коже, носовые кровотечения. Часто возникают расстройства пищеварения: тошнота, рвота, абдоминальные боли, поносы или запоры.
Клинико-рентгенологические изменения могут сохраняться в течение 4-6 недель. Типичными осложнениями орнитоза выступают гепатит, ДВС-синдром, венозные тромбозы, гемолитическая анемия, полиневропатии, миокардит.
Диагностика
Затруднения при установлении этиологического диагноза связаны с тем, что в отличие от бактериальных пневмоний, при хламидийной пневмонии отсутствуют отчетливые физикальные и рентгенологические признаки, а также характерные изменения в периферической крови. В этих условиях терапевтам и пульмонологам приходится ориентироваться, главным образом, на указания анамнеза, особенности клинической картины и подтверждать свои подозрения лабораторными методами (ИФА, ПЦР и др.).
- Физикальный осмотр. Аускультативные данные вариабельны: дыхание может быть жестким, бронхиальным или ослабленным везикулярным; хрипы в разгар заболевания чаще влажные или крепитирующие. Перкуторный звук обычно притуплен.
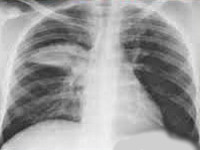
- Рентгенография. При рентгенографии легких выявляется очаговая, сегментарная или долевая инфильтрация либо интерстициальные изменения.
- Лабораторная диагностика. Наиболее специфичным и чувствительным является культуральный метод выделение возбудителя, однако из-за длительности и трудоемкости диагностики на практике обычно ограничиваются серотипированием. Стандартом на сегодняшний день служат ИФА и МИФ (реакция микроиммунофлюоресценции). При проведении ИФА на активность хламидийной инфекции указывает повышение титра специфических IgМ, IgG и IgА более 1:16, 1:512 и 1:256 соответственно; МИФ - повышение титра IgG/IgА в парных сыворотках крови в 4 и более раз. ПЦР-анализ позволяет быстро и безошибочно идентифицирвоать ДНК возбудителя, однако не позволяет отличить персистирующую инфекцию от активной.
Дифференциальную диагностику хламидийной пневмонии следует проводить с гриппом, коклюшем; вирусной, микоплазменной, легионеллезной, грибковой пневмонией и другими атипичными легочными инфекциями.
Лечение хламидийной пневмонии
Сложность эффективного лечения хламидийной пневмонии сопряжена с тем, что хламидии присутствуют в организме одновременно как во внеклеточных, так и внутриклеточных формах, поэтому необходимо воздействовать на оба этих звена. Кроме этого, активизация инфекции, как правило, происходит на фоне угнетения иммунитета, что также требует коррекции иммунного ответа.
Средствами эрадикационной терапии при хламидийной пневмонии признаны антимикробные препараты из групп макролидов, фторхинолонов и тетрациклинов. Наиболее предпочтительны среди них макролиды, т. к. могут применяться для терапии новорожденных, детей и беременных. Из препаратов этой группы наибольшей активностью в отношении хламидий обладают кларитромицин, джозамицин, эритромицин, спирамицин.
Также успешно справляются с хламидийной инфекцией фторхинолоны (ципрофлоксацин, офлоксацин, левофлоксацин) и тетрациклины (доксициклин, моноциклин), однако прием последних исключается при беременности и печеночной недостаточности. Длительность курса противомикробного лечения хламидийной пневмонии составляет не менее 2–3 недель.
С целью коррекции иммунологических расстройств, а также предупреждения рецидива инфекции, помимо антимикробных средств, назначаются иммуномодуляторы, витамины, пробиотики. В период реконвалесценции большое внимание уделяется физиотерапии, дыхательной гимнастике.
Прогноз
У пациентов молодого возраста с отсутствием сопутствующей патологии хламидийная пневмония обычно оканчивается выздоровлением. Среди пожилых летальные исходы возникают в 6-10% случаев. Наблюдения специалистов указывают на возможную этиологическую роль Ch. pneumoniae в развитии атеросклероза, саркоидоза легких, ишемического инсульта, болезни Альцгеймера, поэтому перенесенная хламидийная пневмония может иметь далеко идущие последствия. Однозначно доказано отрицательное влияние респираторного хламидиоза на течение бронхиальной астмы и частоту ее обострений.
Читайте также:

