Иммуноглобулины и сыворотки для лечения и профилактики инфекционных болезней
Обновлено: 26.04.2024
Сывороточные иммуноглобулины. Свойства различных классов иммуноглобулинов
У взрослых нормальный диапазон иммуноглобулинов широк. Нормальные уровни сывороточных иммуноглобулинов у взрослых приведены были ранее (здесь приходится пользоваться геометрическими средними из-за большого разброса вокруг средней в нормальной популяции) . Большие колебания наблюдаются также у различных рас, и это необходимо учитывать при сравнении результатов исследований, проведенных в разных странах. Например, более высокие показатели можно видеть у африканцев. В старости сохраняется уровень, который остается в нормальном диапазоне, но с возрастом могут появиться атипичные, неполные иммуноглобулины.
В некоторых условиях общее количество иммуноглобулинов данного класса может быть увеличено, но редко это общее количество состоит из каких-то специфических антител. Следовательно, в клинической практике общее содержание отдельных классов иммуноглобулинов может довольно точно коррелировать с различными респираторными болезнями, хотя на разных стадиях одной болезни могут быть большие колебания. Безусловно, эти определения дополняют специфическое выявление антител, возможное, когда известен антиген. При заболеваниях дыхательных путей уменьшение количества отдельных или всех классов иммуноглобулинов имеет большое значение, так как примерно в 70% случаев вместе с рецидивирующими респираторными инфекциями наблюдаются различные типы расстройств, связанных с дефицитом антител [Squire, 1962]..
При выявлении тех или иных специфических антител надо точно установить роль их при данном заболевании, так как в некоторых условиях они могут означать просто контакт с антигеном (например, преципитипы пенициллина), а в других условиях могут быть признаками защиты, например после иммунизации, и, наконец, в некоторых случаях — проявлением в реакции повышенной чувствительности, связанной с повреждением тканей (например, в некоторых случаях экзогенного аллергического альвеолита).
Субклассы IgG. В настоящее время известны четыре субкласса, или подкласса, IgG, причем антигенные различия между ними установлены на основании моноклональных вариантов миелом. Биологические свойства этих субклассов у человека могут иметь большое значение. Parish (1974) установил, что IgG, вызывающий быструю сенсибилизацию (IgG-KBC), который ответствен за некоторые кожпые реакции немедленного типа, связан с IgG,j. Недавно был идентифицирован также IgG2 в виде цитофильных антител на поверхности лейкоцитов при бронхолегочном аспергиллезе [Assem, Turner-Warwick, 1976]. IgG1 и IgG3 связывают комплемент и могут быть особенно важны при легочных заболеваниях иммунных комплексов, хотя эта роль их пока не была непосредственно доказана.
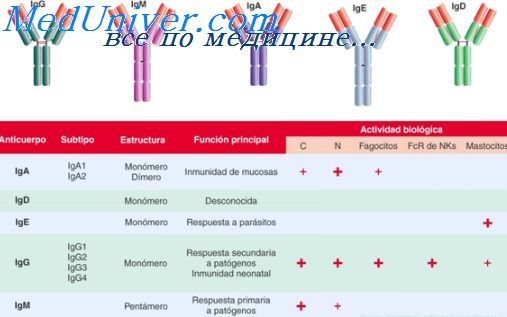
Свойства различных классов иммуноглобулинов. При первом контакте индивида с возбудителем инфекции прежде всего увеличивается содержание специфического IgM. Это повышение можно обнаружить через 3—4 дня. Медленнее повышается уровень IgG. Это повышение начинается примерно через 10 дней и достигает пика через 3 нед (первичный ответ). При реинфекции индивида (вторичный ответ) реактивное увеличение содержания IgG ускоряется и наблюдается через 3—4 дня, причем на протяжении 3 нед достигается гораздо более высокий уровень. Именно из-за этого, для того чтобы потвердить наличие свежей инфекции, например вирусной, необходимы парные образцы сыворотки. Это важно для того, чтобы исключить инфекции, перенесенные когда-либо в прошлом.
Образование антител IgM происходит временно, и, следовательно, повышение их уровня указывает па св.ежую инфекцию. Недавно этот факт был использован для выявления активной инфекции, вызванной М. tuberculosis [Nicholls, Hersfield, 1976]. Однако другие исследователи сомневаются в клиническом значении этого теста [Geddes et al., 1977; Mitchison et al., 1977]. Антитела IgM характерны также для изоагглютинипов групп крови, Холодовых агглютининов и некоторых бактериальных антител, и тесты, их выявляющие, могут быть применены для того, чтобы наблюдать за дефицитом IgM у больных с подозрением на избирательные дефекты антител.
IgG присутствует в сыворотке в значительно большем количестве и является основным видом специфических антител, направленных против бактерий, вирусов и других, микроорганизмов. В зависимости от условий лабораторных исследований антитела IgG можно обнаружить по их способности связывать комплемент, образовывать видимые преципитины или агглютинировать сенсибилизированные эритроциты.
Роль IgA в сыворотке значительно менее ясна. Видимо, он не связывает комплемент, что, вероятно, объясняется конфигурацией его фрагмента Fc. Уровень IgA повышен при циррозе [Hobbs, 1970], саркоидозе i[Hobbs, 1970], в некоторых случаях фиброзирующего альвеолита [Hobbs, Turner-Warwick, 1967] и пиевмокониозах [Hagadorn, Burrell, 1968], но причина этого повышения неизвестна. Были открыты специфические антитела IgA, примером могут быть антитела IgA против клеточных ядер (антиядерные антитела) (АЯА).
IgE содержится в сыворотке в очень малых количествах (менее 200 МЕ/мл, 1 МЕ/мл — примерно 2,4 нг/мл). Однако уровень его повышен при атопии, гельминтозах и при некоторых состояниях повышенной чувствительности к плесени, особенно при бронхолегочном аспергиллезе [Patterson et al., 1973]. О функции IgD в сыворотке известно очень мало, однако количество его оказалось повышенным у лиц с атопией [Butcher et al., 1975].
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сывороточные препараты содержат антитела, специфически связывающие и нейтрализующие определенные бактерии, вирусы, токсины.
Сыворотки используют для лечения, экстренной профилактики и диагностики инфекционных заболеваний. Различают лечебно-профилактические и диагностические сыворотки.
Лечебно-профилактические сыворотки применяют для создания пассивного искусственно приобретенного иммунитета и делят на противовирусные, антибактериальные и антитоксические. К диагностическим сывороткам относятся агглютинирующие, преципитирующие, гемолитические, антивирусные и антитоксические сыворотки. Преимущество сывороток перед вакцинами в том, что они сразу же после введения создают иммунитет (12 – 24 час). Недостаток– непродолжительный иммунитет, т.к. антитела - чужеродные белки, которые быстро (через 1 – 2 недели) выводятся из организма.
Лечебно-профилактические сыворотки получают из крови гипериммунизированных животных (лошадей) и из крови людей (донорской, плацентарной, абортивной), переболевших или иммунизированных.
Диагностические сыворотки получают из крови иммунизированных кроликов.
Для получения антитоксических сывороток проводят гипериммунизацию (многократное введение) лошадей токсинами. Иммунизацию проводят подкожно или внутривенно возрастающими дозами антигена с определенными интервалами времени между инъекциями. Вначале вводят анатоксин, а через 4 – 5 дней – токсин. Антитоксические сыворотки используют для создания антитоксического иммунитета, т.е. для лечения и профилактики токсинемических инфекций (ботулизма, столбняка, газовой гангрены, дифтерии).
Для получения антибактериальных сывороток проводят гипериммунизацию вакцинными штаммами бактерий или убитыми бактериями. Они содержат антитела с агглютинирующими и лизирующими свойствами. Это нетитруемые препараты. Малоэффективны.
Для получения противовирусных сывороток проводят гипериммунизацию штаммами вирусов.
Сыворотки очищают различными методами, концентрируют, стерилизуют и определяют ее активность (титр антител).
Активность антитоксических сывороток выражают в Международных единицах (МЕ). Активность сыворотки отражает ее способность нейтрализовать определенную дозу токсина. Это условно взятая величина для каждого вида сыворотки. Например, для дифтерийной сыворотки 1 МЕ – это наименьшее количество сыворотки, которое нейтрализует 100 DLM дифтерийного токсина для морской свинки.
Сыворотки представляют собой прозрачные жидкости, бледно- желтого цвета. Выпускают в ампулах. Сыворотки, так же как и вакцины, после производства проходят государственный контроль в соответствии с инструкциями Министерства здравоохранения. Сыворотки контролируют на стерильность, безвредность, количество белка, прозрачность и активность (титр антител). Сыворотки вводят подкожно, внутримышечно, реже - внутривенно или в спинномозговой канал. Вводят сыворотки по методу Безредке для предупреждения анафилактического шока и сывороточной болезни.
Из сывороток получают иммуноглобулины путем водно-спиртового извлечения (очистки). Иммуноглобулины – это очищенные и концентрированные иммунные сыворотки.
Иммуноглобулины, как и иммунные сыворотки бывают гомологичными и гетерологичными. Гомологичные получают из крови людей, гетерологичные – из крови животных. Иммуноглобулины из крови человека бывают 2-х видов: 1) противокоревой (нормальный) иммуноглобулин – получают из донорской, плацентарной или абортивной крови здоровых людей, которая содержит антитела против вируса кори, вирусов гриппа, гепатита, полиомиелита, против коклюша и некоторых других бактериальных и вирусных инфекций; 2) иммуноглобулины направленного действия – получают из крови переболевших людей и добровольцев, которых иммунизируют против определенной инфекции; они содержат повышенные концентрации специфических антител и применяются с лечебной целью; получают иммуноглобулины направленного действия против гриппа, бешенства, оспы, клещевого энцефалита, столбняка и стафилококковых инфекций.
Гетерологичные иммуноглобулины: иммуноглобулины лошадиные против бешенства (антирабический g-глобулин), клещевого энцефалита, лихорадки Эбола, японского энцефалита, сибирской язвы; иммуноглобулины из сыворотки крови волов для лечения лептоспироза.
Гомологичные сывороточные препараты широко применяют для профилактики и лечения вирусного гепатита, кори, для лечения ботулизма, столбняка, стафилококковых инфекций, клещевого энцефалита, гепатита В. и др.
Гетерологичные сыворотки – это лошадиные сыворотки против ботулизма, газовой гангрены, дифтерии, столбняка.
Применение гомологичных сывороток и иммуноглобулинов предпочтительнее (лучше), так как антитела более длительно находятся в организме (4 – 5 недель) и не вызывают сильных побочных реакций, как гетерологичные. Гетерологичные препараты быстро выводятся из организма (через 1 – 2 недели) и вызывают побочные эффекты. Они имеют строго ограниченное применение из-за опасности аллергических осложнений.
ИММУНОМОДУЛЯТОРЫ – препараты, которые стимулируют, ингибируют или регулируют иммунные реакции. Они воздействуют на активность иммунокомпетентных клеток, процессы образования иммунных факторов. К ним относятся интерферон, интерлейкины, миелопептиды, вещества тимуса, а также химические вещества: декарис, циклоспорин А; препараты микробного происхождения: продигиозан, пирогенал, мурамилпептид. Иммуномодуляторы назначают при опухолях, первичных и вторичных иммунодефицитах, аутоиммунных заболеваниях.
часть 1. общая микробиология
Методы лабораторной диагностики бактериальных инфекций. Бактерии – возбудители кишечных инфекций. Характеристика кишечной палочки и ее значение для макроорганизма. Заболевания, вызываемые кишечной палочкой. Принципы их лабораторной диагностики, лечения и профилактики.
Для диагностики инфекционных болезней в настоящее время широко используют лабораторные методы исследования. К ним относятся следующие методы:
3. Биологические (биопроба).
Выбор методов исследования зависит от предварительного диагноза заболевания.
Материалом для исследования может быть кровь, спинномозговая жидкость, мокрота, кал, моча, желчь, рвотные массы, слизь из зева, носа, отделяемое уретры, шейки матки, пунктаты органов, и.т.д, что зависит от характера, формы, периода болезни.
Микросопический метод основан на микроскопии мазков приготовленных из патологического материала. Мазки могут быть нативными, фиксированными и окрашенными.
Преимущество метода : простота и быстрота получения результата (30-60 минут).
Недостатки метода:
1) частая невозможность видовой идентификации возбудителей (например, патогенных энтеробактерий);
2) необходимость достаточного количества возбудителя в исследуемом материале.
Метод в большинстве случаев является ориентировочным. Однако в диагностике некоторых инфекций (например, менингита, лептоспироза, возвратного тифа, сифилиса) этот метод может быть основным.
Достоверность метода повышается при проведении иммунофлюоресцентного исследования. Этот метод основан на обработке препаратов из исследуемого материала специальными сыворотками, содержащими антитела к возбудителю, меченные флюорохромами. Меченые антитела соединяются с соответствующим антигеном, который выявляется. Под люминесцентным микроскопом вокруг этих комплексов видна зона свечения.
В настоящее время этот метод широко применяется для обнаружения различных микроорганизмов в патологическом материале.
Микробиологический метод основан на выделении чистой культуры возбудителя из патологического материала и ее идентификации. Выделение проводят путем его посева на соответствующие питательные среды. Идентификацию чистых культур проводят по морфологическим, культуральным, биохимическим, антигенным, токсигенным и другим признакам.
Преимущества метода:
1) высокая информативность и достоверность;
2) возможность определения in чувствительности выделенной культуры к антибиотикам и назначения рациональной химиотерапии;
3) возможность выявления бактерионосителей среди различных групп населения;
4) возможность расшифровки эпидемиологической цепочки (источник инфекции, пути ее передачи) на основании идентификации био-, серо-, фаговаров возбудителей.
Недостаток метода : длительность исследования (от 2-4 дней до 3-4 недель - 2 месяцев).
Метод является основным в диагностике большинства инфекций.
Биологический метод основан на заражении исследуемым материалом лабораторных животных с целью выделения и идентификации чистой культуры возбудителя (или его токсина), а также для постановки диагноза по клинической картине заболевания.
Преимущества метода:
1) возможность выделения возбудителя, когда он не растет или плохо культивируется на искусственных питательных средах (например, возбудители туляремии, риккетсиозов, хламидиозов);
2) возможность выделения возбудителя при обильном загрязнении патологического материала посторонней микрофлорой;
3) возможность дифференциации патогенных микроорганизмов (например, возбудителей эндемического и эпидемического риккетсиозов) и определение их вирулентности;
4) возможность изучить иммунитет и эффективность лечебно-профилактических препаратов.
Недостатки метода:
гибель лабораторных животных (в результате инфекционного процесса или специального умерщвления).
Биопроба на животных применяется главным образом при зоонозах, а также для обнаружения токсинов ( например, ботулинического).
Серологический метод направлен на обнаружение антител в сыворотке больного (серодиагностика) и на выявление антигенов возбудителей (сероидентификация) непосредственно в исследуемом материале.
Для серодиагностики и сероидентификации применяются различные высокочувствительные иммунологические реакции: агглютинации, РНГА,РСК, преципитации,иммунофлюоресценции, иммуноферментный, радиоиммунный анализ.
При серодиагностике в качестве антигенов используют живые культуры микроорганизмов или диагностикумы – убитые взвеси микроорганизмов или экстракты из них, полученные химическим путем.
Для сероидентификации возбудителей применяют диагностические сыворотки с высоким содержанием антител и выраженной специфичностью.
Преимущества серологического метода:
1) является одним из основных в диагностике вирусных инфекций и риккетсиозов (в связи с трудностями выделения и идентификации этих возбудителей);
2) быстрота получения результатов;
3) высокая чувствительность;
4) позволяет оценить эффективность вакцинопрофилактики;
5) позволяет провести эпидемиологический анализ инфекциооной заболеваемости.
Основной недостаток метода: относительная достоверность, так как могут быть положительные результаты серологических исследований не только у больных, но и у лиц, перенесших соответствующую инфекцию в прошлом (анамнестическая реакция) или у получавших профилактические прививки (прививочная реакция).
Возможны ложноположительные результаты при идентификации антигенов возбудителей в связи с широким антигенным родством между родами и видами внутри каждого семейства и даже среди различных семейств.
В целом серологический метод в лабораторной практике чаще имеет вспомогательное значение и не может заменить бактериологическое исследование.
Аллергический метод основан на выявлении повышенной чувствительности организма к специфическому аллергену, которым является возбудитель заболевания. Для выявления такой чувствительности ставят кожно-аллергические пробы. Человеку, у которого предполагают наличие заболевания, сопровождающегося аллергией (туберкулез, бруцеллез, туляремия, сап, сибирская язва и др.), вводят внутрикожно малые количества аллергена из возбудителя данной инфекции (убитые микробные клетки или извлеченные из них антигенные комплексы или продукты жизнедеятельности возбудителя). При наличии инфекционной аллергии через 24-72 часа возникает воспалительная реакция в виде гиперемии, инфильтрата, отека кожи. В основе положительной кожной реакции лежит клеточная реакция ГЗТ, которая отражает специфическую повышенную чувствительность организма к инфекционному аллергену. Она возникает в результате текущего, перенесенного заболевания, вакцинации или инфицирования организма.
Кроме кожно-аллергических проб используются методы аллергодиагностики in vitro (реакции лейкоцитолиза, торможения миграции лейкоцитов, лимфобласттрансформации), позволяющие оценить состояние специфической сенсибилизации лейкоцитов крови в отношении определенного антигена.
Преимущество аллергического метода: высокая специфичность.
Недостатки метода:
1) положительные реакции наблюдаются не только у больных, но у переболевших или ранее иммунизированных против этих инфекций лиц;
2) внутрикожные пробы способствуют нежелательной дополнительной сенсибилизации организма (методы аллергодиагностики in vitro лишены этого недостатка;
3) метод применим в диагностике заболеваний, сопровождающихся аллергией к возбудителю, то есть имеет ограниченное использование.
В последнее время используется новая группа методов-молекулярно-генетические. Они применяются для идентификации некоторых прихотливых бактерий (например, легионелл, хламидий), а также гонококков, микобактерий и др. Эти методы основаны на идентификации ДНК. К ним относятся:
а) метод гибридизации нуклеиновых кислот; основан на способности ДНК (и РНК) специфически соединяться (гибридизироваться) с комплементарными фрагментами искусственно созданных нитей ДНК (и РНК), меченных изотопами или ферментами (пероксидазой или щелочной фосфатазой). В дальнейшем образцы исследуют различными методами (например, ИФА).
б) полимеразная цепная реакция (ПЦР) основана на многократном образовании копий определенного участка ДНК с получением большого количества изучаемого фрагмента ДНК даже в том случае, если в распоряжении имелась всего одна исходная молекула геномной ДНК. Идентификацию копий ДНК проводят методом электрофореза.
Сывороточные препараты содержат антитела, специфически связывающие и нейтрализующие определенные бактерии, вирусы, токсины.
Сыворотки используют для лечения, экстренной профилактики и диагностики инфекционных заболеваний. Различают лечебно-профилактические и диагностические сыворотки.
Лечебно-профилактические сыворотки применяют для создания пассивного искусственно приобретенного иммунитета и делят на противовирусные, антибактериальные и антитоксические. К диагностическим сывороткам относятся агглютинирующие, преципитирующие, гемолитические, антивирусные и антитоксические сыворотки. Преимущество сывороток перед вакцинами в том, что они сразу же после введения создают иммунитет (12 – 24 час). Недостаток– непродолжительный иммунитет, т.к. антитела - чужеродные белки, которые быстро (через 1 – 2 недели) выводятся из организма.
Лечебно-профилактические сыворотки получают из крови гипериммунизированных животных (лошадей) и из крови людей (донорской, плацентарной, абортивной), переболевших или иммунизированных.
Диагностические сыворотки получают из крови иммунизированных кроликов.
Для получения антитоксических сывороток проводят гипериммунизацию (многократное введение) лошадей токсинами. Иммунизацию проводят подкожно или внутривенно возрастающими дозами антигена с определенными интервалами времени между инъекциями. Вначале вводят анатоксин, а через 4 – 5 дней – токсин. Антитоксические сыворотки используют для создания антитоксического иммунитета, т.е. для лечения и профилактики токсинемических инфекций (ботулизма, столбняка, газовой гангрены, дифтерии).
Для получения антибактериальных сывороток проводят гипериммунизацию вакцинными штаммами бактерий или убитыми бактериями. Они содержат антитела с агглютинирующими и лизирующими свойствами. Это нетитруемые препараты. Малоэффективны.
Для получения противовирусных сывороток проводят гипериммунизацию штаммами вирусов.
Сыворотки очищают различными методами, концентрируют, стерилизуют и определяют ее активность (титр антител).
Активность антитоксических сывороток выражают в Международных единицах (МЕ). Активность сыворотки отражает ее способность нейтрализовать определенную дозу токсина. Это условно взятая величина для каждого вида сыворотки. Например, для дифтерийной сыворотки 1 МЕ – это наименьшее количество сыворотки, которое нейтрализует 100 DLM дифтерийного токсина для морской свинки.
Сыворотки представляют собой прозрачные жидкости, бледно- желтого цвета. Выпускают в ампулах. Сыворотки, так же как и вакцины, после производства проходят государственный контроль в соответствии с инструкциями Министерства здравоохранения. Сыворотки контролируют на стерильность, безвредность, количество белка, прозрачность и активность (титр антител). Сыворотки вводят подкожно, внутримышечно, реже - внутривенно или в спинномозговой канал. Вводят сыворотки по методу Безредке для предупреждения анафилактического шока и сывороточной болезни.
Из сывороток получают иммуноглобулины путем водно-спиртового извлечения (очистки). Иммуноглобулины – это очищенные и концентрированные иммунные сыворотки.
Иммуноглобулины, как и иммунные сыворотки бывают гомологичными и гетерологичными. Гомологичные получают из крови людей, гетерологичные – из крови животных. Иммуноглобулины из крови человека бывают 2-х видов: 1) противокоревой (нормальный) иммуноглобулин – получают из донорской, плацентарной или абортивной крови здоровых людей, которая содержит антитела против вируса кори, вирусов гриппа, гепатита, полиомиелита, против коклюша и некоторых других бактериальных и вирусных инфекций; 2) иммуноглобулины направленного действия – получают из крови переболевших людей и добровольцев, которых иммунизируют против определенной инфекции; они содержат повышенные концентрации специфических антител и применяются с лечебной целью; получают иммуноглобулины направленного действия против гриппа, бешенства, оспы, клещевого энцефалита, столбняка и стафилококковых инфекций.
Гетерологичные иммуноглобулины: иммуноглобулины лошадиные против бешенства (антирабический g-глобулин), клещевого энцефалита, лихорадки Эбола, японского энцефалита, сибирской язвы; иммуноглобулины из сыворотки крови волов для лечения лептоспироза.
Гомологичные сывороточные препараты широко применяют для профилактики и лечения вирусного гепатита, кори, для лечения ботулизма, столбняка, стафилококковых инфекций, клещевого энцефалита, гепатита В. и др.
Гетерологичные сыворотки – это лошадиные сыворотки против ботулизма, газовой гангрены, дифтерии, столбняка.
Применение гомологичных сывороток и иммуноглобулинов предпочтительнее (лучше), так как антитела более длительно находятся в организме (4 – 5 недель) и не вызывают сильных побочных реакций, как гетерологичные. Гетерологичные препараты быстро выводятся из организма (через 1 – 2 недели) и вызывают побочные эффекты. Они имеют строго ограниченное применение из-за опасности аллергических осложнений.
ИММУНОМОДУЛЯТОРЫ – препараты, которые стимулируют, ингибируют или регулируют иммунные реакции. Они воздействуют на активность иммунокомпетентных клеток, процессы образования иммунных факторов. К ним относятся интерферон, интерлейкины, миелопептиды, вещества тимуса, а также химические вещества: декарис, циклоспорин А; препараты микробного происхождения: продигиозан, пирогенал, мурамилпептид. Иммуномодуляторы назначают при опухолях, первичных и вторичных иммунодефицитах, аутоиммунных заболеваниях.
часть 1. общая микробиология
Методы лабораторной диагностики бактериальных инфекций. Бактерии – возбудители кишечных инфекций. Характеристика кишечной палочки и ее значение для макроорганизма. Заболевания, вызываемые кишечной палочкой. Принципы их лабораторной диагностики, лечения и профилактики.
Для диагностики инфекционных болезней в настоящее время широко используют лабораторные методы исследования. К ним относятся следующие методы:
3. Биологические (биопроба).
Выбор методов исследования зависит от предварительного диагноза заболевания.
Материалом для исследования может быть кровь, спинномозговая жидкость, мокрота, кал, моча, желчь, рвотные массы, слизь из зева, носа, отделяемое уретры, шейки матки, пунктаты органов, и.т.д, что зависит от характера, формы, периода болезни.
Микросопический метод основан на микроскопии мазков приготовленных из патологического материала. Мазки могут быть нативными, фиксированными и окрашенными.
Преимущество метода : простота и быстрота получения результата (30-60 минут).
Недостатки метода:
1) частая невозможность видовой идентификации возбудителей (например, патогенных энтеробактерий);
2) необходимость достаточного количества возбудителя в исследуемом материале.
Метод в большинстве случаев является ориентировочным. Однако в диагностике некоторых инфекций (например, менингита, лептоспироза, возвратного тифа, сифилиса) этот метод может быть основным.
Достоверность метода повышается при проведении иммунофлюоресцентного исследования. Этот метод основан на обработке препаратов из исследуемого материала специальными сыворотками, содержащими антитела к возбудителю, меченные флюорохромами. Меченые антитела соединяются с соответствующим антигеном, который выявляется. Под люминесцентным микроскопом вокруг этих комплексов видна зона свечения.
В настоящее время этот метод широко применяется для обнаружения различных микроорганизмов в патологическом материале.
Микробиологический метод основан на выделении чистой культуры возбудителя из патологического материала и ее идентификации. Выделение проводят путем его посева на соответствующие питательные среды. Идентификацию чистых культур проводят по морфологическим, культуральным, биохимическим, антигенным, токсигенным и другим признакам.
Преимущества метода:
1) высокая информативность и достоверность;
2) возможность определения in чувствительности выделенной культуры к антибиотикам и назначения рациональной химиотерапии;
3) возможность выявления бактерионосителей среди различных групп населения;
4) возможность расшифровки эпидемиологической цепочки (источник инфекции, пути ее передачи) на основании идентификации био-, серо-, фаговаров возбудителей.
Недостаток метода : длительность исследования (от 2-4 дней до 3-4 недель - 2 месяцев).
Метод является основным в диагностике большинства инфекций.
Биологический метод основан на заражении исследуемым материалом лабораторных животных с целью выделения и идентификации чистой культуры возбудителя (или его токсина), а также для постановки диагноза по клинической картине заболевания.
Преимущества метода:
1) возможность выделения возбудителя, когда он не растет или плохо культивируется на искусственных питательных средах (например, возбудители туляремии, риккетсиозов, хламидиозов);
2) возможность выделения возбудителя при обильном загрязнении патологического материала посторонней микрофлорой;
3) возможность дифференциации патогенных микроорганизмов (например, возбудителей эндемического и эпидемического риккетсиозов) и определение их вирулентности;
4) возможность изучить иммунитет и эффективность лечебно-профилактических препаратов.
Недостатки метода:
гибель лабораторных животных (в результате инфекционного процесса или специального умерщвления).
Биопроба на животных применяется главным образом при зоонозах, а также для обнаружения токсинов ( например, ботулинического).
Серологический метод направлен на обнаружение антител в сыворотке больного (серодиагностика) и на выявление антигенов возбудителей (сероидентификация) непосредственно в исследуемом материале.
Для серодиагностики и сероидентификации применяются различные высокочувствительные иммунологические реакции: агглютинации, РНГА,РСК, преципитации,иммунофлюоресценции, иммуноферментный, радиоиммунный анализ.
При серодиагностике в качестве антигенов используют живые культуры микроорганизмов или диагностикумы – убитые взвеси микроорганизмов или экстракты из них, полученные химическим путем.
Для сероидентификации возбудителей применяют диагностические сыворотки с высоким содержанием антител и выраженной специфичностью.
Преимущества серологического метода:
1) является одним из основных в диагностике вирусных инфекций и риккетсиозов (в связи с трудностями выделения и идентификации этих возбудителей);
2) быстрота получения результатов;
3) высокая чувствительность;
4) позволяет оценить эффективность вакцинопрофилактики;
5) позволяет провести эпидемиологический анализ инфекциооной заболеваемости.
Основной недостаток метода: относительная достоверность, так как могут быть положительные результаты серологических исследований не только у больных, но и у лиц, перенесших соответствующую инфекцию в прошлом (анамнестическая реакция) или у получавших профилактические прививки (прививочная реакция).
Возможны ложноположительные результаты при идентификации антигенов возбудителей в связи с широким антигенным родством между родами и видами внутри каждого семейства и даже среди различных семейств.
В целом серологический метод в лабораторной практике чаще имеет вспомогательное значение и не может заменить бактериологическое исследование.
Аллергический метод основан на выявлении повышенной чувствительности организма к специфическому аллергену, которым является возбудитель заболевания. Для выявления такой чувствительности ставят кожно-аллергические пробы. Человеку, у которого предполагают наличие заболевания, сопровождающегося аллергией (туберкулез, бруцеллез, туляремия, сап, сибирская язва и др.), вводят внутрикожно малые количества аллергена из возбудителя данной инфекции (убитые микробные клетки или извлеченные из них антигенные комплексы или продукты жизнедеятельности возбудителя). При наличии инфекционной аллергии через 24-72 часа возникает воспалительная реакция в виде гиперемии, инфильтрата, отека кожи. В основе положительной кожной реакции лежит клеточная реакция ГЗТ, которая отражает специфическую повышенную чувствительность организма к инфекционному аллергену. Она возникает в результате текущего, перенесенного заболевания, вакцинации или инфицирования организма.
Кроме кожно-аллергических проб используются методы аллергодиагностики in vitro (реакции лейкоцитолиза, торможения миграции лейкоцитов, лимфобласттрансформации), позволяющие оценить состояние специфической сенсибилизации лейкоцитов крови в отношении определенного антигена.
Преимущество аллергического метода: высокая специфичность.
Недостатки метода:
1) положительные реакции наблюдаются не только у больных, но у переболевших или ранее иммунизированных против этих инфекций лиц;
2) внутрикожные пробы способствуют нежелательной дополнительной сенсибилизации организма (методы аллергодиагностики in vitro лишены этого недостатка;
3) метод применим в диагностике заболеваний, сопровождающихся аллергией к возбудителю, то есть имеет ограниченное использование.
В последнее время используется новая группа методов-молекулярно-генетические. Они применяются для идентификации некоторых прихотливых бактерий (например, легионелл, хламидий), а также гонококков, микобактерий и др. Эти методы основаны на идентификации ДНК. К ним относятся:
а) метод гибридизации нуклеиновых кислот; основан на способности ДНК (и РНК) специфически соединяться (гибридизироваться) с комплементарными фрагментами искусственно созданных нитей ДНК (и РНК), меченных изотопами или ферментами (пероксидазой или щелочной фосфатазой). В дальнейшем образцы исследуют различными методами (например, ИФА).
б) полимеразная цепная реакция (ПЦР) основана на многократном образовании копий определенного участка ДНК с получением большого количества изучаемого фрагмента ДНК даже в том случае, если в распоряжении имелась всего одна исходная молекула геномной ДНК. Идентификацию копий ДНК проводят методом электрофореза.
Сывороточные препараты содержат антитела, специфически связывающие и нейтрализующие определенные бактерии, вирусы, токсины.
Сыворотки используют для лечения, экстренной профилактики и диагностики инфекционных заболеваний. Различают лечебно-профилактические и диагностические сыворотки.
Лечебно-профилактические сыворотки применяют для создания пассивного искусственно приобретенного иммунитета и делят на противовирусные, антибактериальные и антитоксические. К диагностическим сывороткам относятся агглютинирующие, преципитирующие, гемолитические, антивирусные и антитоксические сыворотки. Преимущество сывороток перед вакцинами в том, что они сразу же после введения создают иммунитет (12 – 24 час). Недостаток– непродолжительный иммунитет, т.к. антитела - чужеродные белки, которые быстро (через 1 – 2 недели) выводятся из организма.
Лечебно-профилактические сыворотки получают из кровигипериммунизированных животных(лошадей)ииз крови людей(донорской, плацентарной, абортивной), переболевших или иммунизированных.
Диагностические сыворотки получают из крови иммунизированных кроликов.
Для получения антитоксических сывороток проводят гипериммунизацию (многократное введение) лошадей токсинами. Иммунизацию проводят подкожно или внутривенно возрастающими дозами антигена с определенными интервалами времени между инъекциями. Вначале вводят анатоксин, а через 4 – 5 дней – токсин. Антитоксические сыворотки используют для создания антитоксического иммунитета, т.е. для лечения и профилактики токсинемических инфекций(ботулизма, столбняка, газовой гангрены, дифтерии).
Для получения антибактериальных сывороток проводят гипериммунизацию вакцинными штаммами бактерий или убитыми бактериями. Они содержат антитела с агглютинирующими и лизирующими свойствами. Это нетитруемые препараты. Малоэффективны.
Для получения противовирусных сывороток проводят гипериммунизацию штаммами вирусов.
Сыворотки очищают различными методами, концентрируют, стерилизуют и определяют ее активность (титр антител).
Активность антитоксических сывороток выражают в Международных единицах (МЕ). Активность сыворотки отражает ее способность нейтрализовать определенную дозу токсина. Это условно взятая величина для каждого вида сыворотки. Например, для дифтерийной сыворотки 1 МЕ – это наименьшее количество сыворотки, которое нейтрализует 100 DLM дифтерийного токсина для морской свинки.
Сыворотки представляют собой прозрачные жидкости, бледно- желтого цвета. Выпускают в ампулах. Сыворотки, так же как и вакцины, после производства проходят государственный контроль в соответствии с инструкциями Министерства здравоохранения. Сыворотки контролируют на стерильность, безвредность, количество белка, прозрачность и активность (титр антител). Сыворотки вводят подкожно, внутримышечно, реже - внутривенно или в спинномозговой канал. Вводят сыворотки по методу Безредкедля предупреждения анафилактического шока и сывороточной болезни.
Из сывороток получают иммуноглобулины путем водно-спиртового извлечения (очистки). Иммуноглобулины – это очищенные и концентрированные иммунные сыворотки.
Иммуноглобулины,как ииммунные сывороткибываютгомологичными и гетерологичными.Гомологичные получают из крови людей, гетерологичные – из крови животных. Иммуноглобулины из крови человека бывают 2-х видов: 1) противокоревой (нормальный) иммуноглобулин – получают из донорской, плацентарной или абортивной крови здоровых людей, которая содержит антитела против вируса кори, вирусов гриппа, гепатита, полиомиелита, против коклюша и некоторых других бактериальных и вирусных инфекций; 2) иммуноглобулины направленного действия – получают из крови переболевших людей и добровольцев, которых иммунизируют против определенной инфекции; они содержат повышенные концентрации специфических антител и применяются с лечебной целью; получают иммуноглобулины направленного действия против гриппа, бешенства, оспы, клещевого энцефалита, столбняка и стафилококковых инфекций.
Гетерологичные иммуноглобулины: иммуноглобулины лошадиные против бешенства (антирабический g-глобулин), клещевого энцефалита, лихорадки Эбола, японского энцефалита, сибирской язвы; иммуноглобулины из сыворотки крови волов для лечения лептоспироза.

Гомологичные сывороточные препараты широко применяют для профилактики и лечения вирусного гепатита, кори, для лечения ботулизма, столбняка, стафилококковых инфекций, клещевого энцефалита, гепатита В. и др.
Гетерологичные сыворотки – это лошадиные сыворотки против ботулизма, газовой гангрены, дифтерии, столбняка.
Применение гомологичных сывороток и иммуноглобулинов предпочтительнее (лучше), так как антитела более длительно находятся в организме (4 – 5 недель) и не вызывают сильных побочных реакций, как гетерологичные. Гетерологичные препараты быстро выводятся из организма (через 1 – 2 недели) и вызывают побочные эффекты. Они имеют строго ограниченное применение из-за опасности аллергических осложнений.
ИММУНОМОДУЛЯТОРЫ – препараты, которые стимулируют, ингибируют или регулируют иммунные реакции. Они воздействуют на активность иммунокомпетентных клеток, процессы образования иммунных факторов. К ним относятся интерферон, интерлейкины, миелопептиды, вещества тимуса, а также химические вещества: декарис, циклоспорин А; препараты микробного происхождения: продигиозан, пирогенал, мурамилпептид. Иммуномодуляторы назначают при опухолях, первичных и вторичных иммунодефицитах, аутоиммунных заболеваниях.
Читайте также:

