Кишечная инфекция у недоношенных детей
Обновлено: 26.04.2024
Состояние воспалительной реакции кишечника у недоношенных новорожденных детей
Обсуждая защитные механизмы кишечника новорожденного, следует иметь в виду, что пищеварительный тракт ребенка во внутриутробном периоде не подвергается воздействию МАМР. Контакт с ними начинается с момента рождения, когда происходит заселение нормальной микрофлорой. Предварительные исследования показывают, что у плодов до 20 нед гестации в кишечных криптах определяется экспрессия TLR2 и TLR4.
Тем не менее очень мало информации о функционировании врожденных иммунных сигнальных путей во время пре- и постнатального развития in vivo. Есть интересное предположение, что у зародышей мух система NFkB изначально возникает как эволюционный путь. Роль, которую выполняет NFkB в развитии кишечника у млекопитающих, пока не ясна, необходимы дальнейшие исследования.
Результаты недавно проведенного исследования in vitro с использованием культуры клеток кишечного эпителия показывают, что незрелые клетки кишечника могут иметь предрасположенность к чрезмерному воспалительному ответу (оцениваемому по секреции IL-8) на патогенные стимулы. Авторы указанных работ предполагают, что в период развития недостаточная экспрессия IкВ может способствовать усиленной активности NFkB.
При данных условиях чрезмерный воспалительный ответ будет приводить к выраженному клеточному воспалению и неконтролируемому повреждению тканей. Воспаление представляет собой важный процесс, необходимый для выживания в условиях многообразия кишечной микрофлоры. Однако воспалительный ответ, подобно многим другим иммунным реакциям, имеет свои плюсы и минусы. Воспаление ведет к одновременному повреждению тканей, в основном за счет высвобождения оксидантов и протеаз — производных нейтрофилов.
Это может обусловить нарушение защитного эпителиального барьера и инвазии тех микроорганизмов, которые при нормальных условиях не способны проникать через него. Таким образом, вредное содержимое просвета кишки может достичь субэпителиальной поверхности, в результате возникнет порочный круг провоспалительной активации и повреждения тканей. Использование противовоспалительных лекарственных средств, как предполагается, способно тормозить развитие ЯНЭК на ранней стадии, но необходимы дальнейшие исследования in vivo, способные подтвердить, что описанные здесь процессы действительно происходят в кишечнике человека.
При другой патофизиологической ситуации возможен альтернативный сценарий. Активация путей NFkB и МАРК бактериальными и другими стимулирующими факторами индуцирует транскрипционную активность целого ряда провоспалительных эффекторов и приводит к острому воспалению.
Вполне вероятно, что внутреннее нарушение способности отвечать на бактериальное заражение в период начальной колонизации кишечника (возможно, вследствие онтогенетической незрелости, врожденных дефектов или опосредованного внешней средой снижения экспрессии сигнальных путей) способно вызвать разрушение ткани. В клинической практике у взрослых пациентов, не способных к генерации адекватного воспалительного ответа в кишечнике (например, имеющих наследственные дефекты врожденного иммунитета или острую нейтропению), выявляется повышенная чувствительность к кишечным бактериальным инфекциям, часто приводящая к системной диссеминации заболевания.
Аналогично у специально выведенной линии мышей, имеющих мутации воспалительных регуляторов, также выявляется повышенная чувствительность к кишечным инфекциям. Представляет интерес тот факт, что мутации гена NOD2, предрасполагающие к болезни Крона, ведут к потере функции NOD2, причем дефектный NFkB-сигнал преобладает над гиперактивным. К тому же при исследовании у мышей в экспериментальной модели воспалительного заболевания кишечника блокада NFkB посредством трансгенной экспрессии нераспадающегося варианта IкВ в эпителиальных клетках приводит к более тяжелому течению заболевания по сравнению с контрольной группой.
Уменьшенный воспалительный сигнал может привести к избыточному росту бактерий или к гиперчувствительности к проапоптозным стимулам. Вполне вероятно, что невозможность активации воспалительных путей может снизить индукцию антиапоптозных, цитопротективных факторов. Таким образом, незрелость воспалительного ответа в онтогенетическом аспекте делает кишечник новорожденного ребенка уязвимым для апоптоза, возникающего вследствие действия стрессорных факторов внешней среды, избыточного роста микроорганизмов или гипоксии.
Очевидно, что здоровье организма хозяина зависит от баланса между излишней провоспалительной активацией (ведущей к повреждению тканей и клиническим последствиям) и ее дефицитом (что лишает слизистую оболочку защиты и/или провоцирует ее саморазрушение). Как указывалось ранее, в ответ на транзиторную гипоксию кишечника мыши, у которых отсутствовала активация NFkB в энтероцитах, реагировали избыточным апоптозом эпителия. Исследования с применением модели ЯНЭК у крыс показывают, что ранний апоптоз играет решающую роль в патогенезе ЯНЭК.
Таким образом, необходимо дальнейшее изучение in vivo гиперактивных воспалительных процессов, ведущих к выраженному воспалению или его дефициту, обусловливающему неконтролируемый рост бактерий или усиленный апоптоз. Выраженное воспаление или его дефицит могут иметь значение для различных клинических ситуаций либо определенных стадий патогенеза, что может приводить к патологическим повреждениям кишечника, поскольку уже начался и прогрессирует процесс разрушения эпителия (как, например, при ЯНЭК).

Пути взаимодействующих протеинов обозначены стрелками. Слева указаны функциональные классы ферментов.
ATF — трансмембранный фактортранскрипции;
IкВ — ингибитор каппа В;
IкК — IкВ-киназа;
IRAK — киназа, ассоциированная с рецептором IL-1;
IRF — фактор транскрипции, индуцирующий интерфероновый ответ;
МАМР — ассоциированные с микроорганизмами молекулярные паттерны;
МАРК — митоген-активируемая протеинкиназа;
МАРКК — киназа МАРК;
МАРККК — киназа киназы МАРК;
NFkB — нуклеарный фактор каппа В;
TLR — Toll-подобные рецепторы;
TRAF6 — ассоциированный с TNF фактор 6.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Некротизирующий энтероколит у недоношенных новорожденных: причины, диагностика, лечение
Некротизирующий энтероколит является серьёзным заболеванием, в основном поражает недоношенных младенцев в первые несколько недель жизни. Он возникает в результате бактериальной инвазии или ишемии стенки кишечника и усиливается под действием молока.
У недоношенных младенцев, получающих искусственное кормление на основе коровьего молока, в 6 раз выше вероятность развития этого состояния по сравнению с теми, кто полностью находится на грудном вскармливании. У младенца развивается непереносимость пищи и возникает рвота с жёлчью, молоко может быть аспирировано. Наблюдается вздутие живота, стул иногда содержит свежую кровь.
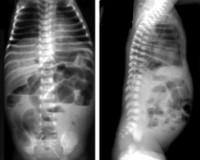
У младенца может быстро развиться шок и потребоваться ИВЛ вследствие вздутия живота и боли. Характерными изменениями на рентгенограмме брюшной полости являются растянутые петли кишечника и утолщение стенок кишок за счёт интрамурального газа, также может быть наличие газа в портальном тракте. Заболевание может прогрессировать вплоть до перфорации кишки, которая выявляется на рентгенограмме или при трансиллюминации брюшной полости.

*PAF — фактор активации тромбоцитов; TNF — фактор некроза опухоли
Лечение заключается в прекращении энтерального вскармливания и назначении антибиотиков широкого спектра действия для покрытия как аэробных, так и анаэробных микроорганизмов. Всегда необходимо парентеральное питание, кроме того, часто требуются ИВЛ и поддержка кровотока. Хирургическое вмешательство проводится при перфорации кишки.
Заболевание имеет значительную распространённость и смертность около 20%. Отдалённые последствия включают развитие стриктур и мальабсорбцию в случае проведения обширной резекции кишки. Более подробно о некротизирующем энтероколите можно почитать в нашей статье "Некротический энтероколит новорожденных".
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Причины язвенного некротизирующего энтероколита (ЯНЭК) у недоношенных новорожденных детей
Язвенный некротизирующий энтероколит представляет собой некротическое воспаление, которое отмечается преимущественно у недоношенных детей после введения энтерального питания.
Точные патофизиологические механизмы пока еще плохо изучены, но известно, что основными факторами риска ЯНЭК являются недоношенность, бактериальная колонизация, энтеральное питание и нарушение кровотока в кишечнике.
Известно, что кишечник плода подвергается воздействию амниотической жидкости, содержащей гормоны и пептиды, которые могут играть определенную роль в созревании кишечника. На стадии плода кишечник в норме защищен благодаря стерильному окружению и может быть не готов ко встрече с бактериальной инфекцией.
К моменту начала бактериальной колонизации и энтерального питания ЖКТ недоношенного ребенка может еще не достичь стадии полного созревания, что ведет к увеличению риска возникновения ЯНЭК. Одна из гипотез заключается в том, что повреждение кишечника при ЯНЭК может быть результатом колонизации особо чувствительного кишечника недоношенного ребенка патогенными бактериями, что приводит к повреждению слизистой оболочки и вызывает чрезмерную воспалительную реакцию.
Желудочно-кишечный тракт недоношенного ребенка отличается незрелостью. Такие дети подвергаются воздействию меньшего количества микроорганизмов, способствующих созреванию кишечника, и, напротив, имеют контакт с большим спектром патогенных микроорганизмов, повышающих в совокупности риск возникновения сепсиса или ЯНЭК. Более того, имеющиеся на настоящий момент данные позволяют говорить о неспособности незрелого кишечника плода или недоношенного ребенка подавлять воспалительный ответ.
Эпителиальные клетки незрелого кишечника проявляют чрезмерный ответ на действие как эндогенных медиаторов воспаления (например, TNF-a или IL-1b), так и экзогенных медиаторов воспаления (например, бактерий). Такой чрезмерный ответ может отмечаться при действии как комменсальных, так и патогенных бактерий. Исследования, в которых сравнивали ответы эпителиальных клеток кишечника плода и взрослого человека, показали отсутствие различий в экспрессии рецепторов на эти медиаторы воспаления, но у незрелых энтероцитов была отмечена стимуляция NFKB-сигнала из-за сниженной экспрессии его ингибитора IкВ.
К тому же было показано, что иммунные клетки собственной пластинки слизистой оболочки (lamina propria) или периферической крови могут ограничивать экспрессию провоспалительных генов, несмотря на индукцию NFKB-сигнала бактериями. Таким образом, недоношенные дети с незрелой иммунной системой составляют группу риска по формированию провоспалительного ответа в дальнейшей жизни.
Увеличение NFKB-сигнала ведет к повышению продукции IL-8 — хемокина, который стимулирует миграцию нейтрофилов из сосудов в интерстиций, может напрямую активировать нейтрофилы и регулировать экспрессию молекул адгезии нейтрофилов. Таким образом, рекрутируя и активируя иммунные клетки, IL-8 может играть важную роль в воспалении. Исследования, проведенные ранее, показали, что уровень IL-8 сыворотки значительно увеличивается в первые 24 час в случае тяжелого течения ЯНЭК.
Данные гистологических исследований кишки, полученные при ее резекции по поводу острого ЯНЭК, показывают стимуляцию мРНК IL-8 во всех слоях слизистой и мышечной оболочек и кишечном эпителии по сравнению с изменениями, выявленными у детей с другими воспалительными заболеваниями или без таковых.
Проведенные исследования также демонстрируют различный ответ на действие бактериальных токсинов у незрелых энтероцитов ребенка и зрелых энтероцитов взрослого. Было показано повышение экспрессии рецепторов на токсин холеры и снижение ее на токсин Шига и токсин A Clostridium difficile.
В дополнение к этому последние исследования выявили увеличенное поступление токсина в незрелые энтероциты. Путем эндоцитоза, проходя через клатриновую сеть, токсин быстро попадает в незрелые энтероциты, что отличается от более медленного попадания токсина посредством кавеол и рафт в энтероциты взрослого. Этим можно объяснить более быстрое течение заболевания у младенцев по сравнению с детьми старшего возраста. Ускоренный эндоцитоз может увеличивать способность клеток быстро растущего незрелого кишечника поглощать интактные гормоны и факторы роста.
В то же время незрелый кишечник не в состоянии дифференцировать полезные вещества и вредные микроорганизмы, токсины и антигены, что увеличивает риск возможного негативного воздействия.

Пути взаимодействующих протеинов обозначены стрелками. Слева указаны функциональные классы ферментов.
ATF — трансмембранный фактортранскрипции;
IкВ — ингибитор каппа В;
IкК — IкВ-киназа;
IRAK — киназа, ассоциированная с рецептором IL-1;
IRF — фактор транскрипции, индуцирующий интерфероновый ответ;
МАМР — ассоциированные с микроорганизмами молекулярные паттерны;
МАРК — митоген-активируемая протеинкиназа;
МАРКК — киназа МАРК;
МАРККК — киназа киназы МАРК;
NFkB — нуклеарный фактор каппа В;
TLR — Toll-подобные рецепторы;
TRAF6 — ассоциированный с TNF фактор 6.
Роль бактерий в развитии язвенного некротизирующего энтероколита (ЯНЭК)
Несмотря на то что описаны многие случаи ЯНЭК, до сих пор не выявлена связь этого заболевания с каким-либо определенным микроорганизмом. Неясно, являются ли бактерии первичным фактором возникновения ЯНЭК или они играют роль пассивного участника, проникающего в стенку кишечника при нарушении барьерной функции его слизистой оболочки. Присутствие бактерий является предпосылкой к возникновению ЯНЭК; в исследованиях показана роль профилактического назначения антибиотиков в снижении частоты возникновения ЯНЭК.
Таким образом, ведущая роль при лечении ЯНЭК принадлежит антибактериальной терапии. Однако нельзя считать ЯНЭК инфекционной патологией в чистом виде. Более правильно говорить о чрезмерном воспалительном ответе на присутствие бактерий с развитием септического процесса или без такового, поскольку лишь у 30% детей с этой патологией посевы крови оказываются положительными.
РА-1 обусловливает повышенную проницаемость кишечного эпителия для цитотоксинов псевдомонад. Более того, было показано, что этот фактор вирулентности может быть индуцирован супернатантом из культуры эпителиальных клеток кишки при гипоксии. Это позволило говорить о чувствительности бактерий к фактору, секретируемому в окружающую бактерии среду, что может способствовать трансформации этих микроорганизмов в более вирулентные фенотипы.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Некротический энтероколит новорожденных (НЭК) – это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Общие сведения

Причины НЭК новорожденных
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
Классификация НЭК новорожденных
По скорости развития выделяют следующие формы некротического энтероколита новорожденных:
В зависимости от массивности поражения различают следующие варианты НЭК:
- Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
- Полисегментарный. Характерно поражение сразу нескольких участков.
- Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Симптомы и осложнения НЭК новорожденных
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
Диагностика НЭК новорожденных
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение НЭК новорожденных
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Прогноз и профилактика НЭК новорожденных
Исход НЭК зависит от тяжести общего состояния ребенка и стадии заболевания. Так как данные показатели почти всегда отличаются нестабильностью, прогноз считается сомнительным даже на фоне полноценного лечения. Профилактика некротического энтероколита новорожденных включает в себя антенатальную охрану здоровья плода, рациональное ведение беременности, грудное вскармливание в физиологических объемах. Согласно некоторым исследованиям, риск развития заболевания снижается при использовании эубиотиков, пробиотиков и IgA у детей из группы риска. При высоком риске преждевременных родов применяют глюкокортикостероиды с целью профилактики РДС.
Читайте также:

