Косоглазие у детей при токсоплазмозе
Обновлено: 13.05.2024
Глаз является одним из важнейших органов, с помощью которых человек познает мир. При его повреждении теряется эффективность остальных органов чувств. Восприятие происходит, но не так, как хотелось бы.
Астигматизм – это патология, которая появляется из-за искажения хрусталика или роговицы. Специалисты считают, что астигматизм, вызванный нарушением сферичности роговицы, значительно ухудшает качество зрения, так как именно она является первой составляющей, в которой происходит преломление световых лучей. Степень астигматизма определяется величиной, характеризующей силу оптического преломления – диоптриями (D).
При определении остроты и качества зрения определяют 3 его степени:
- Слабая. Зрение снижается до 3 D.
- Средняя. Снижение остроты зрительного восприятия от 3 включительно до 6 D.
- Высокая. От 6 D и выше.
Происхождение заболевания может отличаться. Оно бывает врожденным и возникает в результате каких-либо патологических воздействий на орган зрения, то есть патология имеет приобретенный характер. Врожденный астигматизм обычно передается генетически, при этом в роду обязательно найдутся лица с такой патологией.
Причина астигматизма кроется в неправильном формировании структур глаза в процессе его развития. Дети рождаются с искривленной формой роговицы, иногда – неправильной формы хрусталика. Из-за таких деформаций преломление лучей в этих образованиях нарушается, и изображения, фиксируемые сетчаткой глаза, получаются искаженными.
Приобретенный астигматизм может развиться как у взрослых, так и детей. Он может явиться результатом хирургических вмешательств на органе зрения, травматизации, а также некоторых заболеваний и состояний; инфекционных поражений, гипер- и гиповитаминозов, различной этиологии конъюнктивитов.
Лечение астигматизма
Такую патологию, естественно, следует лечить в любом возрасте. Она значительно ухудшает способность к ориентации и выполнению таких простых заданий, как чтение или рисование. Существует несколько видов лечения астигматизма:
- Медикаментозные.
- Хирургические (лазерная коррекция).
- С помощью контактных линз либо ношения специальных очков.
Обойтись одними только лекарственными препаратами для приема внутрь и глазными каплями вряд ли будет достаточно для лечения астигматизма. Эти методы являются лишь дополнительными.
До определенного времени астигматизм лечился жесткими контактными линзами. Это вызывало у человека дискомфорт на глазах и оказывало негативное воздействие на роговицу. С недавних пор для коррекции зрения используют торические линзы.
Если Вам поставили астигматизм, необходимо обратиться к офтальмологу. После назначения лечения следует регулярно посещать врача. Несвоевременная диагностика и лечение могут привести к осложнению в виде косоглазия.
Для справки. Торические контактные линзы — имеют сферическую форму и разную оптическую силу в вертикальном и горизонтальном направлениях.
Косоглазие
Косоглазие — это нарушение, которое выражено ненормальным положением глаз. Проявляется поочередным отклонением глаз при взгляде прямо.
При этом заболевании картинка получается раздвоенной. Нервная система исключает изображение косого глаза для защиты. При несвоевременном лечении возникает амблиопия — состояние зрительной системы, когда один глаз практически не функционирует.
Причин возникновения косоглазия довольно много. Это может быть психологический стресс, травма, паралич или расстройство центральной нервной системы. Но самой распространенной считается снижение остроты зрения.
Этиология заболевания
По происхождению различают два вида косоглазия: содружественное и паралитическое.
При содружественном отклонение происходит то левого, то правого глаза. Стоит заметить, что угол откоса одинаковый на обоих глазах. К причинам стоит отнести:
- Нарушение центральной нервной системы.
- Нарушение сетчатки.
- Заболевание зрительного нерва.
- Ситуация, в которой острота одного глаза ниже остроты другого.
Во время паралитического косоглазия косит только один глаз. Это обусловлено ограничением или отсутствием движения глаза в сторону дефектной мышцы. Причинами такого отклонения могут стать:
- Поражение анатомической морфологии зрительной системы.
- Нарушение функций глазодвигательных мышц.
Симптомами паралитического косоглазия являются отсутствие движения одного глаза; двоение, головокружение и отклонение головы в сторону пораженной мышцы.
Лечение косоглазия
Лечение этого заболевания разнообразно. К более простым методам относятся оптическая коррекция (очки или линзы) и развитие бинокулярного зрения.
Сложным методом является хирургическое вмешательство. Суть процесса направлена на усиление или ослабление одной из мышц пораженного глаза.
Эта операция не дает стопроцентной гарантии возвращения бинокулярного зрения. Всю сложность хирург определяет уже в момент, когда пациент находится на хирургическом столе.
Для справки. Бинокулярное зрение — способность зрительной системы одновременно видеть четкую картинку обеими глазами.
Астигматизм и косоглазие
Если же косоглазие появилось независимо от астигматизма, необходимо лечить косоглазие, а затем астигматизм.

Расходящимся косоглазием (страбизмом) принято называть состояние, при котором глазные яблоки отклоняются от точки фиксации в стороны висков.
Заболевание имеет следующие формы:
- Постоянное, с патологически неизменным положением глазных яблок.
- Непостоянное или периодическое (экзофория), которое становится заметным только при определенных условиях.
При постоянной форме косоглазия различают следующие виды:
Вторичное косоглазие – состояние, которое развивается при неудачно проведенной операции коррекции длины двигательных мышц глаза при первичном страбизме.
Страбизм различают и по стороне поражения:
- Монолатеральный страбизм, когда косит один глаз.
- Альтернирующее косоглазие, с попеременным отклонением глазных яблок от правильного положения.
Непостоянное косоглазие
Такую форму заболевания принято называть экзофорией. Зачастую она развивается у маленьких детей, характеризуясь небольшими отклонениями глазных яблок от точки фиксации в височные стороны.
Заметить непостоянное расходящееся косоглазие можно при следующих условиях:
- Сильная усталость, заболевание, интоксикация и прочие причины, ослабляющие контроль;
- Интенсивное освещение;
- Взгляд вдаль.
Со временем симптомы непостоянного косоглазия только усиливаются. Нередко оно переходит в постоянную форму.
Основными факторами влияния, при этом являются:
- Слабость конвергенции при приобретенной миопии (близорукости);
- Чрезмерная дивергенция (истинная или стимулированная).
Лечение расходящегося косоглазия
Для лечения расходящегося косоглазия сегодня применяют несколько способов:
- Контактную коррекцию. Она заключается в подборе очков либо контактных линз, позволяющих компенсировать аномалии рефракции, которые послужили причиной развития расходящегося косоглазия.
- Плеопто-ортоптическую терапию. Пенализация (к примеру, наложение окклюдора на видящий лучше глаз), а также аппаратные или компьютерные методики, которые используют, как самостоятельно, так и в качестве предоперационных методик.
- Хирургическое лечение. Оно заключается в изменении (коррекции) длины двигательных мышц глаза, для оптимизации баланса при содружественном движении глазами.

Лечение расходящегося косоглазия в МГК
В Московской Глазной Клинике пациентам при расходящемся косоглазии предоставляют широкий спектр диагностических, а также лечебных процедур. Диагностику выполняют квалифицированные специалисты, имеющие уникальный опыт клинической работы. При назначении лечения действует строго индивидуальный подход. Клиника располагает обширной методической и аппаратной базой для лечения подобных патологий. Эти методики подходят как для детей, так и для взрослых:
Проблемами всех видов косоглазия в Московской Глазной Клинике занимается доктор медицинских наук Чернышева Светлана Гавриловна. Светлана Гавриловна – офтальмохирург, профессор, лучший специалист Москвы в области диагностики бинокулярной глазодвигательной патологии у взрослых и детей, а также функционального и хирургического ее лечения. Владеет различными методами оперативного лечения всех видов косоглазия.
Общие сведения

Причины токсоплазмозного увеита
Возбудителем токсоплазмозного увеита является Toxoplasma gondii, которая относится к типу простейших, классу споровиков. Жизненный цикл состоит из двух фаз развития – половой и бесполой. Процесс размножения токсоплазм происходит только в эпителиоцитах кишечника кошачьих. Фаза бесполого развития реализуется в клетках большинства органов и тканей человека, включая глазное яблоко. Данный этап жизненного цикла характеризуется склонностью к инвазии, что обуславливает не только функциональные, но и органические изменения органа зрения при токсоплазмозном увеите.
Врожденная форма заболевания наблюдается при вертикальном (трансплацентарном) пути передачи возбудителя от матери к ребенку. Причина приобретённого токсоплазмозного увеита – инфицирование от плотоядных, сельскохозяйственных животных или птиц. Чаще переносчиками выступают кошки, голуби. Возбудители проникают в системный кровоток через небольшие повреждения кожи или интактную слизистую оболочку. Менее распространённым путём заражения является алиментарный, который реализуется при употреблении мяса больных животных, а также овощей и фруктов, не прошедших полноценную обработку. Развитие токсоплазмозного увеита может быть связано с переливанием крови или трансплантацией инфицированных органов.
Проникновение возбудителей в лимфатические узлы приводит к регионарному лимфадениту. Очаги инфекции формируются при диссеминации токсоплазмы в кровеносном русле. Возникновение токсоплазмозного увеита возможно только при проникновении инфекционного агента через гематоофтальмический барьер. Реже зрительная дисфункция наблюдается при нарушении проницаемости гематоэнцефалического барьера и поражении зрительной коры головного мозга.
Симптомы токсоплазмозного увеита
С клинической точки зрения специалисты в сфере офтальмологии различают врожденную и приобретённую формы заболевания. В большинстве случаев в патологический процесс вовлечена сосудистая оболочка, поэтому токсоплазмозный увеит проявляется симптоматикой хориоретинита. Реже развивается генерализованный увеит. При этом интактными остаются передние отделы глазного яблока. Орган зрения чаще поражается в хроническом периоде болезни. Приобретенная форма заболевания при отсутствии нарушений со стороны иммунной системы протекает латентно. При хроническом течении возбудитель может длительное время находиться в стадии персистенции и провоцировать периодическое развитие рецидивов.
Клинические проявления врожденной формы токсоплазмозного увеита зависят от того, в каком триместре беременности произошло инфицирование. Заражение в I триместре несовместимо с жизнью, при инфицировании во II и III триместрах отмечается подострое или хроническое течение токсоплазмозной инфекции. Очень редко токсоплазмозный увеит протекает латентно и является только причиной развития вторичного страбизма. Данный вариант патологии часто сочетается с олигофренией, гидроцефалией, микрофтальмом, злокачественным течением миопии.
При генерализованном увеите поражение передних отделов глазного яблока протекает в форме токсико-аллергической реакции, спровоцированной специфическим воспалением увеальной сосудистой оболочки глаза. Наиболее распространёнными сопутствующими патологиями, наблюдающимися при токсоплазмозном увеите, являются миопия, катаракта и колобома хориоидеи, птоз век. Об осложненном течении заболевания свидетельствует хориоидальная неоваскуляризация.
Диагностика токсоплазмозного увеита
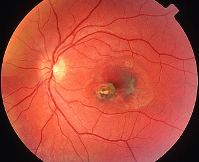
Диагностика токсоплазмозного увеита основывается на проведении офтальмологом наружного осмотра, офтальмоскопии, биомикроскопии, визометрии, биопсии, гониоскопии, цитологического исследования, иммуноферментного анализа (ИФА). При наружном осмотре пациентов с врожденным токсоплазмозным увеитом выявляется гиперемия бульбарной конъюнктивы, птоз века, нистагм. Офтальмоскопически визуализируется поражение центральных отделов глазного дна. Очаг воспаления или хориоретинальная гранулема с бело-желтым или коричневым оттенком чаще всего имеют диаметр около ⅓ от диаметра диска зрительного нерва. Реже образуются крупные очаги, диаметр которых больше диаметра ДЗН.
Длительное течение токсоплазмозного увеита приводит к дегенерации зоны поражения с последующим развитием коагуляционного некроза. При проведении офтальмоскопии определяется округлый очаг белого цвета с четко очерченными фестончатыми краями. По периферии очага атрофии наблюдается скопление пигмента, интра- и субретинальное кровоизлияние. Для генерализованной формы токсоплазмозного увеита с вовлечением переднего отдела глазного яблока характерно появление преципитатов на роговой оболочке. При гониоскопии в передней камере выявляется клеточная взвесь.
При проведении биомикроскопии со щелевой лампой при остром течении токсоплазмозного увеита определяются участки кровоизлияния, скопления экссудата, помутнение стекловидного тела. Эндозоиты можно обнаружить в экссудате или внутри клеток структур увеального тракта в процессе цитологического исследования биоптата. В цистах располагаются цистозоиты. Подтвердить наличие токсоплазм можно при биопсии неповрежденных тканей по периферии зоны специфического воспаления или некроза. Биомикроскопия при приобретённом токсоплазмозном увеите позволяет выявить большое количество преципитатов в задних отделах глазного яблока, множественные задние синехии в сочетании с помутнением стекловидного тела. При проведении ИФА в острой фазе заболевания повышается титр антитоксических антител класса IgM. Изолированное выявление IgG указывает на хроническое течение токсоплазмозного увеита или фазу реактивации.
Лечение токсоплазмозного увеита
Тактика лечения токсоплазмозного увеита определяется формой и особенностями течения заболевания. Используются иммуномодуляторы, общеукрепляющие средства. Специфическая терапия показана только пациентам с риском снижения остроты зрения. Препаратами выбора являются лекарственные средства из группы синтетических антибактериальных препаратов в комплексе с сульфаниламидами. Курс лечения длится от 2 до 4 недель. В течение всего курса показано применение фолиевой кислоты и проведение общего анализа крови в динамике. Это обусловлено тем, что препараты указанных групп могут приводить к снижению уровня лейкоцитов и тромбоцитов. При изолированном развитии токсоплазмозного увеита рекомендовано парабульбарное введение глюкокортикоидов. В случае развития системных проявлений токсоплазмоза показана пульс-терапия глюкокортикоидами.
При необходимости хирургического вмешательства антитоксоплазмозную терапию необходимо проводить в пред- и послеоперационном периоде. Лазерная коагуляция выполняется с целью отграничения зоны воспаления, но не используется для удаления токсоплазмозных очагов, что связано с их глубоким расположением и высоким риском развития послеоперационных осложнений. При выявлении атрофического очага большого размера у пациента с врожденной формой токсоплазмозного увеита специфическое лечение рекомендовано только при возникновении рецидива заболевания.
Прогноз и профилактика токсоплазмозного увеита
Специфические превентивные меры не разработаны. Неспецифическая профилактика токсоплазмозного увеита направлена на укрепление иммунитета. При необходимости назначаются иммуномодуляторы. Также пациентам необходимо нормализовать режим сна и отдыха, избегать возникновения стрессовых ситуаций. Риск инфицирования снижается при соблюдении правил личной гигиены, уходе за домашними животными, правильной термической обработке продуктов питания.
Прогноз зависит от степени тяжести заболевания. При легких формах специальная терапия не требуется, поскольку для токсоплазмозного увеита характерно благоприятное течение. При увеите средней степени тяжести применение иммуномодуляторов и стимуляция защитных сил организма способствуют достижению длительной ремиссии. Инфицирование женщины в І триместре беременности ассоциировано с неблагоприятным прогнозом для плода.
Врожденный токсоплазмоз – это паразитарная патология, которая возникает при трансплацентарном инфицировании ребенка Toxoplasma gondii. У большинства детей протекает бессимптомно. Возможные проявления заболевания: интоксикационный синдром, пятнисто-папулезная сыпь, лимфаденопатия, желтуха, гепатоспленомегалия, отеки нижних конечностей. Часто провоцирует развитие патологий органа зрения, слуха, ЦНС; реже – миокарда, легких и печени. Антенатальная диагностика базируется на проведении биопсии, постнатальная – на совокупности анамнестических и клинико-лабораторных данных (ИФА, ПЦР). Этиотропное лечение врожденного токсоплазмоза проводится при помощи схем на основе препаратов пириметамина и сульфадимезина или спирамицина.
МКБ-10
Общие сведения
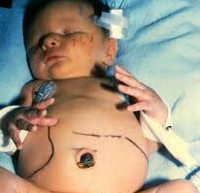
Врожденный токсоплазмоз – заболевание в педиатрии и неонатологии, возникающее в результате трансплацентарного заражения плода на фоне острой формы токсоплазменной инфекции у матери. Впервые Toxoplasma gondii была описана французами К. Николь и Л. Монсо в 1908 году. В 1939 г. американцы Э. Вольф, Д. Кауэн и Б. Пэйдж подтвердили трансплацентарный механизм передачи возбудителя. Промежуточными хозяевами могут выступать более 400 видов животных. Согласно статистическим данным ВОЗ, число инфицированных токсоплазмой людей в мире составляет порядка 1,5 млрд. человек, в России – около 30% всего населения. Частота врожденной формы 1,5:1000 новорожденных. Даже на фоне лечения средний показатель смертности у детей до 5 лет составляет 12%, осложнения возникают почти у 90%.

Причины врожденного токсоплазмоза
Врожденный токсоплазмоз развивается только при инфицировании матери Toxoplasma gondii во время вынашивания ребенка. Механизм заражения беременной женщины – фекально-оральный. Наиболее распространенные причины: контакт с животными из семейства кошачьих и употребление термически необработанной пищи. Инвазивная форма возбудителя – ооциста – формируется в кишечнике животных и выделяется с калом, после чего может на протяжении 12 и больше месяцев сохранять контагиозность в условиях внешней среды. В крайне редких случаях этиологическим фактором может стать трансплантация контаминированных органов или переливание крови. Заражение плода T. gondii происходит трансплацентарным путем. После рождения ребенка развивается интенсивный гемолиз, возникают геморрагии на слизистых оболочках, расширение камер сердца, пневмония или интерстициальный отек легких, некроз печени и селезенки, увеличение лимфоузлов, воспаление и отек тканей головного мозга, некробиоз сетчатки. При гистологическом исследовании непосредственно пораженных тканей определяется некроз, гранулематозная или диффузная пролиферация ретикулоцитов, инфильтрация плазмоцитами и лимфоцитами, перифокально – множество токсоплазм. Впоследствии на месте некротизированных участков формируется фиброз, переходящий в кальциноз.
Классификация врожденного токсоплазмоза
В зависимости от периода инфицирования плода врожденный токсоплазмоз может протекать в трех формах:
- Хроническая форма. Заражение происходит в I-II триместрах беременности. Риск передачи возбудителя – 13-18%. При такой форме могут развиваться атрофия головного мозга, гидроцефалия, деформация желудочков мозга, анофтальмия, колобома, атрофия сетчатки, врожденные пороки сердца и других органов и систем.
- Подострая форма. Инфицирование – III триместр. Риск заражения ребенка – 75-85%. Проявления могут включать в себя энцефалит, менингоэнцефалит, очаговый некроз сетчатки, увеит.
- Острая форма. Токсоплазма попадает в организм ребенка непосредственно перед родами. Возможные симптомы: гипертермия, пятнисто-папулезная сыпь, интенсивная желтуха, гепатоспленомегалия, анемия, миокардит, пневмония.
Симптомы врожденного токсоплазмоза
Врожденный токсоплазмоз может проявляться в различные периоды жизни ребенка – от первых дней до нескольких месяцев. Специфических симптомов данное заболевание не имеет. Зачастую присутствующая клиника нечеткая и имитирует другие врожденные патологии. Наиболее вероятные проявления врожденного токсоплазмоза: ухудшение общего состояния, пятнисто-папулезная сыпь различной локализации, генерализованная лимфаденопатия, увеличение печени и селезенки, желтуха, отеки нижних конечностей, субфебрильное повышение температуры тела. Тяжесть симптомов зависит от степени инфицирования токсоплазмами, триместра беременности, в котором произошло инфицирование, и иммунных сил матери. Примерно 70-90% детей не имеют каких-либо проявлений в ранние периоды жизни, но почти у всех спустя некоторое время возникают осложнения. Классический врожденный токсоплазмоз проявляется триадой Сэбина – обструктивная гидроцефалия, хориоретинит и массивное внутричерепное обызвествление. Наблюдается данный комплекс не более чем у 3% детей. Помимо триады, часто возникают миокардит, миозит, гепатит и пневмония. Клинические проявления напрямую зависят от присутствующих патологических изменений. Вероятность развития поздних осложнений на фоне латентного врожденного токсоплазмоза составляет порядка 90%. Период возникновения может быть разным – от нескольких месяцев до нескольких лет. Наиболее часто наблюдается поражение глаз, органа слуха и ЦНС. Самое распространенное осложнение – ретинит (примерно 85% случаев). К другим последствиям перенесенного врожденного токсоплазмоза относят олигофрению, гидроцефалию, повышение внутричерепного давления, острый и хронический энцефалит, эпилепсию, полную глухоту и/или слепоту, микрофтальм, увеит, хроническую гипертермию, редко – шизофрению.
Диагностика врожденного токсоплазмоза
Диагностика врожденного токсоплазмоза может проводиться в антенатальном и постнатальном периоде. Антенатальное исследование подразумевает использование инвазивных методов с дальнейшими лабораторными анализами. Абсолютное показание к их проведению – острый токсоплазмоз матери в сумме с нарушениями развития плода по результатам акушерского УЗИ. Выбор методики исследования зависит от срока беременности. При гестации от 10 недель проводится биопсия хориона, от 16 недель – амниоцентез, от 18 – кордоцентез. Для верификации инфекции полученный материал исследуют при помощи ПЦР. Постнатальная диагностика включает в себя сбор анамнестических данных и проведение клинического и лабораторного исследования. Данная мера является обязательной для всех детей, входящих в группу риска внутриутробного инфицирования. Неспецифическая диагностика и ее результаты зависят от присутствующих симптомов и синдромов. Список исследований может включать в себя ОАК (анемия, тромбоцитопения, лейкоцитоз); рентгенографию ОГК (признаки инфильтрации легких); нейросонографию и КТ головного мозга; биохимическое исследование крови с измерением АЛТ и АСТ, определением СРБ, уровня билирубина и его фракций (все показатели выше нормы); офтальмоскопию (некроз сетчатки); спинномозговую пункцию (признаки воспаления). Специфические методы подразумевают серодиагностику биологических жидкостей методом ИФА, при котором наблюдается возрастание титра антител IgG в 4 и больше раз и высокий уровень IgM на протяжении 10-14 суток. При необходимости проводится ПЦР с целью идентификации ДНК токсоплазмы.
Лечение врожденного токсоплазмоза
Лечение новорожденного с выраженной клинической картиной врожденного токсоплазмоза проводится только в условиях стационара, в отделении патологии новорожденных. Соблюдение специфического режима и рациона не требуется, их коррекция проводится в соответствии с состоянием ребенка. При наличии отягощенного анамнеза матери этиотропную терапию начинают с момента постановки предварительного диагноза. В других случаях перед началом лечения требуется проведения лабораторных методов исследования. Используемые схемы: пириметамин и сульфадимезин на 1-1,5 месяца; спирамицин или другие макролиды на 4-6 недель. В некоторых случаях применяют системные глюкокортикостероиды – преднизолон. Симптоматическое лечение зависит от присутствующих симптомов и синдромов, выявленных педиатром или неонатологом. При стойком повышении внутричерепного давления или развитии гидроцефалии показано хирургическое лечение. При необходимости дальнейшее лечение может проводиться амбулаторно под контролем педиатра, инфекциониста и других специалистов. В таких же условиях проводится терапия субклинической и латентной формы врожденного токсоплазмоза. Решение об отказе от приема препаратов принимается на основе клинико-лабораторных показателей, находящихся в пределах возрастной нормы, и заключения всех лечащих врачей.
Прогноз и профилактика врожденного токсоплазмоза
Прогноз при врожденном токсоплазмозе зависит от триместра, в котором произошло инфицирование плода и тяжести клинических проявлений. При развитии патологии в I триместре может наблюдаться самопроизвольное прерывание беременности и выкидыш или дальнейшее развитие тяжелых форм заболевания, однако аномалии органов при этом не возникают. При адекватной и своевременной терапии прогноз для жизни благоприятный, для выздоровления – сомнительный. Неспецифическая профилактика врожденного токсоплазмоза включает в себя ограничение контакта домашних животных с беременной женщиной, соблюдение гигиенических норм, прием в пищу только термически обработанных продуктов, тщательное мытье овощей и фруктов. При наличии факторов, указывающих на возможное инфицирование матери, проводится специфическая диагностика, направленная на идентификацию T. gondii. При подтверждении диагноза показано немедленное проведение этиотропной терапии. Специфической профилактики врожденного токсоплазмоза не разработано.
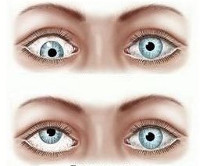
Паралитическое косоглазие – это заболевание, характеризующееся отклонением зрительной оси глаза от общей точки фиксации. Клинические проявления болезни – нарушение подвижности глазного яблока, двоение перед глазами, головная боль, повышенная зрительная утомляемость. В процессе диагностики паралитического косоглазия изучают степень девиации и подвижности глазных яблок, исследуют поля взора и тортиколлис, выполняют электромиографию. Лечение проводят консервативным (специальная гимнастика, наложение окклюзионной повязки, электрофорез с миорелаксантами) или оперативным путем.
МКБ-10
Общие сведения
Паралитическое косоглазие (паретический страбизм, гетеротропия) – широко распространенная патология. Заболевание встречается во всех возрастных группах. Согласно статистическим данным, у детей паретический страбизм диагностируют в 2-3 раза чаще, чем у взрослых. В период новорожденности признаки косоглазия выявляют у 2% младенцев. В 70% случаев при отсутствии своевременного лечения развиваются осложнения, наиболее частым из которых является дисбинокулярная амблиопия. Лица мужского и женского пола страдают с одинаковой частотой. Болезнь распространена повсеместно.

Причины
В основе заболевания лежит паралич или парез одной и более глазодвигательной мышцы. В этиологии врожденного косоглазия ведущую роль отводят родовой травме, аномалиям строения зрительной и нервной систем, внутриутробному поражению органа зрения при токсоплазмозе, краснухе, кори. Основными причинами возникновения приобретенного варианта патологии являются:
- Повреждение глазодвигательных мышц. Нарушение целостности глазных мышц – одно из осложнений черепно-мозговой травмы, контузии глаза или других повреждений органа зрения. Возможно ятрогенное отклонение глазного яблока от точки фиксации после операций.
- Инфекционные заболевания. Триггерами могут выступать инфекции головного мозга и глаз. Страбизм – частое проявление нейросифилиса, лептоменингита, нейротуберкулеза. Поражение мышц глаза при трихинеллезе также сопровождается клиникой косоглазия.
- Злокачественные новообразования. Компрессия глазного яблока опухолью ведет к ограничению его подвижности и развитию орбитальной формы болезни. При вовлечении в онкологический процесс черепных ядер и стволовых структур наблюдается центральная форма патологии.
- Миозит. Воспаление одной или нескольких глазодвигательных мышц – преходящее явление при интоксикации. В то же время, дерматомиозит, полимиозит, полифибромиозит зачастую имеют необратимый характер.
- Неврит. Наиболее часто симптомы заболевания связаны с токсическим инфекционным невритом. Воспаление нервов, отвечающих за иннервацию глазодвигательных мышц, возникает из-за переохлаждения, на фоне вирусных или бактериальных заболеваний.
- Поражение глазницы. Патологические изменения костных стенок орбиты при периостите или субпериостальном абсцессе приводят к сдавливанию глазного яблока и провоцируют клиническую картину страбизма.
Патогенез
При паралитическом косоглазии отмечается поражение ядер глазодвигательного, блокового или отводящего нервов. Важная роль в патогенезе отводится патологии основания мозга или глазницы. Реже развитие болезни обусловлено непосредственным повреждением нервных волокон, иннервирующих соответствующие глазодвигательные мышцы. При травме или неврите нарушается прохождение импульса по нервному волокну. Страбизм может сопровождаться наружной или внутренней офтальмоплегией. При наружной форме болезни парализованы наружные мышцы глаза, но сфинктер зрачка и цилиарная мышца функционируют нормально. При внутренней офтальмоплегии поражены только зрачковый сфинктер и ресничная мышца.
Классификация
Различают врожденный и приобретенный варианты болезни. Возможно изолированное поражение одной мышцы, вовлечение двух и более глазодвигательных мышц. Процесс может быть одно- ли двухсторонним. В соответствии с патогенетической классификацией выделяют следующие формы паралитического косоглазия:
- Ядерная. Развитие этой разновидности болезни ассоциировано с непосредственным поражением черепных ядер при заболеваниях головного мозга (энцефалит, нейросифилис, множественный склероз). Выявление дегенеративно-дистрофических изменений на ядерном уровне является неблагоприятным прогностическим критерием.
- Стволовая. При данном варианте патологии повреждение локализируется на уровне основания мозга, поэтому косоглазие часто называют базальным. Доказана токсическая, ангиогенная, инфекционная и травматическая природа болезни.
- Орбитальная. Это наиболее благоприятная форма страбизма. Этиологическим фактором выступает поражение глазницы (периостит, субпериостальный абсцесс). После устранения провоцирующего процесса функции органа зрения восстанавливаются в полном объеме.
Симптомы паралитического косоглазия
Осложнения
Паралитическое косоглазие чаще всего осложняется дисбинокулярной амблиопией, что обусловлено ограничением участия одного из глазных яблок в акте зрения. При этом наблюдается прогрессивное снижение остроты зрения. Из-за образования новых рефлекторных связей у пациентов с врожденным вариантом болезни формируется аномальная корреспонденция сетчатки. Длительное течение заболевания способствует возникновению скотомы торможения, которая является компенсаторным механизмом. Отмечается повышенный риск развития аномалий рефракции (миопии, реже – гиперметропии).
Диагностика
Для постановки диагноза необходимо определить, какая из глазодвигательных мышц вовлечена в патологический процесс. При физикальном обследовании врач обращает внимание на подвижность глазных яблок, ширину зрачкового отверстия и состояние переднего сегмента глаза. Всем пациентам проводят визометрию для оценки остроты зрения. Специфическая диагностика базируется на:
Дифференциальная диагностика проводится между парезом и параличом глазодвигательных мышц. При парезе ограничение подвижности глаза, а также его отклонение в сторону менее выражены. Визуально девиация практически не определяется. Для полного неврологического обследования показана консультация невропатолога.
Лечение паралитического косоглазия
При приобретенной форме страбизма осуществляют лечение основного заболевания (удаление патологических новообразований, терапию инфекционных болезней). Зачастую этого достаточно, чтобы нивелировать девиацию и диплопию. Целью симптоматического лечения является восстановление симметричного положения глаз, устранение вторичных проявлений болезни. При лёгком течении консервативная терапия сводится к выполнению зрительной гимнастики и ортоптических упражнений на слияние двойных изображений. Чтобы свести к минимуму выраженность диплопии, используют очки с призматическими линзами. Эффективна временная окклюзия пораженного глаза. Физиотерапевтическое лечение включает в себя применение электрофореза с миорелаксантами, электростимуляции глазодвигательных мышц и рефлексотерапии.
Проведение оперативного вмешательства целесообразно только при стойком параличе или парезе. Операция осуществляется после 6-12 месяцев лечения при отсутствии прогрессирования процесса. При врожденной форме косоглазия оперативное вмешательство рекомендовано по достижении 3-4 лет. Хирургическое лечение заключается в пластике глазодвигательных мышц. Минимальная подвижность глаз восстанавливается сразу после операции. Для полной компенсации в послеоперационном периоде со 2-4 дня проводится специальная гимнастика для разработки глазодвигательных мышц.
Прогноз и профилактика
Прогноз при паретическом страбизме чаще благоприятный. Достичь симметричного положения глаз легче, чем обеспечить восстановление бинокулярного зрения. Специфические превентивные меры не разработаны. Неспецифическая профилактика сводится к предупреждению производственных и бытовых травм. При возникновении инфекционных заболеваний с высокой тропностью к органу зрения следует с профилактической целью обратиться к офтальмологу. Чтобы снизить риск развития врожденной формы паралитического косоглазия, рекомендовано проводить кесарево сечение при крупном плоде, несоответствии размеров плода и малого таза беременной.
2. Хирургическое лечение паралитического косоглазия/ Канюков В.Н., Чеснокова Е.Ф.// Вестник Оренбургского государственного университета. – 2008.
3. Паралитическое косоглазие: опыт хирургии/ Канюков В.Н., Чеснокова Е.Ф.// Вестник Оренбургского государственного университета. – 2010.
4. К патогенезу паралитического косоглазия// Телеуова Т.С., Адилханкызы А., Мамутова Г.Б.// Вестник Алматинского государственного института усовершенствования врачей. – 2014.
Читайте также:

