Лечение пневмококковой инфекции у детей бактериофагами
Обновлено: 25.04.2024
Инфекция вызванная пневмококком (Streptococcus pneumoniae): диагностика, лечение, профилактика
Streptococcus pneumoniae (пневмококк) — грамположительный кокк, который при росте на питательных средах образует ланцетовидные пары. Чувствителен к оптохину, подвержен лизису в присутствии солей жёлчи.
При росте на кровяном агаре штаммы пневмококка обычно обладают частичным гемолизом (а-гемолиз), в то же время гемолитическая активность различных штаммов может меняться. Инфекционные заболевания, вызванные пневмококком, — одна из самых распространённых причин смерти пациентов во всём мире. В группу риска входят дети, пожилые пациенты, а также лица с сопутствующими заболеваниями.
Патогенез пневмококковой инфекции (Streptococcus pneumoniae)
Пневмококки окружены полисахаридной капсулой, препятствующей фагоцитозу. Существует более девяноста различных капсульных серотипов возбудителя с различным уровнем патогенности и способностью к инвазии. Полисахарид, входящий в состав капсулы, обладает выраженными антигенными свойствами.
Антитела к капсульным полисахаридам у различных серотипов пневмококка — протективные, в то же время возможны перекрёстные иммунные реакции между различными серотипами. Компоненты клеточной стенки микроорганизма также способны вызывать выраженный воспалительный процесс.
Кроме того, пневмококки имеют несколько факторов адгезии, способствующих прикреплению возбудителя к полисахаридам поверхности клеток, что способствует колонизации организма.
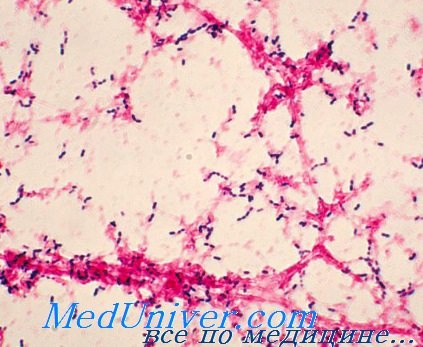
Колонизация пневмококковой инфекции (Streptococcus pneumoniae)
Единственный источник инфекции — человек; носительство обычно протекает бессимптомно. Распределение серотипов зависит от региона, возраста пациента и социальной группы. Наиболее подвержены острой пневмонии дети первого года жизни.
Факторы, предрасполагающие к развитию тяжёлой инфекции: недостаточность комплемента, агаммаглобулинемия, ВИЧ-инфекция, алкоголизм и спленэктомия (удаление селезёнки). Немаловажную роль в развитии инфекционного процесса играют пневмококковые токсины: пневмолизин, нейраминидаза, гиалуронидаза и адгезины (например, пневмококковый поверхностный белок типа А).
Бактерии способны прикрепляться к пневмоцитам и проникать в кровоток, связываясь с рецепторами фактора агрегации тромбоцитов и активируя выработку пневмолизина или комплемент-индуцированного повреждения альвеол.
Клинические признаки инфекции вызванной пневмококком (Streptococcus pneumoniae)
Чаще всего Streptococcus pneumoniae вызывает острые отиты, синуситы и пневмонию. В 50—70% случаев причиной возникновения внебольничной пневмонии становятся пневмококки, при этом у 25—30% пациентов развивается бактериемия.
Прямое или гематогенное распространение инфекции приводит к развитию менингита и реже к целлюлиту, абсцессам, перитониту и эндокардиту. Бактериемия — тяжелейшее осложнение пневмококковой инфекции с высокой летальностью даже при соответствующем лечении.
Пневмококк считают второй из наиболее распространённых причин развития внебольничного менингита у детей, вакци-низированных против Haemophilus influenzae типа В, и основной причиной менингита у пациентов старше сорока лет. При этом отмечают достаточно высокий уровень смертности и вероятности развития осложнений.
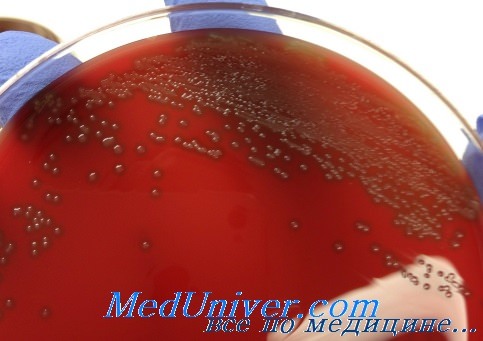
Чувствительность пневмококка (Streptococcus pneumoniae) к антибиотикам
Ранее при лечении пневмококковых инфекций самым эффективным препаратом был пенициллин, но позднее благодаря генетической модификации пенициллинсвязывающего белка большинство штаммов приобрело к нему устойчивость. В настоящее время в клинической практике используют эритромицин, цефалоспорины, тетрациклин, рифампицин и хлорамфеникол, но всё чаще сталкиваются с мультирезистентными штаммами.
Препаратом выбора продолжает оставаться пенициллин, а при менингите, вызванном менее чувствительными штаммами, применяют цефотаксим или цефтриаксон. В случае высокой устойчивости к пенициллину дополнительно назначают гликопептидные препараты (ванкомицин).
Профилактика заболевания вызванной пневмококком (Streptococcus pneumoniae)
Для профилактики пневмококковой инфекции применяют поливалентную капсульную полисахаридную вакцину для профилактики пневмококковых инфекций, эффективную при назначении пациентам в зрелом возрасте и менее действенную у лиц со сниженным иммунитетом и детей младше двух лет.
Недавно созданная конъюгированная вакцина обладает достаточно высокой иммуностимулирующей способностью у детей младшего возраста.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в раздел "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Наименование лекарственного средства: Пиобактериофаг комплексный.
Группировочное наименование: Пиобактериофаг.
Лекарственная форма
раствор для приёма внутрь, местного и наружного применения.
Форма выпуска
Раствор для приема внутрь, местного и наружного применения во флаконах по 20 или 100 мл. 8 флаконов по 20 мл или 1 флакон по 100 мл в пачке из картона с инструкцией по применению.
Состав
Описание
Прозрачная жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Фармакологическая группа лекарственного препарата
Фармокологические свойства
Препарат вызывает специфический лизис бактерий Staphylococcus, Enterococcus, Streptococcus, энтеропатогенных Escherichia coli, Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Klebsiella pneumoniae, Klebsiella oxytoca.
Показания для применения
Лечение и профилактика гнойно-воспалительных и кишечных заболеваний, вызванных стафилококками, энтерококками, стрептококками, синегнойной палочкой, клеб- сиеллами, патогенной кишечной палочкой различных серогрупп, протеем при внутреннем, ректальном и наружном применении.
- заболевания уха, горла, носа, дыхательных путей и легких - воспаления пазух носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит;
- хирургические инфекции - нагноения ран, ожоги, абсцесс, флегмона, фурункулы, карбункулы, гидроаденит, панариции, парапроктит, мастит, бурсит, остеомиелит;
- урогенитальные инфекции - уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит;
- посттравматические конъюнктивиты, кератоконъюнктивиты, гнойные язвы роговицы и иридоциклиты;
- энтеральные инфекции - гастроэнтероколит, холецистит, дисбактериоз;
- генерализованные септические заболевания;
- гнойно-воспалительные заболевания новорожденных - омфалит, пиодермия, конъюнктивит, гастроэнтероколит, сепсис и др.;
- другие заболевания, вызванные бактериями стафилококков, стрептококков, энтерококков, протея, клебсиелл пневмонии и окситока, синегнойной и кишечной палочек.
С профилактической целью препарат используют для обработки операционных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Противопоказания
Гиперчувствительность к компонентам препарата.
Режим дозирования и способ введения.
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и через рот, 7-20 дней (по клиническим показаниям).
В зависимости от характера очага инфекции бактериофаг применяют:
- Местно в виде орошения, примочек и тампонирования жидким фагом в количестве до 200 мл в зависимости от размеров пораженного участка. При абсцессах бактериофаг вводят в полость очага после удаления гноя с помощью пункции. Количество вводимого препарата должно быть несколько меньше объема удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
- Введение в полости - плевральную, суставную и другие ограниченные полости до 100 мл бактериофага, после чего оставляют капиллярный дренаж, через который в течение нескольких дней повторно вводят бактериофаг.
- При циститах, пиелонефритах, уретритах препарат принимают внутрь. В случае, если полость мочевого пузыря или почечной лоханки дренированы, бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку.
- При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины, матки в дозе 5-10 мл ежедневно однократно.
- При гнойно-воспалительных заболеваниях уха, горла, носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания, промывания, закапывания, введение смоченных турунд (оставляя их на 1 час).
- При конъюнктивитах и кератоконъюнктивитах препарат закапывают по 2-3 капли 4-5 раз в день, при гнойной язве роговицы - по 4-5 капель, при гнойных иридо- циклитах препарат применяют по 6-8 капель каждые 3 часа в сочетании с приемом внутрь.
- При лечении стоматитов и хронических генерализованных пародонтитов препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в пародонтальные карманы турунд, пропитанных пиобактериофагом, на 5-10 минут.
- При кишечных формах заболевания, заболеваниях внутренних органов, дисбактериозе бактериофаг применяют через рот и в клизме. Через рот бактериофаг дают 3 раза в сутки натощак за 1 час до еды. В виде клизм назначают 1 раз в день вместо одного приема через рот.
Рекомендуемые дозировки препарата
Доза на 1 приём (мл)
при различных способах введения препарата
Применение бактериофагов не исключает использования других антибактериальных препаратов. В случае, если до применения бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0,9 % раствором натрия хлорида.
Применение бактериофага у детей (до 6 месяцев).
При сепсисе, энтероколите новорожденных, включая недоношенных детей, бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки (см. табл.). При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в клизмах) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалитов, пиодермий, инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или на пораженный участок кожи).
Побочное действие
Особые указания
Важным условием эффективной фаготерапии является предварительное определение чувствительности возбудителя к бактериофагу и раннее применение препарата.
Не пригоден к применению препарат во флаконах с нарушенной целостностью или маркировкой, при истекшем сроке годности, при помутнении.
Вследствие содержания в препарате питательной среды, в которой могут развиваться бактерии из окружающей среды, вызывая помутнение препарата, необходимо при вскрытии флакона соблюдать следующие правила:
- тщательно мыть руки;
- обработать колпачок спиртсодержащим раствором; снять колпачок не открывая пробки;
- не класть пробку внутренней поверхностью на стол или другие предметы;
- не оставлять флакон открытым;
- вскрытый флакон хранить только в холодильнике.
Перед использованием флакон с бактериофагом необходимо встряхнуть и просмотреть. Препарат должен быть прозрачным.
Вскрытие флакона и извлечение необходимого объема препарата может проводиться стерильным шприцем путем прокола пробки. Препарат из вскрытого флакона при соблюдении условий хранения, вышеперечисленных правил и отсутствии помутнения, может быть использован в течение всего срока годности.

Наименование лекарственного средства: Пиобактериофаг поливалентный очищенный.
Группировочное наименование: Пиобактериофаг.
Лекарственная форма
раствор для приёма внутрь, местного и наружного применения.
Форма выпуска
Раствор для приема внутрь, местного и наружного применения во флаконах по 10 или 20 мл. По 4 или 10 флаконов в пачке из картона. По 4 флакона в контурной ячейковой упаковке из пленки поливинилхлоридной, по 1 контурной ячейковой упаковке в пачке из картона.
Состав
Препарат представляет собой стерильную смесь очищенных фильтратов фаголизатов бактерий Staphylococcus, Streptococcus, Proteus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli. Вспомогательное вещество; консервант - хинозол - 0,0001 г/мл.
Описание
Представляет собой прозрачную жидкость желтого цвета различной степени интенсивности, допускается зеленоватый оттенок. Определяют визуально.
Фармакологическая группа лекарственного препарата
Биологические свойства
Препарат вызывает специфический лизис бактерий Staphylococcus, Streptococcus, Proteus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli.
Показания для применения
Лечение и профилактика различных форм гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями Staphylococcus, Streptococcus, Proteus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli.
- заболевания желудочно-кишечного тракта (гастроэнтероколит, холецистит, панкреатит, дисбактериоз кишечника);
- воспалительные заболевания новорожденных и детей раннего возраста (гастроэнтероколит, дисбактериоз кишечника, омфалит, пемфигус, пиодермия, септицемия и септикопиемия различной локализации);
- хирургические инфекции (нагноения ран, гнойные поражения кожи, ожоги, перитонит, плеврит, мастит, остеомиелит);
- урогенитальные инфекции (цистит, пиелонефрит, эндометрит, вульвит, бартолинит, кольпит, сальпингоофорит);
- гнойно-воспалитеьные заболевания уха, горла, носа, пазух носа, ротовой полости, глотки, гортани, легких и плевры (отит, ангина, фарингит, стоматит, пародонтит, гайморит, фронтит, пневмония, плеврит);
- посттравматический конъюнктивит, кератоконъюнктивит, гнойная язва роговицы и иридоциклит;
- профилактика внутрибольничных инфекций, вызванных бактериями Staphylococcus, Streptococcus, Proteus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Противопоказания
Гиперчувствительность к компонентам препарата.
Режим дозирования и способ введения.
Препарат используют для приема внутрь (через рот), в виде клизм, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа, а также в дренированные полости: абсцессов, брюшную, плевральную, мочевого пузыря, почечной лоханки.
Внутрь препарат принимают натощак за 0,5-1 час до приема пищи.
Рекомендуемые дозировки препарата
Доза на 1 приём (мл)
при различных способах введения препарата
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь.
В случае обработки погости гнойного очага химическими антисептиками* перед применением бактериофага она должна быть промыта стерильным 0,9 % раствором натрия хлорида.
При лечении ангины, фарингита, ларингита препарат используют для полосканий полости рта и глотки 3 раза в день по 10-20 мл, курс лечения 7-10 дней.
При лечении бронхита, пневмонии препарат принимают внутрь 3 раза в день по 10-20 мл, а также применяют в виде аэрозолей и ингаляций (без подогрева и использования ультразвука), курс лечения 15-20 дней.
При лечении отита препарат используют для промывания и введения в полость среднего уха по 2-5 мл 1-3 раза в день. Курс лечения 7-15 дней.
При лечении воспаления пазух носа препарат используют для промывания полости носа, носоглотки и пазух носа в дозе 5-10 мл и введения в пазухи 2-3 мл. Процедуру повторяют ежедневно однократно в течение 7-10 дней. Кроме того, препарат вводят в полость носа в виде турунд, смоченных бактериофагом, по очереди в каждый носовой ход и оставляют в течение 0,5-1 часа. Процедуру повторяют 3 раза в день, курс лечения 7-15 дней.
При лечении стоматита и хронического пародонтита препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в парадонтальные карманы турунд, пропитанных бактериофагом, на 5-10 мин, курс лечения 7-10 дней.
При конъюнктивите и кератоконъюнктивите препарат применяют по 2-3 капли 4-5 раз в день, курс лечения 5-7 дней; при гнойной язве роговицы - по 4-5 капель в день в течение 7-10 дней, при гнойном иридоциклите - по 6-8 капель каждые 3 часа в сочетании с приемом внутрь в терапевтических дозировках в течение 7-10 дней.
При абсцессе после вскрытия и удаления гнойного содержимого препарат вводят в количестве меньшем, чем объем удаленного гноя ежедневно однократно, курс лечения 7 -10 дней.
При перитоните и плеврите препарат вводят в дренированные полости - брюшную и плевральную через дренажные трубки ежедневно однократно 20-70 мл, курс лечения 10-15 дней.
При остеомиелите препарат вводят в полость раны через турунды, дренажи в количестве 10-30 мл ежедневно однократно, курс лечения 15-20 дней.
При лечении мастита, нагноений ран и ожогов, препарат применяют в виде орошения, аппликаций, йовязок, введения в дренаж в дозе 5-50 мл в зависимости от очага поражения не менее 1 раз в день, курс лечения 10-15 дней.
При лечении гнойно-воспалительных гинекологических заболеваний (нагноений ран, эндометрита, вульвита, бартолинита, кольпита, сальпингоофорита) препарат используют для орошений, аппликаций, вводят в полости ран, вагины, матки по 5-20 мл один раз в день в течение 7-10 дней.
При цистите, пиелонефрите, уретрите препарат принимают внутрь в терапевтической дозе 3 раза в день за 1 час до еды в течение 10-20 дней. В том случае, если полость мочевого пузыря или почечной лоханки дренированы, препарат вводят через цистостому или нефростому 1-3 раза в день по 20-50 мл в мочевой пузырь и 5-7 мл в почечную лоханку, курс лечения 7-15 дней.
При гастроэнтероколите, панкреатите, холецистите, а также дисбактериозе кишечника бактериофаг принимают внутрь в возрастных дозировках 3 раза в день за 1 час до еды в течение 7-15 дней (по клиническим показаниям). При неукротимой рвоте препарат применяют в виде высоких клизм 2-3 раза в день по 20-40 мл. При дисбактериозе кишечника препарат может применяться с препаратами нормофлоры.
Для профилактики внутрибольничных хирургических инфекций препарат используют для обработки послеоперационных и свежеинфицированных ран в дозе 5 - 50 мл в зависимости от очага поражения ежедневно однократно в течение 5-7 дней.
Применение препарата у детей до 1 года (включая недоношенных детей).
При гастроэнтероколите, пневмонии и сепсисе новорожденных препарат применяют через рот 2-3 раза в сутки по 3-5 мл за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно однократно в дозе 5-10 мл. Возможно сочетание ректального (в виде высоких клизм) и перорального применения препарата. Курс лечения 7-15 дней (по клиническим показаниям). При рецидивирующем течении заболевания возможно повторное проведение курсов лечения.
При лечении омфалита, пиодермии, инфицированных ран бактериофаг применяют в виде аппликаций по 5-10 мл 2-3 раза в день (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или пораженный участок кожи) в течение 7-15 дней.
С целью профилактики возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют по эпидемическим показаниям внутрь по 3-5 мл 3 раза день за 30 минут до кормления в течение всего срока пребывания в стационаре.
Инфекции дыхательных путей (ИДП) являются основной причиной обращаемости за медицинской помощью и обусловливают наибольший объeм амбулаторного потребления антибактериальных препаратов (АБ).
Инфекции дыхательных путей (ИДП) являются основной причиной обращаемости за медицинской помощью и обусловливают наибольший объeм амбулаторного потребления антибактериальных препаратов (АБ). Типичными возбудителями нетяжeлых ИДП являются Haemophilus influenza, Streptococcus pneumoniae и Moraxella catarrhalis. Преобладание пневмококка при внебольничной пневмонии — факт, не вызывающий сомнений. В то же время при остром риносинусите и обострении хронической обструктивной болезни лeгких (хроническом обструктивном бронхите) пневмококк уступает этиологическую нишу грамотрицательным микроорганизмам, в том числе продуцирующим бета-лактамазы H. influenzae и M. catarrhalis. Очевидно, что на фоне неблагоприятной эпидемиологической обстановки для лечения указанной патологии обосновано применение препаратов, обладающих как высоким антигемофильным, так и антипневмококковым потенциалом.
В данном случае оправдано применение пероральных цефалоспоринов и ингибиторозащищeнных аминопенициллинов (ИЗА), устойчивых к действию гидролитических ферментов. Однако ситуация с эмпирическим применением ИЗА может осложняться присутствием H. influenzae, устойчивой к ИЗА за счет мутаций пенициллинсвязывающих белков (ПСБ-3; штаммы BLNAR — бета-лактамазонегативные, устойчивые к ампициллину, и BLPAСR — бета-лактамазопозитивные, устойчивые к ко-амоксиклаву).
Известно, что частота BLNAR-фенотипа в Европе достигает 8,8% (от 0% в Нидерландах и Франции (по другим данным 22,8%), до 11,8% в Германии, 12,8% в Польше, 33,9%–66,4% в Испании). Высока распространeнность BLNAR-фенотипа в Азиатско-Тихоокеанском регионе: 29,3% в Южной Корее, 40–65% в Японии. В то же время их распространeнность в России, по данным 6-летней давности, составляет 2,5% в Екатеринбурге и 1,8% в Москве. Вполне вероятно, что для достижения более неблагоприятной ситуации требуется некоторое, судя по мировой динамике, незначительное время. Этот факт определяет крайнюю необходимость оценки перспектив применения анти-BLNAR препаратов, в том числе цефиксима.
Цефиксим (CFX), пероральный цефалоспорин III поколения, в последние годы широко используется при лечении внебольничных ИДП, так как удовлетворяет вышеперечисленным требованиям. Универсально высокая активность против грамотрицательных бактерий, в том числе синтезирующих бета-лактамазы H. influenzae, M. catarrhalis, Escherichia coli и Klebsiella pneumoniae, а также против устойчивой к ко-амоксиклаву H. influenza определяет его эффективность при нетяжeлых ИДП: остром риносинусите, остром среднем отите и обострении хронической обструктивной болезни лeгких (оХОБЛ).
Поскольку одним из возбудителей перечисленных ИДП является S. pneumoniae, для безопасного применения CFX необходим постоянный мониторинг чувствительности клинических штаммов возбудителя.
Целью настоящего исследования явилась оценка чувствительности внебольничных штаммов S. pneumoniae к CFM и другим пероральным АБ, традиционно применяемым на амбулаторном этапе оказания медицинской помощи.
Материал и методы
Штаммы получены в 2005–2006 гг. от пациентов с нетяжeлыми ИДП в возрасте 18–60 лет. Условием включения являлось отсутствие в анамнезе предшествующей госпитализации и проведения антибактериальной терапии (АТ) в предшествующие 3 мес. От каждого пациента исследован штамм, полученный до начала АТ. Хранение и тестирование выделенных культур методом микроразведений в бульоне выполнено в соответствии с рекомендациями Института клинических и лабораторных стандартов США (Clinical and Laboratory Standards Institute) CLSI 2007 и по критериям Британского общества по антимикробной химиотерапии (BSAC), согласно которым к чувствительным отнесены штаммы с МПК ≤ 1 мкг/мл, к устойчивым — ≥ 4 мкг/мл.
Результаты исследования и обсуждение
Отобрано 250 респираторных штаммов S. pneumoniae. Структура клинического материала и обобщенные результаты определения чувствительности S. pneumoniae представлены в табл., распределение минимальных подавляющих концентраций цефиксима — на рис. 1.
Наблюдаемое с течением времени повышение резистентности S. pneumoniae к АБ определяет необходимость проведения систематического микробиологического мониторинга. Поскольку бета-лактамные антибиотики составляют основу терапии респираторных, в том числе пневмококковых инфекций, распространение резистентных штаммов оказывает существенное влияние на выбор АБ для эмпирической терапии.
На настоящий момент география распространенности устойчивых к АБ пневмококков не однозначна. Наибольшую актуальность устойчивость пневмококков приобрела в странах Юго-Восточной Азии, в ряде стран Европы (Испания, Франция). С другой стороны, существуют страны с низким уровнем пенициллинорезистентности, особенно высокой степени (R ≥ 2 мг/л). К ним традиционно относят Германию, Великобританию и Россию. По данным нашего исследования пневмококк характеризовался высокой чувствительностью к амоксициллину. В то же время данный препарат, как показано в ряде исследований, обеспечивает минимальный безинфекционный интервал при хроническом обструктивном бронхите, что ограничивает его применение при данной патологии. Аналогичные результаты, при коррекции на современные критерии CLSI, приводятся в исследовании Pegas.
Цефиксим, пероральный цефалоспорин III поколения, характеризуется крайне высокой бактерицидной активностью против грамотрицательных микроорганизмов, преобладающих при обострениях ХОБЛ, остром среднем отите и остром риносинусите. По антигемофильной активности практически не уступает респираторным фторхинолонам; его активность в 32 раза превышает таковую цефуроксима и в 128 раз цефаклора — распространенных в амбулаторной практике цефалоспоринов, в том числе используемых при внебольничной пневмонии.
Известно, что CFX эффективно подавляет жизнедеятельность чувствительных к пенициллину штаммов пневмококка, преобладающих в России. Активность CFX в отношении пневмококка, одного из потенциальных респираторных возбудителей, по результатам нашего исследования может быть оценена как высокая. При анализе распределения МПК видно, что данный показатель для большинства протестированных штаммов не приближается к верхней границе зоны чувствительности (рис. 1). С клинической точки зрения, практически одинаковый уровень чувствительности пневмококка к CFX, цефуроксиму и макролидам позиционирует его в один ряд с указанными АБ при лечении нетяжeлых случаев острого риносинусита, среднего отита и обострений хронического обструктивного бронхита, вызванных пневмококком. В то же время более высокая антигемофильная активность придаeт препарату определeнные преимущества. Последние, в частности, касаются полноты и длительности эрадикации возбудителя, а значит, и длительности безинфекционного интервала при хроническом обструктивном бронхите.
С фармакодинамической (ФД) точки зрения, эффективность CFX определяется временем, в течение которого концентрация несвязанного препарата в 4–5 раз превышает значение минимальной подавляющей концентрации (МПК) в очаге инфекции (fT > МПК). Для оптимального бактерицидного эффекта CFX необходимо, чтобы этот показатель перекрывал интервал между введениями не менее чем на 50–60%. С этой точки зрения препарат, даже при однократном суточном приeме, обеспечивает требуемые показатели в отношении основных возбудителей: Haemophilus spp. (МПК чувствительных штаммов ≤ 1 мкг/мл), чувствительного к пенициллину S. pneumoniae (МПК Ч ≤ 1 мкг/мл) и M. catarrhalis (рис. 1).
Цефиксим продемонстрировал достаточную антипневмококковую активность и в фармакодинамической/фармакокинетической модели. Показано, что симуляция воздействия реально достижимой сывороточной и тканевой концентрацией обеспечивает, к 12 часу, уверенное подавление роста микроорганизмов (рис. 2). В клинической практике это означает купирование инфекционно-воспалительного процесса, в том числе за счeт оптимизации саногенетических процессов на фоне блокированной логарифмической фазы роста бактерий.
Выводы
Среди пациентов с ИДП отмечен высокий, 82% уровень чувствительности пневмококка к цефиксиму, что сравнимо с показателями, выявленными для цефуроксима и макролидов. Выявленное распределение МПК CFX против пневмококка подтверждает возможность однократного суточного приeма препарата.
Применение цефиксима при внебольничных инфекциях, где преобладающими возбудителями являются грамотрицательные микроорганизмы, а роль пневмококка не исключается, является безопасным и эффективным.
Литература
Tristram S. G., Burdach J. G. Effect of cloned inhibitor-resistant TEM beta-lactamases on the susceptibility of Haemophilus influenzae to amoxicillin/clavulanate // J Antimicrob Chemother. Nov 2007; 60 (5):1 151–1154.
Farrell D. J., Couturier C. European survey of antibacterial activity against H. influenzae from 2006–2007: focus on fluoroquinolones [P2067] // Clin Microbiol Infect. 2008; 14 (Suppl. 7).
Alou L., Gimenez M. J,. Sevillano D. et al. Are beta-lactam breakpoints adequate to define non-susceptibility for all Haemophilus influenzae resistance phenotypes from a pharmacodynamic point of view? // The Journal of antimicrobial chemotherapy. Apr 2007; 59 (4): 652–657.
Dabernat H., Seguy M., Faucon G., Delmas C. Epidemiology of Haemophilus influenzae strains collected in 2004 in France and in vitro assessment of their susceptibility to antibiotics // Med Mal Infect. Jun 2007; 37 (6): 320–324.
5. Skoczynska A., Kadlubowski M., Wasko II., Fiett J., Hryniewicz W. Resistance patterns of selected respiratory tract pathogens in Poland // Clin Microbiol Infect. Apr 2007;13 (4): 377–383.
Jansen W. T., Verel A., Beitsma M., Verhoef J., Milatovic D. Longitudinal European surveillance study of antibiotic resistance of Haemophilus influenzae // The Journal of antimicrobial chemotherapy. Oct 2006;
58 (4): 873–877.
Garcia-Cobos S., Campos J., Lazaro E. et al. Ampicillin-resistant non-beta-lactamase-producing Haemophilus influenzae in Spain: recent emergence of clonal isolates with increased resistance to cefotaxime and cefixime // Antimicrobial agents and chemotherapy. Jul 2007; 51 (7): 2564–2573.
Kim II. S., Ki C. S., Kim S. et al. Diversity of ampicillin resistance genes and antimicrobial susceptibility patterns in Haemophilus influenzae strains isolated in Korea // Antimicrobial agents and chemotherapy. Feb 2007;51 (2): 453–460.
Hotomi M., Fujihara K., Billal D. S. et al. Genetic Characteristics and Clonal Dissemination of
Hasegawa K., Kobayashi R., Takada E. et al. High prevalence of type b beta-lactamase-non-producing ampicillin-resistant Haemophilus influenzae in meningitis: the situation in Japan where Hib vaccine has not been introduced // The Journal of antimicrobial chemotherapy. Jun 2006; 57 (6): 1077–1082.
Боронина Л. Г., Блинова С. М. Антибиотикорезистентность штаммов Н. influenzae, выделенных в Екатеринбурге в 2000–2005 гг. у детей с инфекцией различной локализации // Клиническая микробиология и антимикробная химиотерапия. 2007; 9 (2): 187–192.
Филимонова О. Ю., Грудинина С. А., Сидоренко С. В. et al. Антибиотикорезистентность штаммов Haemophilus influenzae, выделенных в Москве с 2002 по 2004 гг. // Антибиотики и химиотерапия. 2004; 49 (12): 14–20.
Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Seventeenth Informational Supplement. CLSI document M100-S17 [ISBN 1–56238–625–5]. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087–1898 USA, 2007.
Козлов Р. С., Сивая О. В., Шпынев К. В. et al. Антибиотикорезистентность Streptococcus pneumoniae в России в 1999–2005 гг.: результаты многоцентровых проспективных исследований ПеГАС-I и ПеГАС-II // Клиническая микробиология и антимикробная химиотерапия. 2006; 8 (1): 33–47.
Jansen W. T. M., Verel A., Beitsma M., Verhoef J., Milatovic D. Longitudinal European surveillance study of antibiotic resistance of Haemophilus influenzae // Journal of Antimicrobial Chemotherapy. 2006;
58 (4): 873–877.
16. Fenoll A., Robledo O., Lerma M. et al. [Activity of cefpodoxime and other oral beta-lactams against Haemophilus influenzae and Streptococcus pneumoniae with different susceptibilities to penicillin] // Rev Esp Quimioter. Mar 2006; 19 (1): 39–44.
Craig W. A., Ebert S. C. Killing and regrowth of bacteria in vitro: a review // Scand J Infect Dis Suppl. 1990; 74: 63–70.
Liu P., Rand K. H., Obermann B., Derendorf H. Pharmacokinetic-pharmacodynamic modelling of antibacterial activity of cefpodoxime and cefixime in in vitro kinetic models // International journal of antimicrobial agents. Feb 2005; 25 (2): 120–129.
Nakamura T., Takahashi H. Antibacterial activity of oral cephems against various clinically isolated strains and evaluation of efficacy based on the pharmacokinetics/pharmacodynamics theory // The Japanese journal of antibiotics. Dec 2004; 57 (6): 465–474.
И. А. Гучев, кандидат медицинских наук 421 Военный госпиталь Московского военного округа, Московская область
Читайте также:

