Лекарства в инфекционном отделении
Обновлено: 25.04.2024
По спектру активности антимикробные препараты делятся на: антибактериальные, антигрибковые и антипротозойные. Кроме того, все антимикробные средства делят на препараты узкого и широкого спектра действия.
К препаратам узкого спектра действия преимущественно на грамположительные микроорганизмы относятся, например, природные пенициллины, макролиды, линкомицин, фузидин, оксациллин, ванкомицин, цефалоспорины I поколения. К препаратам узкого спектра действия преимущественно на грамотрицательные палочки относятся полимиксины и монобактамы. К препаратам широкого спектра действия относятся тетрациклины, левомицетин, аминогликозиды, большинство полусинтетических пенициллинов, цефалоспорины начиная со 2 поколения, карбопенемы, фторхинолоны. Узкий спектр имеют антигрибковые препараты нистатин и леворин (только против кандиды), а широкий – клотримазол, миконазол, амфотерицин В.
По типу взаимодействия с микробной клеткой антимикробные препараты делятся на:
· бактерицидные – необратимо нарушают функции микробной клетки либо ее целостность, вызывая немедленную гибель микроорганизма, применяются при тяжелых инфекциях и у ослабленных больных,
· бактериостатические – обратимо блокируют репликацию или деление клетки, применяются при нетяжелых инфекциях у неослабленных больных.
По кислотоустойчивости антимикробные препараты классифицируются на:
· кислотоустойчивые – могут применяться перорально, например, феноксиметилпенициллин,
· кислотонеустойчивые – предназначены только для парентерального применения, например, бензилпенициллин.
В настоящее время используются следующие основные группы антимикробных препаратов для системного применения.
¨ Лактамные антибиотики
Лактамные антибиотики (табл. 9.2) из всех антимикробных препаратов наименее токсичны, так как, нарушая синтез клеточной стенки бактерий, не имеют мишени в организме человека. Их применение при наличии чувствительности к ним возбудителей является предпочтительным. Наиболее широкий спектр действия среди лактамных антибиотиков имеют карбапенемы, они используются как препараты резерва – только при инфекциях, резистентных к пенициллинам и цефалоспоринам, а также при госпитальных и полимикробных инфекциях.
¨ Антибиотики других групп
Антибиотики других групп (табл. 9.3) имеют различные механизмы действия. Бактериостатические препараты нарушают этапы синтеза белка на рибосомах, бактерицидные – нарушают либо целостность цитоплазматической мембраны, либо процесс синтеза ДНК и РНК. В любом случае они имеют мишень в организме человека, поэтому по сравнению с лактамными препаратами более токсичны, и должны использоваться только при невозможности применения последних.
¨ Синтетические антибактериальные препараты
Синтетические антибактериальные препараты (табл. 9.4) также имеют различные механизмы действия: ингибирование ДНК-гиразы, нарушение включения ПАБК в ДГФК и т.д. Также рекомендуются к применению при невозможности использования лактамных антибиотиков.
¨ Побочные эффекты антимикробных препаратов,
их профилактика и лечение
Антимикробные препараты обладают целым рядом разнообразных побочных эффектов, некоторые из которых могут привести к тяжелым осложнениям и даже к летальному исходу.
Аллергические реакции
Аллергические реакции могут иметь место при применении любого антимикробного препарата. Могут развиться аллергический дерматит, бронхоспазм, ринит, артрит, отек Квинке, анафилактический шок, васкулит, нефрит, волчаночноподобный синдром. Чаще всего они наблюдаются при применении пенициллинов и сульфаниламидов. У некоторых пациентов развивается перекрестная аллергия на пенициллины и цефалоспорины. Зачастую отмечаются аллергии на ванкомицин и сульфаниламиды. Очень редко дают аллергические реакции аминогликозиды и левомицетин.
Профилактике способствует тщательный сбор аллергологического анамнеза. Если пациент не может указать, на какие именно антибактериальные препараты в у него наблюдались аллергические реакции, перед введением антибиотиков необходимо выполнение проб. Развитие аллергии независимо от тяжести реакции требует немедленной отмены вызвавшего ее препарата. В последующем введение даже сходных по химической структуре антибиотиков (например, цефалоспоринов при аллергии на пенициллин) допускается только в случаях крайней необходимости. Лечение инфекции должно быть продолжено препаратами других групп. При тяжелых аллергических реакциях требуется внутривенное введение преднизолона и симпатомиметиков, инфузионная терапия. В нетяжелых случаях назначаются антигистаминные препараты.
Раздражающее действие на путях введения
При пероральном применении раздражающее действие может выражаться в диспепсических явлениях, при внутривенном введении – в развитии флебитов. Тромбофлебиты чаще всего вызывают цефалоспорины и гликопептиды.
Суперинфекция, в том числе дисбактериоз
Вероятность дисбактериоза зависит от широты спектра действия препарата. Наиболее часто возникающий кандидомикоз развивается при применении препаратов узкого спектра через неделю, при применении препаратов широкого спектра – уже от одной таблетки. Однако цефалоспорины относительно редко дают грибковую суперинфекцию. На 1 месте по частоте и тяжести вызываемого дисбактериоза находится линкомицин. Нарушения флоры при его применении могут принять характер псевдомембранозного колита – тяжелого заболевания кишечника, вызываемого клостридиями, сопровождающегося диареей, дегидратацией, электролитными нарушениями, и в отдельных случаях осложняющегося перфорацией толстой кишки. Гликопептиды тоже могут вызвать псевдомембранозный колит. Часто вызывают дисбактериоз тетрациклины, фторхинолоны, левомицетин.
Дисбактериоз требует отмены применявшегося препарата и длительного лечения эубиотиками после предварительной антимикробной терапии, которая проводится по результатам чувствительности микроорганизма, вызвавшего воспалительный процесс в кишечнике. Применяемые для лечения дисбактериоза антибиотики не должны оказывать влияния на нормальную кишечную аутофлору – бифидо- и лактобактерии. Однако при лечении псевдомембранозного колита используется метронидазол или, как альтернатива, ванкомицин. Необходима также коррекция водно-электролитных нарушений.
Нарушение толерантности к алкоголю - свойственно всем лактамным антибиотикам, метронидазолу, левомицетину. Проявляется появлением при одновременном употреблении алкоголя тошноты, рвоты, головокружения, тремора, потливости и падения артериального давления. Пациенты должны быть предупреждены о недопустимости приема алкоголя на весь период лечения антимикробным препаратом.
Органоспецифичные побочные эффекты для различных групп препаратов:
· Поражение системы крови и кроветворения – присущи левомицетину, реже линкосомидам, цефалоспоринам 1 поколения, сульфаниламидам, производным нитрофурана, фторхинолонам, гликопептидам. Проявляется апластической анемией, лейкопенией, тромбицитопенией. Необходима отмена препарата, в тяжелых случаях заместительная терапия. Геморрагический синдром может развиться при применении цефалоспоринов 2-3 поколения, нарушающих всасывание витамина К в кишечнике, антисинегнойных пенициллинов, нарушающих функции тромбоцитов, метронидазола, вытесняющего кумариновые антикоагулянты из связей с альбумином. Для лечения и профилактики используются препараты витамина К.
· Поражение печени – присущи тетрациклинам, которые блокируют ферментную систему гепатоцитов, а также оксациллину, азтреонаму, линкозаминам и сульфаниламидам. Холестаз и холестатический гепатит могут вызвать макролиды, цефтриаксон. Клиническими проявлениями служит повышение печеночных ферментов и билирубина в сыворотке крови. При необходимости применения гепатотоксических антимикробных средств более недели необходим лабораторный контроль перечисленных показателей. В случае повышения АСТ, АЛТ, билирубина, щелочной фосфатазы или глутамилтранспептидазы лечение должно быть продолжено препаратами других групп.
· Поражение костей и зубов характерны для тетрациклинов, растущих хрящей – для фторхинолонов.
· Поражение почек присуще аминогликозидам и полимиксинам, которые нарушают функции канальцев, сульфаниламидам, вызывающим кристаллурию, цефалоспоринам поколения, вызывающим альбуминурию, и ванкомицину. Предрасполагающими факторами являются старческий возраст, заболевания почек, гиповолемия и гипотензия. Поэтому при лечении данными препаратами необходима предварительная коррекция гиповолемии, контроль диуреза, подбор доз с учетом функции почек и массы ткла, Курс лечения должен быть коротким.
· Миокардит – побочный эффект левомицетина.
· Диспепсия, не являющаяся следствием дисбактериоза, характерна при применении макролидов, которые обладают прокинетическими свойствами.
· Различные поражения ЦНС развиваются от многих антимикробных препаратов. Наблюдаются:
- психозы при лечении левомицетином,
- парезы и периферические параличи при применении аминогликозидов и полимиксинов за счет их курареподобного действия (поэтому их нельзя применять одновременно с миорелаксантами),
- головная боль и центральная рвота при использовании сульфаниламидов и нитрофуранов,
- судороги и галлюцинации при использовании аминопенициллинов и цефалоспоринов в высоких дозах, являющиеся результатом антагонизма этих препаратов с ГАМК,
- судороги при применении имипенема,
- возбуждение при использовании фторхинолонов,
- менингизм при лечении тетрациклинами из-за увеличения ими продукции ликвора,
- нарушения зрения при лечении азтреонамом и левомицетином,
- периферическая нейропатия при применении изониазида, метронидазола, левомицетина.
· Поражение слуха и вестибулярные расстройства – побочный эффект аминогликозидов, более свойственный 1 поколению. Так как данный эффект связан с накоплением препаратов, длительность их применения не должна превышать 7 дней. Дополнительными факторами риска являются старческий возраст, почечная недостаточность и одновременное применение петлевых диуретиков. Обратимые изменения слуха вызывает ванкомицин. При появлении жалоб на снижение слуха, головокружение, тошноту, неустойчивость при ходьбе необходима замена антибиотика на препараты других групп.
· Поражения кожи в виде дерматита характерны для левомицетина. Тетрациклины и фторхинолоны вызывают фотосенсибилизацию. При лечении этими препаратами не назначаются физиотерапевтические процедуры, и следует избегать нахождения на солнце.
· Гипофункцию щитовидной железы вызывают сульфаниламиды.
· Тератогенность присуща тетрациклинам, фторхинолонам, сульфаниламидам.
· Возможен паралич дыхательной мускулатуры при быстром внутривенном введении линкомицина и кардиодепрессия при быстром внутривенном введении тетрациклинов.
· Электролитные нарушения вызывают антисинегнойные пенициллины. Особо опасно развитие гипокалиемии при наличии заболеваний сердечно-сосудистой системы. При назначении данных препаратов необходим контроль ЭКГ и электролитов крови. При лечении используют инфузионно-корригирующую терапию и диуретики.
Микробиологическая диагностика
Эффективность микробиологической диагностики, абсолютно необходимой для рационального подбора антимикробной терапии, зависит от соблюдения правил забора, транспортировки и хранения исследуемого материала. Правила забора биологического материала включают:
- взятие материала из области, максимально приближенной к очагу инфекции,
- предотвращение контаминации другой микрофлорой.
Транспортировка материала должна с одной стороны обеспечить жизнеспособность бактерий, а с другой - предотвратить их размножение. Желательно, чтобы материал хранился до начала исследования при комнатной температуре и не более 2 часов. В настоящее время для забора и транспортировки материала используются специальные плотно закрывающиеся стерильные контейнеры и транспортные среды.
В не меньшей степени эффективность микробиологической диагностики зависит от грамотной интерпретации результатов. Считается, что выделение патогенных микроорганизмов даже в малых количествах всегда позволяет отнести их к истинным возбудителям заболевания. Условно патогенный микроорганизм считают возбудителем, если он выделяется из стерильных в норме сред организма или в большом количестве из сред, не характерных для его обитания. В противном случае он является представителем нормальной аутофлоры либо контаминирует исследуемый материал в процессе забора или исследования. Выделение малопатогенных бактерий из нехарактерных для их обитания областей в умеренных количествах свидетельствует о транслокации микроорганизмов, однако не позволяет отнести их к истинным возбудителям заболевания.
Гораздо сложнее бывает интерпретировать результаты микробиологического исследования при высевании нескольких видов микроорганизмов. В таких случаях ориентируются на количественное соотношение потенциальных возбудителей. Чаще значимыми в этиологии данного заболевания бывают 1-2 из них. Следует иметь в виду, что вероятность равной этиологической значимости более чем 3 различных видов микроорганизмов незначительна.
В основе лабораторных тестов на выработку грамотрицательными микроорганизмами БЛРС лежит чувствительность БЛРС к ингибиторам бета-лактамаз, таким как клавулановая кислота, сульбактам и тазобактам. При этом, если микроорганизм семейства энтеробактерий оказывается резистентен к цефалоспоринам 3 поколения, а при добавлении к этим препаратам ингибиторов бета-лактамаз демонстрирует чувствительность, то данный штамм идентифицируется как БЛРС-продуцирующий.
Антибиотикотерапия должна быть направлена только на истинный возбудитель инфекции! Однако в большинстве стационаров микробиологические лаборатории не могут установить этиологию инфекции и чувствительность возбудителей к антимикробным препаратам в день поступления больного, поэтому неизбежным является первичное эмпирическое назначение антибиотиков. При этом учитываются особенности этиологии инфекций различных локализаций, характерные для данного лечебного учреждения. В связи с чем необходимы регулярные микробиологические исследования структуры инфекционных заболеваний и чувствительности их возбудителей к антибактериальным препаратам в каждом стационаре. Анализ результатов такого микробиологического мониторинга необходимо проводить ежемесячно.
Лекарства для лечения вирусных инфекций
Вирусы состоят в основном из генетического материала (нуклеиновой кислоты) и защитной оболочки, образованной белками, которая часто покрыта фосфолипидным бислоем со встроенными белками. У них отсутствует метаболическая система, а рост и репликация зависят от инфицированной клетки.
Целенаправленная терапевтическая супрессия репликации вируса достигается за счет ингибирования метаболических процессов, которые являются специфическими для вирусной репликации в инфицированных клетках.
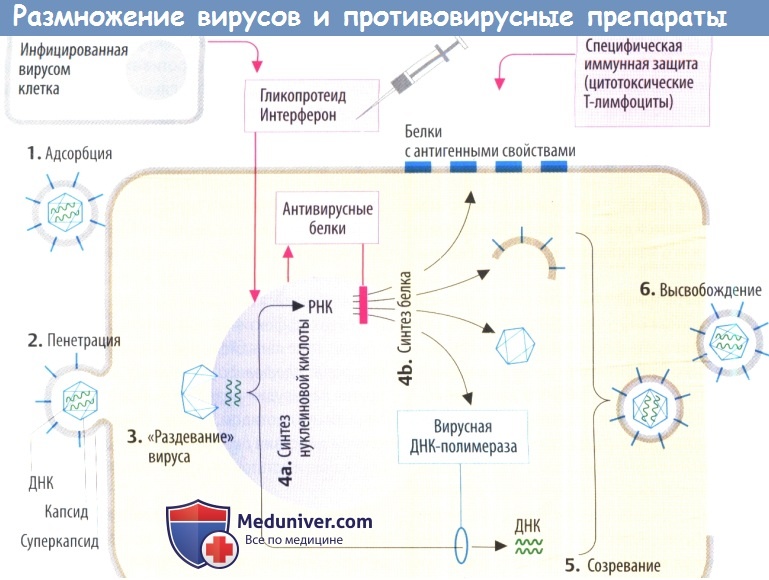
II. Противовирусные механизмы. Организм нарушает репликацию вируса с помощью цитотоксических Т-лимфоцитов, которые распознают и разрушают вируспродуцирующие клетки (на их поверхности находятся вирусные белки) или с помощью антител, которые связывают и инактивируют внеклеточные вирусные частицы. Вакцинация разработана с целью запуска специфической иммунной защиты.
а) Интерфероны (IFN) — гликопротеиды, которые в отличие от других препаратов высвобождаются из инфицированных вирусом клеток. В соседних клетках интерферон стимулирует образование антивирусных белков. Они ингибируют синтез вирусных белков за счет (предпочтительного) разрушения вирусной ДНК или ингибирования трансляции. Интерфероны не направлены против конкретного вируса, а имеют широкий спектр антивирусной активности, который, тем не менее, является видоспецифическим.
Следовательно, интерферон для использования у человека необходимо получать из его клеток, а именно лейкоцитов (IFN-a), фибробластов (IFN-β; или лимфоцитов (IFN-y). Интерфероны используются при лечении определенных вирусных заболеваний, а также злокачественных новообразований и аутоиммунных расстройств. Например, IFN-a применяется при хроническом гепатите С, волосатоклеточном лейкозе и рассеянном склерозе.
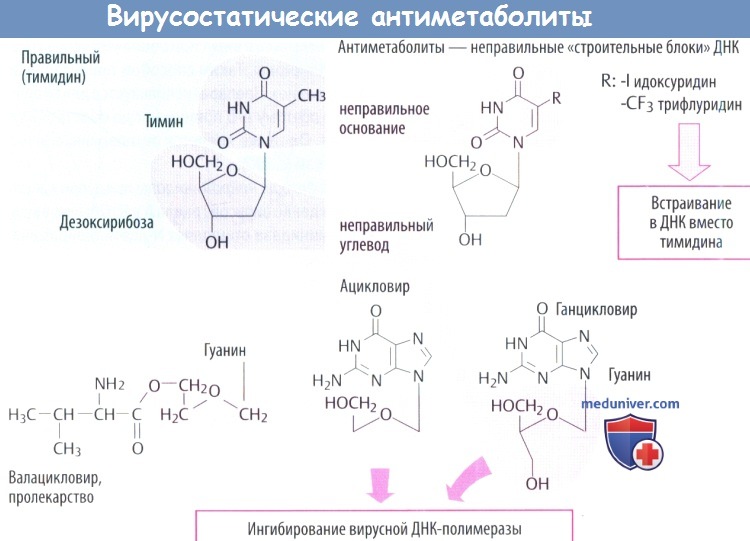
в) Идоксуридин и синергисты встраиваются в ДНК с отрицательными последствиями, в т. ч. нарушением синтеза ДНК человека. Поэтому идоксуридин и аналоги подходят только для местного использования (при простом герпетическом кератите).
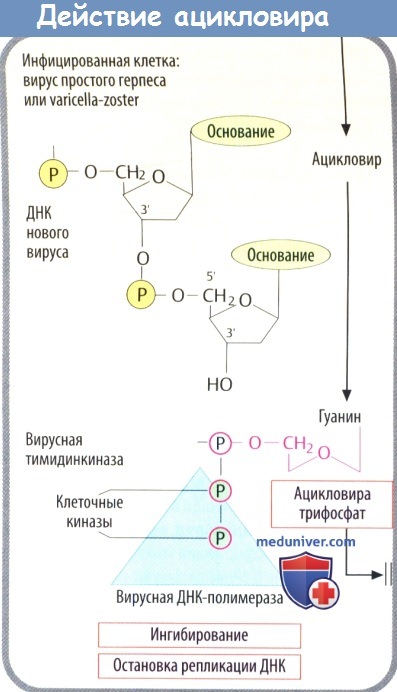
г) Среди вирусостатических антиметаболитов ацикловир имеет высокую специфичность, т. к. его биоактивация происходит только в инфицированных клетках, где он предпочтительно ингибирует синтез вирусной ДНК.
1. Кодируемая вирусом тимидинкиназа (специфичная для вирусов простого герпеса и ветряной оспы) осуществляет первый этап фосфорилирования. Два других фосфатных остатка присоединяются клеточной киназой.
2. Полярные фосфатные остатки делают мембрану непроницаемой для ацикловира трифосфата, что приводит к его накоплению в инфицированных клетках.
3. Ацикловира трифосфат является предпочтительным субстратом вирусной ДНК-полимеразы. Он ингибирует активность ферментов, а после встраивания в вирусную ДНК вызывает расщепление нити, т. к. у него отсутствует З'-ОН-группа дезоксирибозы, которая необходима для присоединения дополнительных нуклеотидов. При тяжелых инфекциях, вызванных вирусом простого герпеса (энцефалит, генерализованная инфекция) и вирусом ветряной оспы (тяжелый опоясывающий лишай), его вводят в виде в/в инфузии.
Ацикловир также применяют внутрь, несмотря на неполное (15-30%) кишечное всасывание. Кроме того, он используется местно.
г) У валацикловира гидроксильная группа этерифицирована с аминокислотой L-валином. Это позволяет использовать дипептидный переносчик тонкой кишки, что почти удваивает скорость кишечного всасывания препарата по сравнению с ацикловиром. В дальнейшем при отщеплении остатка валина образуется ацикловир.
д) Ганцикловир используется при лечении тяжелых цитомегаловирусных инфекций (тоже принадлежащих к группе герпеса). Они не образуют тимидинкиназу, поэтому фосфорилирование начинается другим вирусным ферментом. Ганцикловир хуже переносится, нередко приводит к развитию лейкопении и тромбопении. Он вводится в виде инфузии или внутрь как эфир валина (валганцикловир).
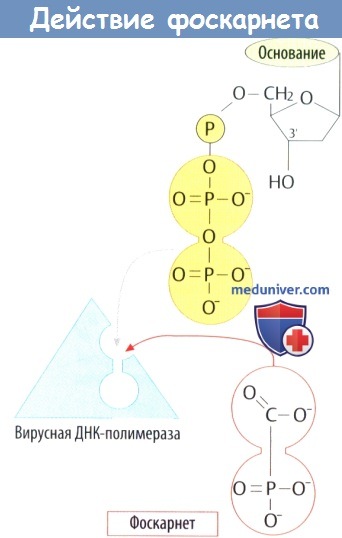
е) Фоскарнет представляет собой аналог дифосфата. Встраивание нуклеотида в нить ДНК приводит к отщеплению дифосфатного остатка. Фоскарнет ингибирует ДНК-полимеразу за счет взаимодействия со связывающим участком. Показания: системная терапия тяжелых цитомегаловирусных инфекций у больных СПИДом; местное лечение герпесвирусных инфекций.
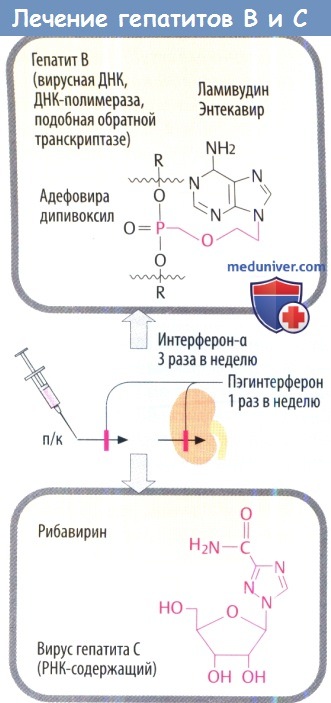
ж) Препараты для лечения вирусных гепатитов. Интерферон-а действует против вирусов гепатитов В и С (HBV, HCV) во время репликации. Присоединение молекулы полиэтиленгликоля к IFN-a (пегилирование) позволяет пегилированному IFN-a медленнее высвобождаться из места инъекции и выводиться почками, что увеличивает продолжительность действия пегилированного препарата.
Вирусостатические антиметаболиты необходимо рассматривать индивидуально в зависимости от возбудителя. Гепатит В: ламивудин, первоначально использовавшийся только как анти-ВИЧ препарат, в низких дозах эффективен против HBV. Телбивудин и энтекавир тоже являются производными нуклеозидов. Фосфонат адефовира дипивоксил, который активен против ламивудин-резистентного HBV, является атипичным нуклеотидом. Гепатит С: молекулярный механизм действия рибавирина, в котором изменены основание и остаток сахара (D-рибоза), неясен.
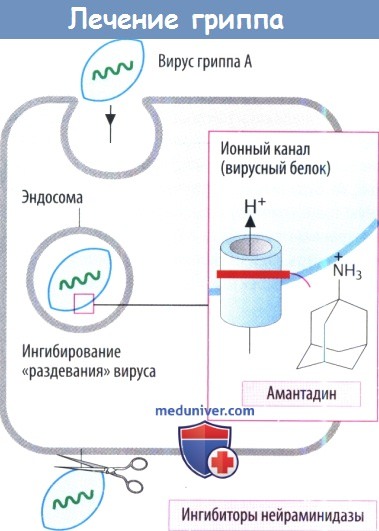
Препарат используется для профилактики, и поэтому его принимают до обострения симптомов. Он также является антипаркинсоническим средством.
Ингибиторы нейраминидазы предупреждают высвобождение вирусов гриппа А и В. Обычно вирусная нейраминидаза отщепляет N-ацетилнейраминовые (сиаловые) кислотные остатки на поверхности клеточной оболочки, что дает возможность вновь образованным вирусным частицам отделиться от клетки хозяина. Занамивир вводится в виде ингаляции. Оселтамивир подходит для применения внутрь, т. к. представляет собой сложный эфир пролекарства. Он используется при лечении и профилактики инфекций, вызванных гриппом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Возбудители нозокомиальных инфекций (НКИ). Причины послеоперационной раневой инфекции
Послеоперационные раневые инфекции (РИ) могут быть обусловлены широким спектром микроорганизмов, включая аэробные, факультативно-анаэробные и строго анаэробные бактерии, а также микобактерии и грибы. Для клинициста и клинического микробиолога важно получить информацию о точной идентификации микроорганизма, поскольку определенный вид микроба часто связан и с конкретным инфекционным осложнением, с типом послеоперационной раны. Микроскопия присланного в лабораторию биоматериала есть первое и обязательное условие грамотно организованной работы лаборатории.
Благодаря микроскопии можно не только решить, целесообразно ли делать посев присланного материала, по и во многих случаях дать предварительный результат (палочки, кокки, грибы, смешанная микрофлора или отсутствие микроорганизмов), а также рационально выполнить дальнейшие этапы микробиологического исследования. Результаты микроскопии следует всегда связывать с данными культуралыюго метода (посев на искусственные питательные среды, получение чистой культуры микроорганизма и точной идентификации).
Диагноз анаэробной инфекции, как правило, на первом этапе ставят по клиническим проявлениям. Что касается определения токсина С. difficile, результат может быть неспецифичеп, но тест весьма подходит как скрининг. При инфекции, обусловленной С. tetani (столбняк), микроскопия и посев часто дают отрицательные результаты (> 50%). При актиномикозе и нокардиозе очень важна предварительная микроскопия, поскольку в этих случаях (обнаружение морфологически сходных микроорганизмов) необходимо использовать специальные среды и длительную инкубацию, причем в случае актиномикоза инкубация посевов требует анаэробной атмосферы.
Структура лидирующих возбудителей в том или ином стационаре зависит от его профиля, принятых методов диагностики и лечения основного заболевания, применяемых схем антимикробной профилактики и терапии послеоперационных осложнений, а также от качества инфекционного контроля в клинике. Согласно кооперированным зарубежным данным, спектр возбудителей в клиниках Северной Америки, Европы, Азии, Австралии и даже Африки в основном сходный.
Наши данные по составу возбудителей также не отличаются от данных крупных международных исследований. Но частота их выделения, состав лидирующих возбудителей зависят от различных факторов, в т. ч. от профиля конкретного лечебного учреждения. Все связанные с НКИ проблемы наиболее ярко представлены в отделениях реанимации. При сравнении собственных результатов н данных Системы государственного надзора за нозокомнальными инфекциями США (NNIS) за 2003 г. очевидны значительные различия в частоте выделения всех основных возбудителей послеоперационных РИ, кроме E. coli и Enterococcus spp..
Частота выделения основных возбудителей нозокомиальных инфекций (НКИ) различна. Так, S.aureus, лидирующий в клиниках США, в РОНЦ выделяется более чем в 4 раза реже, остальные возбудители, напротив, чаще. Различия обусловлены многими факторами, в т. ч. и различным уровнем инфекционного контроля, отличной политикой антибиотикопрофилактики и антибиотикотерапии.
S. aureus занимает 1-е место в структуре возбудителей послеоперационных инфекционных осложнений в 50% рассматриваемых Н.В. Дмитриевой отделений РОНЦ, особенно в отделениях опухолей молочной железы (32,6%) и нейрохирургии (25,9%).
Е. coli лидирует как возбудитель в сравнении с S. aureus только в пяти отделениях: проктологии (22,7%), гинекологии (21,4%), рентген-хирургических методов диагностики и лечения (15,5%), отделениях радиохирургии (14,1%) и абдоминальной хирургии (11,9%). Значительную роль как возбудитель инфекций Е. coli играет в таких отделениях, как отделение опухолей женской репродуктивной системы (13,8%), урология (12,5%), диагностическое (10,8%), опухолей печени и поджелудочной железы (10,7%), опухолей верхних дыхательных и пищеварительных путей (8,7%).
Доля P. aeruginosa в отделениях реанимации в целом составила 18,5% (426 или 2297), что достоверно выше частоты инфекций, обусловленных Candida spp. (12,0%, 276 из 2297), A. baumannii (10,8%, 249 из 2297), К. pneumoniae (9,2%, 212 из 2297) и E.faecium (9,1 %, 210 из 2297), значение которых в данных отделениях также высоко. Следует отметить, что в ОРИТ № 1 (основное отделение реанимации для пациентов после хирургических операций) P. aeruginosa имеет первостепенное значение и составляет 19,6% (384 из 1958 штаммов), на 2-м месте A. baumannii (12,4%, 243 из 1958), затем идет Candida spp. (11,4%, 223 из 1958). В то же время в ОРИТ № 4 (отделение кардиореанимации) на 1-м месте стоит Candida spp. (15,6%, 53 из 339 штаммов), а уже затем P. aeruginosa (12,4%, 42 из 339). В обоих отделениях реанимации значение стафилококков как возбудителей инфекционных осложнений невелико.
Помимо отделений реанимации P. aeruginosa имеет либо основное, либо весьма существенное значение для всех остальных отделений. Так, в отделениях торакоабдоминальной хирургии и опухолей верхних дыхательных и пищеварительных путей это лидирующий возбудитель (14,5 и 16,3% соответственно). Отделения проктологии, урологии, нейрохирургии, радиохирургии, рентген-хирургических методов диагностики и лечения, опухолей головы и шеи, опухолей молочной железы также имеют значительную долю инфекций, обусловленных синегнойной палочкой.
A. baumannii занимает 1-е место (12,4%) в структуре возбудителей НКИ в отделении опухолей печени и поджелудочной железы, но статистически значимых различий по сравнению с Е. coli не наблюдается (10,7%). Частота выделения P. aeruginosa, К. pneumoniae, Е. faecalis и E.faecium ниже и примерно одинакова (около 8% для каждого возбудителя). Кроме отделения опухолей печени и поджелудочной железы A. baumannii составляет также значительную долю (12,5%) возбудителей в отделении опухолей головы и шеи после P. aeruginosa (13,2%) и лидирующего в этом отделении S. aureus (18,8%), хотя статистически значимой разницы в частоте их выявления в данном отделении не наблюдается.
Candida spp. — лидирующий возбудитель в ОРИТ № 4 (15,6%), а в четырех других отделениях стоит на 2-м месте по частоте выделения: ОРИТ № 1 (11,4%), торакоабдоми-нальной хирургии (11,2%), абдоминальной хирургии (10,7%) и опухолей верхних дыхательных и пищеварительных путей (8,7%).
E. faecalis занимает 1-е место в структуре возбудителей послеоперационных инспекционных осложнений только одного отделения — урологического (15%), на 2-м месте в этом отделении Е. coli (12,5%) и P. aeruginosa (11,8%), хотя статистически значимых различий в частоте их выделения не отмечается.
Группа коагулазонегативных стафилококков (КГС) в основном представлена двумя клинически значимыми видами: S. epidermidis и S. haemolyticus. В отделении реконструктивной и сосудистой хирургии S. epidermidis (19,5%) наравне с S. aureus (19,1 %) — наиболее значимые возбудители, статистически значимо реже встречается E.faecalis (11,4%). В трех отделениях S. epidermidis занимает 2-е место после 5. aureus: отделение опухолей молочной железы (23,9%), отделение опухолей женской репродуктивной системы (18,2%) и отделение общей онкологии (14,1 %).
К. pneumoniae составляет в целом по клинике 7,4%. Только в одном отделении (нейрохирургия) этот вид энтеробактерий имеет существенное значением занимает 2-е место, составляя 16,7%.
S. maltophilia, несмотря на то что нечасто выделяется из биоматериалов пациентов хирургических отделений и составляет только 3,7%, имеет большое значение как возбудитель НКИ. С каждым годом доля этого вида грамотрицательных неферментирующих палочек в общей структуре возбудителей растет во всех странах. Кроме того, при инфекции, обусловленной S. maltophilia, весьма ограничен выбор антимикробных препаратов (триметоприм/сульфаметоксазол [Бисептол] и тикарпиллип/клавулаповая кислота [Тиментин]).
Таким образом, несмотря на то что в целом по клинике лидирующим возбудителем следует считать P. aeruginosa, отделения отличаются но спектру возбудителей и микроорганизмам, имеющих основное значение. Принципиально важно понимать, что эмпирическая антимикробная терапия должна быть конкретизирована и адаптирована к условиям определенного стационара. Следует отметить, что применение антибиотика с уровнем резистентности 10-20% является достоверно высоким, поэтому рекомендуется избегать их назначения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Известно, что отделения реанимации и интенсивной терапии характеризуются чрезвычайно высоким риском возникновения внутрибольничных инфекций (ВБИ), которые являются одной из самых актуальных проблем в современной медицине.

Основными причинами высокой заболеваемости ВБИ в отделениях реанимации являются следующие:
- Высокая восприимчивость пациентов. Пациентами отделений реанимации являются люди, ослабленные основным заболеванием, тяжесть которого делает невозможным жизнь пациента без применения искусственной вентиляции легких, парентерального питания и пр. Применение антибиотиков широкого спектра, которое в большинстве случаев начинается сразу после поступления больного в отделение, повышает риск колонизации пациентов антибиотикорезистентными штаммами микроорганизмов.
- Высокая концентрация медицинского персонала и тесный контакт медицинских работников с пациентами. Пациенты здесь нуждаются в более интенсивном и квалифицированном уходе, чем пациенты других отделений, что определяет интенсивность контактов.
- Высокая частота использования инвазивных лечебно-диагностических манипуляций и процедур. Для лечения и диагностики в отделениях реанимации используются методы, являющиеся факторами риска возникновения госпитальных инфекций. Искусственная вентиляция легких, частая санация трахеобронхиального дерева предопределяют возможность колонизации дыхательных путей условно-патогенными микроорганизмами с последующим развитием поствентиляционных трахеобронхитов и пневмоний, которые являются ведущей формой госпитальных инфекций в отделениях реанимации. С массивной инфузионной терапией и длительной катетеризацией центральных вен и артерий часто связано возникновение бактериемий. С частой и длительной катетеризацией мочевого пузыря связано возникновение мочевой инфекции.
В нашем отделении предусмотрена возможность непрерывного наблюдения за каждым больным с поста медицинской сестры, свободного доступа к койке каждого больного со всех сторон, возможность проведения тщательной уборки и дезинфекции.
В отделениях интенсивной терапии и реанимации используется компактное, удобное в обращении и отвечающее повышенным требованиям гигиены, современное оборудование. Мебель изготовлена из материалов, легко поддающихся дезинфекции. Для стен и пола используются легко моющиеся покрытия из специальных облицовочных материалов.
Отделения реанимации, при необходимости, может быть разделено на 2 сектора — для больных с уже имеющейся инфекцией и для “чистых” больных.
Предусмотрена возможность проведения изоляционно-ограничительных мероприятий в отношении пациентов с манифестной формой ВБИ, а также пациентов — носителей эпидемически опасных штаммов, которые наиболее часто вызывают вспышки ВБИ в отделениях реанимации, а также антибиотикорезистентных штаммов любых условно-патогенных микроорганизмов.
Помимо внутрибольничных инфекций, вызванных возбудителями, которые были переданы пациентам в стационаре (экзогенные инфекции), существует большая группа так называемых эндогенных инфекций, т.е. инфекций, вызванных собственной флорой пациента (условно-патогенными микроорганизмами, вегетирующими на кожных покровах и слизистых и в пищеварительном тракте) или микроорганизмами, колонизирующими пациента. Чем тяжелее состояние больного, тем больше микроорганизмов поселяется на кожных покровах и слизистых. В связи с этим тщательный уход за тяжелыми больными реанимационных отделений имеет чрезвычайно важное значение.
Уход за кожей. Наружные покровы служат средой обитания множества микроорганизмов, которые в обычных условиях из-за мощных барьерных функций кожи редко вызывают патологию. Опасность постоянных обитателей кожи проявляется при нарушении целостности кожных покровов, а также при трофических изменениях кожи, наблюдающихся у тяжелых больных. В связи с этим, каждому тяжелому больному ежедневно проводится обтирание тела теплой водой, в которую добавляют спирт, уксус. Под больного подкладывают клеенку или специальную гигиеническую подкладную. Больным с непроизвольным мочеиспусканием и дефекацией обтирание производят после каждого загрязнения кожи. Несвоевременная смена постельного белья приводит к образованию пролежней, их инфицированию и таким образом способствует присоединению еще более серьезных госпитальных инфекций, утяжеляющих состояние больных; для профилактики возникновения опрелостей тело обрабатывается 3% камфарным спиртом или 3% уксусной кислотой.
Уход за полостью рта, промывание глаз. Эти меры являются средством профилактики стоматитов, гнойных конъюнктивитов, паротитов. Глаза промываются теплым раствором фурациллина; в порядке профилактики используют раствор альбуцида.
Для лечения пациентов отделений реанимации и интенсивной терапии требуется массивная инфузионная терапия, при которой незаменимы внутрисосудистые катетеры. Они используются для внутривенного введения жидкостей, лекарственных средств, производных крови, парентеральных питательных растворов, а также для наблюдения за состоянием гемодинамики у больных в критическом состоянии. Однако, использование внутрисосудистых катетеров часто осложняется развитием местных или системных инфекций, включая септические тромбофлебиты, эндокардиты, инфекции крови, метастатические инфекции, развивающиеся в результате переноса инфекции гематогенным путем от места установки катетера к другим участкам тела и местные воспалительные изменения (нагноения в месте катетера). Инфекции, связанные с катетеризацией, в особенности, инфекции кровотока, повышают заболеваемость и смертность на 10-20%, удлиняют сроки госпитализации (в среднем на 7 дней) и увеличивают затраты на лечение.
При инфекциях, связанных с катетеризацией, наиболее частыми возбудителями являются коагулазонегативные стафилококки, в основном, Staphylococcus epidermidis, St. aureus, грибы рода Candida, а также грамотрицательные микроорганизмы, такие как Enterobacter, Acinetobakter, Serratia marcescens.
Факторы риска развития сепсиса, связанного с катетерами, могут быть обусловлены следующими обстоятельствами:
1. Материал, из которого изготовлен катетер: предпочтительным материалом является полиуретан.
2. Размер катетера: центральные катетеры с тремя отверстиями несут больший риск, по сравнению с одинарными.
3. Использование сосудов нижних конечностей опаснее из-за повышенного риска инфекции.
4. Техника введения катетеров: постановка катетеров должна проводиться в асептических условиях. Нарушение техники асептики при постановке катетера — неадекватная обработка рук, использование нестерильных перчаток, неправильная обработка кожи больного в месте катетеризации и др. — приводит к возникновению гнойных осложнений.
5. Длительность нахождения катетера в месте введения: чем дольше катетер находится в сосуде, тем вероятнее развитие инфузионных флебитов и других осложнений.
6. Состав вводимых жидкостей.
7. Частота смены перевязочного материала.
8. Опыт персонала, устанавливавшего катетер.
9. Подготовка кожи.
10. Индивидуальные особенности больного.
Факторы заражения внутрисосудистых устройств:
- руки медицинского персонала,
- микрофлора кожи больного,
- инфицирование поршня,
- обсеменение при введении катетера,
- обсеменение жидкостей.
Основным средством профилактики осложнений, связанных с катетеризацией, является ограничение использования внутрисосудистых катетеров: установку катетера следует назначать только в случае необходимости.
Показаниями для катетеризации центральных вен являются:
- отсутствие выраженных периферических вен;
- необходимость массивной инфузионной терапии;
- измерение центрально-венозного давления;
- проведение гемодиализа, гемосорбции, плазмофереза;
- внутрисердечное введение электродов.
Правила работы с подключичными катетерами.
- Соблюдение асептики при постановке катетера. Барьерные меры предосторожности (стерильный халат, перчатки, индивидуальный стерильный набор для подключичного катетера);
- Адекватная обработка кожи в месте установки катетера, использование кожных антисептиков (раствор АХД-2000, 70% спирт, иодонат);
- Ограничение манипуляций с катетером;
- Ежедневная смена лейкопластырной наклейки по специальному образцу;
- Ежедневная обработка кожи вокруг катетера 70% раствором спирта, водными или спиртовыми растворами хлоргексидина. Перед началом работы с катетером и по ее окончании производится промывание его просвета физиологическим раствором с гепарином; в катетере не должно быть крови. Раствор — гепариновый замок лучше вводить через прокол резиновой заглушки тонкой иглой. Катетер не должен перегибаться и скручиваться. Смена катетера производится 1 раз в 10 дней при отсутствии инфекции крови;
- При появлении признаков воспаления или инфекции крови катетер должен быть удален. При удалении катетера место пункции прижать шариком со спиртом и удерживать 10 минут, затем накладывается асептическая повязка. При замене катетера — смена места катетеризации.
- Обязательное микробиологическое исследование отделяемого из места воспаления;
- При отсутствии центральных венозных катетеров вливание растворов в периферические вены не должно производиться более 12 часов в связи с возможным развитием флебитов.
Особое внимание уделяется инфузионным растворам, при этом стерильные растворы должны быть фабричного изготовления или изготовлены в аптеке с соблюдением правил асептики. Для вскрытия флаконов с жидкостями необходимо использовать стерильный инструментарий. Флаконы с растворами используются строго индивидуально на каждое вливание, расфасовка растворов в аптеках больниц должна соответствовать количеству переливаемого раствора. Срок стерильности растворов, завальцованных в больничных аптеках, не более 30 дней.

Коронавирусная инфекция наиболее часто передается воздушно-капельным путем. Ее опасность заключается в том, что она поражает нижние дыхательные пути и провоцирует развитие вирусной пневмонии. Лечение COVID-19 предусматривает применение противовирусных препаратов и антибиотиков. Дополнительно в комплексном лечении используются при необходимости обезболивающие и жаропонижающие средства, а также сорбенты.
Антибиотики при инфекционных заболеваниях, в том числе и после заражения коронавирусом назначают при среднетяжелой и тяжелой форме заболевания. Лекарственные препараты препятствуют размножению патогенной микрофлоры.
Принципы выбора противомикробных препаратов
Самолечение с использованием антибиотиков категорически запрещено, так как неконтролируемый прием сильнодействующих средств может ослабить организм и ухудшить защитные реакции организма. Препараты подбирает исключительно врач, учитывая форму болезни и состояние пациента.
Показаниями для назначения антибиотиков с целью лечения инфекционных заболеваний является следующее:
Развитие в респираторном тракте бактериальной микрофлоры. На это указывает мокрота с зеленым или желтым оттенком, которая отходит вместе с кашлем.
Сохранение температуры тела выше 38,5°С более 4 дней.
Сильная слабость и появление выраженной усталости при минимальных нагрузках.
Наличие в кале гнойной слизи.
Перед тем, как будут назначены антибиотики определенного вида, обязательно должен быть проведен бактериологический посев. Для этого берут мазок из носоглотки и трахеи, а также слизь из кала. Образцы помещают в питательную среду с целью определения вида микроорганизма. После этого подбирают группу антибиотиков, которые уничтожают определенные бактерии.
Чтобы выбранный антибиотик не спровоцировал ухудшение общего состояния, проводят следующие общие анализы:
Крови. В процессе теста определяют количество основных компонентов. При применении противомикробных лекарств может произойти снижение их уровня, поэтому важно исключить вероятность критических показателей.
Мочи. Тестирование позволяет определить состояние мочевыделительной системы и предотвратить возможные воспалительные процессы вследствие повышенных нагрузок на органы при выведении антибиотика из организма.
Биохимический анализ крови для исключения обострений имеющихся патологий при применении сильнодействующих противомикробных препаратов.
КТ грудной клетки для оценки степени поражения легочной ткани и выбора дозировки антибиотика.
Эффективные антибиотики широкого спектра действия
Современные противомикробные препараты относятся к сильнодействующим эффективным средствам.Они отличаются широким спектром действия в отношении различных видов патогенных микроорганизмов. Если инфекционное заболевание проходит в тяжелой форме, то часто нет времени на проведение бактериологического посева, в частности, это касается и коронавируса. Поэтому доктор может принять решение о приеме антибиотиков на основании имеющихся показаний.
Цефтриаксон
Это медикаментозное средство является антибиотиком 3-го поколения. Препарат характеризуется сильным воздействием на патогенные микроорганизмы. При его приеме действующее вещество быстро распространяется по системному кровотоку, что позволяет уничтожить все бактерии. Это минимизирует риски развития хронических заболеваний.
Поскольку действующее вещество может проникать через плаценту, то при беременности лечение им не проводят. Также противопоказанием является индивидуальная непереносимость действующего вещества. Средство отличается минимальным количеством побочных эффектов. Основные из них:
Амоксиклав
Эффективность комплексного препарата гарантируется содержанием в составе двух активных веществ:
Амоксициллина, который борется с вирусной инфекцией.
Клавулановой кислоты, подавляющей синтез бактерий.
Антибиотик часто назначают для лечения бронхитов и пневмонии. При проникновении инфекции в кровоток лекарственное средство позволяет предотвратить сепсис. Побочные эффекты наблюдаются только при нарушении дозировки, это могут быть:
Воспалительные процессы в почках.
Противопоказаниями является индивидуальная непереносимость активных веществ. Также лекарственное средство не назначают при инфекционном мононуклеозе и фенилкетонурии. При беременности и лактации проводить лечение антибиотиком допустимо, но с осторожностью: для контроля понадобится более часто проводить анализ крови и мочи .
Флуимуцил
Этот антибиотик используется для инъекций или ингаляций. Действующее вещество препарата - триамфеникол. Уникальное средство оказывает муколитическое, отхаркивающее, бактерицидное и бактериостатическое воздействие.
При инфекционных заболеваниях, протекающих в среднетяжелой форме, назначают ингаляции. В этом случае активное вещество попадает в кровь в малых количествах, что позволяет снизить риски возникновения побочных реакций. Раствор готовят с одной вскрытой упаковки. Его нужно использовать в течение 2-3 часов.
Побочные эффекты проявляются:
Противомикробные препараты при лечении инфекционных заболеваний назначают в комплексе с другими медикаментозными средствами. Для того чтобы было принято решение о включении антибиотиков в схему лечения должны иметься подтверждения возникновения осложнений и отягощения бактериальной инфекцией. Чтобы подтвердить диагноз желательно провести бактериологический посев, если это позволяет ситуация.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Читайте также:

