Место в структуре инфекционной заболеваемости
Обновлено: 12.05.2024
Методика изучения инфекционной заболеваемости.
В РФ действует строгая система контроля за инфекционной заболеваемостью. Специальный обязательный учет инфекционных заболеваний связан с необходимостью проведения текущих и предупредительных противоэпидемических мероприятий.
Информация о каждом случае обнаружения инфекционного заболевания должна быть представлена в районные или городские центры санэпиднадзора (ЦСЭН). Все инфекционные заболевания в зависимости от способа оповещения о них можно разделить на четыре группы, для каждой из которых существует своя система сбора информации и обработки данных.
1. Карантинные заболевания – особо опасные инфекции (чума, холера, натуральная оспа, желтая лихорадка, возвратный тиф) характеризуются высокой контагиозностью и высокой летальностью, к которым применяют международные карантинные ограничения в соответствии с международными медико-санитарными правилами.
При выявлении карантинных заболеваний или подозрении на них незамедлительно информируются не только руководители санитарно-эпидемиологической службы, но и органы управления здравоохранением вплоть до Министерства здравоохранения РФ. В случае выявления карантинных заболеваний применяются меры экстренного характера, включая создание чрезвычайных противоэпидемических комиссий (ЧПК).
3. Заболевания, о каждом случае которых сообщается в центр санэпиднадзора с приведением детальных сведений: брюшной тиф, паратифы, дизентерия, энтериты, туляремия, сибирская язва, бруцеллез, дифтерия, корь, коклюш, эпидемический паротит, ветряная оспа, краснуха, менингиты, энцефалиты, инфекционный гепатит, скарлатина, столбняк, полиомиелит, бешенство, риккетсиозы (включая сыпной тиф), малярия, лептоспироз, сепсис у детей первого года жизни, геморрагическая лихорадка и орнитоз.
При анализе инфекционной заболеваемости вычисляются следующие показатели.
Общий показатель инфекционной заболеваемости:
Число инфекционных заболеваний, выявленных за год х 1000 (10 000, 100 000) / среднегодовая численность населения.
Возрастно-половые показатели инфекционной заболеваемости:
Число инфекционных заболеваний, выявленных за год у лиц данного пола и возраста х 1000 (10 000, 100 000) / среднегодовая численность населения этого пола и возраста.
Показатель инфекционной заболеваемости по диагнозам:
Число заболеваний с данным диагнозом, выявленных за год х 1000 (10 000, 100 000) / среднегодовая численность населения.
Структура инфекционной заболеваемости (экстенсивный показатель):
Число заболеваний с данным диагнозом, выявленных за год х 100% / общее число инфекционных заболеваний.
Удельный вес (доля) инфекционной заболеваемости в общей заболеваемости:
Число инфекционных заболеваний, выявленных за год х 100% / общее число заболеваний.
Очаговость (интенсивный показатель):
Число выявленных инфекционных больных данным заболеванием / число очагов данного заболевания.
Показатель смертности (характеризует тяжесть заболевания):
Число умерших от данного инфекционного заболевания х 1000 (10 000, 100 000) / среднегодовая численность населения.
Показатель летальности (экстенсивный показатель):
Число умерших от данного инфекционного заболевания х 100 / число больных данным заболеванием.
При углубленном изучении инфекционной заболеваемости анализируются сезонность, частота выявленных бактерионосителей, эффективность профилактических прививок и иное, что дает возможность врачам разработать необходимые мероприятия по борьбе с инфекционными заболеваниями.
В структуре инфекционной заболеваемости детей ведущее место занимают респираторные инфекции [1–3]. Известно, что всеобщей закономерностью является повышенная восприимчивость к ним детей раннего и дошкольного возраста [6–8].
В структуре инфекционной заболеваемости детей ведущее место занимают респираторные инфекции [1–3]. Известно, что всеобщей закономерностью является повышенная восприимчивость к ним детей раннего и дошкольного возраста [6–8]. Именно среди детей указанной возрастной группы формируется особо выделяемая категория (15–30%) часто болеющих детей (ЧБД), вопросы лечения и оздоровления которых до сих пор остаются нерешенными и являются трудной задачей для педиатров [5–7]. У 67% ЧБД преимущественно рецидивирующей патологией становятся заболевания ЛОР-органов [9]. Характер воспалительного процесса в ротоглотке во многом зависит от реактивности иммунной системы, факторов местной защиты, в том числе микробиоценоза слизистой ротоглотки. Течение инфекционного процесса в ротоглотке могут обусловить различные микроорганизмы, в том числе и условно-патогенные [4, 6, 8, 10]. Вместе с тем состояние микробиоты ротоглотки изучено еще недостаточно. Отсутствуют однозначные представления о нормобиозе и значимости выделения различных видов микробов.
Нами проведено исследование микрофлоры задней стенки глотки у здоровых детей и больных различной респираторной патологией, госпитализированных в стационар. Обследован 351 ребенок в возрасте от 2 месяцев до 15 лет (в том числе: здоровые дети — 98, острый тонзиллит — 58, ОРВИ — 128, пневмония — 20, инфекционный мононуклеоз с гнойно-воспалительным поражением ротоглотки — 47). Использовалась стандартная методика забора мазков с миндалин и задней стенки глотки с проведением качественно-количественного определения состава выделенных микроорганизмов. Анализ полученных результатов был проведен по трем группам микроорганизмов (постоянные, добавочные, транзиторные), подразделенных в соответствии с частотой и количеством их обнаружения у здоровых детей по методу Воропаевой Е. А. [11]. По данным автора постоянная (облигатная) микрофлора данного биотопа в основном представлена альфа- и гамма-гемолитическими стрептококками (105–106 КОЕ/мл) и нейссериями (102–104 КОЕ/мл). Добавочную группу составляют стафилококки, коринебактерии и гемофилы, выделяемые у 26,9–46,2% здоровых детей, в количестве 101–104 КОЕ/мл. К случайным (транзиторным) микроорганизмам отнесены Bacillus, грибы рода Candida, Micrococcus, синегнойная палочка, грамотрицательные энтеробактерии в количестве не выше 101–102 КОЕ/мл, в 1,9–25,0%. Частота выделения различных видов микробов и интенсивность обсеменения ими задней стенки глотки у различных групп детей приведена в табл. 1.
Сравнительный анализ полученных результатов обнаружил достоверные различия в состоянии микроэкологии задней стенки глотки в группах здоровых детей и пациентов с респираторной патологией (табл. 2).
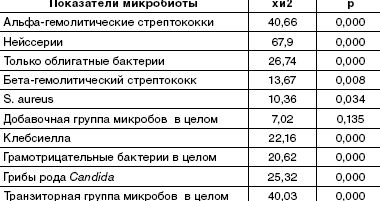
При гнойном или катаральном воспалительном процессе в ротоглотке обнаружено угнетение облигатной ассоциации альфа-гемолитического стрептококка и нейссерий, образующих защитную биопленку. Дисбиоз локуса развивался в 75–100% случаев. Он имел определенные особенности в зависимости от характера инфекционного процесса. Наиболее выраженное угнетение пролиферации облигатных бактерий было обусловлено местным гнойно-воспалительным процессом при ангине и системным поражением при пневмонии (рис. 1).
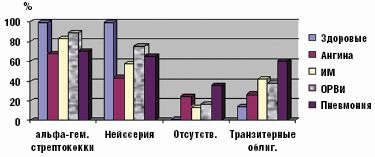
Именно при данной патологии чаще всего отсутствовали облигатные микробы, выделялись монокультуры или ассоциации микроорганизмов, состоящие только из добавочных и/или транзиторных представителей с высокой вероятностью их этиологической значимости, обнаруживались отрицательные посевы (рис. 2). Наиболее устойчивым компонентом облигатной ассоциации был стрептококк, отсутствие нейссерий либо снижение их количества наблюдалось значительно чаще.
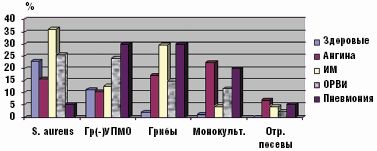
Инициация инфекционного процесса респираторными вирусами способствовала преимущественной пролиферации грамотрицательных бактерий (особенно клебсиеллы) в больших количествах (более 104 КОЕ/мл), а также их ассоциаций (р = 0,000, рис. 2). Синегнойная палочка выделялась только у ЧДБ либо больных пневмонией. Лечение в стационаре способствовало нарастанию частоты обнаружения грамотрицательных микробов в 2–3 раза вне зависимости от этиологии инфекционного процесса. Обнаружение грамотрицательных бактерий у здоровых детей являлось следствием перенесенной ОРВИ (20% против 0, р < 0,001) и сохранялось до двух месяцев. Наиболее часто грамотрицательные бактерии высевались со слизистой ротоглотки у детей первого года жизни (р = 0,002) или часто болеющих (р = 0,004).
Пролиферация грибов рода Candida, особенно в больших количествах (более 102 КОЕ/мл), была характерна для больных инфекционным мононуклеозом, пневмонией, ЧБД — особенно младших возрастных групп (р = 0,000), активировалась на фоне антибактериальной терапии и расценивалась как неблагоприятный фактор, поскольку отсутствовала у здоровых детей из группы эпизодически болеющих.
Наши данные показали, что отсутствие альфа-гемолитических стрептококков и/или нейссерий, обнаружение синегнойной палочки, грибов рода Candida и спорообразующих анаэробов, а также грамотрицательных бактерий нескольких видов или их монокультур является признаком глубокого дисбиоза и требует внимания педиатра. Оценка выраженности дисбиоза ротоглотки у детей, не имеющих признаков острой инфекции на момент обследования, должна проводиться с учетом клинического состояния пациентов их преморбидного состояния и анамнеза. Внимание следует уделять частоте эпизодов ОРВИ в году, срокам и тяжести последнего заболевания, а также наличию хронической патологии ЛОР-органов, поскольку именно наличие этих клинических признаков коррелировало с глубиной дисбиотических нарушений в ротоглотке.
Рассматривая состав микрофлоры слизистой оболочки задней стенки глотки как индикатор инфекционной резистентности детей, мы включали в состав комплексного лечения и реабилитации пациентов иммунотропные средства.
В качестве одного из современных иммуномодуляторов использован препарат Кипферон® суппозитории для вагинального или ректального введения. Кроме того, в терапевтический комплекс включались пробиотики: Полибактерин, Кипацид и Флорин форте.
Кипферон® представляет собой композицию из комплексного иммуноглобулинового препарата (КИП) с высоким содержанием специфических IgG, IgA и IgM и рекомбинантного человеческого интерферона альфа-2b. Содержащийся в препарате рекомбинантный человеческий интерферон альфа-2b обуславливает активацию местного иммунитета, позволяет эффективно устранять очаги воспаления, а КИП — уменьшает количество условно-патогенных микроорганизмов и устойчиво восстанавливает нормальную микрофлору, как минимум на протяжении 2–3 месяцев. У детей с ОРВИ, получавших Кипферон®, после лечения в 3 раза снизилась частота высева S. aureus (от 33,3% до 10%, p < 0,05). Не отмечено угнетение облигатных микроорганизмов. В 2 раза реже регистрировалась транзиторная микрофлора. В группе сравнения, в динамике лечения, возросло число несвойственных для данного биотопа микроорганизмов, в том числе выявлялись ранее отсутствовавшие гемолизирующая кишечная палочка и грибы рода Candida.
У больных тонзиллитом после лечения в 6 раз уменьшилась частота высева S. aureus (от 20% до 3,3%, p < 0,05), реже (6,6% против 24,2%, p < 0,05), чем в контроле, обнаруживались грамотрицательные энтеробактерии.
У больных инфекционным мононуклеозом лечение Кипфероном® способствовало улучшению микробиологических показателей, в том числе снижению числа детей с высоким уровнем (3–6) микробных ассоциантов на слизистой ротоглотки, элиминации S. aureus (от 53,3% до 23,1%), грибов рода Candida, бета-гемолитического стрептококка группы А (от 20% до 0%, p < 0,05).
Микробиологический эффект пробиотиков способствовал высеву исключительно облигатных микробов, отсутствию ассоциаций двух и более транзиторных микробов за счет элиминации микробов добавочной группы, энтеробактерий, синегнойной палочки и грибов рода Candida.
Таким образом, вышеизложенное позволяет считать целесообразным пересмотр значимости выделения отдельных видов микробов со слизистой ротоглотки. Наши исследования свидетельствуют о том, что препараты, действие которых направлено на повышение собственной противоинфекционной резистентности организма ребенка, должны составлять основу реабилитации часто болеющих детей.
По вопросам литературы обращайтесь в редакцию.
Л. В. Феклисова, доктор медицинских наук, профессор
Е. Р. Мескина, кандидат медицинских наук
Л. А. Галкина, кандидат медицинских наук
Е. Е. Целипанова, кандидат медицинских наук
Н. А. Савицкая, кандидат медицинских наук
С. П. Казакова, кандидат медицинских наук
Е. А. Воропаева, кандидат медицинских наук
ГУ МОНИКИ им. М. Ф. Владимирского, Москва
Ключевые слова: микробиота ротоглотки, дети, ОРВИ, инфекционный мононуклеоз, острый тонзиллит, Кипферон ® .
В последние годы на территории РФ, в том числе и в Астраханской области, отмечается увеличение числа случаев заражения человека различными инфекционными заболеваниями, как эндемичными, так и неэндемичными для данной территории. К эндемичным относят такие инфекции, как крымская геморрагическая лихорадка, астраханская риккетсиозная лихорадка, коксиеллез (лихорадка Ку) и многие другие [1, 2].
В мире более 2 млрд человек заражены гельминтами. По официальной статистике ВОЗ, причиной более 16 млн из 50 млн летальных исходов, которые ежегодно регистрируют в мире, являются паразитарные и инфекционные заболевания. В последнее время повсеместно увеличивается количество гельминтозов, которые раньше были редким явлением и регистрировались в спорадических случаях [3].
Несмотря на то, что санитарно-эпидемиологическая обстановка в целом по РФ в последние годы характеризуется как стабильная (не считая пандемии новой коронавирусной инфекции), паразитарные болезни продолжают занимать одно из ведущих мест в структуре инфекционной заболеваемости. Ежегодно в стране регистрируются сотни тысяч новых случаев паразитарных болезней. В их структуре особая роль принадлежит так называемым тканевым (ларвальным) гельминтозам, среди которых токсокароз до настоящего времени остается недостаточно изученным и трудно верифицируемым гельминтозом человека. Токсокароз является одним из наиболее часто встречающихся зоонозных гельминтозов в мире. В настоящее время он приобрел устойчивую социально-экономическую значимость и в нашей стране. С начала официальной регистрации (1991 г.) отмечен значительный рост уровня заболеваемости токсокарозом населения РФ, который колебался от 0,03 в 1991 г. до 1,72 на 100 тыс. населения в 2015 г. [4].
С точки зрения зоонозных инвазий, токсокароз является наиболее распространенным и важным для общественного здравоохранения паразитарным заболеванием [6]. Территории юга России характеризуются своеобразными природно-климатическими, экогеографическими и социально-экономическими условиями, определяющими поддержание активности очагов токсокароза. Высокая степень обсемененности яйцами Toxocara canis фекалий собак, значительная численность и плотность последних на селитебных территориях, контаминация почвы, сточных вод канализации и осадков, а также высокая доля жизнеспособных яиц Toxocara canis в объектах окружающей среды создают благоприятные условия для реализации путей передачи и широкого распространения инвазии на юге России [7].
Токсокароз характеризуется тяжелым, длительным и рецидивирующим течением, полиморфизмом клинических проявлений, обусловленных миграцией личинок токсокар в различные органы и ткани. Рост числа бродячих собак в городах, их высокая пораженность токсокарами, интенсивность экскреции яиц половозрелыми гельминтами, обитающими в кишечнике животных, устойчивость яиц во внешней среде являются определяющими факторами распространения инвазии среди людей [8].
Токсокароз – одна из наиболее часто регистрируемых зоонозных гельминтозных инвазий в мире с более высокой распространенностью в тропических регионах и среди сельского населения. Это вызвано личиночной стадией аскарид Toxocara canis, обыкновенного круглого червя собак, и, вероятно, также личиночной стадией Toxocara cati, аскариды кошек. Клинический спектр токсокароза у людей варьирует от бессимптомного течения до тяжелого повреждения органа, вызванного миграцией личинок в основные органы (висцеральная мигрирующая личинка) [9, 10].
Гельминтозы собак причиняют значительный экономический ущерб животноводству и представляют серьезную опасность для здоровья населения [11].
Токсокароз – зоонозное паразитарное заболевание, которое характеризуется попаданием (иначе – миграцией) и ходом вредоносной жизнедеятельности личинок круглых червей (токсокар) в организме человека с частотным поражением внутренних органов или систем. Человек заражается токсокарами при проглатывании яиц паразита вместе с пищей или водой, которые загрязнены испражнениями собак, либо при непосредственном контакте с инвазированными собаками. Опасность болезни усугубляется и тем, что самка токсокары способна за одни сутки отложить около 200 000 яиц. С кровотоком они попадают в ткани и органы носителя, а за сутки число отложенных яиц измеряется уже миллионами. При этом чаще всего заболевают именно дети 1-4 лет.
Протекает заболевание с аллергическими симптомами (зудящие высыпания, лихорадка, гепатоспленомегалия, бронхопневмония, приступы мучительного кашля, удушье, одутловатость лица, образование в органах гранулем, которые содержат личинки токсокар). Встречается токсокарозный офтальмит, при котором поражается задний сегмент глаза (хориоретинит), а также возникает кератит. Глазной токсокароз опасен необратимыми повреждениями глаз (абсцессы, мигрирующие личинки в стекловидном теле, потеря зрения). Болезнь может протекать от нескольких месяцев до нескольких лет. Актуальность исследования и лечения токсокароза связана с тем, что в наше время в связи с экономическими и политическими кризисами в разных странах планеты снижается уровень жизни людей, ухудшаются бытовые условия существования, не соблюдаются санитарно-гигиенические нормы. Токсокароз широко распространен в ряде регионов и стран, например, в Африке, Юго-Восточной Азии. Встречается он и в России, США, Европе. Болезнь в основном распространяется среди бродячих собак и кошек, которые являются пожизненными носителями личинок и выделяют в жилых массивах яйца гельминтов вместе с фекалиями. Показатель средней инфицированности среди собак и кошек – около 16%, но в ряде случаев может достигать и 90% [12, 13].
Токсокароз, вызванный инфицированием личинками Toxocara canis и, в меньшей степени, Toxocara cati и другими видами аскарид, проявляется у человека в виде ряда клинических синдромов. К ним относятся мигрирующие висцеральные и глазные личинки, нейротоксокароз и скрытый или общий токсокароз. Исследования по серологической распространенности показали, что это забытое заболевание особенно распространено среди детей из социально-экономически неблагополучных групп населения как в тропиках, так и в субтропиках, а также в промышленно развитых странах [14].
Увеличение популяций людей и собак, перемещение населения и изменение климата будут способствовать увеличению значимости этого зооноза [14].
Заражению токсокарами подвержены как домашние, так и дикие животные, выступающие чаще всего в качестве окончательных хозяев с различными путями передачи [15].
Паразитические нематоды из рода Toxocara являются социально-экономически важными зоонозными инвазиями. Эти паразиты обычно напрямую передаются человеку-хозяину фекально-оральным путем и могут вызывать токсокароз и связанные с ним осложнения, включая аллергические и неврологические расстройства [16].
В ряде субъектов РФ токсокароз практически не регистрируется на протяжении нескольких лет. Это связано не с благополучной санитарно-эпидемиологической обстановкой, а скорее с неудовлетворительной клинической и лабораторной диагностикой этой инвазии. Подтверждением тому служат многочисленные серо-эпидемиологические исследования населения, по результатам которых доля серопозитивных лиц колеб-лется от 5% до 46%. Широкое распространение токсокароза среди населения во многом зависит от проблемы несоблюдения правил содержания домашних собак, наличия большого количества бродячих животных, отсутствия мер по систематической контролируемой дезинвазии их экскрементов. В некоторых субъектах РФ пораженность собак токсокарозом составляет до 40% в городской и 80-100% в сельской местностях. Данные многочисленных санитарно-паразитологических исследований показывают, что контаминация почвы яйцами токсокар колеблется от 1-3% до 50-60% в разных регионах России, интенсивность загрязнения составляет от 1 до 10 яиц на 100 г почвы [4].
Возбудители токсокароза собак и кошек – Toxocara canis и Toxocara mistax способны в миграционной (ларвальной) стадии длительно паразитировать у человека, вызывая повреждение тканей внутренних органов и сенсибилизацию организма продуктами обмена личинок. Проблема токсокароза обусловлена, с одной стороны, высоким уровнем инвазированности собак, что связано с универсальным механизмом передачи возбудителя, с другой стороны – ростом численности собак и кошек, несоблюдением правил их содержания, отсутствием действенных мер по их дегельминтизации и дезинвазии почвы, что способствует широкой циркуляции возбудителя в природной среде [17].
По данным серологических и эпидемиологических исследований, от 1,5% до 14% обследованных практически здоровых людей имеют положительные иммунологические реакции на токсокароз. Человек способен заражаться круглогодично при попадании инвазионных яиц токсокар в кишечник через загрязненные яйцами почву, воду, продукты питания и руки. Возможно заражение человека через шерсть. Сам человек не является источником инвазии при токсокарозе, так как в его организме токсокары паразитируют в личиночной стадии, а не в половозрелой. В организме человека личинка возбудителя токсокароза способна выживать до 10 лет. Токсокароз протекает в острой, хронической и латентной форме. При латентном характере течения симптоматика отсутствует, а выявление гельминтоза возможно только по данным лабораторных анализов. Наиболее характерным лабораторным показателем является лейкемоидная реакция по эозинофильному типу с повышением эозинофилов от 30% до 90%. О заболевании свидетельствуют наличие клинических проявлений и титр специфических антител 1:800 и выше. Титр антител ниже 1:800 свидетельствует о носительстве, а титры 1:400 – о глазном токсокарозе при наличии патологического процесса в глазах [18].
Наиболее высокие уровни заболеваемости населения токсокарами отмечены в Уральском и Сибирском федеральных округах. Заболеваемость токсокарозом в целом по Южному федеральному округу ниже по сравнению с таковой в РФ, несмотря на высокую обсемененность возбудителем данного гельминтоза объектов среды обитания человека, значительную пораженность токсокарозом собак в округе (до 30%) и высокую серопревалентность населения (до 39%) [19].
Целью данного исследования было провести ретроспективный анализ заболеваемости населения Астраханской области токсокарами за 2012-2019 гг.
Материалы и методы исследования
Работа проводилась на базах кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО Астраханский ГМУ Минздрава России, лаборатории бактериологических и паразитологических исследований и эпидемиологического отдела ФБУЗ ЦГиЭ в Астраханской области.
Всего за анализируемый период было изучено и обработано 48 эпидемиологических карт лиц, инвазированных токсокарами. Наибольшее число случаев токсокароза у людей зафиксировано в 2013 и 2017 гг., составив 20,8% (n = 10) и 25,0% (n = 12) соответственно (рис. 1).
Статистическая обработка результатов проводилась при помощи программы Microsoft Office Exel и BioStat Professional 5.8.4. Определяли процентное выражение ряда данных (%).
Результаты исследования
В большинстве случаев паразит регистрировался у женщин – 54,2% (n = 26).
Доля взрослых, которые были инвазированы токсокарами, составила 81,2% (n = 39), в том числе работающие граждане – 69,2% (n = 27), пенсионеры – 20,5% (n = 8) и безработные – 10,3% (n = 4).
Чаще всего токсокароз регистрировался у проживавших в городской местности – 70,8% (n = 34) (рис. 2).
Из городских районов наиболее часто токсокароз выявлялся у жителей Трусовского – 38,2% (n = 13) и Ленинского – 32,4% (n = 11) районов. Доля паразитарной контаминации населения, проживавшего в Кировском и Советском районах Астрахани, незначительна – 20,6% (n = 7) и 8,8% (n = 3) соответственно.
Больше всего зараженных токсокарами было среди жителей Икрянинского, Камызякского и Наримановского районов Астраханской области – 35,7% (n = 5), 28,6% (n = 4) и 21,4% (n = 3) соответственно. Спорадические случаи отмечались в Приволжском и Володарском районах области – по 7,1% (по n = 1) (рис. 3).
Предположить наличие данного заболевания и в дальнейшем провести соответствующие диагностические исследования заставили жалобы пациентов, выявленные при проведении ежегодных медицинских осмотров в 83,3% (n = 40) случаев, а также при непосредственном обращении за первичной медико-санитарной помощью в различные лечебно-профилактические учреждения Астрахани и ее области – 14,6% (n = 7), и у одного пациента (2,1%), проходившего как контактное лицо с заболевшим токсокарозом членом семьи.
В большинстве случаев паразитоз протекал в виде различных клинических проявлений и симптомов – 60,4% (n = 29) (табл. 1).
Так, из приведенной выше таблицы видно, что большая часть пациентов предъявляла жалобы на боль в области живота – 37,9% (n = 11), в том числе на боль в эпигастральной области – 27,6% (n = 8) и в правом подреберье – 10,3% (n = 3), общую слабость – 34,5% (n = 10) и кашель – 31,0% (n = 9).
Также отмечались жалобы на боль в суставах верхних конечностей – 10,3% (n = 3), частую утомляемость – 13,8% (n = 4), аллергический насморк, тошноту и незначительное повышение температуры – по 3,4% (по n = 3), отсутствие аппетита – 6,9% (n = 2). В редких случаях пациенты предъявляли жалобы на вздутие живота, крапивницу, чувство удушья в ночное время, незначительное снижение веса и расслоение ногтей – по 3,4% (по n = 1).
Почти у половины больных – 39,6% (n = 19) наблюдалось бессимптомное течение токсокароза. Собранный эпидемиологический анамнез показал, что большая часть инвазированных – 91,7% (n = 44) не соблюдала правила личной гигиены (употребляли в пищу грязные немытые фрукты и овощи – 89,6% (n = 43), не мыли руки перед едой – 16,7% (n = 8), контактировали с недегельминтизированными животными – 58,4% (n = 28): собаками – 43,8% (n = 21), в том числе домашними – 90,5% (n = 19), кошками – 14,6% (n = 7), в том числе домашними – 85,7% (n = 6). Склонность к геофагии (поеданию почвы) отмечалась у 68,8% (n = 33) инвазированных. А привычка грызть ногти на руках и ногах (онихофагия) зафиксирована у 18,8% (n = 9) детей.
Продолжительность заболевания от появления первых клинических признаков до установления окончательного диагноза составляла от нескольких дней до 2 лет (табл. 2).
Чаще всего длительность клинического течения составляла несколько дней – 29,2% (n = 14). В редких случаях длительность заболевания составляла 2 недели и 1 месяц – 14,6% (n = 7) и 18,8% (n = 9) соответственно.
После установления окончательного диагноза все пациенты проходили курс химиотерапии препаратом албендазол (10 мг/кг/сутки от 7 до 14 дней) в сочетании с антигистаминными и симптоматическими средствами.
После окончания курса лечения проводился контроль его эффективности (все пациенты были обследованы методом ИФА, табл. 3).
Как видно из приведенной выше таблицы, после курса химиотерапии титр антител стал снижаться: через 3 месяца после лечения он уменьшился незначительно только у двух пациентов – 4,2%. Спустя еще 3 месяца (6 месяцев после курса лечения) титр антител снизился до нулевых цифр почти у половины больных – 45,8% (n = 22). А еще через 6 месяцев (12 месяцев после окончания химиотерапии) титр антител снизился до нуля у всех пациентов.
Клинически висцеральный токсокароз проявляется поражением внутренних органов с различными аллергическими проявлениями. У наших пациентов отмечались общая слабость – 34,5%, боль в эпигастральной области – 27,6% и кашель – 31,0%. В редких случаях больные жаловались на утомляемость – 13,8%, боль в области правого подреберья и в суставах верхних конечностей, повышение температуры до субфебрильных цифр и аллергический насморк – по 10,3%, а также отсутствие аппетита – 6,9%, крапивницу, чувство удушья ночью, снижение веса, расслоение ногтей и вздутие живота – по 3,4%.
В то же время зарубежные авторы [20] отмечают, что, по их наблюдениям, при висцеральном токсокарозе чаще отмечались головная боль и продолжительный кашель – по 33,0%, гепатомегалия, головокружение, боли в животе и кожный зуд – от 20,0% до 10,0%. В редких случаях наблюдались астения и потеря веса.
Если рассматривать симптоматику токсокароза, выявленную российскими авторами [8], то она напоминает симптомы, обнаруженные нами.
Недостатком нашего исследования явилась невозможность наблюдения за лицами с токсокарозом, связанным с другими паразитозами.
Выводы
- Высокий уровень зараженности жителей Ленинского и Трусовского районов Астрахани связан с высокой плотностью населения и преобладанием домовладений частного сектора, в котором находятся домашние животные (кошки и собаки).
- Предположительно основными причинами заражения человека токсокарами стали несоблюдение правил личной гигиены, употребление в пищу плохо вымытых фруктов и овощей, контакт с животными и геофагия.
- Ведущую роль в диагностике токсокароза человека играет серологическое исследование – ИФА с титрованием.
- Титр антител к антигенам токсокар выше разведения 1:800 свидетельствует о заболевании обследуемого висцеральным токсокарозом.
- Снижение титра антител до нулевых значений после курса химиотерапии свидетельствует об эффективности лечения пациентов на 100%.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
1 ФГБОУ ВО Астраханский ГМУ Минздрава России; 414000, Россия, Астрахань, ул. Бакинская, 121
2 ГБУЗ АО КРД им. Ю. А. Пасхаловой; 414024, Россия, Астрахань, ул. Ахшарумова, 82
3 ГБУЗ АО ДГП № 3; 414041, Россия, Астрахань, ул. Куликова, 61
4 ФБУЗ ЦГиЭ в Астраханской области; 414057, Россия, Астрахань, ул. Н. Островского, 138
Сведения об авторах:
Information about the authors:
Читайте также:

