Моно микст инфекция это
Обновлено: 25.04.2024
Изучена распространенность и этиологическая структура активной герпесвирусной инфекции у детей с различными формами и вариантами ювенильного артрита, сопоставлены форма и вариант ювенильного артрита у пациентов с активностью герпесвирусной инфекции и без
The article describes the prevalence and etiological structure of the active herpes virus infection in children with different forms and variants of juvenile arthritis, the form and variant peculiarities of juvenile arthritis in patients with active herpes infection, and without it were compared.
В последние десятилетия изучение роли инфекционных (вирусно-бактериальных ассоциаций) и наследственных факторов в развитии хронических воспалительных заболеваний суставов у детей сохраняет свою актуальность. Согласно современным представлениям ювенильный артрит (ЮА) рассматривается как обобщающее понятие, объединяющее гетерогенную группу хронических заболеваний суставов, имеющих различный этиопатогенез и иммуногенетическое происхождение, различную нозологическую принадлежность и неоднозначный прогноз. В группу ЮА можно отнести ювенильный ревматоидный артрит (ювенильный идиопатический артрит (ЮИА)) и ювенильный спондилоартрит (ЮСА), а также ювенильный хронический артрит, который представлен хроническим течением реактивного артрита [1, 2]. Среди ЮА наиболее значимым является ЮИА, приводящий к ранней инвалидизации в детском возрасте [3–5]. ЮИА так же, как ювенильные артриты в целом, представляет гетерогенную группу, в которой выделяют различные формы и варианты течения. Традиционно принято выделение системных и преимущественно суставных форм [3].
ЮА относятся к мультифакториальным заболеваниям, в развитии которых имеют место не только экзогенные (инфекционные и средовые), но и наследственные факторы, в том числе иммуногенетические [3, 5–7]. Развитие и прогрессирование ЮИА определяется сочетанием генетически детерминированных и вторичных дефектов иммунорегуляторных механизмов, приводящих к быстрой трансформации физиологической острой воспалительной реакции в хроническое прогрессирующее воспаление. Однако механизмы становления аутоиммунного патогенеза ЮИА довольно сложны и, несмотря на многочисленные исследования, до конца не раскрыты [6–8]. Влияние вирусной инфекции, в том числе герпесвирусной, в качестве триггерного фактора развития ЮА очевидно, в то время как этиологическая роль только предполагается. Во многом нерешенным остается вопрос об уровне взаимосвязи инфекционных и генетических факторов в развитии и течении ювенильного артрита. По мнению ряда авторов, не исключается возможность инициации инфекционным агентом артрита, особенно у генетически предрасположенного больного [9–11]. В литературе имеются данные о том, что герпесвирусные инфекции у детей с ЮИА не только утяжеляют его течение, но и могут участвовать в реализации патогенетических иммунокомплексных процессов [8, 12].
У детей спектр клинических проявлений герпесвирусной инфекции (ГВИ) весьма разнообразен: он зависит от локализации патологического процесса, его распространенности, состояния иммунной системы больного и антигенного типа вируса [13–15]. По данным литературы у детей с ЮИА выделяется два варианта инфицирования вирусами и бактериями: в начале заболевания и спустя несколько месяцев и лет от его дебюта. Во всех случаях как носительства, так и острой герпесвирусной инфекции ЮИА протекает в виде более тяжелых клинических форм [8, 9], и вирусно-бактериальное инфицирование у детей с ЮИА является прогностически неблагоприятным признаком, указывающим на большую тяжесть болезни с возможностью возникновения необратимых процессов с нарушением функции суставов, развитием висцеритов и васкулитов [3, 8].
Кроме того, использование иммуносупрессивной терапии, а в последние десятилетия генно-инженерных биологических препаратов, мишенью которых являются узловые патогенетические звенья воспалительного процесса (ФНО-α, интерлейкины-1, 6 и т. д.), способствует не только подавлению аутоиммунных реакций, но и создает условия для реактивации латентных вирусных инфекций [16–21].
Поэтому вопрос о роли герпесвирусной инфекции как о причинном агенте, усугубляющем дефект иммунорегуляторных систем и обуславливающем развитие иммунных нарушений, лежащих в основе ЮИА, является актуальным.
Целью настоящего исследования было изучить распространенность активной герпесвирусной инфекции (ГВИ) у больных с различными формами и вариантами ЮА.
Пациенты и методы исследования
В исследование были включены 163 ребенка с воспалительными заболеваниями суставов, наблюдавшиеся в детском ревматологическом отделении на клинической базе (УДКБ № 1) кафедры детских болезней лечебного факультета ФГБОУ ВО Первый МГМУ им. И. М. Сеченова.
При формировании групп больных по нозологическим формам и вариантам течения использовались Берлинские диагностические критерии (Берлин, 1996 г.) реактивного артрита, классификационные критерии ЮСА Гармиш-Партенкирхен (1987 г.) и критерии диагностики ЮИА (1997 г.) Американской коллегии ревматологов (American College of Rheumatology, ACR). Согласно этой классификации и в соответствии с поставленными задачами нами выделялась системная и преимущественно суставная форма ЮИА.
Всем пациентам проводилось комплексное клинико-лабораторное и инструментальное обследование, принятое в детской ревматологии, которое включало оценку жалоб, анамнеза, данных физикального осмотра (выраженность суставного синдрома и внесуставных проявлений), стандартные лабораторные исследования (клинические, биохимические и иммунологические анализы крови, общий анализ мочи), а также инструментальные методы. С целью исключения поражения глаз все больные были осмотрены окулистом, по показаниям — другими специалистами.
У всех обследованных детей методом сплошного скринингового исследования крови осуществлялась идентификация ДНК вирусов герпеса 1-го, 2-го, 3-го, 4-го, 5-го и 6-го типов с помощью качественной ПЦР.
Результаты исследования и их обсуждение
Всего в исследование вошло 163 пациента. С системным ЮИА было 34 ребенка, с суставной формой — 87, с ЮСА — 17, с хроническим реактивным артритом (ХРеА) — 25. Во всех группах, за исключением ЮСА, преобладали девочки — их в 1,4 раза больше мальчиков. Как известно, ЮСА развивается преимущественно у мальчиков подросткового возраста, о чем свидетельствует и средний возраст в этой группе, который составил 14,88 ± 0,6 года в сравнении с другими вариантами ЮА, где средний возраст соответствовал 8–10 годам (табл. 1). Средний возраст дебюта заболевания был наименьшим в группе с суставной формой ЮИА — 3,77 ± 0,3 года, набольшим в группе ЮСА — 9,7 ± 0,59. Средняя продолжительность заболевания в целом по группам составила 5 лет, за исключением ХРеА, где средняя продолжительность заболевания составила 2,98 ± 0,66 года.
В целом ГВИ была выявлена у 81 пациента с ЮА (49,7%). С системным ЮИА — 21 ребенок (62%), что достоверно выше, чем при суставном ЮИА — 39 (45%, р ≤ 0,05).
Частота ГВИ в зависимости от пола и возраста
В группе пациентов с активной ГВИ, как и группе без ГВИ, соотношение девочек и мальчиков было примерно одинаково и составило 1,4:1 (р ≤ 0,005). То есть группы сопоставимы по половому составу.
Анализ распределения по возрасту пациентов с ГВИ и без ГВИ показал, что среди детей с маркерами активной ГВИ достоверно преобладает возрастная группа от 1 года до 6 лет — 65% (р ≤ 0,001), а пациенты без ГВИ в основном 7–11 лет — 67% (р ≤ 0,001). Число пациентов в возрасте 12–17 лет в обеих группах было примерно одинаково — 49% и 51% (р > 0,05) (рис. 1).
Структура герпесвирусной инфекции у пациентов с ЮА
Частота выявления моно- и микст-ГВИ у пациентов с ЮА (n = 81) представлена на рис. 2.
У обследованных детей с различными формами и вариантами ЮА был проведен анализ структуры положительных маркеров активной ГВИ. Моноинфекция (положительный маркер активной ГВИ к одному вирусу герпеса) диагностирована в 47% (53 ребенка), микст-инфекция (положительные маркеры двух и более активных ГВИ) — у 53% (60 детей).
При анализе структуры положительных маркеров ГВИ (табл. 2) достоверно чаще выявлялись положительные маркеры активной инфекции ВПГ 1-го типа — 34 ребенка (30%), по сравнению с положительными маркерами активной ВЗВ-инфекции — 17 детей (15%, р ≤ 0,05). Положительные маркеры активной ВГЧ 6-го типа и ВЭБ-инфекции — у 31 ребенка (27,5%, р > 0,05) соответственно. Положительных маркеров активной ЦМВ-инфекции не было выявлено ни у одного пациента с ЮА, что согласуется с данными зарубежной литературы [19].
У больных с положительными маркерами ГВИ ВЗВ достоверно чаще встречается в виде моноинфекции — 59% (р ≤ 0,05), а ВГЧ 6-го типа достоверно чаще встречался в виде микст-инфекции — 65% (р ≤ 0,001). Положительные маркеры ВПГ 1-го типа и ВЭБ были выявлены примерно в одинаковом проценте случаев — как в виде моноинфекции, так и в составе микст-инфекции (рис. 3).
Анализ положительных маркеров активной ГВИ при различных формах и вариантах ЮА показал (табл. 3), что при суставной форме ЮИА достоверно чаще выявляются положительные маркеры ВПГ 1-го типа и ВГЧ 6-го типа — 33%, по сравнению с ВЗВ — 10% (р ≤ 0,001). У пациентов с ХРеА достоверно чаще выявляются положительные маркеры ВЭБ и ВГЧ 6-го типа — 35%, по сравнению с ВПГ 1-го типа и ВЗВ — 12% (р ≤ 0,001) и 18% (р ≤ 0,005) соответственно. При системной форме ЮИА и ЮСА достоверных различий по частоте встречаемости положительных маркеров ГВИ не получено: ВПГ 1-го типа, ВЭБ, ВГЧ 6-го типа, ВЗВ определяются примерно с одинаковой частотой (рис. 4). Это, вероятно, связано с более высокой вирусной и антигенной нагрузкой: пациенты с системной формой ЮИА получают агрессивную иммуносупрессивную терапию, что увеличивает риск активации латентных и коморбидных инфекций, в том числе ГВИ. Обращает внимание, что при ЮСА положительных маркеров ВГЧ 6-го типа не обнаружено ни у одного пациента. Больные с ЮСА — преимущественно в возрасте 14–15 лет, а инфекция ВГЧ 6-го типа характерна для детей раннего возраста — к пяти годам жизни различными видами герпеса инфицируются до 90% детей [14].
При анализе моно-ГВИ у пациентов с различными формами и вариантами ЮА (табл. 4) выявлено, что при ЮИА (как при суставной, так и при системной форме особенно) преобладает моноинфекция ВЭБ — 27% и 38%. При системной форме ЮИА достоверно реже выявляется моноинфекция ВГЧ 6-го типа — 8% (р ≤ 0,001). У пациентов с суставной формой ЮИА, помимо моноинфекции ВЭБ, преобладает моноинфекция ВПГ 1-го типа и ВГЧ 6-го типа — 35% и 30% соответственно по сравнению с ВЗВ — 8% (р ≤ 0,001). При ЮСА преобладает моноинфекция ВПГ 1-го типа — 58% по сравнению с ВЭБ — 13% (р ≤ 0,001) и ВЗВ — 29% (р ≤ 0,005). Как было показано ранее, маркеры ВГЧ 6-го типа у больных с ЮСА не выявлялись ни у одного ребенка. У больных с ХРеА, напротив, с одинаковой частотой определялись ВПГ 1-го типа, ВЗВ, ВГЧ 6-го типа — 29% по сравнению с ВЭБ — 13% (р ≤ 0,05) (рис. 5).
В общей структуре микст-инфекции у пациентов с ЮА преобладают сочетания ВГЧ 6-го типа + ВЭБ и ВГЧ 6-го типа + ВПГ 1-го типа — в 32% и 25% соответственно, реже встречаются сочетания ВПГ 1-го типа + ВЭБ и ВПГ-1-го типа + ВЗВ — 11% (рис. 6).
Анализ микст-ГВИ у пациентов с различными формами и вариантами ЮА выявил, что микст-инфекция у больных с системным ЮИА составляла 24%, при этом преобладала микст-инфекция ВПГ 1-го типа + ВГЧ 6-го типа, при суставной форме микст-инфекция выявлялась в 15% случаев и была представлена преимущественно сочетаниями: ВПГ 1-го типа + ВГЧ 6-го типа и ВЭБ + ВГЧ 6-го типа. При ЮСА микст-инфекция встречалась реже, чем при других вариантах ЮА, и составляла 12% — в виде сочетания ВЭБ + ВЗВ. При ХРеА микст-инфекция выявлялась в 20%, преобладало сочетание ВЭБ + ВЧГ 6-го типа (рис. 7). Это в целом отражает тенденцию, выявленную при анализе общей структуры положительных маркеров ГВИ: при суставной форме ЮИА достоверно чаще выявляются положительные маркеры ВПГ 1-го типа, при ХРеА — ВГЧ 6-го типа.
Обнаруженные в настоящем исследовании различия в частоте и структуре ГВИ при разных формах и вариантах ЮА требуют дальнейшего анализа с целью оценки влияния ГВИ на клиническое течение ЮА и обсуждением возможной этиопатогенетической роли ГВИ в развитии ЮА.
Выводы
- У больных с различными формами и вариантами ЮА активная ГВИ выявлялась в 49,7%. Среди положительных маркеров ГВИ у детей с ЮА наиболее часто встречаются ВПГ 1-го типа, а реже других — ВЗВ. Активная ЦМВ-инфекция не была диагностирована ни у одного пациента с ЮА.
- При системном варианте ЮИА ГВИ выявляются чаще, чем при других вариантах и формах ЮА, и составляют 62%. Преобладает активная инфекция ВПГ 1-го типа и ВЭБ, чаще встречается микст-герпесвирусная инфекция.
- При суставной форме ИЮА ГВИ выявляется несколько реже, чем при других формах ЮА, — 45% и представлена ВПГ 1-го типа, ВГЧ 6-го типа и ВЭБ (выявляются с одинаковой частотой), в то время как ВЗВ встречается достоверно реже.
- ЮСА характеризуется высокой частотой выявления ГВИ — 53%. Преимущественно за счет ВПГ 1-го типа и ВЗВ. Особенностью ЮСА является отсутствие маркеров ВГЧ 6-го типа.
- При ХРеА частота выявления ГВИ составляет 48%. В структуре ГВИ преобладает ВЭБ и ВГЧ 6-го типа — как в виде моно-, так и в форме микст-инфекции.
Литература
- Cassidy J. T., Petty R. E., Laxer R. M., Lindsley C. B. Textbook of pediatric rheumatology. 6 th ed. Philadelphia: Saunders Elsevier, 2010. 794 р.
- Cellucci T., Guzman J., Petty R. E., Batthish M., Benseler S. M., Ellsworth J. E., Houghton K. M., LeBLANC C. M., Huber A. M., Luca N., Schmeling H., Shiff N. J., Soon G. S., Tse S. M. Management of Juvenile Idiopathic Arthritis 2015: A Position Statement from the Pediatric Committee of the Canadian Rheumatology Association // J Rheumatol. 2016; 43 (10): 1773–1776.
- Жолобова Е. С., Шахбазян И. Е., Улыбина О. В. Афонина Е. Ю. Ювенильный ревматоидный (идиопатический) артрит. В кн.: Геппе Н. А., Подчерняева Н. С., Лыскина Г. А. (ред.). Ювенильный ревматоидный артрит. Рук-во по детской ревматологии. М.: ГЭОТАР-Медиа, 2011. С. 162–245.
- Баранов А. А., Алексеева Е. И., Бзарова Т. М. Протокол ведения пациентов с ювенильным артритом // Вопросы современной педиатрии. 2013; 12 (1): 37–56.
- Ravelli A. Handbook of Juvenile Idiopathic Arthritis. Switzerland, Adis (Springer International Publishing). 2016; 115–124.
- Donn R., De Leonibus., Meyer S., Stevens A. Network analysis and juvenile idiopathic arthritis (JIA): a new horizon for understanding of disease pathogenesis and therapeutic target identification // Pediatr Rheumatol Online J. 2016; 14 (1): 40. DOI: 10.1186/s12969–016–0078–4.
- Кравченко Н. П., Олейник Е. К. Механизмы нарушения иммунологической толерантности // Труды карельского научного центра РАН, 2015; (12): 3–22. DOI: 10. 17076/eb230.
- Соболева Н. Г. Ювенильный ревматоидный артрит у детей Краснодарского края (особенности этиопатогенеза, оптимизация лечебной тактики). Автореф. дис. … д.м.н. Краснодар, 2009.
- Ball R. J., Avenell A., Aucott L., Hanlon P., Vickers M. A. Systematic review and meta-analysis of the sero-epidemiological association between Epstein-Barr virus and rheumatoid arthritis // Arthritis Research & Therapy. 2015; 17: 274. DOI: 10.1186/s13075–015–0755–6.
- Halenius A., Hengel H. Human cytomegalovirus and autoimmune disease // Biomed Res Int. 2014; 2014: 472978. DOI: 10.1155/2014/472978. Epub 2014 Apr 29.
- Draborg A. H., Duus K., Houen G. Epstein-Barr virus in systemic autoimmune diseases // Clin Dev Immunol. 2013; 2013: 535738. DOI: 10.1155/2013/535738. Epub 2013 Aug 24.
- Бочанцев С. В., Потрохова Е. А., Соботюк Н. В., Устян Л. А., Пертельс Т. Г. Диагностика вирусной инфекции Эпштейна–Барр при системной красной волчанке и ревматоидном артрите // Российский педиатрический журнал. 2014; 17 (5): 42–48.
- Исаков В. А., Архипова В. И., Исаков Д. В. Герпесвирусные инфекции человека. СПб: СпецЛит, 2013. С. 51–198.
- Боковой А. Г. Герпесвирусные инфекции у детей: диагностика, клиника и лечение. Роль в формировании контингента часто болеющих детей. Учебное пособие. М.: МАКС Пресс, 2008. 144 с.
- James S. H., Kimberlin D. W. Neonatal Herpes Simplex Virus Infection // Infect Dis Clin North Am. 2015; 29 (3): 391–400. DOI: 10.1016/j.idc.2015.05.001. Epub 2015 Jul 4.
- Davies H. D., Byington C. L., Maldonado Y. A., Barnett E. D., Edwards K. M., Lynfield R., Munoz-Rivas F. M., Nolt D. L., Nyquist A. C., Rathore M. H., Sawyer M. H., Steinbach W. J., Tan T. Q., Zaoutis T. E. Infectious Complications With the Use of Biologic Response Modifiers in Infants and Children // Pediatrics. 2016; 138 (2): e20161209. DOI: 10.1542/peds.2016–1209. Epub 2016 Jul 18.
- Nicolai R., Cortis E., Ravà L., Bracaglia C., Pardeo M., Insalaco A., Buonuomo P. S., Tozzi A. E., De Benedetti F. Herpes Virus Infections During Treatment With Etanercept in Juvenile Idiopathic Arthritis // J Pediatric Infect Dis Soc. 2016; 5 (1): 76–79. DOI: 10.1093/jpids/piu078. Epub 2014 Jul 31.
- Comar M., Delbue S., Lepore L., Martelossi S., Radillo O., Ronfani L., D’Agaro P., Ferrante P. Latent viral infections in young patients with inflammatory diseases treated with biological agents: prevalence of JC virus genotype 2 // J Med Virol. 2013; 85 (4): 716–722. DOI: 10.1002/jmv.23525. Epub 2013 Jan 30.
- Kawada J., Iwata N., Kitagawa Y., Kimura H., Ito Y. Prospective monitoring of Epstein-Barr virus and other herpesviruses in patients with juvenile idiopathic arthritis treated with methotrexate and tocilizumab // Mod Rheumatol. 2012; 22 (4): 565–70. DOI: 10.1007/s10165–011–0552–2. Epub 2011 Nov 5.
- Zhang N., Wilkinson S., Riaz M., Ostor A. J., Nisar M. K. Does methotrexate increase the risk of varicella or herpes zoster infection in patients patients with juvenile rheumatoid arthritis? A systematic literature review // Clin Exp Rheumatol. 2012; 30 (6): 962–71. Epub 2012 Dec 17.
- Che H., Lukas C., Combe B. Risk of herpes/herpes zoster during antitumor necrosis factor therapy in patients with rheumatoid arthritis. Systematic rewiew and meta-analysis // Joint Bone Spine. 2014; 81 (3): 215–221. DOI: 10.1016/j.jbspin.2013.07.009. Epub 2013 Aug 7.
Е. Ю. Солдатова* , 1
Е. С. Жолобова**, доктор медицинских наук, профессор
Е. В. Мелёхина*, кандидат медицинских наук
А. В. Горелов**, доктор медицинских наук, профессор, член-корреспондент РАН
* ФГУН ЦНИИЭ Роспотребнадзора, Москва
** ФГБОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
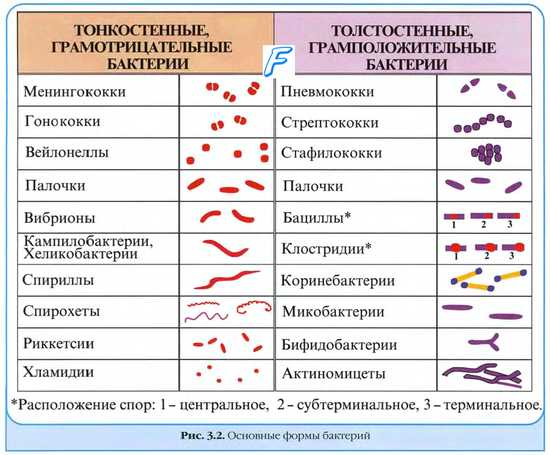
Классификация ( формы ) инфекционных заболеваний. Экзогенные инфекции. Эндогенные инфекции. Регионарные и генерализованные инфекции. Моноинфекции. Микстинфекции.
Инфекционные болезни обычно сопровождаются нарушениями гомеостаза организма и его физиологических функций. Множество взаимодействующих параметров в системе конкретный возбудитель-конкретный организм находит отражение в различных формах инфекционного процесса и его вариантах. Другими словами, в зависимости от эпидемиологической ситуации, типа и свойств возбудителя (например, инфицирующей дозы, вирулентности и т.д.), состояния параметров гомеостаза человека, а также от конкретных особенностей взаимодействия возбудителя и организма инфицированного человека, инфекционный процесс может принимать различные формы (от клинически выраженных до бессимптомных, от суперинфекций до бактерионосительства). Ниже рассмотрены основные формы инфекционных процессов.
Экзогенные инфекции. Эндогенные инфекции.
Экзогенные инфекции развиваются в результате проникновения в организм патогенных микроорганизмов из внешней среды.
Эндогенные инфекции обычно развиваются в результате активации и, реже, проникновения условно-патогенных микроорганизмов нормальной микрофлоры из нестерильных полостей во внутреннюю среду организма (например, занос кишечных бактерий в мочевыводящие пути при их катетеризации). Особенность эндогенных инфекции — отсутствие инкубационного периода.

Регионарные инфекционные заболевания. Генерализованные инфекции
• Регионарные инфекционные заболевания — инфекционный процесс протекает в каком-либо ограниченном, местном очаге и не распространяется по организму.
• Генерализованные инфекционные заболевания развиваются в результате диссеминирования возбудителя из первичного очага, обычно по лимфатическим путям и через кровоток.
Моноинфекции. Микстинфекции ( миксты )
Моноинфекции — заболевания, вызванные одним видом микроорганизмов.
Смешанные инфекции ( микстинфекции, миксты ) развиваются в результате заражения несколькими видами микроорганизмов; подобные состояния характеризует качественно иное течение (обычно более тяжёлое) по сравнению с моноинфекцией, а патогенный эффект возбудителей не имеет простого суммарного характера. Микробные взаимоотношения при смешанных (или микст-) инфекциях вариабельны:
• если микроорганизмы активизируют или отягощают течение болезни, их определяют как активаторы, или синергисты (например, вирусы гриппа и стрептококки группы Б);
• если микроорганизмы взаимно подавляют патогенное действие, их обозначают как антагонисты (например, кишечная палочка подавляет активность патогенных сальмонелл, шигелл, стрептококков и стафилококков);
• индифферентные микроорганизмы не влияют на активность других возбудителей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
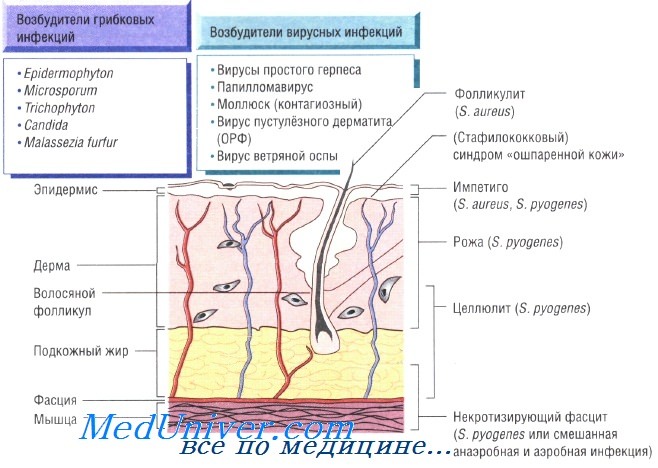
Инфекции кожи и мягких тканей: причины, диагностика, лечение, профилактика
Бактериальные инфекции кожи. Передача кожных инфекций осуществляется посредством контактного механизма. Заболевания быстро распространяются в местах скопления людей и в условиях антисанитарии. Возбудителями кожных инфекций могут быть многие микроорганизмы. Наиболее распространены Staphylococcus aureus и Streptococcus pyogenes.
Бактерии возбудители инфекций кожи и мягких тканей:
- S. aureus: импетиго, фурункулёз, невскрывающийся фурункул, токсический эпидермальный некролиз, острая паронихия
- S. pyogenes: целлюлит, рожа, импетиго
- С. diphtheriae: дифтерия (кожная форма)
- М. tuberculosis: волчанка обыкновенная
- М. marinum: хронические язвенные поражения кожи
- М. ulcerans: деструктивные язвы (язва Бурули)
- С. minutissimum: эритразма
- Pseudomonas aeruginosa: колонизация ожогов
- Erysipelothrix rhusiopathiae: эризипелоид
При целлюлите, вызванном S. pyogenes, S. aureus, Pasteurella multocida, реже вибрионами, обитающими в морской воде, и грамотрицательными бациллами, происходит поражение всех слоев кожи. Микроорганизмы проникают в организм человека через повреждённые участки кожи, раны и места укусов насекомых. Эмпирическое лечение флуклоксациллином необходимо начинать до получения результатов бактериологического исследования. В тяжёлых случаях применяют внутривенные антибактериальные препараты (бензилпенициллин и флуклоксациллин).
Некротизирующий фасцит — быстро прогрессирующая инфекция, поражающая также кожу и подкожную клетчатку. Заболевание развивается в результате микст-инфекции, вызванной аэробными и анаэробными микроорганизмами, а также вследствие моноинфекции S. pyogenes. Болезнь быстро прогрессирует и может привести к смерти пациента за очень короткое время. Большую роль в лечении играет успешное иссечение инфицированных некротических тканей, проводимое на фоне лечения бензилпенициллином, цефалоспоринами третьего поколения и метронидазолом.
Эритразма — поверхностная инфекция, возникающая на сгибательных поверхностях конечностей и вызываемая Corynebacterium minutissimum. Очаги поражения флюоресцируют в ультрафиолетовом свете. Возбудитель может быть выделен при посеве. Для лечения применяют эритромицин или тетрациклин.
Рожа — стрептококковая инфекция, поражающая органические участки кожи на лице или голенях. При обследовании отмечают обычно повышение количества лейкоцитов в периферической крови. Для лечения назначают приём внутрь амоксициллина и флуклоксациллина; в тяжёлых случаях может потребоваться внутривенное введение антибиотиков.
Эризипелоид — зоонозная инфекция, вызываемая Erysipelothrix rhusiopathiae. Местный очаг (обычно пальцы рук) характеризуется развитием эритемы красно-фиолетового цвета. В группу риска входят мясники (поражаются пальцы рук при работе с инфицированным мясом, чаше свиньи) и рыбаки. В большинстве случаев заболевание разрешается самостоятельно, но применение внутрь пенициллина или тетрациклина позволяет ускорить процесс выздоровления, назначение антибиотиков обязательно при развитии вторичной бактериемии.
Ожоги могут стать причиной инфекции, вызванной Pseudomonas aeruginosa, S. aureus, S. pyogenes и иногда бактериями кишечной группы. Возможно заражение антибиоти-коустойчивыми формами микроорганизмов. Бактериальное поражение может привести к отторжению пересаженной кожи и вторичной бактериемии.
Паронихия. Паронихия, или воспаление околоногтевой ткани, — распространённое заболевание, возникающее вследствие бактериальной инвазии (например, S. aureus) в местах повреждения кутикулы. При этом возникают боль, отёчность с последующим формированием небольшого абсцесса. Абсцесс дренируют и назначают антибактериальную терапию (флуклоксациллин и др.).
Причины инфекций кожи
Кожные проявления системных инфекций
На коже могут отражаться проявления системных инфекций. Ярким примером может служить петехиальная сыпь при менингококковой септицемии — несомненный признак тяжёлого сепсиса. У пациентов с синегнойной септицемией на коже возникают гангренозные очаги (гангренозная эктима). Менее выражены кожные изменения при эндокардите (кровоизлияния у оснований ногтей). При стафилококковой септицемии возникают участки инфаркта кожи, а при некоторых вирусных заболеваниях высыпания на коже становятся частью характерной клинической картины (ветрянка и корь).
Для вируса простого герпеса кожные покровы — первичный очаг инфекции. Некоторые штаммы Staphylococcus aureus и бета-гемолитических стрептококков вызывают системные заболевания, обусловленные действием токсинов и сопровождающиеся различными кожными изменениями: при синдроме токсического шока — генерализованная и сыпь на ладонях, при скарлатине — сыпь с бледностью носогубного треугольника, а при синдроме ошпаренной кожи у новорождённых — сильное шелушение.
Бородавки как инфекция кожи
Папилломавирус человека поражает клетки кожи и усиливает их репликацию, в результате чего формируется бородавка (папиллома). Существуют папулёзные, пятнистые и мозаичные виды папиллом, а также подошвенная (роговая) бородавка. Заболевание передаётся при непосредственном контакте с больным, а также через предметы общего пользования особенно при повышенной влажности (при совместном купании в бассейне).
Передача генитальных бородавок (остроконечных кондилом) осуществляется половым путём. Диагноз устанавливают на основании клинических признаков. Для определения вируса остроконечных кондилом применяют реакцию иммунофлюоресценции и полимеразную цепную реакцию.
Папилломавирусы вызывают злокачественные новообразования шейки матки (тип 16 и 18) и гортани (тип 6 и 11). В настоящее время существуют вакцины против виусов типа 16 и 18, которые формируют продолжительный иммунитет.
Папилломы со временем самостоятельно исчезают, не оставляя рубцов (за исключением случаев у людей со сниженным иммунитетом). Очень часто для самолечения применяют местные кератолитические вещества (салициловая кислота). При генитальных бородавках используют подофил щитовидный*. В качестве альтернативы применяют криотерапию, ускоряющую исчезновение папиллом. Прижигание в настоящее время не рекомендуют для частого использования у одного пациента.
Некоторые штаммы поксвирусов поражают кожный покров и вызывают возникновение характерных симптомов (например, контагиозный моллюск и контагиозный пустулёзный дерматит).
Дерматофитозы - грибковые инфекции кожи
Клинические признаки дерматофитозов. При дерматофитии (стригущем лишае) возникают бляшки, сопровождаемые зудом и покраснением. Со временем их диаметр увеличивается, а в центре образуется бледное пятно. При хроническом поражении ногтей наблюдают обесцвечивание и истончение ногтей, а при заболеваниях кожи головы — облысение и рубцевание. В основе названия заболевания лежит место заражения, например дерматофития головы (tinea capitis — стригущий лишай), дерматофития туловища (tinea corporis).
Лабораторная диагностика грибковых инфекций кожи. При инфекции кожного покрова отмечают свечение поражённых участков в ультрафиолетовом свете.
В лабораторию доставляют сухие соскобы с поражённых участков кожи, образцы ногтей и волос. При нагревании в растворе натрия гидроксида они обесцвечиваются, и во время микроскопии становятся видны гифы грибов. Дерматофиты растут на декстрозосодержащем агаре Сабурада при температуре 30 °С в течение четырёх недель.
В основе идентификации лежат морфологические свойства колоний, особенности микроскопической картины (окраска лактофеноловым синим), биохимическое исследование, а также секвенирование 18S рибосомальной РНК гена.
Лечение грибковых инфекций кожи. При дерматофитозах применяют местные препараты группы имидазола (миконазол, клотримазол, тиоконазол или аморолфин). При некоторых формах инфекции назначают тербинафин (внутрь) в течение нескольких недель.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Бессимптомные инфекции. Абортивная инфекция. Латентная ( скрытая ) инфекция. Инаппарантные инфекции. Дремлющие инфекции. Микробоносительство.
• Абортивная инфекция [от лат. aborto, не вынашивать, в данном контексте — не реализовывать патогенный потенциал] — одна из наиболее распространённых форм бессимптомных поражений. Такие процессы могут возникать при видовой или внутривидовой, естественной либо искусственной невосприимчивости (поэтому человек не болеет многими болезнями других животных). Механизмы невосприимчивости эффективно блокируют жизнедеятельность микроорганизмов, возбудитель не размножается в организме, инфекционный цикл возбудителя прерывается, он погибает и удаляется из макроорганизма.
• Латентная, или скрытая, инфекция [от лат. latentis, спрятанный] — ограниченный процесс с длительной и циклической циркуляцией возбудителя, аналогичной наблюдаемой при явных формах инфекционного процесса. Возбудитель размножается в организме; вызывает развитие защитных реакций, выводится из организма, но никаких клинических проявлений не наблюдают. Подобные состояния также известны как инаппарантные инфекции (от англ. inapparent, неявный, неразличимый). Так, нередко в латентной форме протекают вирусные гепатиты, полиомиелит, герпетические инфекции и т.д. Лица с латентными инфекционными поражениями представляют эпидемическую опасность для окружающих.
• Дремлющие инфекции могут быть разновидностью латентных инфекций или состояниями после перенесённого и клинически выраженного заболевания. Обычно при этом устанавливается клинически не проявляемый баланс между патогенными потенциями возбудителя и защитными системами организма. Однако под влиянием различных факторов, понижающих резистентность (стрессы, переохлаждения, нарушения питания и т.д.), микроорганизмы приобретают возможность оказывать патогенное действие. Таким образом, лица, переносящие дремлющие инфекции, — резервуар и источник патогена.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В настоящее время острые кишечные инфекции (ОКИ), являясь одной из важных медицинских и социальных проблем, вносят значительный вклад в формирование экономического ущерба для общества [1, 2]. В последние годы в этиологической структуре ОКИ возросла роль вирусных гастроэнтеритов. Молекулярно-генетическое разнообразие вирусов, формирование нестойкого, типоспецифического иммунитета, частое бессимптомное течение инфекции у взрослого населения способствуют сохранению ведущего положения вирусных диарей в общей структуре ОКИ детского возраста [3, 4], при этом главная роль принадлежит ротавирусам [5].
Высокая частота повторного заражения ротавирусной инфекцией (РВИ) детей первого года жизни и раннего возраста (30–70%), подчас длительное вирусоносительство после клинического выздоровления, влияние на формирование хронической патологии желудочно-кишечного тракта (ЖКТ) у детей [6–8] определяют необходимость дальнейшего изучения тактики ведения пациентов с моно- и микст-вариантами РВИ.
Цель исследования — изучить катамнез детей, перенесших моно- и микст-варианты РВИ.
Материал и методы
Данное исследование проводилось в отделении кишечных инфекций детского инфекционного стационара МУЗ ОГКБ № 1 им. А. Н. Кабанова г. Омска. Критериями включения больных в исследование являлось наличие клиники кишечной инфекции вирусной этиологии; возраст от одного месяца до трех лет; обращение за медицинской помощью в первый-второй день заболевания; отсутствие у больных хронической патологии и врожденных пороков развития со стороны органов ЖКТ.
В соответствии с критериями клинико-катамнестическое наблюдение проведено за 58 детьми (30 девочек и 28 мальчиков), из которых 39 детей перенесли острый моновариант РВИ, 19 детей — микст-вариант РВИ. Средний возраст детей с моновариантом РВИ составлял 20,8 ± 10,1 мес, с микст-вариантом РВИ 9,8 ± 17,6 мес.
Результаты и обсуждение
Генетическая идентификация изолятов ротавируса, выделенных из фекальных проб от 53 детей, показала, что генотип G4 преобладал и составил 56,6% (p = 0,000), вторым по встречаемости был генотип G2 — 16,9%. Генотипы G1 и G3 встречались реже — 5,7% и 11,3% соответственно. Среди P-генотипов преимущественно встречался генотип P [8] — 69,8% (p = 0,000), следующим генотипом был P [4] — 16,9%, в двух пробах (3,9%) не был определен P-генотип, в пяти пробах (9,4%) не определялись оба генотипа — нетипируемый генотип. При микст-варианте РВИ условно-патогенная флора была представлена Klebsiella pneumonia, Pseudomonas aeruginosa, Citrobacter amalanaticus, Enterobacter cloacae, Proteus vulgaris, P. mirabilis. У всех наблюдаемых детей с моно- и микст-вариантом РВИ острый период заболевания характеризовался клинической картиной средней степени тяжести. При этом тяжесть течения заболевания оценивалась по балльной шкале T. Vesikari и T. Ruusaka (1990) (табл. 1) [9].
Оценка степени тяжести в соответствии со шкалой Т. Vesikari для моноварианта РВИ составила в среднем 8,9 балла, для микст-варианта — 9,3 балла.
Всем пациентам с моно- и микст-вариантом РВИ при поступлении в стационар проводилась в соответствии с рекомендациями ВОЗ общепринятая базисная терапия (диета, оральная регидратация, ферментативные препараты, симптоматические средства). Детям, находящимся на естественном вскармливании, сохранялось питание грудным молоком, при искусственном вскармливании на острый период болезни назначались безлактозные (NAN Безлактозный, Нутрилон Безлактозный) и низколактозные смеси (Нутрилон Низколактозный, Нутрилак Низколактозный). У детей старшего возраста из питания исключались молочные, богатые углеводами продукты и продукты, усиливающие перистальтику кишечника (свежие овощи и фрукты, в том числе соки).
Регидратационную терапию при моно- и микст-варианте РВИ проводили по общепринятым правилам. Оральная регидратация при эксикозе 1–2 степени проводилась с использованием глюкозосолевых растворов Оралит, Регидрон, Гастролит. Инфузионная терапия назначалась при эксикозе 2–3 степени и неукротимой рвоте. Объем вводимых растворов зависел от степени обезвоживания и массы тела ребенка.
При моноварианте РВИ назначались индукторы интерферонов (Кипферон суппозитории per rectum детям до 12 лет — в средней разовой дозе 50000 МЕ/кг массы тела, но не более 1 млн МЕ/сут (2 суппозитория)). При микст-варианте РВИ дополнительно антибактериальные препараты: нифуроксазид (Энтерофурил суспензия 5 мл/200 мг, детям в возрасте от одного до шести месяцев — 100 мг (1/2 мерной ложки) 2–3 раза в день, от 7 месяцев до двух лет — 100 мг (1/2 мерной ложки) 4 раза в день. Эрцефурил суспензия 5 мл/220 мг; детям от одного до 30 месяцев — 220–660 мг (1–3 мерных ложки) за 2–3 приема, старше 30 месяцев — 220 мг (1 мерная ложка) 3 раза в день. Курс лечения — не более 7 дней), а также парентеральные антибиотики: цефалоспорины 1–2 поколения (цефазолин 20–50 мг/кг, в/м 3 раза в день, курс лечения 5–7 дней).
Детям, находящимся на грудном вскармливании или получавшим низколактозные смеси, с первых дней заболевания назначались ферментативные препараты (Лактаза — при грудном вскармливании, перед началом кормления грудью в 30 мл предварительно сцеженного грудного молока добавляют 1/6 капсулы). При выраженных копрологических признаках нарушения пищеварения, с 3–4 дня заболевания назначались препараты на основе панкреатина (Панкреатин детям до одного года — 0,10–0,15 г, до двух лет — 0,20 г, на прием 3–4 раза в день до еды).
Дети основной группы (30 человек) дополнительно к базисной терапии получали энтеросорбент смектит диоктаэдрический (Неосмектин — детям до одного года — 1 пакетик в сутки (3 г), 1–2 лет — 2 пакетика в сутки (6 г), старше двух лет — 2–3 пакетика в сутки (6–9 г)) до нормализации частоты и характера стула. Курс лечения составил 3–5 дней. Контрольную группу (18 человек) составили дети, сопоставимые по возрасту и степени тяжести заболевания, но получавшие только базисную терапию.
При сравнительном анализе купирования основных симптомов заболевания, в группе детей, получавших в лечении смектит диоктаэдрический, симптомы интоксикации у 22 детей (73%) купировались на 2-й день, а на 3-й день — у 28 пациентов (93%), в то время как в группе сравнения лишь у 6 детей (χ 2 = 6,54, p = 0,016). У детей, получавших энтеросорбент, быстрее прекращалась рвота и купировались явления метеоризма, происходила нормализация стула. На 3-й день лечения рвота прекратилась у 83,3% пациентов основной группы, в то время как в группе сравнения рвота в эти сроки купировалась только у 70% (p < 0,05). В контрольной группе пациентов, не получавших смектит диоктаэдрический в комплексной терапии, средняя частота стула в первые сутки лечения сохранялась той же, а улучшения характера стула не регистрировалось. На 4–5 день лечения смектитом диоктаэдрическим у всех больных наступало клиническое выздоровление с нормализацией стула, при этом в группе сравнения в эти сроки клиническое выздоровление имело место лишь в 80% случаев.
Катамнестическое наблюдение и изучение основных жалоб детей, перенесших острый моно- и микст-вариант РВИ, было проведено в течение трех месяцев от начала заболевания. Контрольное исследование антигена ротавируса в копрофильтрате детей проводилось на 14-й день, если результат ИФА был положительным, то антиген ротавируса у данной группы детей определяли через 1, 2 и 3 месяца после перенесенной РВИ до получения отрицательного результата.
По данным эпидемиологического анамнеза в 21,4% случаев заболевшие дети находились в контакте с детьми или взрослыми, имеющими клинические проявления ОКИ. У детей, выделяющих Ag ротавируса более 30 суток от начала заболевания, было проведено амбулаторное обследование родственного окружения, и в 10,2% случаев реакция на Ag ротавируса методом ИФА в копрофильтрате была положительной.
У детей, перенесших острый моновариант РВИ, достоверное уменьшение большинства жалоб было отмечено к 2-му месяцу катамнестического наблюдения. Восстановление аппетита у 92,3% детей отмечалось на 2-м месяце наблюдения (p = 0,02), периодические абдоминальные боли и их эквиваленты, а также нарушение работы кишечника в виде неустойчивого стула регистрировались и на 2-м, и на 3-м месяце диспансерного наблюдения, но достоверное уменьшение данных симптомов отмечалось на 2-м месяце наблюдения (p = 0,007).
Катамнез детей, перенесших микст-вариант РВИ, показал, что купирование основных жалоб отмечалось к 2–3 месяцу наблюдения, к 2-му месяцу наблюдения реже регистрировались: метеоризм (p = 0,000), боли в животе непостоянного характера (p = 0,001), при этом неустойчивый стул у 1/3 наблюдаемых детей сохранялся и на 3-м месяце наблюдения (p = 0,008).
При исследовании контрольного анализа копрофильтрата на Ag ротавируса методом ИФА на 14-й день, а также на 1-м и 2-м месяце наблюдения после перенесенного моно- или микст-варианта РВИ достоверных различий выявлено не было (p > 0,05).
Сравнительная характеристика жалоб детей, находившихся под наблюдением в течение трех месяцев после перенесенного острого моно- и микст-варианта РВИ, позволила выявить, что купирование основных жалоб в период реконвалесценции у детей с моновариантом РВИ отмечалось уже на 1-м месяце наблюдения (восстановление аппетита (p = 0,01), купирование абдоминальной боли (p = 0,03), нормализация функции кишечника (p = 0,02)), на 2-м месяце наблюдения полностью восстановилась функция кишечника (p = 0,004) по сравнению с детьми, перенесшими микст-вариант РВИ, у которых неустойчивый характер стула отмечался на 3-м месяце наблюдения (табл. 2).
Таким образом, дети после перенесенного острого моноварианта РВИ нуждаются в диспансерном наблюдении в течение не менее двух месяцев, а дети с перенесенным острым микст-вариантом РВИ в течение трех месяцев, так как в этот период сохраняются как общие жалобы, так и жалобы со стороны ЖКТ не только у детей, которые продолжают выделять Ag ротавируса, но и у детей без выделения Ag ротавируса. Дети, выделяющие Ag ротавируса более 14 дней, независимо от перенесенного микст- или моноварианта РВИ, нуждаются в обязательном контрольном обследовании в течение 30 дней после выписки, при одновременном обследовании родителей и/или ближайшего окружения на ротавирусную инфекцию с целью оценки возможного риска реинфецирования.
Литература
- Rheingans R. D. et al. Economic costs of rotavirus gastroenteritis and cost-effectiveness of vaccination in developing countries // J. Infec. Dis. 2009. Vol. 200, № 1. P. 16–27.
- Chai P. F., Lee W. S. Out-of-pocket costs associated with rotavirus gastroenteritis requiring hospitalization in Malaysia // Vaccine. 2009. Vol. 27, № 5. P. 112–115.
- Tran A. et al. Prevalence of Rotavirus, Adenovirus, Norovirus and Astrovirus Infections and Co-infections Among Hospitalized Children in Northern France // J. Clin. Microbiol. 2010. Vol. 26, № 1. P. 26–30.
- Ushijima H. Diagnosis and molecular epidemiology of viral gastroenteritis in the past, present and future // Uirusu. 2009. Vol. 59, № 1. P. 75–90.
- Anderson E. J. Prevention and treatment of viral diarrhea in pediatrics/E. J. Anderson // Expert. Rev. Anti. Infect. Ther. 2010. Vol. 8, № 2. P. 205–217.
- Учайкин В. Ф. и др. Роль ротавирусов в хронической гастроэнтерологической патологии у детей // Детские инфекции. 2003. № 1. С. 10–12.
- Turck D. Prevention and treatment of acute diarrhea in infants // Arch. Pediatr. 2007. Vol. 14, № 11. P. 1375–1378.
- Newton H. Viral diarrhea can be infectious for a long time // Child. Health. Alert. 2007. Vol. 25, № 2. P. 4–5.
- Ruuska T. et al. Rotavirus disease in Finnish children: use of numerical scores for clinical severity of diarrhoeal episodes // Scand. J. Infect. Dis. 1990. Vol. 22, № 3. P. 259–267.
Ю. Б. Белан, доктор медицинских наук, профессор
Н. А. Полянская
Читайте также:

