Нейтрофильные внеклеточные ловушки сепсис
Обновлено: 06.05.2024
Статья посвящена анализу результатов исследования с изучением современных представлений о нейтрофильных внеклеточных ловушках. Нейтрофилы являются доминирующими клетками иммунной системы и служат первой линией защиты организмв от вторжения патогенных микроорганизмов. После активации нейтрофилы атакуют и уничтожают патогенные микроорганизмы благодаря фагоцитозу, в процессе которого высвобождаются бактерицидные пептиды, протеолитические ферменты, активные формы кислорода (АФК) и недавно описанные нейтрофильные внеклеточные ловушки (НВЛ). Одним из актуальных направлений исследования социально-значимых заболеваний является изучение внеклеточных нейтрофильных ловушек, обладающих двоякой ролью: с одной стороны, выполняют защитную функцию, с другой - являются потенциальными медиаторами тканевого повреждения. В этой связи оценка образования внеклеточных ловушек представляет безусловную актуальность и важность поскольку во многом может определить развитие и исходы различной патологии. Согласно данным за последние годы, установлено, что нейтрофилы обладают большой фенотипической гетерогенностью и функциональной универсальностью, которые ставят нейтрофилы в качестве важных модуляторов как воспаления, так и иммунных реакций. Таким образом, представляет интерес оценка способности нейтрофилов к образованию внеклеточных ловушек при социально-значимых заболеваниях, поскольку внеклеточные ловушки определяют баланс между воспалительным процессом и клиренсом патогена.

1. Gura, T.Innate immunity: ancient system gets new respect / T. Gura // Science. – 2001 Mar. – Vol.291, N 5511. – P. 2068–2070.
2. Долгушин, И. И. Нейтрофилы и гомеостаз / И. И. Долгушин, О. В. Бухарин. – Екатеринбург: Изд-во УрОРАН, 2001. – 256 с. 3. Пинегин, Б. В. Нейтрофилы: структура и функция / Б. В. Пинегин, А. Н. Маянский // Иммунология. – 2007. – № 6. – С. 374-382.
3. Palmer L.J. Neutrophil extracellular traps in periodontitis. A thesis submitted to The University of Birmingham for the degree of doctor of philosophy 2010; 307.
4. Brinkmann V., Goosmann C., Kühn L.I., Zychlinsky A. Automatic quantification of invitro NET formation. Front. Immunol. 2013; 3: 413. doi: 10.3389/fimmu.2012.00413,
5. Fush T.A., Abed U., Goosmann C., Hurwitz R., Schulze I., Wahn V. Novel cell death program leads to neutrophil extracellular traps. J Cell Biol. 2007; 176: 231–41.
6. Branzk N., Papayannopoulos V.Molecular mechanisms regulating NETosis in infection and disease. Semin Immunopathol. 2013; 35(4): 513–30.doi: 10.1007/s00281-013-0384-6.
7. Patel S., Kumar S., Jyoti A., Srinag B.S., Keshari R.S., Saluja R., Verma A., Mitra K., Barthwal M. K Krishnamurthy H. Nitricoxide donors release extracellular traps from human neutrophils by augmenting free radical generation.Nitric Oxide. 2010; 22: 226–34.
8. Rao A.N., Kazzaz N.M., Knight J.S. Do neutrophil extracellular traps contribute to the heightened risk of thrombosis in inflammatory diseases? World J Cardiol. 2015; 7(12): 829–42. doi: 10.4330/wjc.v7.i12.829
9. Fuchs T.A., Abed U., Goosmann C. etal. Novel cells death program leads to neutrophil extracelllula rtraps. J. CellBiol. 2007; 176(2):231_241.
10. Yousefi S., Gold J. A., Andina N., Lee J. J. etal. Catapult_like release of mitochondrial DNA by eosinophils contributes to antibacterial defense. Nature Medicine 2008; 14(9): 949_953.
11. Brinkmann V., Rechard U., Goosmann C. etal. Neutrophil extracellular traps kill bacteria. Science 2004; 303: 1532_1535. 28. Brinkmann V., Zychlinsky A. Beneficial suicide: why neutrophils die to, make NETs. NatureRev. 2007; 5: 577_582.
12. Fuchs H. J., Borowitz D. S., Christiansen D. H. etal. Effect of Aerosolized Recombinant Human Dnase on Exacerbationsof Respiratory Symptoms and on Pulmonary_Function in Patients with Cystic_Fibrosis. New England Journal of Medicine 1994; 331(10): 637_642.
13. Lee W. L., Grinstein S. The tangled webs that neutrophils weave. Science 2004; 303(5663): 1477-1478.
14. Oehmcke S., Morgelin M., Herwald H. Activation of the Human Contact Systemon Neutrophil Extracellular Traps. J.InnateImmun. 2009; l:225-230.
16. Citrullinated Histone H3: Early Biomarker of Neutrophil Extracellular Traps in Septic Liver Damage. Nomura K, Miyashita T, Yamamoto Y, Munesue S, Harashima A, Takayama H, Fushida S, Ohta T.J Surg Res. 2019 Feb;234:132-138. doi: 10.1016/j.jss.2018.08.014. Epub 2018 Oct 10.PMID: 30527465.
18. Steroids.2018 May;133:96-101. doi: 10.1016/j.steroids.2017.11.006.Epub 2017 Nov16. Neutrophil elastase in the tumor microenvironment. Lerman I, Hammes SR.
19. Chronic obstructive pulmonary disease and mortality from pneumonia: a meta-analysis / Y.K. Loke [et al.] // Int. J. Clin. Pract. – 2013. – Vol. 67, № 5. – P. 477–487.
Введение. Тщательное изучение морфологических форм нейтрофильных гранулоцитов и их функциональной активности всё ещё остается важной задачей практической медицины. Нейтрофильные гранулоциты активно участвуют в реакциях как врожденного так и приобретенного иммунитета, а также в поддержании гомеостаза организма в целом [1,2]. В современной литературе известно, что нейтрофилы обладают свойством сохранять свою антимикробную активность даже после того, как клетка заканчивает свой антимикробный цикл.
Цель данной статьи - изучить современные представления о механизмах формирования нейтрофильных внеклеточных ловушек для формулирования дальнейших научных поисков по данной проблеме.
Материал исследования - аналитический обзор научных данных за последние 10 лет по проблеме исследования НВЛ; систематизация имеющихся материалов. Методы исследования – теоретический, методологический, организационный, построение научной гипотезы.
В 2004 году описан новый механизм антимикробного действия нейтрофилов – образование нейтрофильных внеклеточных ловушек (neutrophil extracellulartraps, NETs или НВЛ). Длительный период времени апоптоз считался единственной физиологической формой программируемой гибели нейтрофилов в процессе поддержания гомеостаза. Тем не менее, в исследованиях последних лет было обнаружено, что для эффективного разрешения исхода воспаления в нейтрофилах предусмотрены и иные антибактериальные стратегии – дегрануляция и нетоз (внеклеточные ловушки, НВЛ). Эти пути взаимодействия организма и патогена также играют ключевую роль в повреждении тканей, обеспечивая цитотоксические функции.
Нейтрофилы являютсяодним из важнейших компонентов неспецифической защитной системы организма. После активации нейтрофилов патогенными микроорганизмами в них происходит каскад окислительных реакций. Окислительные реакции провоцируют формирование большого количества свободных радикалов, обладающих выраженным бактерицидным действием. Нейтрофильные гранулы содержат ряд веществ, разрушающие клеточную стенку бактерий: лизоцим и лактоферрин, а также и гидролитические ферменты [3]. Нейтрофилы, являясь первыми иммунными клетками, достигающие места повреждения или инфицирования, являются ключевыми компонентами в уничтожении микробов [4, 5]. Следовательно, нейтрофилы выступают в качестве первой линии защиты от патогенных микроорганизмов посредством фагоцитоза, выделения активных форм кислорода (АФК) и дегрануляции [6,7].
Процесс формирования внеклеточных ловушек отличается от некроза морфологическими изменениями ядра, предшествующие образованию сетей. Ядерная мембрана во время некроза остается обычно неизменной, а при образования сетей распадается на большое количество пузырьков. Нейтрофилы нейтрализуют или локализуют распространение патогенных микроорганизмов, образовав внеклеточные ловушки в тех случаях, когда поглощаемый патоген слишком велик для фагоцитоза [9]. Еще одной отличительной особенностью в процессе формирования НВЛ является специфическая активация нейтрофила с участием NADPH оксидазы. Выявлено, что большинство нейтрофильных гранулоцитов имеют способность генерировать внеклеточные сети. Литературные источники свидетельствуют, что существуют механизмы регулирования программы запуска нейтрофилов, которая завершается формированием НВЛ [10]. Данная стратегия действия нейтрофилов является последним шагом в программе активной контролируемой клеточной гибели нейтрофилов. По мнению ряда исследователей, установлено, что генерация нейтрофилами внеклеточных ловушек является важным механизмом врожденного иммунного ответа, защищающий организм от большинства инфекционных агентов [11, 12].
В результате проведенных исследований были предложены две модели формирования нейтрофильных ловушек. Первая модель генерации нейтрофилами ловушек является одной из форм запрограммируемой клеточной гибели, характеризующаяся нарушением целостности клеточной мембраны с последующей секрецией деконденсированного хроматина и содержимого гранул во внеклеточное пространство [13]. Эта модель формирования ловушек является зависимой от НАДФН-оксидазы. Данный механизм характеризуется фрагментацией ядерной оболочки, секрецией деконденсированного хроматина вместе с гистоновыми белками в цитоплазму. Впоследствии чего происходит сокращение нитей цитоскелета, клеточная мембрана теряет свою целостность, и сформированная масса биологически активных веществ высвобождается во внеклеточное пространство[14]. Механизм формирования сети занимает 120–240 минут [15]. Вторая модель (альтернативный механизм) формирования ловушек представлена образованием сетей из митохондриальной ДНК интактных нейтрофилов, содержащих пузырьки, которые секрктируют деконденсированный хроматин и гранулярные гистоновые белки в межклеточное пространство. Альтернативный механизм образования внеклеточных ловушек зависит от индукции активных форм кислорода, протекающий быстро (в течение 5–60 мин). Данная модель не связана с клеточной гибелью, но ассоциирована с аутофагией [16]. Из анализа литературных источников установлено, что нейтрофильная внеклеточная ловушка, образованная из митохондриальной ДНК отличается от ловушек, полученных из ядерной ДНК. Исследования показали, что митохондриальные внеклеточные ловушки содержат гистоновые белки и ферменты гранул нейтрофилов с митохондриальной ДНК, в которых отсутствовали ядерные протеины (Yousefi et al. 2009).
Исследованиями ученых выявлено, что количество формирования нейтрофильных внеклеточных ловушек зависит от течения заболевания. Распределение нейтрофилов и нейтрофильных внеклеточных ловушек при сердечно-сосудистой патологии обусловлено в различных типах осложнений бляшек или кровоизлияний. Ученые доказали, что присутствие нейтрофильных сетей обратно пропорционально возрасту массы тромба или кровотечения, но остается высоким в продолжающихся кровотечениях.
Таким образом, доказано что образование нейтрофильных внеклеточных ловушек может способствовать прогрессированию тромботических или геморрагических осложнений, приводящих к формированию клинических коронарных ишемических синдромов[17, 18].
Представления о роли НВЛ при онкологии сильно варьируют. С одной стороны, есть данные об антиканцерогенных свойствах НВЛ, связанных с прямым разрушением опухолевых клеток и стимуляцией иммунной системы. Миелоидные клетки секретируют нейтрофильную эластазу и внеклеточные ловушки нейтрофилов в ответ на сигналы в микроокружении опухоли, что приводит к усилению активности при различных типах рака. Нейтрофильная эластаза, действительно, может быть движущей силой онкогенеза, в качестве стимулирующего фактора при раке, уделяя особое внимание точным механизмам, с помощью которых она способствует росту первичной опухоли и метастазированию вторичных органов [19].
Высокая заболеваемость внебольничной пневмонией и возрастающая доля в их числе резистентных и тяжелых форм, приводящих к летальному исходу, определяют необходимость углубленных исследований патогенетических механизмов тяжелых пневмоний в целях открытия путей оптимизации диагностики и лечения.
Одним из актуальных направлений исследования ВП является изучение внеклеточных нейтрофильных ловушек, обладающих двоякой ролью: с одной стороны, выполняют защитную функцию, с другой - являются потенциальными медиаторами тканевого повреждения [20]. В этой связи оценка образования внеклеточных ловушек представляет безусловную актуальность и важность поскольку во многом может определить развитие и исходы острой пневмонии и ХОБЛ.
Таким образом, представляет интерес оценка способности нейтрофилов к образованию внеклеточных ловушек при социально-значимых заболеваниях. Необходимо провести дальнейшие исследования, которые расширят представление о механизмах формирования НВЛ при различной патологии. Полученные результаты исследования возможно внесут определенный вклад в изучение механизмов развития внеклеточных ловушек и определить новые цели для терапевтического воздействия.
Приводятся новые сведения о нейтрофильных внеклеточных ловушках (НВЛ), осуществляющих захват и киллинг патогенных микроорганизмов с большей эффективностью, чем при фагоцитозе. Представлен современный взгляд на то, каким образом нейтрофилы выбирают внутриклеточный (фагоцитоз) или внеклеточный (нетоз) механизм бактерицидное™ при взаимодействии с патогенными микроорганизмами. Проанализированы экспериментальные данные о наличии у возбудителей чумы, холеры и мелиоидоза механизмов защиты от бактерицидного эффекта НВЛ, а также о роли НВЛ в регуляции иммунного ответа и развитии сепсиса.
Ключевые слова
Об авторе
Список литературы
2. Воробьева Н.В., Пинегин Б.В. Нейтрофильные внеклеточные ловушки: механизмы образования, роль в норме и при патологии. Биохимия. 2014, 79 (12): 1580-91.
3. Долгушин И.И., Савочкина А.Ю., Курносенко И.В., Долгушина В.Ф., Савельев А.А. Самусева И.В., Майкова В.Б. Участие внеклеточных нейтрофильных ловушек в защитных и патологических реакциях организма. Российский иммунологический журнал. 2015, 9 (18), 2: 164-170.
4. Киселева Е.П. Новые представления о противоинфекционном иммунитете. Инфекция и иммунитет. 2011, 1:9-14.
5. Кравцов А.Л., Шмелькова Т.П., Щуковская Т.Н. Влияние противочумной вакшошаа на функциональную активность клеток врожденного иммунитета человека. Прос.-особо опасных инф. 2011, 1 (107): 77-80.
6. Кравцов А.Л. Формирование внеклеточных ловушек - эффективный механизм защиты от патогена. Пробл. особо опасных инф. 2012, 2 (112): 69-74.
7. Кутырев В.В., Коннов Н.П., Волков Ю.П. Возбудитель чумы: ультраструктура и локализация в переносчике. М., Медицина, 2007.
9. Семенов Б.Ф., Зверев В.В. Концепция быстрой иммунологической защиты от патогенов. Журн. микробиол. 2007, 4: 93-100.
10. Фрадкин В.А. Диагностика аллергии реакциями нейтрофилов крови. М., Медицина, 1985.
11. Beiter К., Wartha Е, Albiger В. et al. An endonuclease allows Streptococcus pneumoniae to escape from neutrophil extracellular traps. Curr. Biolology. 2006, 16: 401-407.
12. Branzk N., Lubojemska A., Hardison S.E. et al. Neutrophil sense microbial size and selectively release neutrophil extracellular traps in response to large pathogens. Nat. Immunol. 2014, 15 (11): 1017-1025.
13. Brinkmann V., Reichard U., Goosmann C. et al. Neutrophil extracellular traps kill bacteria. Science. 2004, 303: 1532-1535.
14. Camicia G., Pozner R., Larranaga G. Neutrophil extracellular traps in sepsis. Shock. 2014,42 (4): 286-294.
15. Casutt-Mayer S., Renzi E, Schmaler M. et al. Oligomeric coiled-coil adhesin YadA is a double-edged sword. PLoS ONE. 2010, 5 (12): e 15159. doi: 10.1371/journal. pone. 0015159.
16. Chen G., Zhang D., Fuchs T.A. et al. Heme-induced neutrophil extracellular traps contribute to the pathogenesis of sickle cell disease. Blood. 2014, doi: 10.1182/blood-2013-10-529982.
17. Clark S.R., Ma A.C., Tavener S.A. et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nat. Med. 2007, 13: 463-469.
18. Davey H.M., Kell D.B. Flow cytometry and cell sorting of heterogeneous microbial populations: the importance of single-cell analysis. Microbiol. Rev. 1996, 60: 641-696.
19. de Jong H.K., Koh G., Achouiti A. et al. Neutrophil extracellular traps in the host defense against sepsis induced Burkholderia pseudomallei (melioidosis). Intensive Care Medicine Experimental. 2014, 2 (21). doi: 10.1186/s40635-014-0021-2.
20. Domenech M., Ramos-Sevillano E., Garcia E. et al. Biofilm formation avoids complements immunity and phagocytosis of Streptococcus pneumoniae. Infect. Immun. 2013, 81: 2606-2615.
21. Eisele N.A., Lee-Lewis H., Besch-Williford C. et al. Chemokine receptor CXCR2 mediates bacterial clearance rather than neutrophil recruitment in murine model of pneumonic plague. Am. J. Pathol. 2011, 178 (3): 1190-1200.
22. Fuchs T.A., Abed U., Goosmann C. et al. Novel cell death program leads to neutrophil extracellular traps. J. Cell Biol. 2007, 176: 231-241.
24. Gupta A.K., Joshi M.B., Phillippova M. et al. Activated endothelial cells induce neutrophil extracellular traps and are susceptible to NETosis-mediated cell death. FEBS Lett. 2010, 584: 3193-3197.
25. Hickey M.J., Kubes P. Intravascular immunity: the host-pathogen encounter in blood vessels. Nat. Rev. Immunology. 2009, 9: 364-375.
26. Kravtsov A.L., Bobyleva E.V., Grebenyukova T.P., Kuznetsov O.S., Kulyash Y.V. Flow micro-fluorometric analysis of phagocyte degranulation in bacteria infected whole human blood cell cultures. Proc. SPIE. 2002, 4707: 395-402.
27. Landoni V.I., Chiarella R, Martire-Greco D. et al. Tolerance to lipopolysaccharide promotes an enhanced neutrophil extracellular trap formation leading to a more efficient bacterial clearance in mice. Clin, and Exper. Immunol. 2012, 168: 153-163.
28. Ma C.A., Kubes P.K. Platelets, neutrophils, and neutrophil extracellular traps in sepsis. J. Thromb. Haemostasis. 2008, 6 (3): 415-420.
30. Mayer-School A., Hurwitz R., Brinkmann V. et al. Human neutrophils kill Bacillus anthracis. PLos Pathog. 2005, 1 (3): e23. doi: 10.1371/joumal. ppat. 0010023.
31. McAdow M., Kim H.A., DeDent A.C.etal. Preventing Staphylococcus aureus sepsis through the inhibition of its agglutination in blood. PLoS Pathog. 2011,7 (10): e 1002307. doi: 10.1371/ jounal. ppat: 1002307.
32. McDonald B., Urrutia R., Yipp B.G. et al. Intravascular neutrophil extracellular traps capture bacteria from bloodstream during sepsis. Cell Host Microbe. 2012, 12 (3): 324-333.
33. Murphey E.D., Fang G., Varma T.K., Sherwood E.R. Improved bacterial clearance end decreased mortality can be induced by LPS tolerance and is not dependent upon IFN-gamma. Shock. 2007, 27: 289-295.
34. Papayannopoulos V, Metzier K.D., Hakkim A., Zychlinsky A. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps. J. Cell Biol. 2010, 191: 677-691.
35. Prashar A., Bhatia S., Gigliozzi D. et al. Filamentous morphology of bacteria delays the timing of phagosome morphogenesis in macrophages. J. Cell Biol. 2013, 203: 1081-1097.
36. Riyara D., Buddhisa S., Korbsrisate S. et al. Neutrophil extracellular traps exhibit antibacterial activity against Burkholderia pseudomallei and are influenced by bacterial and host factors. Infec.Immun. 2012, 80 (11): 3921-3929.
37. Seper A., Hosseinzadeh A., Gorkiewicz G. et al. Vibrio cholerae evades neutrophil extracellular traps by the activity of two extracellular nucleases. PLoS Pathog. 2013, 9 (9): el003614. doi: 10.1371/journal, ppat.1003614.
38. Seper A., Fengler V.H., Roier S. et al. Extracellular nucleases and extracellular DNA play important roles in Vibrio cholerae biofilm formation. Mol. Microbiol. 2011, 82: 1015-1037.
39. Shannon J.G., Hasenkrug A.M., Dorward D.W. et al. Yersinia pestis subverts the dermal neutrophil response in mouse model of bubonic plague. mBio. 2013,4(5): eOO 170-13. doi: 10.1128/ mBio. 00170-13.
40. Silva T.M. Bacteria-induced phagocyte secondary necrosis as a pathogenicity mechanism. J. Leuk. Biology. 2010, 88 (5): 885-896.
41. Simpson A.J. Melioidosis: a clinical model for gram-negative sepsis. J. Med. Microbiology. 2001,50 (8): 657-658.
42. Tanaka K., Koike Y., ShimuraT. etal. In vivo characterization of neutrophil extracellular traps in various organs of a murine sepsis model. PLoS One. 2014, 9 (11): ell 1888. doi: 10.1371/ journal, pone.0111888.
43. Tang A.H., Brunn G.J., Cascalho M., Platt J.L. Pivotal advance: endogenous pathway to SIRS, sepsis, and related conditions. J. Leuk. Biology. 2007, 82: 282-285.
44. Tillack K., Breiden R, Martin R., Sospedra M. T-lymphocyte priming by neutrophil extracellular traps links innate and adaptive immune responses. J. Immunology. 2012, 188 (7): 3150-3159.
45. Weinrauch Y., Drujan D., Shapiro S.D. et al. Neutrophil elastase targets virulence factors of enterobacteria. Nature. 2002, 417: 91-94.
46. Yoong P., Cywes-Bentley C., Pier G.B. Poly-N-Acetylglucosamine expression by wild-type Yersinia pestis is maximal at mammalian, not flea, temperatures. mBio. 2012,3(4). E00217-12. Doi: 10.1128/mBio.00217-12.

Нейтрофилы — наиболее распространенный вид лейкоцитов. Они являются важной составляющей врожденного иммунитета и представляют собой первую линию защиты организма от инфицирования бактериями, грибами и простейшими. Фагоцитоз и секреция антимикробных веществ из гранул — не единственные функции нейтрофилов. В 2004 году был открыт еще один механизм борьбы с микробной инвазией: формирование нейтрофильных внеклеточных ловушек (NET — neutrophil extracellular traps). Эти ловушки позволяют нейтрофилам уничтожать внеклеточные патогены при минимальном повреждении клеток хозяина.
Механизм образования NETs
Основными компонентами внеклеточных нейтрофильных ловушек являются гистоны, ферменты и пептиды гранул (нейтрофильная эластаза, миелопероксидаза, катепсин G, лактоферрин, желатиназа, лизоцим С, кальпротектин и другие). Процесс образования NETs называется NETosis и может быть вызван различными индукторами: микроорганизмами, бактериальными компонентами, активированными тромбоцитами, комплементарными пептидами, аутоантителами, IL-8, перекисью водорода, кристаллами урата, сигаретным дымом. После контакта индуктора с рецепторами на мембране клетки активируется молекулярный каскад, который приводит к выходу кальция из эндоплазматического ретикулума, что в свою очередь вызывает повышение активности цитоплазматической деиминазы PAD4. Наряду с этим уменьшается конденсация хроматина. Через некоторое время нейтрофилы теряют гетерохроматические области ядра, в результате чего ядра расширяются и становятся круглыми. Ядерная оболочка распадается на везикулы, мембраны гранул и митохондрий разрушаются, что приводит к смешению цитоплазмы, кариоплазмы и антибактериальных пептидов. Белки гранул адсорбируются на отрицательно заряженных фибриллах деконденсированного хроматина, который служит скелетом для ловушки. В конечном итоге клеточная мембрана разрывается и содержимое клетки выбрасывается наружу и разворачивается в пространстве, образуя сеть [1].
Описанный механизм называется suicidal NETosis (суицидальный нетоз). Однако известно, что нейтрофилы могут продуцировать NET, выделяя часть ядра или ядро целиком, и не нарушать целостность клеточной мембраны. Такой механизм получил название vital NETosis (прижизненный нетоз). Эти две формы одного и того же процесса имеют существенные различия. Во-первых, суицидальный нетоз вызывается в основном химической стимуляцией гранулоцитов и требует несколько часов для продукции NET, в то время как прижизненный нетоз активируется при раздражении нейтрофилов бактериальными агентами и занимает меньшее время. Во-вторых, vital NETosis не приводит к лизированию клетки, и она сохраняет способность к хемотаксису и фагоцитозу. Третье отличие заключается в механизме выпуска ловушек. Как было описано выше, при суицидальном нетозе происходит деконденсация хроматина, растворение ядерной оболочки и выброс содержимого клетки через перфорацию в плазматической мембране. Во время прижизненного нетоза происходит перенос ДНК из ядра во внеклеточное пространство с помощью везикул. Везикулы с ДНК, отделившиеся от ядра, проходят через цитоплазму и сливаются с клеточной мембраной, тем самым выбрасывая NET из клетки без перфорации мембраны [2].
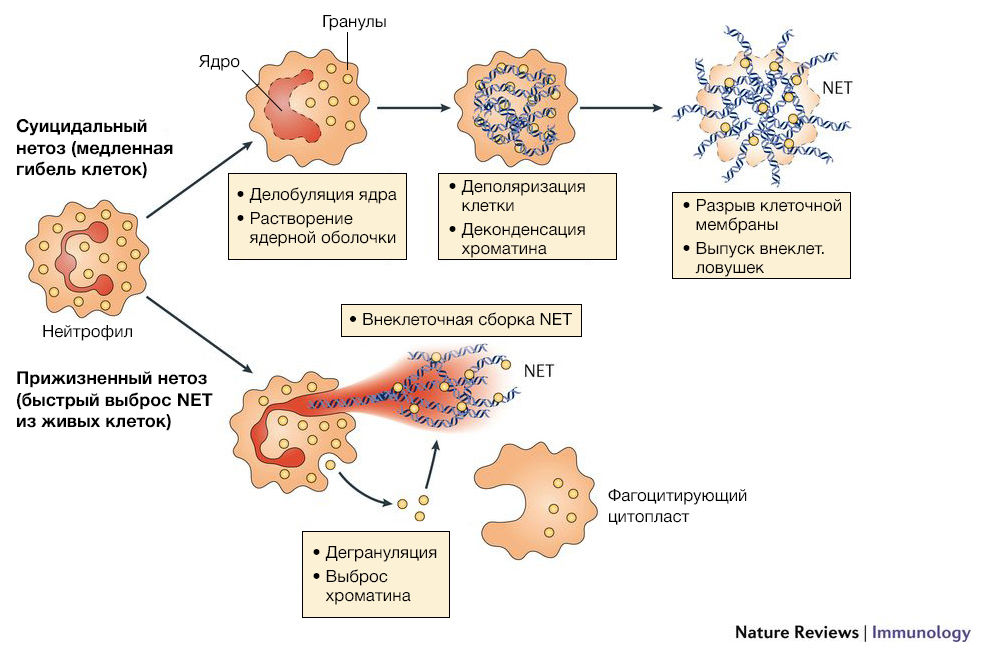
Источник: Nature Reviews Immunology
Антимикробные функции NETs
Антимикробная функция внеклеточных нейтрофильных ловушек связана с уничтожением микроорганизмов, а также с предотвращением их распространения из точки входа. Отрицательно заряженная ДНК служит каркасом для компонентов NET, одновременно захватывая и удерживая микроорганизмы. Бактерии, продуцирующие нуклеазы, могут расщеплять ловушки и высвобождаться из них, что способствует распространению бактерий за пределы места инвазии. Например, род Streptococcus, вызывающий у людей опасные заболевания, продуцирует нуклеазы. Ингибирование экспрессии ДНКаз способствует снижению вирулентности, а индуцирование их экспрессии способствует образованию гипервирулентной формы стрептококков [1] [2].
NETs также эффективны против грибов. Они могут захватывать и уничтожать как дрожжевые, так и гифальные формы. Причем дрожжевые формы грибов задерживаются относительно низким количеством нейтрофилов, тогда как штаммы, образующие гифы, подвергаются атакам большего числа гранулоцитов [1].
Роль NETs в тромбозе
Хотя патогенез артериального и венозного тромбоза различен, в обоих этих процессах принимают участие NETs. При венозном тромбозе активированный эндотелий высвобождает фактор фон Виллебранда и P-селектин, которые привлекают тромбоциты и нейтрофилы. Во время активации тромбоциты индуцируют нейтрофилы, и те высвобождают внеклеточные ловушки, которые становятся каркасом для построения тромба и адгезии тромбоцитов. NETs способствует расщеплению ингибитора тканевого фактора и стимуляции Ха фактора [3].
NETs также играют значимую роль в образовании атеросклеротических бляшек, которые могут привести к артериальному тромбозу. При контакте нейтрофилов с кристаллами холестерина может спонтанно запускаться нетоз, который приводит к задержке тромбоцитов, активации коагуляции и образованию артериальных тромбов [4].
NETs при заболеваниях легких
Муковисцидоз (кистозный фиброз) — наследственное заболевание, при котором происходит мутация гена трансмембранного регулятора муковисцидоза. Пациенты с этим заболеванием страдают от скопления вязкой слизи в легких, которая закупоривает дыхательные пути. Различные инфекции легких, которые развиваются на фоне этого заболевания, вызывают массивную инфильтрацию нейтрофилами и хроническое воспаление. Слизь у больных муковисцидозом содержит большое количество ДНК, большая часть которой находится в NETs [5]. Количество внеклеточной ДНК напрямую коррелирует со сниженной функцией легких [6]. Для симптоматического лечения можно использовать ингаляции ДНКазы I. При этом уменьшается вязкость слизи и улучшается функция легких, однако возрастает риск высвобождения высокоактивных ферментов и токсинов, которые могут повредить эпителий легких [1].
При хронической обструктивной болезни легких также обнаруживается большое количество нейтрофилов в легочной ткани. После длительного воздействия на дыхательные пути раздражителей, например, табачного дыма, больные начинают страдать от рецидивирующих бактериальных и вирусных инфекций, приводящих к повторным обострениям. Табачный дым провоцирует образование нейтрофильных внеклеточных ловушек. Кроме того, никотин непосредственно вызывает нетоз. Как и в случае с муковисцидозом, при тяжелой степени ХОБЛ повышается содержание NETs в слизи, особенно в фазе обострения [1].
NETs и рак
Длительное время считалось, что нейтрофилы остаются инертными по отношению к раковым клеткам во время роста опухоли и метастазирования. Однако в недавнем исследовании пациентов с саркомой Юинга в 25 % случаев NETs были найдены внутри опухоли. Впоследствии у этих пациентов появились метастазы, что указывает на то, что внеклеточные нейтрофильные ловушки могут способствовать прогрессированию опухоли [7].
В исследовании, сравнивающем две линии мышей с раком молочной железы (метастатическим и не метастатическим), было обнаружено большое количество нейтрофилов в местах имплантации метастаз, где они формировали внеклеточные ловушки, однако в местах имплантации не метастатических клеток они найдены не были [8].
В последние годы внеклеточные нейтрофильные ловушки интересны не только как фактор врожденного иммунитета, их также изучают с позиции участия в патогенезе различных заболеваний. Очевидно, что неконтролируемое избыточное или недостаточное формирование NETs может иметь серьезные последствия. Однако необходимо более точно определить их роль в механизмах развития различных заболеваний, поскольку это может открывать новые, более прогрессивные методы диагностики и лечения болезней.
Источники
Сепсис, характеризующийся избыточной иммунокоагуляцией, полиорганной недостаточностью и ограниченный терапевтическими возможностями, остается серьезной проблемой для фундаментальных и прикладных клинических исследований. Точечное воздействие на единственный медиатор (например, на активированный протеин C) пока не привело к значимому снижению смертности у пациентов с сепсисом [92]. Использование животных моделей (мышей) позволило выявить новые механизмы сепсиса, но многие факторы (например, важные различия в геномах людей и мышей) ограничивают возможность применения всех результатов для человека. Тем не менее, в последние годы было обнаружено множество молекулярных связей между процессами воспаления и гемокоагуляции [14, 17, 18], что расширило понимание особенностей патогенеза и последствий реакции макроорганизма на системную бактериальную инфекцию. Однако эти важные достижения поднимают новые научные вопросы, на которые необходимо ответить (см. Нерешенные вопросы). Ключевым открытием может быть новая функция инфламмасом в регуляции выделения и активации III фактора, что, как полагают авторы, приведет к всплеску исследований в области клеточного распознавания экзогенных или эндогенных сигналов о наличии угрозы, а также к определению структурной основы активации воспалительных каспаз и молекулярного механизма запрограммированной гибели клеток. Благодаря пересекающимся метаболическим путям активация зависимой от инфламмасом гемокоагуляции при сепсисе дополнительно усиливается с помощью STING1, HMGB1 и SQSTM1. Однако самая большая проблема связана с тем, что почти у всех иммунных медиаторов или факторов свертывания крови различные и взаимосвязанные друг с другом роли в патофизиологии сепсиса, а это означает, что отключение чего-то одного из них может одновременно повлиять как на гомеостатические, так и на патогенетические механизмы. Авторы выражают надежду, что, несмотря на эту сложность, дальнейшее углубленное изучение факторов инициации гемокоагуляции и сепсиса, промежуточных взаимосвязей, эффекторных механизмов и механизмов обратной связи иммунокоагуляции может выявить новые потенциальные методы терапии, которые могут принести пользу пациентам со смертельно опасными инфекциями. Учитывая, что 50 % бактериальных инфекций при сепсисе вызываются грамположительными микроорганизмами [3], также будет важно сравнить различия в иммунокоагуляции, вызванной грамотрицательными или грамположительными бактериями. Помимо воздействия на NLRP3 (Nod-подобный рецептор третьего типа из семейства NALP, цитозольный белок криопирин), NLRC4 также может оказаться подходящей точкой приложения антикоагулянтной терапии при сепсисе у людей, инфицированных Salmonella, Legionella и Pseudomonas aeruginosa, потому как NLRC4 опосредует ответ хозяина на эти патогены [93].
Каким образом GSDMD удается выполнять разные функции в разных иммунных клетках? Помимо каспаз, GSDMD может расщепляться иными ферментами. Согласно недавним исследованиям, расщепление и активация GSDMD в нейтрофилах человека или мыши опосредовано эластазой нейтрофилов (ELANE) независимо от каспаз [94], что помогает формировать нейтрофильные внеклеточные ловушки (NET) для элиминации бактерий [95]. Таким образом, разные способы такой элиминации GSDMD могут приводить к различной степени активности иммунокоагуляции. Кроме того, остается загадкой, могут ли быть белки-члены семейства GSDMD взаимодополняемы по своим функциям?
Оказывают ли различные варианты клеточной гибели разные эффекты на иммунокоагуляцию? В зависимости от вида клеток или инициирующих факторов, существуют различные способы клеточной гибели [96]. Высвобождение III фактора, HMGB1 и SQSTM1, а также тип и функционирование DAMP (damage-associated molecular patterns — молекулярный фрагмент, ассоциированный с повреждениями) и их рецепторов могут влиять на иммунокоагуляцию при инфекции и на степень повреждения тканей на мышиных моделях сепсиса [97].
Влияет ли иммунокоагуляция на течение иммуносупрессии при септическом шоке? После сверхсильного воспаления при сепсисе быстро возникают симптомы иммуносупрессии, что способствует присоединению вторичных инфекций [98]. Важно детально изучить динамические взаимоотношения и то, какие модуляторы (например, STING1 [17, 72]) служат связующим звеном между иммунокоагуляцией и иммуносупрессией при сепсисе.
Каковы различия в физиологии и патологии протекания сепсиса между мышами и людьми? В исследованиях по изучению сепсиса чаще всего используются мыши из-за простоты экспериментов, доступности генетически модифицированных видов и относительно низкой стоимости самих животных. Однако в последние несколько десятилетий экспериментальные попытки перенести результаты исследований на мышах на людей к явным успехам не привели [99].
Как создать лекарственное средство точного воздействия (т. н.прецизионную терапию) для лечения сепсиса? Прецизионная терапия — это метод лечения, подобранный к генетическим особенностям конкретного человека, впервые примененный у онкологических больных. Сепсис является гетерогенным синдромом [100], в развитии которого огромную роль играют различные генетически обусловленные и функциональные изменения в механизмах иммунокоагуляции. Ученые предполагают, что некоторые новые технологии (такие как секвенирование цельного генома из единственной клетки) могут способствовать более точному (индивидуально обусловленному) лечению сепсиса.
Когда могут быть готовы экспериментальные препараты для лечения сепсиса? Разработка лекарств — длительный, сложный и дорогостоящий процесс. Конечно же, трудно четко ответить, можно ли добиться успешного применения препарата из доклинических испытаний в исследованиях на людях. В связи с этим необходимы совместные усилия и сотрудничество промышленности, ученых и соответствующих компетентных властных структур.

Нейтрофилы составляют первую линию защиты при развитии воспаления. Воздействуя на патогены биологически-активными веществами, а также формируя нейтрофильные внеклеточные ловушки (NETs), они разрушают микроорганизмы и вызывают их гибель. Такой механизм уничтожения патогенов называется нетозом. Образование NETs имеет большое значение в патогенезе воспалительных процессов и в диагностике, лечении многих заболеваний. Обладая универсальным механизмом синтеза и высвобождения пептидов, в их биологически активной форме нейтрофилы играют ключевую роль во многих процессах: в несептическом воспалительном процессе при аутоиммунных заболеваниях, в тромбозе за счет экспрессии тканевого фактора (ТФ), в образовании фиброзной ткани за счет экспрессии ИЛ 17 и как следствие активации миофибробластов. Детальное изучение нетоза и его роли в патогенезе различных процессов имеет колоссальное значение в открытие новых диагностических тестов. Кроме того, изучение механизмов специфической активации нетоза с последующей экспрессией биологически активных молекул или напротив блокады нетоза открывает новые горизонты для патогенетического лечения многих заболеваний. Ключевые слова: нейтрофильные внеклеточные ловушки, нетоз Актуальность Изучение функции нейтрофильных гранулоцитов или нейтрофилов, по-прежнему остается весьма актуальным. Нейтрофилы составляют наибольшую популяцию белых кровяных клеток, первыми выходят в очаг воспаления, обнаруживаются в ткани уже через 6-24 часа и играют доминирующую роль в воспалительных процессах. Хемотаксис-фундаментальный механизм, посредством которого нейтрофиллы мигрируют в очаг повреждения. Хемотаксис нейтрофилов запускается хемокинами. К ним относятся различные молекулы и белки семейства цитокинов, название которых в переводе с греческого, означает способность вызывать клеточное (cyto-) движение (-kinos). Хемотактические цитокины, выделены в отдельную группу хемокинов, οсновными представителями которых являются интерлейкин-8 (IL-8) и компонент комплемента C5a или анафилатоксин. Вышеуказанные медиаторы продуцируются пораженной тканью или соседними клетками в месте воспаления. Кроме того, микробные продукты, такие как липополисахарид (LPS) и N-формил-метионин-лейцин-фенилаланин (fMLP), оказывают сильное хемотаксическое действие на нейтрофилы [1]. Взаимодействие нейтрофилов и активированных клеток эндотелия посредством молекул адгезии лежит в основе процесса миграции лейкоцитов из кровяного русла. В начале процесса межклеточное взаимодействие непрочно, и клетки перекатываются вдоль стенки сосудов по направлению тока крови. Одновременно с этим происходит экспрессия лейкоцитарных интегринов на клеточной мембране с последующим взаимодействием с их рецепторами, экспрессированными на поверхности эндотелиальных клеток. Усиление межклеточного взаимодействия приводит к прочной адгезии и последующей экстравазацией нейтрофилов в интерстициальное пространство. В очаге воспаления нейтрофилы используют плеяду механизмов для борьбы с патогенами микроорганизмами.
Читайте также:

