Некроз тазобедренного сустава вич
Обновлено: 11.05.2024
3. Клюшин Н.М., Ермаков А.М., Абабков Ю.В., Кушнаре С.В. Значение клинико-рентгенологических исследований в диагностике и лечении больных с перипротезной инфекцией после эндопротезирования тазобедренного сустава // Гений ортопедии. – 2017. – Т. 23., №3. – С. 341-345.
4. Национальные рекомендации по диспансерному наблюдению и лечению больных ВИЧ-инфекцией (клинический протокол) – 2015. – 205 с.
6. Хоминец В.В., Метленко П.А., Богданов А.Н., Кудяшев А.Л., Мироевский Ф.В. Ближайшие результаты лечения больных с перипротезными переломами бедренной кости после эндопротезирования тазобедренного сустава // Травматология и ортопедия России. – 2015. – №4. – С. 70-78.
Актуальность исследования. Операция по замене тазобедренного суставапозволяет человеку вернуться к полноценной жизни и распрощаться с теми артрозными симптомами, которые мешали испытывать жизненные радости много лет подряд. Как показывают исследования, осложнения после эндопротезирования тазобедренного сустава развиваются у 1% молодых людей и у 2,5% пожилых пациентов [3, с.341; 6, с.70]. По данным Joseph T., King Jr. (Yale University School of Medicine) и его коллег в исследовании, посвященном послеоперационной летальности у ВИЧ-инфицированных пациентов при эндопротезировании тазобедренного сустава, смертность в тридцатидневный период после операций составила 3,4%, тогда как у людей без ВИЧ-инфекции – 1,6% (разница в 2,11 раза) [3, с.341; 4; 6, с.71]. Послеоперационная смертность у ВИЧ-инфицированных была выше, чем у людей без ВИЧ, при любом уровне CD4-клеток, однако, уровень CD4-клеток значимо влиял на таковые риски в пределах группы ВИЧ-инфицированных [3, с.142; 6, с.72].
После корректировки потенциально значимых факторов исследователи обнаружили, что по сравнению с ВИЧ-отрицательной группой ВИЧ-инфицированные, которые имели 500 или больше CD4-клеток, имели риски 30-дневной послеоперационной летальности в 1,92 выше, чем у ВИЧ-отрицательных; при иммунном статусе (ИС)от 200 до 499 CD4-лимфоцитов – в 1,89 раза выше; при ИС от 50 до 199 клеток – в 2,66 раза; и при уровне CD4 менее 50 клеток/мкл – в 6,21 [1; 2; 4, с.133; 5].
Цель исследования – изучить актуальные вопросы эндопротезирования тазобедренного сустава у ВИЧ-инфицированных пациентов по данным литературы и по клиническим случаям больниц города Пермь.
Задачи исследования. Одной из важных задач является выявление всевозможных причин развития постоперационных осложнений у ВИЧ-инфицированных пациентов при эндопротезировании. Провести выборку и рассмотреть истории болезни пациентов травматологических отделений с ВИЧ-статусом, перенесших эндопротезирование тазобедренного сустава. Провести анализ полученных данных.
Нами изучены доступные литературные источники по проблеме эндопротезирования тазобедренного сустава у ВИЧ-инфицированных пациентов, в которых найдены ответы на такие вопросы как показания к операции, особенности хода операций, нюансы постоперационного ведения ВИЧ-инфицированных пациентов, возможные постоперационные осложнения, тактика борьбы с ними, постоперационная смертность ВИЧ-положительных пациентов ввиду развития осложнений.
Показания для эндопротезирования: Вполне естественно, что к выполнению замены тазобедренного сустава искусственным протезом должны быть весомые показания. В их основе лежит такое разрушение компонентов сочленения, при котором человек либо испытывает мучительную боль, либо не в состоянии выполнять элементарные движения пораженной конечностью. Другими словами, сустав перестает соответствовать своему физиологическому предназначению и становится ненужной частью организма, так как резко ухудшает качество жизни. В таких случаях эндопротезирование является единственным выходом их ситуации. К таким ситуациям относится: двусторонний деформирующий артроз II-III степени; односторонний деформирующий артроз II-III степени; деформирующий коксартроз III степени и анкилоз одного из крупных суставов на этой же конечности; односторонний коксартроз II-III степени одного тазобедренного сустава и анкилоз конрлатерального; двусторонний фиброзный или костный анкилоз тазобедренных суставов (болезнь Бехтерева); посттравматический коксартроз III степени на почве тяжелых повреждений вертлужной впадины; перелом и ложный сустав шейки бедренной кости у больных старше 70 лет; опухолевые процессы в головке и шейке бедренной кости, требующие резекции патологического очага.
Неприятные патологические ситуации, связанные с имплантацией, возникают нечасто. Однако они фиксируются, о чем должен быть проинформирован пациент. Согласно проводимым рандомизированным контролируемым исследованиям, получены следующие данные о наиболее распространенных проблемах: вывих головки протеза развивается примерно в 1,9 % случаев; септический патогенез – в 1,37 %;тромбоэмболия– в 0,3 %; перипротезный перелом возникает в 0,2 % случаев [3, с.341].
Второе по частоте неблагоприятное явление, характеризующееся активизацией тяжелых гнойно-воспалительных процессов инфекционной природы происхождения в районе установленного имплантата. Инфекционные антигены заносятся интраоперационно через недостаточно стерильные хирургические инструменты (редко) или после вмешательства по кровеносному руслу перемещаются от любого проблемного органа, имеющего болезнетворно-микробную среду (часто). Плохая обработка раневой зоны или слабое заживление (при диабете) также способствует развитию и размножению бактерий.
Гнойный очаг пагубно воздействует на прочность фиксации эндопротеза, вызывая его расшатывание и нестабильность. Гноеродная микрофлора трудно поддается лечению и, как правило, предполагает снятие имплантата и проведение повторной установки спустя продолжительное время. Основный принцип лечения – тест на установление вида инфекции, долгая и дорогостоящая антибиотикотерапия, обильный лаваж раны антисептическими растворами.
Для ВИЧ-инфицированных пациентов необходимо рассмотреть такой вопрос, как действие наркозного пособия. Общая анестезия существенно влияет на иммунную систему, приводя к еще большему ее угнетению. Ряд препаратов (тиопентал, сукцинилхолин, изофлюран, дроперидол, фентанил, кетамин) вызывает угнетение системы комплемента, подавление фагоцитоза и антителозависимой цитотоксичности, снижая потенциал антибактериальной защиты. В результате воздействия этих анестетиков в крови больных увеличивается скорость синтеза фактора некроза опухоли, α- и β-интерферонов, что вызывает гиперактивацию лимфоцитов, а значит – усиливает проявления воспаления.
Наиболее прогностически значимым является уменьшение содержания NK-клеток – естественных киллеров, осуществляющих противоопухолевую и противовирусную защиту, поскольку именно они являются наиболее чувствительным звеном этого воздействия и считаются самыми информативными критериями реактивности организма после операции. Оперативные вмешательства, выполненные под общей анестезией, могут приводить к нарушениям клеточного и гуморального иммунитета, снижению фагоцитарной активности и естественных киллеров, угнетению противоопухолевой защиты.
Таким образом, пациенты с тяжелой сопутствующей патологией и неблагоприятным фоновым заболеванием в форме ВИЧ-инфекции относятся к категории пациентов с потенциально высоким риском гематогенной диссеминации как источника инфекции в области эндопротеза.
В группе выборки, состоящей из 11 ВИЧ-инфицированных пациентов, которым было проведено одностороннее эндопротезирование тазобедренного сустава, наблюдалось постоперационное осложнение в форме парапротезного остеомиелита. У 9 пациентов данный процесс развивался в большом вертеле бедренной кости, у 2 пациентов процесс распространялся так же на вертлужную впадину. У всех исследуемых заболевание в течение трех месяцев перешло в форму хронического остеомиелита. Рецидив в форме обострения остеомиелита также наблюдался у всех пациентов. В течение года 10 пациентов погибли, у 9 из которых был установлен диагноз диссеминированного молниеносного септического состояния, 1 пациент умер от передозировки наркотическими препаратами. У 11-го пациента заболевание рецидивирует в течение последних 6 лет. На сегодняшний день у него определяется полный лизис большого и малого вертела, нарушение костной структуры вертлужной впадины с ее переломом и вклинением в малый таз чаши эндопротеза и полным вывихом головки эндопротеза (рис. 1).

Рис. 1. Рентгенография левого тазобедренного сустава в 2-х проекциях
(На рентгенограмме левого тазобедренного сустава (вынужденное положение - пациент не может разогнуть левую нижнюю конечность в положение стандартной укладки), произведено рентгеноскопическое исследование с прицельным снимком левого тазобедренного сустава в прямой проекции: состояние после эндопротезирования левого тазобедренного сустава, неадекватное стояние протеза: чаша фиксирована одним шурупом, вывернута, пролябирует в полость малого таза, крыша вертлужной впадины четко не определяется, головка эндопротеза расположена вне чаши, стояние ножки и централизатора эндопротеза в проекции центральной оси диафиза бедра)
Статья посвящена оценке функциональных результатов и определению частоты инфекционных осложнений при операции эндопротезирования тазобедренного сустава у ВИЧ-инфицированных пациентов. Пятилетний анализ результатов операций показал хорошую функциональную активность искусственных тазобедренных суставов, рентгенологическую стабильность компонентов и отсутствие осложнений. Опираясь на собственный опыт и данные зарубежной литературы в статье сделана попытка в качестве дискуссии выявить причинно- следственную связь между возникновением АНГБК и ВИЧ инфекцией, определить важность уровня CD4 лимфоцитов и его влияние на развитие инфекционных осложнений. Подводя итоги обзора литературы и личного клинического опыта, можно сказать, что возраст людей, пораженных АНГБК, страдающих ВИЧ инфекцией ниже, чем у тех, кто обладает ВИЧ отрицательным статусом. Так же можно сделать вывод, что наличие ВИЧ не является главной причиной возникновения асептического некроза, более того исследования показывают, что развитие осложнений происходит примерно с одинаковой вероятностью как у ВИЧ-отрицательных, так и у ВИЧ положительных людей. Именно по этой причине эндопротезирование тазобедренного сустава может существенно улучшить качество жизни ВИЧ инфицированных пациентов с заболеваниями тазобедренного сустава.

1. Barre-Sinoussi F. Chermann J.C., Rey F., Nugeyre M.T., Chamaret S., Gruest J., et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science 1983;220:868–871.
2. Chang C.H., Tsai S.W., Chen C.F., Wu P.K., Wong W.W., Chang M.C., Chen W.M. Optimal timing for elective total hip replacement in HIV-positive patients Orthop Traumatol Surg Res. 2018 Jun 27. S1877-0568.
6. Измайлов З.А., Морозов Д.П., Валитов М.Р. Проблема роста числа зараженных ВИЧ-инфекцией в современной России и возможные пути решения сложившейся ситуации // Молодой ученый. – 2016. – № 12. – С. 491–493.
7. Nicolai Lohse et al, Survival of Persons with and without HIV Infection in Denmark, 1995–2005. Ann Intern Med. Jan. 16, 2007;146:87-89.
8. Тихилов Р.М., Шубняков И.И., Плиев Д.Г., Денисов А.О., Мясоедов А.А., Гончаров М.Ю., Муравьева Ю.В., Коваленко А.Н., Базаров И.С., Артюх В.А., Карагодина М.П., Шильников В.А., Бояров А.А., Малыгин Р.В., Божкова С.А., Кочиш А.Ю., Шнейдер О.В., Разоренов В.Л., Билык С.С. Руководство по хирургии тазобедренного сустава. СПб., 2015. – Т. 2. – С. 356.
9. Pretell-Mazzini J., Subhawong T., Hernandez V.H., Campo R. HIV and orthopaedics: musculoskeletal manifestations and outcomes. J. Bone Joint Surg. Am. 2016;98:775–786.
10. Kirk D. Miller, et all. High Prevalence of Osteonecrosis of the Femoral Head in HIV-Infected Adults FREE.. Ann. Intern. Med. 2002;137(1):17-25.
13. Habermann B., Eberhardt C., Kurth A.A. Total joint replacement in HIV positive patients. J. Infect. 2008; 57(1):41-46
14. Wieser K., Zingg P.O., Betz M., Neubauer G., Dora C. Total hip replacement in patients with history of illicit injecting drug use. Arch Orthop Trauma Surg. 2012 Jul;132(7):1037-1044.
15. Hicks, Ribbans, Buzzard, et al. Infected joint replacements in HIV-positive patients with haemophilia. J Bone Joint Surg [Br] 2001;83-B:1050–1054.
16. Lubega N, Mkandawire N C, Sibande G C, Norrish A R, Harrison W J. Joint replacement in Malawi. Journal of Bone and Joint Surgery - British Volume. 2009;91-B(3):341–343.
17. Tornero E., García S., Larrousse M., Gallart X., Bori G., Riba J., Rios J., Gatell J., Martinez E. Total hip arthroplasty in HIV-infected patients: a retrospective, controlled study. HIV Med. 2012. Nov;13(10):623-9.
18. Brijlall Arthroplasty in HIV-infected patients — A 5 year follow-up. Journal of Bone and Joint Surgery – British Volume. 2008;90-B(SUPP_III):473.
19. Ta-I Wang a, Cheng-Fong Chen a,b, Wei-Ming Chen a,b,, Chao-Ching Chiang a,b, Ching-Kuei Huang a,b, Chien-Lin Liu a,b, Tain-Hsiung Chen a,b Joint replacement in human immunodeficiency virus-infected patients Journal of the Chinese Medical Association 75 (2012) 595-599.
20. Graham S.M., Lubega N., Mkandawire N., Harrison W.J. Total hip replacement in HIV-positive patients. Bone Joint J. 2014 Apr;96-B(4):462-6.
22. Green S., Kong V.Y., Laing G.L., Bruce J.L., Odendaal J., Sartorius B., Clarke D.L. The effect of stage of HIV disease as determined by CD4 count on clinical outcomes of surgical sepsis in South Africa. Ann. R. Coll. Surg. Engl. 2017 Jul; 99(6): 459–463.
23. Horberg M.A., Hurley L.B., Klein D.B., Follansbee S.E., Quesenberry C., Flamm J.A., et al. Surgical outcomes in human immunodeficiency virus-infected patients in the era of highly active antiretroviral therapy. Arch. Surg 2006;141: 238–245.
24. Davison S.P., Reisman N.R., Pellegrino E.D., Larson E.E., Dermody M., Hutchison P.J. Perioperative guidelines for elective surgery in the human immunodeficiency virus-positive patient. Plast. Reconstr. Surg. 2008;121: 1831–1840.
Среди впервые выявленных в 2015 г. ВИЧ-позитивных с установленными факторами риска заражения 53,6% инфицировались при употреблении наркотиков нестерильным инструментарием, 42,8% – при гетеросексуальных контактах, 1,5% – при гомосексуальных контактах, 2,1% составляли дети, инфицированные от матерей во время беременности, родов и при грудном вскармливании [4, 5, 6].
В настоящее время для лечения ВИЧ-инфекции используются высокоэффективные антиретровирусные препараты (ВААР терапия), которые включают мощные ингибиторы протеазы или ингибиторы обратной транскриптазы. Использование данных препаратов привело к увеличению продолжительности жизни ВИЧ-инфицированных и снижению развития оппортунистических инфекций.
Исследование N. Lohse позволяет прогнозировать более чем 35-летнюю выживаемость молодых ВИЧ-инфицированных людей, получающих современную терапию [7].
Наряду с этим все большее внимание врачей привлекают заболевания, возникающие у ВИЧ-положительных пациентов. Одним из таких заболеваний является асептический некроз головки бедренной кости (АНГБК). Асептический некроз головки бедренной кости (АНГБК) — тяжелое хроническое заболевание, вызванное недостаточностью местного кровообращения, которое ведет к разрушению костной ткани в головке бедра.
На ранних стадиях заболевание, как правило, протекает бессимптомно, а уже при наличии болевого синдрома остается чаще всего только один вариант лечения – хирургический. Боль, связанная с аваскулярным некрозом бедра, может сосредоточиться в паховой области, бедрах или крестцово-подвздошном сочленении, маскируя проблему и вынуждая пациентов долгое время получать лечение у неврологов по поводу остеохондроза позвоночника.
Почему асептический некроз головки бедренной кости является проблемой у ВИЧ-инфицированных людей?
Некоторые эксперты считают, что это может быть результатом хронической ВИЧ-инфекции. Другие считают, что длительное применение препаратов, таких как ингибиторы протеазы или стероиды, может привести к повреждению кровеносных сосудов, питающих головку бедра. Третьи считают, что метаболические изменения в организме, которые являются общими у ВИЧ-положительных людей, могут иметь значение в развитии асептического некроза [8].
И ВИЧ-инфекция, и лечение ВААРТ являются факторами риска для остеонекроза головки бедренной кости [9]; риск в 100 раз выше для ВИЧ-инфицированных пациентов, чем для населения в целом.
Американские ученые обнаружили необычайно высокий процент асептического некроза головки бедренной кости при МРТ-исследовании у ВИЧ-инфицированных. Данное исследование проведено у 339 ВИЧ-инфицированных пациентов, и процент с асептическим некрозом головки бедренной кости составил 4,4% [10].
В настоящее время не существует лечения, которое останавливает или лечит асептический некроз. Наркотические и ненаркотические обезболивающие препараты можно использовать краткосрочно для снятия симптомов. Нестероидные противовоспалительные средства могут уменьшать отек и воспаление в области тазобедренного сустава и могут использоваться для купирования болевого синдрома, связанного с асептическим некрозом.
Существуют, конечно, хирургические методы лечения, которые направлены на улучшение притока крови к пораженной области, однако чаще всего требуется тотальное эндопротезирование тазобедренного сустава для восстановления функции нижней конечности.
Распространено мнение, что иммунодефицит у ВИЧ-инфицированных больных увеличивает частоту инфекционных осложнений тотального эндопротезирования тазобедренного сустава. Parvizi с соавторами при анализе 21 операции тотального эндопротезирования тазобедренного сустава у ВИЧ-позитивных пациентов отметили возникновение глубокой инфекции у 6 пациентов. Авторы связали частоту осложнений со снижением количества СD4-лимфоцитов до 239±112 мкл [11].
По данным Калифорнийского университета в США в период c 2002 по 2008 гг. в США выполнено 8229 операций эндопротезирования у ВИЧ-инфицированных больных, что составило 0,14% от общего количества операций эндопротезирования. При этом эндопротезирование тазобедренного сустава составило 6449 пациентов – 79%. Частота инфекционных осложнений у ВИЧ-инфицированных больных в 2 раза превысила количество данных осложнений у ВИЧ-негативных пациентов и составила 0,6% [12].
Haberman с коллегами сообщили о развитии инфекции после тотального эндопротезирования тазобедренного сустава в 12,7% случаев в группе из 41 ВИЧ-инфицированного пациента, при этом не отмечено снижения CD4-лимфоцитов [13].
При исследовании пациентов, имеющих в анамнезе наркоманию и перенесших тотальное эндопротезирование тазобедренного сустава, Wieser с соавторами отметили возникновение септических осложнений в 70% случаев за период в 10 лет наблюдений и не нашли связи септических осложнений с положительными серологическими реакциями на ВИЧ [14].
Hicks с соавторами в результате многоцентрового ретроспективного анализа показали, что существует повышенный риск развития септических осложнений после тотального эндопротезирования тазобедренного сустава у ВИЧ-положительных, больных гемофилией [15].
Наблюдения Lubega не обнаружили различий в послеоперационном периоде при краткосрочном наблюдении за 14 пациентами (перенесшими 18 ТЭП), которые были ВИЧ-положительными, и 28 пациентами, которые были ВИЧ-отрицательными [16].
Tornero E. в своем исследовании показывает, что исход эндопротезирования тазобедренного сустава у ВИЧ-положительных пациентов не хуже, чем у ВИЧ-отрицательных пациентов [17].
Ta-I Wang с соавторами сообщили о 6 ВИЧ-положительных пациентах, которым в общем выполнено 10 оперативных вмешательств с 2000 по 2009 гг. Из них 7 – эндопротезирование тазобедренного сустава, два – коленного сустава и одно – эндопротезирование плечевого сустава. За период наблюдения в 38,6 месяца инфекционных осложнений не выявлено [19].
Graham SM сообщил о краткосрочном наблюдении и функциональном результате после тотального эндопротезирования тазобедренного сустава в группе ВИЧ-инфицированных пациентов, которые не страдают гемофилией и не имеют в анамнезе внутривенного употребления наркотиков. В общей сложности 29 пациентов подверглись 43 операциям тотального эндопротезирования тазобедренного сустава со средним сроком наблюдения от 6 месяцев до 3 лет. В группе было 10 женщин и 19 мужчин, средний возраст которых составил 47 лет и 7 месяцев (от 21 года до 59 лет и 5 месяцев). В период наблюдения инфекционных осложнений не было. Средняя предоперационная оценка по шкале Харриса была 27 (от 6 до 56), средняя послеоперационная была 86 (от 73 до 91), давая среднее улучшение на 59 пунктов [20].
Таким образом, при анализе зарубежной литературы мы не выявили единого мнения на предмет увеличения частоты инфекционных осложнений у ВИЧ-инфицированных пациентов, подвергшихся плановой операции тотального эндопротезирования тазобедренного сустава и влияния уровня CD4-лимфоцитов.
Цель исследования. На собственном клиническом материале выяснить причинно-следственные связи между ВИЧ-инфекцией и АНГБК, а также сравнить пред- и послеоперационный период после тотального эндопротезирования тазобедренного сустава у здоровых и больных людей. Оценить риски развития осложнений.
Материалы и методы. За последние 5 лет в период с 01.01.2011 по 31.12.2015 гг. в ФБГУ РНИИТО им. Р.Р. Вредена были госпитализированы 166 ВИЧ-инфицированных пациентов. Из них экстренная госпитализация у 50 пациентов (30%), плановая – у 116 (70%). Средний возраст пациентов 29,9 лет, от 22 до 66 лет. Среди всех госпитализированных ВИЧ-инфицированных преобладали мужчины ¾ 115 (69,3%) человек, женщины составили 51 человека (30,7%). Жители Санкт-Петербурга составили 85 (51,2%), Ленинградской области ¾ 25 (15%).
С патологией тазобедренного сустава госпитализировались 43 пациента, что составило 25,9% от общего числа ВИЧ-госпитализированных больных и 37% от числа плановых госпитализаций ВИЧ-инфицированных пациентов.
В отделении № 11 в период с 2012 по 2016 гг. выполнено 15 оперативных вмешательств у 13 ВИЧ-инфицированных пациентов, из них 3 операции реэндопротезирования у пациентов с асептической нестабильностью, на момент первичного эндопротезирования у этих больных ВИЧ не диагностировался, одно реэндопротезирование после установки спейсера, который был установлен пациентке с септическим некрозом головки бедренной кости после металлоостеосинтеза перелома шейки бедра. У двух пациентов выполнено двустороннее эндопротезирование с периодом между операциями 6 месяцев. У всех прооперированных пациентов уровень CD4-лимфоцитов перед операцией был более 300 клеток в 1 мм 3 . У троих пациентов на основании анамнеза зафиксировано внутривенное употребление наркотических препаратов, однако последняя инъекция произведена более чем за 3 года до операции.
Таким образом, подводя итоги обзора литературы и личного клинического опыта, можно сказать, что возраст людей, пораженных АНГБК, страдающих ВИЧ-инфекцией, ниже, чем у тех, кто обладает ВИЧ-отрицательным статусом.
Также можно сделать вывод, что наличие ВИЧ не является главной причиной возникновения асептического некроза. Более того, исследования показывают, что развитие осложнений происходит примерно с одинаковой вероятностью как у ВИЧ-отрицательных, так и у ВИЧ-положительных людей. Именно по этой причине эндопротезирование тазобедренного сустава может существенно улучшить качество жизни ВИЧ-инфицированных пациентов с заболеваниями тазобедренного сустава.
Однако предыдущие доклады по этой проблеме показали высокие показатели инфицирования ВИЧ-положительных пациентов, которым выполнялось тотальное эндопротезирование тазобедренного сустава [21, 22].
При глубоком и осмысленном анализе литературы всплывает еще одна патология, которая сопровождает ВИЧ-инфекцию, – гемофилия, представляющая собой патологию коагуляционной системы. И большинство негативных результатов с возникновением ранней перипротезной инфекции возникает у такой группы пациентов.
Так, в ретроспективном исследовании 102 случаев эндопротезирования тазобедренного сустава у ВИЧ-положительных пациентов из 8 центров гемофилии уровень инфицирования составил 18,7% при первичной артропластике и 36,3% при ревизии (средний срок наблюдения составил 5,7 лет) [15]. Кроме того, частота инфекционных осложнений у таких больных была значительно выше в группе с более низким предоперационным количеством CD4-лимфоцитов – в 49% случаев.
В другом исследовании из 27 артропластик коленного сустава и 7 – тазобедренного сустава у пациентов с ВИЧ-положительным статусом с гемофилией уровень ранних инфекционных осложнений составил 29,6% и 14,3% соответственно [21].
В исследовании, проведенном более 20 лет назад американскими коллегами, сообщалось, что 66 ВИЧ-положительных пациентов с предоперационным числом CD4 ≤ 200 клеток/мм 3 имели уровень инфицирования, достигающий 15,1% [22]. Авторы также сообщают об увеличении смертности у пациентов с ВИЧ-положительным статусом с числом лимфоцитов CD4
В настоящее время некоторые иностранные эксперты [20] предположили, что лучшее время для выполнения тотальной артропластики – когда количество CD4 составляет> 200 клеток/мм 3 , а другие > 400 клеток/мм 3 и не обнаруживается вирусная нагрузка [9].
К слову сказать, в немногих исследованиях упоминается вирусная нагрузка в качестве критерия повышения риска осложнений, в том числе инфекционных. В исследовании европейских коллег [23] 332 пациентов с ВИЧ-положительным статусом после ортопедических операций с вирусной нагрузкой из 30 000 к/мл имели высокий уровень осложнений, а другие исследователи сообщают об увеличении осложнений у ВИЧ-положительных пациентов с вирусной нагрузкой > 10 000 к. [24].
Таким образом, нет однозначного мнения и ясной картины о результатах и осложнениях после артропластики у ВИЧ-инфицированных пациентов.
В настоящий момент для решения вопроса о целесообразности эндопротезирования у данной группы пациентов, опираясь на опыт коллег из Европы, мы ориентируемся лишь на уровень CD4-лимфоцитов, а также на отсутствие терминальной стадии СПИД.
Исследования в этом направления будут продолжаться с целью разработки абсолютных противопоказаний для артропластики у ВИЧ-инфицированных пациентов или возможных корректирующих схем подготовки к этой плановой высокотехнологичной операции.
Коллективный опыт тотального эндопротезирования тазобедренного сустава в любом отечественном или западном медицинском учреждении небольшой и ограниченный, что требует дальнейшего изучения данной проблемы.
Асептический некроз (АН) чаще развивается у мужчин в возрасте 35–45 лет и носит двусторонний характер. В 90% случаев основными причинами развития АН служат злоупотребление алкоголем и длительная терапия глюкокортикоидами (ГК). Возникновение АН головок бедренных костей при применении ГК напрямую связано с дозой и продолжительностью их приема. Как правило, нетравматические остеонекрозы (ОН) развиваются при суммарной дозе ГК, эквивалентной ≥ 2 г преднизолона, на протяжении 2-3 мес. терапии. В статье приводится клинический случай развития множественных нетравматических ОН у молодого человека, получавшего ГК в течение относительно короткого периода времени.
Ключевые слова: остеонекроз, асептический некроз, аваскулярный некроз, глюкокортикоиды, осложнения глюкокортикоидной терапии.
Для цитирования: Башкова И.Б., Мадянов И.В. Множественные нетравматические остеонекрозы крупных суставов у молодого человека, спровоцированные непродолжительным лечением глюкокортикоидами // РМЖ. Ревматология. 2016. № 2. С. –128.
Для цитирования: Башкова И.Б., Мадянов И.В. Множественные нетравматические остеонекрозы крупных суставов у молодого человека, спровоцированные непродолжительным лечением глюкокортикоидами. РМЖ. 2016;2:125-128.
Avascular (or aseptic) necrosis (AN) occurs more frequently in men aged 35-45 and is bilateral. In 90% of patients, AN is mainly the result of alcohol abuse and long-term therapy with glucocorticoids (GCs). Avascular necrosis of the femoral head when taking GCs is directly associated with their dose and duration of use. Non-traumatic osteonecrosis (ON) generally occurs when receiving the total dosage of GCs that is equivalent to 2 g or more of prednisolone for 2 or 3 months. The paper describes the clinical case of multiple non-traumatic osteonecrosis in a young man who received GCs for a relatively short period of time.
Keywords: osteonecrosis, aseptic necrosis, avascular necrosis, glucocorticoids, side-effects of glucocorticoid therapy.
For citation: Bashkova I.B., Madyanov I.V. Multiple non-traumatic osteonecrosis of large joints in a young man provoked by short-term treatment with glucocorticoids // RMJ. Rheumatology. 2016. № 2. P. 125–128.
Приведен клинический случай множественных нетравматических остеонекрозов крупных суставов у молодого человека, спровоцированных непродолжительным лечением глюкокортикоидами
Остеонекроз (ОН) – поражение различных отделов кости множественной этиологии, возникающее в ответ на нарушение в ней кровообращения и приводящее к гибели костного мозга и трабекулярной кости [1]. Ежегодно во всем мире ОН тазобедренных, коленных, плечевых суставов и суставов других локализаций регистрируют примерно у 20 тыс. человек. Причем у одного больного может поражаться как один, так и несколько суставов. Например, симптоматический ОН головки бедра более чем в 10% случаев сопровождается вовлечением коленного и плечевого суставов, а у 3% больных встречается поражение суставов более 3-х анатомических областей [2].
Условно выделяют 4 категории ОН [1]:
1. Ишемический ОН (синонимы – аваскулярный или асептический некроз), развивающийся в ответ на локальное нарушение циркуляции при тромбозе основного сосуда или его ветвей, питающих кость.
2. ОН при хронических артритах, остеоартрозах, локальном и системном остеопорозе, при которых патологические изменения связаны с отеком костного мозга или субхондральных отделов кости. Наблюдающиеся при этом нарушения дифференцировки стромальных клеток и замещение костного мозга жировой тканью (как исход реактивного воспаления) неминуемо приводят к отеку (сдавлению) сосудов микроциркуляторного русла. Аналогичные изменения наблюдаются и в случае микропереломов костных трабекул при субхондральном остеопорозе.
3. ОН челюсти как нежелательная реакция терапии костных метастазов бисфосфонатами у онкологических больных.
4. Спорадический ОН (болезнь Легга – Кальве – Пертеса, болезнь Хасса и др.).
При асептическом некрозе (АН) гибель остеоцитов и клеток костного мозга наступает вследствие инфаркта кости, чему может способствовать недостаточное развитие в ней сосудистых коллатералей. В частности, недостаточное коллатеральное кровоснабжение свойственно области головки бедренной кости [3], что, вероятно, делает ее уязвимой в плане нарушения кровообращения.
АН, как правило, развиваются у молодых пациентов – в возрасте 35–45 лет [4], в 3 раза чаще у мужчин, в 75% случаев отмечается двустороннее поражение суставов [4, 5]. В 90% случаев основными причинами развития АН служат злоупотребление алкоголем и длительная терапия ГК [4]. В 5% случаев АН может быть обусловлен другими патологическими состояниями, круг которых достаточно широк. Среди них, в частности, системная красная волчанка (СКВ), ревматоидный артрит, системные васкулиты, различные коагулопатии, болезни накопления и многие другие [4, 6–11]. В 5% случаев причину АН установить не удается (идиопатический АН). Однако не исключено, что у некоторых больных с идиопатическим АН поражение кости обусловлено злоупотреблением алкоголя [1].
Из причинных факторов наиболее отчетливую связь с развитием АН обнаруживает терапия ГК. ОН – одно из серьезных осложнений лечения этими высокоэффективными лекарственными средствами, которые продолжают занимать достойное место среди современных фармакологических средств, используемых в ревматологической практике.
Развитие ОН при СКВ, дермато-/полимиозите, системных васкулитах сопряжено с длительным применением ГК в супрессивных дозах [12]. По наблюдениям В.В. Цурко, у пациентов, страдающих СКВ и получающих высокие дозы ГК, рентгенологическая картина АН головки бедренной кости развивается уже спустя 1,5–2 года от начала появления болей [13]. По данным Т. Yoshida et al., двустороннее поражение крупных суставов наблюдалось у 90% больных СКВ, находящихся на стероидной терапии, в период от 12 до 95 мес. (в среднем – через 51 мес.) [14].
Возникновение АН головок бедренных костей при применении ГК напрямую связано с дозой и продолжительностью их приема: риск увеличивается при получении суточной дозы преднизолона, превышающей 25 мг, на протяжении нескольких недель и месяцев, при достижении суммарной дозы более 3 г. В исследовании К.Н. Коо с соавт. было показано, что средняя доза преднизолона, при которой развивается АН, составляет в среднем 5928 мг, при этом магнитно-резонансные (МР) признаки АН становятся очевидными уже в течение 1 года (в среднем через 5,3 мес.) от начала стероидной терапии [15].
По мнению M. Mont et al., нетравматические ОН развиваются при суммарной дозе ГК, эквивалентной ≥ 2 г преднизолона, на протяжении 2–3 мес. терапии, при этом риск возникновения ОН весьма велик именно в период от 2 до 3 мес. [16].
Однако есть основания считать, что ОН при терапии ГК может возникать и при непродолжительных сроках лечения. Демонстрацией этого может служить следующий клинический случай.

Появление и усиление болей в плечевых суставах при движении, а затем и в покое, нарастание ограничения функции обоих плечевых суставов послужили поводом для проведения дообследования пациента в условиях стационара.
При поступлении в ревматологическое отделение РКБ в декабре 2015 г. при проведении физикального осмотра изменений со стороны внутренних органов выявлено не было, в то время как отмечались локальная болезненность при пальпации в проекции головок плечевых костей, уменьшение объема активных, в меньшей степени – пассивных, движений в плечевых суставах.
Общеклинические и биохимические анализы крови – в пределах референсных значений, за исключением низкого содержания витамина 25(ОН)D (10,49 нг/мл) и кортизола (110 нмоль/л при норме 150–660) в сыворотке крови. Сывороточный уровень паратгормона составил 15,34 пг/мл (при норме 15–65).
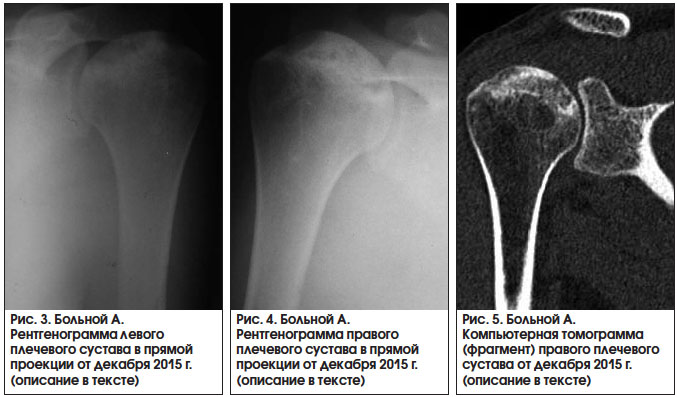
На рентгенограмме левого плечевого сустава выявлены смещение головки плечевой кости вверх и ротация ее кнутри, при этом головка кости была деформирована, уплощена, фрагментирована, отмечалась склерозно-кистозная перестройка ее костной структуры, суставная щель была неравномерна по ширине (рис. 3). На рентгенограмме (рис. 4) и компьютерной томограмме (рис. 5) правого плечевого сустава определялись импрессионный перелом и фрагментация головки плечевой кости с наличием неровной склерозированной зоны демаркации и ступеневидной деформации суставной поверхности глубиной до 0,6 см, склерозно-кистозная перестройка кости, неравномерное сужение суставной щели. Таким образом, у пациента выявлен двусторонний ОН плечевых суставов III рентгенологической стадии.
1. Ильиных Е.В., Барскова В.Г., Лидов П.И., Насонов Е.Л. Остеонекроз. Часть 1. Факторы риска и патогенез // Современная ревматология. 2013. № 1. С. 17–24. [Ilyinykh E.V., Barskova V.G., Lidov P.I., Nasonov E.L. Osteonecrosis. Part 1. Risk factors and pathogenesis // Modern Rheumatology Journal. 2013. Vol. 7(1). P. 17–24. (In Russian)]. doi: 10.14412/1996-7012-2013-2362.
2. Ревматические заболевания. В 3 т. Т. II. Заболевания костей и суставов: руководство / под ред. Д.Х. Клиппела, Д.Х. Стоуна, Л.Дж. Кроффорд, П.Х. Уайт; пер. с англ. под ред. Е.Л. Насонова, В.А. Насоновой, Ю.А. Олюнина. М.: ГЭОТАР-Медиа, 2012. С. 459–471. [Klippel J.L., Stoun J.H., Krofford P.J., Uait P.H. Rheumatic diseases. Vol. 2. Diseases of bones and joints. Nasonov E.L., Nasonova V.A., Olyunin Yu.A., editors. Moscow: GEOTAR-Media; 2012. P. 459–71. (In Russian)].
3. Bejar J., Peled E., Boss J.H. Vasculature deprivation – induced osteonecrosis of the rat femoral head as a model for therapeutic trials // Theor. Biol. Med. Model. 2005. Vol. 2. P. 24.
4. Malizos K.N., Karantanas A.H., Varitimidis S.E. et al. Osteonecrosis of the femoral head: etiology, imaging and treatment // Eur. J. Radiol. 2007. Vol. 63(1). P. 16–28.
5. Mankin H.J. Nontraumatic necrosis of bone (osteonecrosis) // N. Engl. J. Med. 1992. Vol. 326. P. 1473–1479.
6. Mont M.A., Hungerford D.S. Non-traumatic avascular necrosis of the femoral head // J. Bone Joint Surg. Am. 1995. Vol. 77(3). P. 459–474.
7. Vail T.P., Covington D.M. The incidence of osteonecrosis. In: Osteonecrosis: Etiology, Diagnosis, and Treatment. J.R. Urbaniak, J.P. Jones Jr. (еds). Rosemont, IL: American Academy of Orthopedic Surgeons, 1997. P. 43–49.
8. Larson A.N., McIntosh A.L., Trousdale R.T., Lewallen D.G. Avascular necrosis most common indication for hip arthroplasty in patients with slipped capital femoral epiphysis // J. Pediatr. Orthop. 2010. Vol. 30(8). P. 767–773.
9. Luedtke L.M., Flynn J.M., Pill S.G. A review of avascular necrosis in developmental dysplasia of the hip and contemporary efforts at prevention // The University of Pennsylvania Orthopaedic Journal. 2000. Vol. 13. P. 22–28.
10. Mont M.A., Zywiel M.G., Marker D.R. et al. The natural history of untreated asymptomatic osteonecrosis of the femoral head: a systematic literature review // J/ Bone Joint Surg. Am. 2010. Vol. 92(12). P. 2165–2170.
11. Morse C.G., Mican J.M., Jones E.C. et al. The incidence and natural history of osteonecrosis in HIV-infected adults // Clin. Infect. Dis. 2007. P. 44(5). Vol. 739–748.
12. Насонова В.А. Остеонекроз тазобедренного сустава // Consilium medicum. 2003. Т. 5. № 8. С. 452–454. [Nasonova V.A. Osteonecrosis of the femoral head // Consilium medicum. 2003. Vol. 5(8). P. 452–454. (In Russian)].
13. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке // Российский медицинский журнал. 1998. № 2. С. 28–37. [Tsurko V.V. Aseptic necrosis of the femur head in rheumatoid arthritis and systemic lupus erythematosus // Rossijskij medicinskij zhurnal. 1998. Vol. 2. P. 28–37. (In Russian)].
14. Yoshida T., Kanayama Y., Okamura M. et al. Long-term observation of avascular necrosis of the femoral head in systemic lupus erythematosus: an MRI study // Clin. Exp. Rheumatol. 2002. Vol. 20. P. 525–530.
15. Koo K.H., Kim R., Kim Y.S. et al. Risk period for developing osteonecrosis of the femoral head in patients on steroid treatment // Clin. Rheumatol. 2002. Aug. Vol. 21(4). Р. 299–303.
16. Mont M., Jones L., Hungerford D. Nontraumatic osteonecrosis of the femoral head: Ten years later // J. Bone Joint Surg. Am. 2006. Vol. 88. P. 1117–1132.
Тазобедренный сустав – один из самых важных в опорно-двигательной системе. Удерживая вес всего тела, сустав выдерживает огромные перегрузки.
Так выглядит заболевание.
Он представлен шаровидной формой и позволяет использовать все оси движения: аддукцию и абдукцию (сагиттальная ось), сгибание и разгибание (фронтальная ось), пронацию и супинацию (вертикальная ось). Из-за своей подвижности сустав часто повреждается.
Строение тазобедренного сустава
Одним из наиболее опасных повреждений является аваскулярный некроз головки бедренной кости (АНГБК). Он представляет собой следствие грубого нарушения локальной микроциркуляции с развитием ишемии и некротизацией компонентов костного мозга головки бедренной кости. ДДИ становятся следствием перенесенных операций на тазобедренном суставе, травм в анамнезе, перенесенного остеомиелита бедренной кости, развитием эпифизарной и/или спондилоэпифизарной дисплазии.
Перечислим несколько причин расстройства сосудистого русла, ведущих к некрозу:
- повторные инфаркты на фоне тромбоза артерий;
- длительная недостаточность артериального кровоснабжения сустава;
- венозный стаз;
- сочетанное нарушение артериально-венозной сети.
В качестве факторов, провоцирующих такую ситуацию, указываются: врожденная гипоплазия сосудов тазобедренного сустава, нарушение нейрогуморальных механизмов регуляции, недостаточная васкуляризация головки бедра, связанная с анатомической и функциональной незрелостью сосудистой сети.
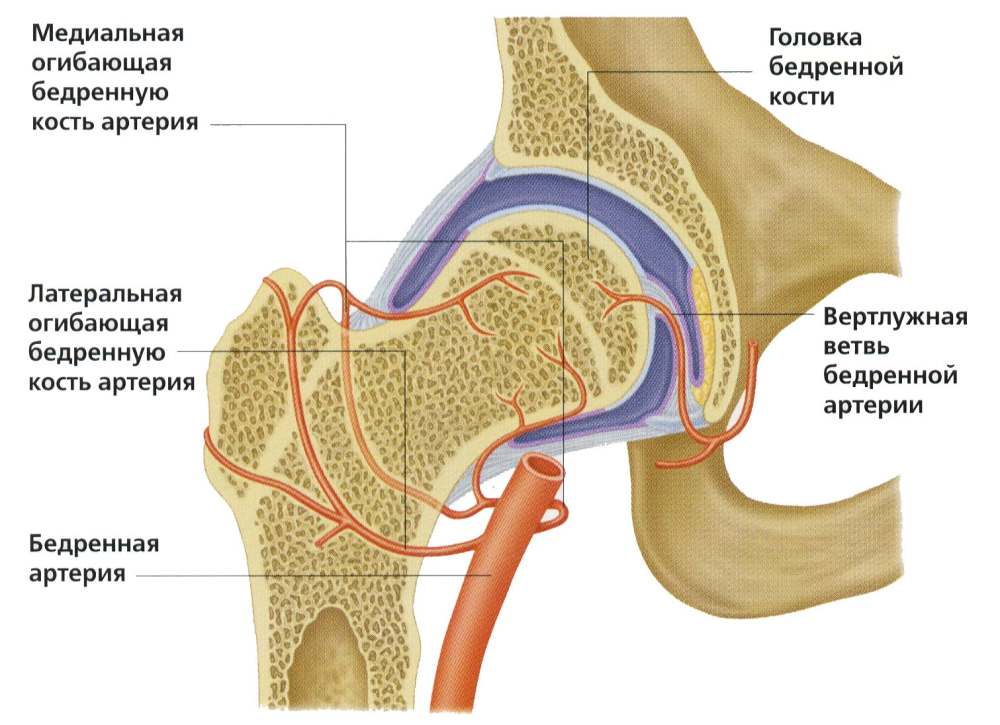
Кровоснабжение тазобедренного сустава
Нарушение питания костных компонентов тазобедренного сустава — распространения причина появления некротических изменений.
Симптомы и отличия от коксартроза
Симптоматика АНГБК определяется этапностью патологии. Начало отмечается бессимптомностью или незначительными болями без видимой причины. При этом сохраняется нормальный объем движения в суставе, болевые ощущения отмечаются при ротации бедра внутрь.
Прогрессирование болезни выражено приступообразными, тяжелыми болями. Такой симптом может свидетельствовать о наличии коллапса или перелома головки бедра, присущих завершающему этапу дегенеративных изменений. Они ведут к снижению объема движения и наличию постоянного болевого синдрома, крепитации и нестабильности головки бедренной кости.
Клиническая симптоматика АНГБК схожа с классической картиной коксартроза:
- боль в паху, которая проходит по переднебоковой поверхности бедра и иррадиирует в коленный сустав. Нагрузка эти ощущения только усиливает, с переходом боли в поясничную область. Они беспокоят человека всегда, даже ночами;
- объем движений в пораженном суставе заметно ограничен. Таким людям нужна помощь в самообслуживании;
- выраженная хромота со стороны больной ноги при ходьбе;
- быстропрогрессирующая гипотрофия мышечного каркаса бедра пораженной стороны;
- укорочение бедра.
Некроз правого тазобедренного сустава
Риск развития асептического некроза вследствие травмы
Одной из основных причин развития АНГБК являются переломы головки или шейки бедренной кости. Наибольший риск несет трансэпифизарный перелом (нарушение кровоснабжения проксимального фрагмента до 97,6%), субэпифизарный перелом (нарушение кровоснабжения проксимальных отделов головки до 97,4%), субкапитальный перелом (нарушение кровоснабжения до 92%).
Выделяют несколько разновидностей переломов:
Тип 1: абдукционный, субкапитальный, неполный перелом без смещения. Происходит он вследствие действия отводящих натяжений. Шейка и диафиз бедра при переломе направлены в сторону головки. Костные фрагменты крепко вклинены, и линия поверхности перелома приближена к горизонтальной. Нарушение кровоснабжения минимальные (до 10,2%). Прогноз на выздоровление хороший.

Слева-направо: субкапитальный, трансцервикальный, базисцервикальный переломы.
Тип 2: аддукционный, субкапитальный, полный перелом без смещения. Перелом расположен в вертикальной плоскости, проходит через шейку бедра. Трабекулы и нижний корковый слой разорваны, без смещения. Микроциркуляция нарушена на 23,6%. Прогноз благоприятный.
Тип 3: аддукционный перелом с неполным смещением костных структур. Он характерен варусной деформацией шейки бедра, но фрагменты остаются соединенными за счет задне-нижнего блока. Дистальный костный фрагмент – в положении наружной ротации и отведения с углом, открытым кпереди. Имеется оскольчатый перелом задней поверхности шейки. Трабекулы и нижний кортикальный слой разорваны. Нарушение васкуляризации достигает 42,8%. Риск развития асептического некроза.
Тип 4: аддукционный перелом с полным смещением. Головка лишается всех связей с синовиальной оболочкой капсулы, в результате чего фрагмент становится свободным. Нарушение кровоснабжения максимальное (54,4%). Риск образования асептического некроза повышенный.
Резюмируем: в случае потенциальной травмы тазобедренного сустава – необходимо обратиться в ближайший травмпункт и сделать рентгенограмму. Ранняя диагностика способна спасти сустав от разрушения и сохранить высокое качество жизни!

Диагностика
Ассоциация по изучению кровоснабжения костной ткани (Association Research Circulation Osseous) выделяет 4 стадии:
- Изменения в суставе на рентгенограмме отсутствуют.
- Демаркационный склероз головки бедренной кости без коллапса.
- На рентгеновских снимках заметен коллапс: IIIA – коллапс < 3 мм; IIIB – коллапс >3 мм.
- Дегенеративные изменения сустава.
Стадии АНГКБ по ARCO
Однако в России больше распространена классификация по пяти стадиям:
- рентгенологические признаки отсутствуют. На гистологическом препарате видны признаки некроза губчатого вещества головки и структур костного мозга. Клинически выражается ноющей болью и скованностью в суставе, нарастающей мышечной слабостью.
- множественные импрессионные переломы. На фоне некроза происходит множество микроскопических переломов. На рентгенограмме видно гомогенное затемнение бедренной кости, снижена ее высота, поверхности головки местами в виде уплотненных фасеток, суставная щель расширена. Данные МРТ исследования определяют некротический дефект в головке.
- образование секвестра. Суставная головка уплощена и имеет вид бесструктурных изолированных фрагментов с разной формой и размерами. Шейка кости укорачивается и утолщается, суставная щель расширяется еще больше.
- репаративная. Восстанавливается губчатое вещество головки бедренной кости. На рентгене секвестроподобных зон не заметно, тень головки обрисовывается, но с закругленными кистовидными просветлениями.
- вторичный деформирующий артроз. Начинает прослеживаться костная структура бедренной кости, в значительной степени измененная, конгруэнтность суставных поверхностей нарушена.
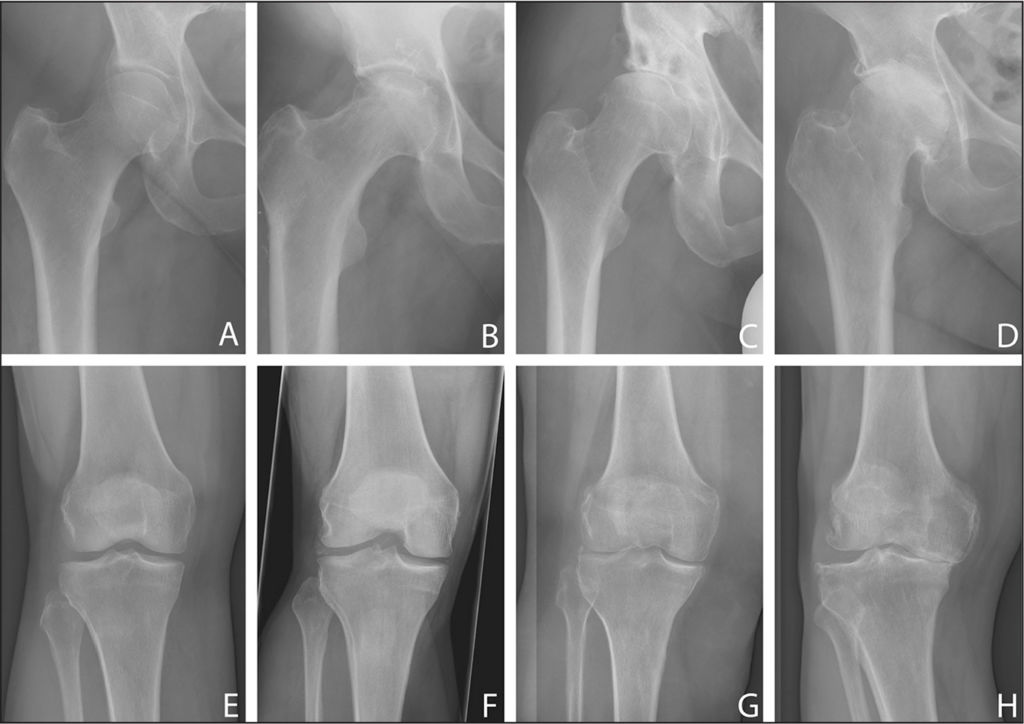
Болезнь в динамике.
Важно: коллапс головки бедренной кости происходит за невероятно короткий промежуток времени – 5 месяцев.
Исследование кровообращения головки бедренной кости
Применяют лазерную доплеровскую флоуметрию и микросенсорные преобразователи внутрикостного давления. Гистологическое исследование позволяет диагностировать болезнь, дифференцировать ее с другими патологиями и определять патогенетические пути развития процесса.
При прогрессировании заболевания структура кости подвергается изменению. В субхондриальной зоне и зоне некроза повышается активность остеокластов, а в зоне склероза наоборот растет активность остеобластов.
При АНГБК лабораторные показатели, такие как протромбиновое время, АЧТВ (активированное частичное тромбопластиновое время), бывают в норме. Однако в сравнении пациентов при нетравматическом некрозе и здоровых добровольцев выявлены значимые отклонения концентрации факторов свертывания в плазме крови.
У людей с АНГБК снижен уровень грелина, повышен уровень фактора Виллебранда, ингибитора активатора плазминогена-1 (PAI-1), С-реактивного белка, что свидетельствует о вовлечении этих факторов в механизм патогенеза.
Использование определенных лабораторных показателей, как маркеров, для диагностики АНГБК, является перспективным методом.
Лечение
Для каждой стадии по ARCO определена продолжительность течения каждого из них. Для I степени и II степени — до 6 месяцев, III – 3-6 месяцев и мгновенным переходом в IV стадию.
Раннее начало лечения, пока из симптомов выявляется только незначительный дискомфорт в околосуставной области с иррадиацией в область паха и коленный сустав – чрезвычайно важно.
Задачи в период лечения:
С учетом того, что АНГБК – мультифакторная патология, необходимо использовать комплексный подход в диагностике, лечении и реабилитации, направленные на восстановление:
- оптимального функционирования всех систем и органов;
- микроциркуляторгого русла и показателей гемокоагуляции;
- нейрорегуляторных факторов;
- иммунных реакций;
- миодискоординатных процессов и биомеханики суставов.
Лечение стадий 1-2
Представляется наиболее эффективным для благоприятного прогноза. Самое главное условие успешного лечения – строгое соблюдение режима. Следует отказаться от вредных привычек (алкоголь и курение), избегать перегрузки и переохлаждения пораженного сустава.
Терапия направлена по нескольким направлениям: прием медикаментов, физиотерапия и ЛФК.
Препараты. При асептическом некрозе назначаются следующие группы лекарственных средств:
- Ингибиторы костной резорбции (бисфосфонаты). Они замедляют разрушение костной ткани, мешают сдавлению и деформации головки бедренной кости.
- Препараты кальция и витамина D. В виде активных форм они облегчают образование костных структур и их минерализацию. Доза подбирается индивидуально.
- Дополнительные источники минералов и фосфатов (оссеин-гидроксиапатит).
- Так как при АНГБК изменяются факторы свертывания крови, обязательно назначаются антиагрегантные препараты (курантил, дипиридамол, ксантинол).
- Нестероидные противовоспалительные препараты (НПВП). Обладают обезболивающим и противовоспалительным эффектом. Наиболее часто назначают препараты – ибупрофен, кетопрофен, диклофенак и их аналоги.
- Миорелаксанты для снятия мышечного напряжения вокруг сустава.
- Поливитаминные комплексы, хондропротекторы.
Физиотерапия. Основная задача – простимулировать кровоток в тканях и запустить/ускорить регенераторные процессы.
- а) гипербарическая оксигенация. Пациента помещают в барокамеру, где на него действует воздух, обогащенный кислородом, в условиях повышенного давления. Такая процедура улучшает кислородное питание поврежденного участка.
- б) ударно-волновая терапия (УВТ). Представляет собой действие звуковой волны. Производится точечно, непременно на место повреждения. Она эффективно воздействует на патологические ткани, мешающие заживлению больных суставов (кристаллы кальция или спайки). УВТ улучшает кровоснабжение обрабатываемой области и тем усиливает репаративный эффект.
- в) миостимуляция. Позволяет восстановить мышечный тонус при развивающейся гипотрофии, что часто встречается при АНГБК. Стимуляция снимает спазм окружающих сустав мышечных волокон и ускоряет локальный кровоток.
Лечебная физкультура
Начальный этап – разгрузка пораженного сустава. В этом случае пациенту подбираются костыли, ходьба на которых может занять до года.
Если после терапии болевые ощущения уменьшились, и маркеры костного обмена нормализовались – через 2-3 месяца костыли отменяют. Но не стоит торопиться. Разгрузка сустава позволит снять боль и предупредить дальнейшее разрушение головки бедренной кости. Щадящий режим ускоряет заживление, оно проходит быстрее и легче.
С другой стороны, пациенту необходимо ЛФК. Специальный набор упражнений позволит уменьшить боль и отечность сустава, увеличить его подвижность. Физические упражнения разработают не только сустав, но и окружающие его мышцы, предупреждая развитие гипотрофии.
Пациентам с ожирением рекомендуется сочетать упражнения со специально подобранной диетой. Такое сочетание позволит добиться лучших результатов.
Особенно следует подчеркнуть важность лечебной физкультуры на этапе реабилитации. Она поможет не только разработать прооперированный/замененный сустав, но и не допустить его нестабильность.
Лечение 3-4 стадий некроза
Если сустав уже перешел в эти стадии, то процесс разрушения головки бедра уже начался. ЛФК и физиотерапия остаются в том же ключе, что и при начальных стадиях, а медикаментозная терапия претерпевает изменения. Это связано с выраженным болевым синдромом, который пациенты уже не в силах терпеть. Назначают более сильные обезболивающие (диклофенак, трамадол).
Лечебное воздействие дополняют внутрисуставными инъекциями гиалуроновой кислоты и введение богатой тромбоцитами плазмы.
Гиалуроновая кислота – важный компонент синовиальной жидкости. Подобные инъекции улучшают амортизацию конгруэнтных поверхностей, облегчают их скольжение относительно друг друга.

Важно: несмотря на широту возможностей современной медицины, консервативной лечение эффективно только на ранних стадиях. При первых признаках разрушения головки сустав восстановлению не подлежит.
В этой ситуации будет приниматься решение о хирургическом вмешательстве. Основные сочетания групп оперативных методик [14]:
- межвертельная корригирующая остеотомия;
- моделирование головки бедренной кости, в том числе с межвертельной корригирующей остеотомией;
- моделирование головки бедренной кости с аутопластикой, в том числе с межвертельной корригирующей остеотомией;
- субхондральная аутопластика головки бедренной кости, в том числе с межвертельной корригирующей остеотомией;
- сегментарная аутопластика головки бедренной кости, в том числе с межвертельной корригирующей остеотомией;
- реконструкция тазовых компонентов, а именно: остеотомия таза по Хиари, в том числе с межвертельной корригирующей остеотомией, надвертлужная ацетабулопластика, в том числе с межвертельной корригирующей остеотомией.
Ни одна операция не гарантирует полноценного выздоровления. Они уменьшают деструктивные процессы внутри сустава и снижают риск развития вторичного коксартроза.
Если не лечить
Асептический некроз головки тазобедренного сустава – тяжелая патология, которая сама не разрешится. Если оставить ситуацию без должного внимания, заболевание может привести к инвалидизации. В одном случае может развиться вторичный коксартроз, требующий замены сустава на протез (эндопротезирование тазобедренного сустава). Во время операции удаляется головка тазобедренного сустава вместе с частью бедренной кости и на их место ставится протез.
Замена сустава позволяет рассчитывать на благоприятный прогноз. Протез позволяет полностью восстановить утраченные функции.
Другим исходом заболевания может стать анкилоз – полная неподвижность в суставе. Происходит полная дегенерация хрящевого покрова суставных поверхностей с разрастанием соединительной фиброзной или костной ткани.
Инвалидность
Инвалидность присваивается на основании выраженности заболевания и снижении качества жизни. Изменение уровня инвалидности осуществлялось только в случае хирургического вмешательства.
Иными словами, наибольшей эффективностью в лечении асептического некроза обладает хирургическое вмешательство. Несмотря на внушительность консервативных методов лечения, доказанная эффективность сомнительна.
Заключение
- АНГБК – тяжелое дегенеративно-дистрофическое заболевание с быстрым прогрессированием симптоматики.
- Консервативная терапия эффективна только на ранних этапах заболевания.
- Наиболее распространенный способ лечения — хирургический.
- Несерьезное отношение к сложившейся ситуации может привести человека к глубокой инвалидности.
Читайте также:

