Паразит убивающий раковые клетки
Обновлено: 26.04.2024
История онкологии началась с незапамятных времён. Первые систематические попытки лечения опухолей предпринимались ещё в Древнем мире. С тех пор прошло несколько тысячелетий, но и сейчас в подавляющем большинстве случаев полное излечение злокачественных новообразований недостижимо. Однако теперь мы хотя бы знаем, что за преграда не даёт нам достигнуть заветной цели. Раковые стволовые клетки, практически никому не известные ещё каких-нибудь пятнадцать лет назад, сегодня оказались в центре внимания учёных. Выяснилось, что буквально все клинические проблемы, от устойчивости онкологических заболеваний к различным препаратам до фатальных рецидивов спустя десятилетия после кажущегося исцеления, связаны с этими клетками.
Модель раковых стволовых клеток (РСК) подразумевает, что любое злокачественное новообразование (неоплазия) развивается из одной клетки. В результате неких событий генетический аппарат некогда нормальной клетки трансформируется настолько, что происходит её перерождение в инициирующую раковую клетку. В результате последующей пролиферации (деления) этой клетки формируется злокачественная опухоль. Согласно концепции РСК, эта опухоль устроена иерархически, то есть разные типы раковых клеток обладают разной способностью к делению.
Раковые стволовые клетки составляют лишь небольшую популяцию опухолевых клеток. Однако, будучи истинно стволовыми клетками, они (и только они) способны к неограниченному числу делений и постоянному самовоспроизведению. Число делений остальных клеток, если они способны к пролиферации (то есть формально обладают неким стволовым потенциалом), строго ограничено.
В основе процесса самовоспроизведения РСК лежит так называемый асимметричный тип деления стволовых клеток, который заключается в том, что родительская стволовая клетка даёт начало двум клеткам. Одна из них — с такими же стволовыми свойствами, что и материнская, другая же способна к ограниченному числу делений и поэтому называется частично дифференцированной, временно пролиферирующей раковой клеткой. Конечные потомки таких клеток — раковые клетки, не способные к делению. Их называют терминально дифференцированными. Соответственно иерархия опухолевой ткани выглядит так: раковые стволовые клетки → временно пролиферирующие раковые клетки → терминально дифференцированные раковые клетки. Два последних типа клеток образуют при этом основную массу опухоли.
Точно такая же иерархия имеет место и в нормальных тканях, стволовые клетки которых, способные к самовоспроизведению и поддержанию собственной популяции, также дают начало ограниченно пролиферирующим клеткам — предшественникам зрелых клеток. Эти зрелые тканевые клетки не способны к делению вовсе и погибают через какое-то время после выполнения свойственных им функций.
Итак, согласно модели раковых стволовых клеток, не все опухолевые клетки обладают равной способностью к делению и самовоспроизведению. И несмотря на то что основная масса опухоли состоит из злокачественных клеток той или иной степени дифференцировки, её рост и развитие определяются небольшой по численности, но наивысшей в иерархии популяцией раковых стволовых клеток.
Cловарик к статье
Клеточная дифференцировка — процесс клеточной дифференцировки заключается в так называемом созревании стволовой клетки-предшественника в клетку со строго определённым фенотипом (например, кардиомиоцит или пирамидный нейрон), называемую дифференцированной.
Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток делением.
Репарация ДНК — внутриклеточная молекулярная система восстановления исходной последовательности ДНК после её повреждений.
Стохастический (от греч. στοχαστικός — умеющий угадывать) означает неопределённость, случайность чего-либо.
Фенотип (от греческого слова phainotip — являю, обнаруживаю) — совокупность характеристик, присущих индивиду на определённой стадии развития (особенности строения и жизнедеятельности).
Упреждая аргументы критиков РСК-модели, следует отметить, что некоторые злокачественные новообразования не вписываются в эту модель, а, скорее, соответствуют модели клональной эволюции. Есть виды неоплазий, при которых могут встречаться разные популяции раковых стволовых клеток, имеющих разные хромосомные нарушения. Хрестоматийные примеры таких новообразований — хроническая миелоидная лейкемия и колоректальный рак. В этих случаях РСК-модель не может полностью описать развитие опухоли, так как в соответствии с ней все клетки опухоли — потомки одной инициирующей РСК. Здесь же возможна либо инициация опухоли сразу из нескольких злокачественных стволовых клеток, формирующих несколько генетически различающихся клонов, либо эволюция одного клона из другого за счёт последовательного накопления генетических нарушений. Разные клоны могут обладать разной злокачественностью и соответственно могут конкурировать за ресурсы. Иными словами, будет проходить эволюция опухолевых клонов.
Некоторые новообразования, отличающиеся экстремальной злокачественностью, также больше соответствуют модели клональной эволюции, нежели иерархической модели РСК. К ним относятся, например, различные злокачественные меланомы, при которых доля активно делящихся раковых клеток составляет чуть ли не более половины опухолевой массы. При этом в пределах одной опухоли сосуществуют РСК с различными фенотипами, которые при различных воздействиях на опухоль могут легко превращаться один в другой. Очевидно, что и для этих случаев РСК-модель не вполне подходит.
Однако, как можно заметить, в современной интерпретации модели клональной эволюции центральная роль инициирующих раковых стволовых клеток в запуске развития злокачественного новообразования ни в коей мере не оспаривается. Дискуссии продолжаются лишь относительно тех или иных сценариев развития опухоли * . А коли так, мы со спокойной совестью можем говорить о раковых стволовых клетках.
Более полувека спустя, в 1930-х годах, теория зародышевого остатка получила новый импульс. Гистологические наблюдения одной из опухолей мозга — медуллобластомы — показали, что её клетки морфологически очень напоминают клетки эмбрионального мозжечка, на основании чего было выдвинуто предположение, что эта форма опухолей мозга развивается из зародышевого остатка, состоящего из медуллобластов, утративших способность к дифференцировке.
Очередной значительный шаг на пути к концепции раковых стволовых клеток сделан в середине прошлого века. Исследования различных миелопролиферативных заболеваний (особой группы злокачественных новообразований, развившихся из клеток крови ** ) показали, что в развитие данной группы заболеваний могут быть вовлечены все ветви гемопоэза, за исключением лимфоидных ростков. Это послужило основанием для предположения, что все указанные патологии связаны со злокачественным перерождением клеток — предшественников всех остальных клеток миелоидного ряда, теперь известных как миелоидные cтволовые клетки.
А уже в 1960 году Питер Ноуэл (Peter Nowell) и Дэвид Хангерфорд (David Hungerford) открыли уникальную взаимосвязь так называемой филадельфийской хромосомы с одним из миелопролиферативных заболеваний — хронической миелоидной лейкемией. Филадельфийская хромосома — следствие хромосомной аномалии, которая приводит к образованию мутантного белка BCR-ABL1. К несчастью, этот мутантный белок сохраняет способность одного из своих родительских белков (ABL) к передаче пролиферативного (стимулирующего деление клетки) сигнала внутрь клетки. Более того, он передаёт сигналы гораздо интенсивнее и при этом делится вне зависимости от внешних сигналов. В результате клетки, несущие такую мутацию, начинают быстро и неконтролируемо делиться. В дальнейшем наличие филадельфийской хромосомы при этом заболевании было подтверждено во всех клетках, не относящихся к лимфоидному ряду, на основании чего выдвинули гипотезу о происхождении всех клонов лейкемических клеток от одного предшественника.

Питер Ноуэлл (университет Пенсильвании, США, на фото — слева) и Дэвид Хангерфорд (Фокс Чэйс Раковый центр при Институте исследования рака, США) — первооткрыватели филадельфийской хромосомы (1960).
Как видно, модель клональной эволюции подразумевает, что одни раковые клоны отличаются большей злокачественностью, другие — меньшей, но в целом все они обладают сопоставимой способностью к делению. И в этом заключается принципиальное отличие стохастической теории канцерогенеза от иерархической теории, которая базируется на модели раковых стволовых клеток.
Тем не менее, как уже было упомянуто выше, модель клональной эволюции до сих пор не потеряла своей актуальности, поскольку в несколько большей степени, нежели модель РСК, объясняет развитие нескольких типов новообразований.
Долгое время концепция РСК находилась на вторых ролях. Однако в 1997 году Доминик Бонне (Dominique Bonnet, London Research Institute) и Джон Дик (John Dick, Toronto General Research Institute) продемонстрировали, что единичные лейкемические стволовые клетки, взятые у пациентов с острой миелоидной лейкемией, при трансплантации мышам дают начало полному спектру клеток с различными злокачественными фенотипами, наблюдаемыми при этом заболевании у человека. После этой работы число исследований, посвящённых РСК, стало лавинообразно нарастать.
В начале 2000-х годов раковые стволовые клетки были идентифицированы и в солидных опухолях (при одной из форм рака молочной железы). На сегодняшний день РСК описаны для абсолютного большинства форм онкологических заболеваний, и с этими клетками связывают все основные клинические проблемы в онкологии.
Поскольку любое новообразование может развиться только из активно делящейся клетки, наиболее подходящие кандидаты для злокачественной трансформации — нормальные тканевые стволовые клетки (дающие начало полностью дифференцированным клеткам, выполняющим свои узкоспецифические задачи в том или ином типе тканей), так как они обладают длительным сроком жизни и высокой скоростью деления. В соответствии с этим концепция РСК подразумевает, что инициирующее событие в канцерогенезе — злокачественное перерождение нормальных тканевых стволовых клеток *** , которые становятся инициирующими РСК.

Схематическое изображение возможных механизмов гетерогенности опухолевых клеток. Внизу — фенотипические различия раковых клеток первичной опухоли и метастазов. Схема сильно упрощена, поскольку не учитывает фенотипические различия между вторичными метастатическими РСК и первичными инициирующими РСК. Вверху — схема путей генерации опухолевой гетерогенности. Рисунок автора
Ещё одна неприятная особенность раковых стволовых клеток — их чрезвычайная устойчивость ко всем известным видам лечения. Какой бы вид противоопухолевой терапии ни применялся (радио-, химио-, иммунотерапия, таргетная), РСК будут погибать последними, когда все дифференцированные раковые клетки уже успешно побеждены.
Известно несколько механизмов терапевтической устойчивости РСК. Во-первых, РСК характеризуются повышенной экспрессией транспортных белков семейства ABC (ATP-binding cassette). Это эволюционно консервативные белки, присутствующие у всех организмов — от бактерий до человека. В норме они локализуются преимущественно в плазматической мембране клеток и отвечают за транспорт полезных веществ (например, витаминов) в клетку и выведение из неё вредных токсинов и ксенобиотиков. В РСК эти белки экспрессируются на особенно высоком уровне и отвечают за выведение из них различных химиотерапевтических препаратов.
Во-вторых, РСК, как никакие другие клетки, отличаются обилием фермента альдегид-дегидрогеназы (ALDH). В норме функция этого белка — окисление токсичных для организма альдегидов до карбоновых кислот. В РСК же он отвечает за инактивацию многих химиотерапевтических препаратов.
Это основные, но далеко не все механизмы устойчивости РСК. В тех же случаях, когда системы резистентности РСК к терапии дают сбой, раковые стволовые клетки впадают в дормантность (состояние покоя), в которой они могут пребывать несколько десятилетий, после чего активируются и обусловливают скоротечный фатальный рецидив. Дормантные РСК отличаются очень низким уровнем метаболизма, экстремальной устойчивостью к повреждающим воздействиям и практически не экспрессируют поверхностные белки, которые могли бы послужить мишенями для создания таргетных препаратов. На сегодняшний день дормантные РСК представляют собой наибольшую трудность для лечения. Однако надежда на успех есть. Во-первых, испытываются и неплохо себя проявляют различные сложные комбинации уже существующих таргетных препаратов. Во-вторых, удалось вплотную приблизиться к получению препаратов, воздействующих на процессы, лежащие в основе образования вторичных метастатических РСК. В-третьих, обнаружены белки, отвечающие за дормантность РСК и обеспечение их жизнеспособности в состоянии покоя. Наконец, разрабатываются препараты, способствующие выходу РСК из дормантности, что делает их более чувствительными к существующим формам терапии.

Обзор
рисунок Марины Католиковой
Автор
Редакторы

Партнер номинации — компания Cytiva.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Когда я разобрался в истории, которую хочу рассказать, первое, о чем я подумал, было Нечто. Мне почудилось, что оно существует, причем всю мою жизнь морского биолога, даже тогда, под Кандалакшей, оно было близко, ближе, чем на расстоянии вытянутой руки. Мой рассказ будет непоследовательным, однако, независимые пересекающиеся сюжетные линии доброму триллеру не помеха.
Между химерами и гибридами
Вначале была собака
Не игнорируйте нестандартные генотипы!
— И все-таки, что за мидий вы хотите генотипировать? — не удержался от вопроса д-р Биерне.
— Они имеют генотипы, которые я не могу интерпретировать, — уклончиво ответил я.
— Это один из моих любимых фильмов, — с пониманием кивнул он.
Дурная кровь
Полярники диагностировали Нечто, тестируя кровь раскаленным гвоздем. Формально, у мидий, как животных с незамкнутой кровеносной системой, крови нет. У них жидкость, которую качает сердце, называется гемолимфой. Форменные элементы (клетки) гемолимфы зовутся гемоцитами. У гемоцитов много функций, главная из которых иммунная. Органы кроветворения у ракушек не найдены. Считается, что гемоциты воспроизводят сами себя. Действительно, на цитологических препаратах видно, что они делятся.
Никто наверняка не знает, как происходит заражение. В отличие от собак и тасманийских дьяволов, у ракушек наружное оплодотворение и они неспособны к кровавым дракам. Экспериментально показано, что при стрессе гемоциты могут выходить из организма мидии во внешнюю среду и проникать в других особей [6]. Скорее всего, раковые клетки используют этот механизм для заражения.
У мидий обнаружены две разные, вероятно, независимо возникшие эволюционные линии рака, получившие названия BTN1 и BTN2 (от bivalve transmissible neoplasia, трансмиссивная неоплазия ракушек). Обе линии произошли от Mytilus trossulus. Судя по филогенетическим данным (см. ниже), BTN1 моложе BTN2. Надежных оценок абсолютного возраста линий нет. BTN1 имеет ограниченное распространение, ее находили только в популяциях M. trossulus тихоокеанского побережья Канады. Зато BTN2 где только не находили — и у чилийской мидии M. chilensis в Чили и в Аргентине, и у двух европейских видов — M. galloprovincialis и M. edulis. До самого последнего времени, BTN2 не находили только у одного вида мидий, а именно у M. trossulus, который ее, собственно, и породил.
Демонстрация трасмиссивной неоплазии у мидий
Давайте вслед за первооткрывателями BTN шаг за шагом пройдем путь доказательства трансмиссивного рака у мидий, используя для этого рисунок 1. Тем из читателей, которые не хотят вникать в детали, стоит пропустить этот параграф.
Для диагностики диссеминированной неоплазии применяют разные гистологические и цитологические методы. Я для иллюстрации выбрал конфокальные фотографии клеток гемолимфы, окрашенных иммуноцитохимическим методом (рис. 1б, из [7]), потому что они красивые. Синим прокрасились ядра клеток, красным — их актиновый цитоскелет. Видны родовые признаки раковых клеток (отмечены звездочками), отличающие их от нормальных гемоцитов (отмечены стрелкой) — форма клетки, далекая от амебоидной, увеличенное ядро и аномальный цитоскелет, напоминающий иглы ощетинившегося ежа.

Рисунок 1. Филогенетический анализ ядерных и митохондриальных локусов у мидий с линиями BTN. a — Филогенетическое дерево EF1α маркеров мидий, построенное методом максимального правдоподобия. б — Конфокальные фотографии гемоцитов в больной мидии, окрашенных DAPI и фаллоидином, меченым флуоресцентным красителем TRITC. в — Схемы контрольных регионов BTN M. trossulus в сравнении с мужскими и женскими контрольными регионами. г — Карта мест находок мидий с BTN, — залитыми кружками отмечены места происхождения мидий, исследованных по аллелям EF1α.
Митохондриальное генотипирование может быть информативным для диагностики СТС. Например, контрольные регионы митохондрий BTN2 (в митохондриальном геноме различают кодирующую часть и контрольный регион) ни с чем не спутаешь. Это иллюстрируют схемы строения контрольных регионов BTN в сравнении с мужскими и женскими контрольными регионами M. trossulus (рис. 1в, из [8]). Однако интерпретация митохондриальных данных у СТС осложняется явлением горизонтального переноса митохондрий между хозяином и раком (подробнее см. ниже) и непониманием механизмов, приводящих к генотипам как у BTN2.
На сегодняшний день (07.10.2021) опубликованы надежные данные всего по 48 случаям BTN из семи географических популяций мидий. На карте (рис. 1г) отмечены места всех находок BTN. Места сбора раковых мидий, изученных по EF1α и использованных в филогенетическом анализе, отмечены залитыми кружками. Кроме этих районов, единичных мидий с BTN находили в Адриатическом и Балтийском морях (звездочки на карте), однако по EF1α их не изучали.
Дым парохода
Распределение Steamer в геномах раковых гемоцитов M. arenaria было иным, чем в здоровых, причем одинаковым во всех раковых клетках, в том числе разных особей. Ретротранспозоны потому и зовутся мобильными элементами, что умеют перемещаться по геномам, но они это делают в значительной степени хаотично. Никто никогда не отмечал такого единообразия в распределении, как у Steamer в раковых клетках мии. Осмысляя этот результат, Майкл Метзгер предположил, что Steamer может быть маркером клеточной линии. Если так, то все раковые гемоциты всех особей представляют одну и ту же линию, то есть это трансмиссивный рак. Дело оставалось за малым — провести тест на химеризм. Эрудированный, следящий за новостями науки Метзгер знал про трансмиссивный рак, тем более что громкое открытие лицевой опухоли дьявола пришлось на первые годы его работы с Mya. Он с самого начала учитывал гипотезу трансмиссивного рака как маловероятную, но теоретически возможную. Оборачиваясь назад, просто диву даешься, насколько близко ученые подбирались к открытию трансмиссивного рака за 50 лет исследований диссеминированной неоплазии у двустворчатых моллюсков. Вплоть до признания того, что все раковые гемоциты у вида имеют общий уникальный генотип [10] и допущения, что они никакие не гемоциты, а паразитические простейшие [11]. На мой прямой вопрос Метзгеру, почему никто не догадался, а он догадался, он пожал плечами: никакого инсайта, просто профессионализм.
Имеет ли Steamer отношение к этиологии неоплазии, так и осталось невыясненным. Может быть, он капитан этого парохода, а может — просто пассажир, заселивший успешную клеточную линию и путешествующий вместе с ней. Интересно, что Steamer-подобные элементы (то есть очень похожие на Steamer) нашли у всех моллюсков, болеющих трансмиссивным раком, а также у многих других водных животных, включая мадрепоровых кораллов, морских ежей и рыбок данио рерио [12]. Поскольку никто всерьез не верит, что трансмиссивный рак может передаваться между этими животными, остается заключить, что Steamer, пускай он формально и не вирус, все-таки способен к горизонтальному переносу и передается между разными организмами.
Картина мира
Шестой тип инфекции
Одноклеточная форма многоклеточной жизни
Генокрад и тать, сбежавший из-под иммунного надзора
Правило, а не исключение
Постскриптум
Для меня занятие наукой сродни переживанию сюжета добротной приключенческой истории. То особое волнение, когда не можешь оторваться от захватившей тебя книги, или фильма. Или, как в детстве, боишься пропустить хоть слово из страшной истории, которую рассказывают у костра ночью.

Обзор
Макрофаг атакует раковую клетку
Автор
Редакторы

Опухоль и иммунитет — драматический диалог в трех частях с прологом

Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги, пожалуй, самые знаменитые клетки врожденного иммунитета — именно с изучения их способностей к фагоцитозу Мечниковым и началась классическая клеточная иммунология. В организме млекопитающих макрофаги — боевой авангард: первыми обнаруживая врага, они не только пытаются уничтожить его собственными силами, но также привлекают к месту сражения другие клетки иммунной системы, активируя их. А после уничтожения чужеродных агентов принимаются активно участвовать в ликвидации причиненных повреждений, вырабатывая факторы, способствующие заживлению ран. Эту двойственную природу макрофагов опухоли используют себе на пользу.
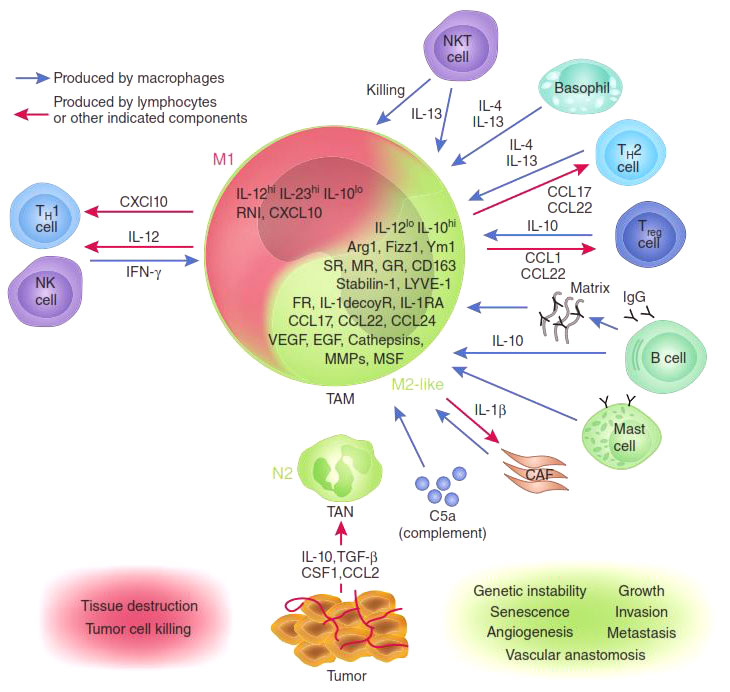
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Как ни удивительно, но идея лечить рак с помощью бактерий возникла очень давно, ещё 200 лет назад. Первые систематические исследования противоракового эффекта бактерий выполнил американский хирург-онколог Вильям Коли в 1890-х годах. Заметив, что перенесённая бактериальная инфекция улучшает состояние онкобольных, он начал специально вводить пациентам бактерии стрептококков. Бактерии были живые, и, хотя в борьбе с раком удалось достичь прогресса, больные умирали из-за самих микробов. Тогда Коли стал убивать микроорганизмы нагревом перед тем, как вводить больным, и добился значительных успехов: многие из его пациентов, которые находились на последних стадиях заболевания, выздоравливали и жили ещё много лет. Причём эффект был как в том случае, когда бактерии вводили прямиком в опухоль, так и тогда, когда их вводили просто в кровь.
Не всякие бактерии оказались пригодны для лечения рака. Когда больным вводили внутривенно ослабленных сальмонелл, те не оказывали почти никакого влияния на опухоль. Но когда в качестве бактериального десанта использовали почвенных бактерий Clostridium novyi, появилась надежда на успех. Клостридии — анаэробы, то есть предпочитают жить там, где кислорода нет или же очень мало. Именно это заставляет их искать в организме опухоль: ведь в раковой опухоли уровень кислорода очень низкий. (А низкий он из-за того, что опухоли приходится обходиться без кровеносных сосудов, хотя на каком-то этапе развития они всё-таки в неё прорастают.)
Живые клостридии убивают опухоль, вероятно, с помощью своих ферментов, а потом используют остатки раковых клеток как источник питательных веществ. Кроме того, они активируют иммунную систему, которая вместе с бактериальными клетками начинает уничтожать и раковые. В экспериментах исследователей из Университета Джонса Хопкинса (США) бактерии перед введением ослабляли нагреванием, и благодаря тому, что бактерии были живыми, они сохраняли способность действовать на раковые клетки своими ферментами. В результате из шестнадцати подопытных собак с опухолью у пяти она остановилась в росте, у шести уменьшилась или вовсе исчезла.
Бактерии, как известно, весьма терпимо относятся к вмешательству в свой геном: их можно снабдить одним, двумя, а то и несколькими генами из какого-нибудь другого организма, и бактериальная клетка не только выживет, но и даст возможность новым генам работать внутри себя. Сейчас генетическая модификация бактерий стала рутинной процедурой: например, диабетики уже не один десяток лет используют инсулин, синтезируемый кишечной палочкой с человеческого гена. Очевидно, что в случае противораковых бактерий исследователям не могла не прийти в голову мысль как-то их усилить. Некоторое время назад сотрудники Маастрихтского (Нидерланды) и Ноттингемского (Великобритания) университетов модифицировали бактерию Clostridium sporogenes, снабдив её ферментом, активирующим противоопухолевый препарат, который надо было вводить следом за бактерией. Анаэробные клостридии, скопившись в опухоли, выделяли фермент, превращавший молекулу — предшественника лекарства — в само лекарство. По сути, это форма химиотерапии, которую удалось ограничить только самой опухолью: за её пределами препарат остаётся неактивным (поскольку там нет бактерий) и не вредит здоровым тканям.
Все три вида модифицированных сальмонелл хорошо сработали на культуре клеток рака шейки матки, но, когда настал этап экспериментов с животными, оказалось, что бактерии дают лучший эффект, если использовать их с обычным химиотерапевтическим средством — 5-фтороурацилом, который подавляет деление раковых клеток. Мыши с опухолью толстого кишечника и метастазами в печени жили дольше, когда получали противораковые бактерии вместе с 5-фтороурацилом, чем если бы им вводили отдельно либо бактерии, либо лекарство. Авторы работы подчёркивают, что полностью опухоль не исчезала, но это говорит лишь о том, что не все возможности такого подхода реализованы до конца: микробов можно снабдить более сильнодействующим оружием, и если учесть, что сальмонелл подвергли достаточно простым модификациям, то методу определённо есть куда расти.
Listeria monocytogenes. Фото: Dr. Gary D. Gaugler/East News
Есть и другой вариант — довериться иммунитету; именно так поступили исследователи из Медицинского колледжа Альберта Эйнштейна (США). В статье, которая вышла в журнале PNAS в 2013 году, они рассказали о радиоактивных бактериях Listeria monocytogenes, которых направили бороться против рака поджелудочной железы. Орудием борьбы служили изотопы рения, закреплённые на поверхности бактериальных клеток. Сами листерии достаточно опасны, но, оказавшись в теле больного животного, они накапливались только в опухоли. Дело в том, что в зоне злокачественных опухолей иммунная система обычно работает плохо, и потому бактерии, которые перед введением в организм ещё и специально ослабляют, обосноваться могут только там — за пределами опухоли их истребит иммунитет. В случае с листериями так и вышло: радиотерапия оказалась адресной, и число метастазов у животных удалось уменьшить на 90% (напомним, что рак поджелудочной железы считается одним из самых агрессивных из-за необычайно высокой склонности к метастазированию). С другой стороны, против первичной опухоли, которая, собственно, и рассылает метастазы, радиобактерии оказались почему-то бессильны. Как заставить бактерии обнаруживать абсолютно все очаги болезни? Это ещё одна проблема разрабатываемых микробных способов противораковой терапии, которую, будем надеяться, удастся в скором времени решить.
Напоследок заметим, что не только бактерии можно использовать в качестве биологического оружия против рака. Так, сотрудники кафедры микробиологии и вирусологии Российского университета дружбы народов под руководством профессора Михаила Далина исследуют антионкогенные свойства трипаносом — одноклеточных организмов, которые паразитируют как на животных, так и на людях, вызывая сонную болезнь, болезнь Шагаса и др. Ранее было показано, что Trypanosoma cruzi уменьшает вероятность развития колоректального рака у крыс и мышей. Среди прочих противораковые свойства трипаносом наблюдали исследователи из Университета Колимы (Мексика), которые вместе с коллегами из РУДН стали соавторами статьи в Bulletin of Experimental Biology and Medicine, опубликованной в 2015 году и посвящённой влиянию трипаносом на лимфатическую опухоль. Опыты ставили с мышами, страдающими от одной из разновидностей Т-клеточной лимфомы (то есть когда опухоль возникает в лимфатической ткани из клеток-предшественников Т-лимфоцитов). Оказалось, что если таким животным вводить обломки клеток трипаносом, то опухоль не только остановится в росте, но и начнёт уменьшаться в размерах. Такой же эффект случается и при контакте живых трипаносом с раковыми клетками, однако вводить разрушенных одноклеточных паразитов видится всё-таки более безопасным.

Fasciola hepatica, гельминты, способные подавлять рост раковых опухолей.
Миллиарды людей в мире инфицированы тропическими червями. Неудивительно, что большинство этих людей живут в бедных странах.
Удивительно то, что в этих странах паразитирующие черви ещё и главная причина заболевания некоторыми видами рака
В журнале Frontiers in Medicine опубликована серия статей о новом исследовании злокачественных образований, возникающих в связи с деятельностью паразитов. Цель этой публикации — проинформировать о профилактике и лечении таких болезней, причём в качестве одного из вариантов борьбы с раковыми клетками рассматривается использование червей же.
Черви вызывают рак
Более миллиона видов червей классифицируются как гельминты. Их общая характерная черта — паразитизм.
В 2015 году весьма странный случай заражения гельминтами оказался в заголовках газет: человек с ВИЧ умер после того, как ленточный червь заразился раком и распространил его по всему телу. Этот случай остаётся единственным в своём роде.
Между тем, учёным уже несколько десятилетий известно, что гельминты могут превратить клетки в раковые.
Рак, вызываемый деятельностью червей, — это не просто сюрприз, это три сюрприза
Но как червь может вызвать рак? Согласно опубликованной серии статей, в этом могут быть повинны особенности питания и размножения сосальщиков.
Некоторые черви защищают хозяев от рака
Заражение сосальщиками и ранние стадии рака часто протекают бессимптомно, поэтому, несмотря на доступность противогельминтных препаратов, пациенты часто поступают в больницу, когда лечиться уже поздно. К счастью, у сосальщиков есть слабое место: прежде чем заражать людей, им нужно поселиться в пресноводных улитках.
Помимо усилий по искоренению заражения, существует ещё одна возможность в ситуации с червями и раком: гельминты могут стать средством борьбы со злокачественными образованиями.
Читайте также:

