Приборы для лечения туберкулеза
Обновлено: 13.05.2024
Согласно данным Всемирной Организации Здравоохранения (ВОЗ) заболеваемость туберкулезом в 2012 году составила 8.6 миллионов случаев с 1.3 миллионов летальных исходов. [1] Несмотря на то, что за последние 20 лет наблюдается небольшое снижение заболеваемости, на первый план выходит проблема мультирезистентного туберкулеза (лекарственная устойчивость как минимум к изониазиду и рифампицину). Так в 2012 году, было зафиксировано 450 000 случаев мультирезистентного туберкулеза, что представляет собой глобальную проблему здравоохранения. [1]
Лечение данной формы туберкулеза – сложный и очень долгий путь, требующий назначения старых препаратов, по большей части, бактериостатиков с большим спектром нежелательных лекарственных реакций. [2] В 2012 году широко лекарственно устойчивый туберкулез (дополнительная резистентность к инъекционной терапии второй линии и фторхинолонам) был диагностирован в 92 странах мира, и количество случаев составляет 9.6% всех пациентов с мультирезистентным туберкулезом. [1]
Бедаквилин (Сиртуро, TMC207) представляет собой диарилхинолин, который ингибирует микобактериальную АТФ-синтазу – фермент, играющий ключевую роль в процессе клеточного дыхания. [3] Это первый противотуберкулезный препарат с принципиально новым механизмом действия, который одобрен для лечения мультирезистентного туберкулеза за последние 40 лет.
Препарат уже доказал свою эффективность in vitro и на мышиных моделях, что позволило продолжить его исследования на пациентах.
Цель.
Оценить эффективность и безопасность бедаквилина в лечении мультирезистентного туберкулеза.
Материалы и методы.
В рандомизированное двойное слепое плацебо-контролируемое клиническое исследование TMC207-C208 были включены пациенты в возрасте от 18 до 65 лет с недавно диагностированным, активным (наличие возбудителя в мокроте), легочным, мультирезистентным туберкулезом. Критериями исключения являлись: предшествующее лечение по поводу мультирезистентного туберкулеза, положительный анализ на ВИЧ с количеством CD4+ лимфоцитов менее 300 на мл3, тяжелые внелегочные и неврологические проявления туберкулеза, тяжелая сердечная аритмия, требующая лекарственной терапии, указание в анамнезе на повышенный риск развития аритмий по типу torsades de pointes, злоупотребление алкоголем и наркотиками, беременность или грудное вскармливание и предшествующее применение бедаквилина. Также было запрещено использование моксифлоксацина, гатифлоксацина и системных ингибиторов цитохрома P-450 3A4 в период исследования и в течение 1 месяца после его завершения.
Исследование проводилось с включением пациентов из Бразилии, Индии, Латвии, Перу, Филиппин, России, ЮАР и Таиланда.
Пациенты были разделены на 2 группы: первая получала бедаквилин в дозе 400 мг 1 раз в день после завтрака в течение первых двух недель, затем по 200 мг 3 раза в неделю в течение 22 недель), вторая - плацебо + все пациенты получали 5-компонентную антитуберкулезную терапию второй линии (этионамид, пиразинамид, офлоксацин, канамицин и циклосерин). При этом внесение изменений в вышеописанную схему разрешалось при наличии данных о серьезных побочных эффектах, низкой чувствительности к препаратам и их отсутствию в стране.
После 24-недельного курса лечения бедаквилин пациенты получали еще в течение 96 недель базовую терапию. Те, кто был исключен из исследования из-за развития нежелательных лекарственных реакций, также продолжались наблюдаться.
Первичной конечной точкой исследования являлось время, необходимое для исчезновения возбудителя из мокроты, которое подтверждалось наличием двух отрицательных анализов мокроты с интервалом не менее 25 дней. Вторичной конечной точкой служило отсутствие микобактерии в культуре через 24 недели и через 120 недель.
Результаты.
В конечный анализ были включены 160 пациентов (64% мужчины): 79 получали бедаквилин и 81 – плацебо.
В первой группе среднее время до исчезновения возбудителя в мокроте было меньше, чем в группе плацебо - 83 дня по сравнению со 125 (HR=2.44, 95% CI, 1.57-3.80; P
Советы при туберкулезе
1. Как лечить туберкулез?
Туберкулез лечится в основном медикаментозным путем. Для проведения кожной пробы на конверсию очищенного от белка туберкулина (ППД) требуется 6-месячный курс лечения изониазидом (ГИНК). При таком лечении почти всегда можно предотвратить развитие активной стадии заболевания.
Лечение активной стадии заключается в 6-месячном курсе приема ППД и рифампина и 2-месячном курсе приема пиразинамида. Вследствие высокой токсичности этих препаратов, больные зачастую стараются уклониться от их приема. Несоблюдение больным режима лечения может привести к развитию у пего микроорганизмов, резистентных к антибиотикам.
Поэтому для предотвращения осложнений все чаще применяется лечение больного в стационаре. (Чтобы больные принимали таблетки, необходимо следить за ними, как за детьми.)
2. Сколько людей во всем мире ежегодно умирает от туберкулеза?
3 000 000 человек.
3. Что является наиболее частым показанием для хирургического лечения больных туберкулезом в США?
Когда инфицирующие микроорганизмы резистентны и к ГИНК, и к рифампину, можно говорить о полирезистентном туберкулезе. Зачастую эти микроорганизмы резистентны и к другим основным препаратам (стрептомицину, этамбутолу, пиразинамиду). Больным с полирезистентным туберкулезом и значительным полостным поражением или разрушением легкого с положительными результатами теста на мокроту или без такового требуется хирургическое вмешательство.
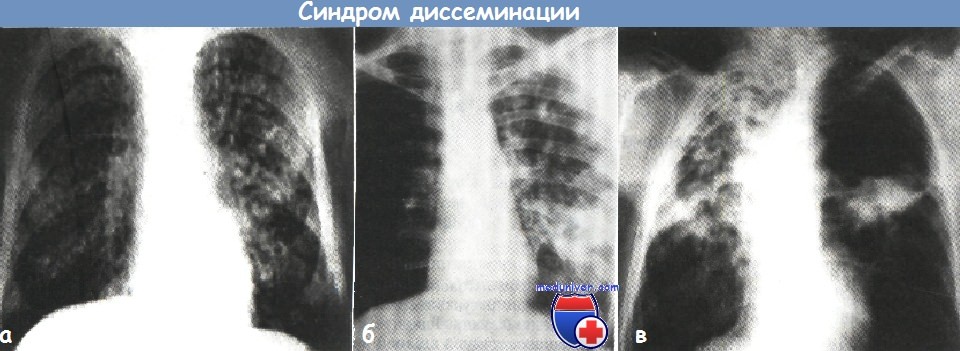
а - синдром выраженной гематогенной диссеминации очагов при диссеминированном туберкулезе легких (рентгенограмма органов грудной клетки в прямой проекции)
б - синдром лимфогенной диссеминации очагов в верхней доле правого легкого (рентгенограмма органов грудной клетки в прямой проекции).
в - синдром бронхогенной диссеминации в правое легкое при фиброзно-кавернозном туберкулезе (рентгенограмма органов грудной клетки в прямой проекции).
4. Назовите другие показания для операции у больных туберкулезом.
Это серьезное кровохарканье (> 600 мл крови в течение 24 часов), бронхостеноз, бронхоплевральный свищ, остановка движений легкого при отсутствии рака.
5. Предрасположены ли больные с полирезистентным туберкулезом к разрушению одного легкого?
По неустановленным причинам у 75% больных с полирезистентным туберкулезом и разрушением только одного легкого разрушается левое легкое.
6. Существуют ли другие легочные инфекции, вызываемые микобактериями?
Нетипичные микобактериальные инфекции, нетуберкулезные микобактериальные инфекции и инфицирование нетуберкулезными микобактериями (МОТТ) — это все синонимы. Наиболее часто среди этих микроорганизмов встречается комплекс Mycobacterium avium (MAC). Среди других можно назвать М. chelonae и абсцессы М. kansaii, М. fortuitum, и М. xenopi. Эти инфекции протекают менее остро, нежели туберкулез.
7. Исчезает ли после операции при микобактериальных инфекциях необходимость в медикаментозном лечении?
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Хирургическое лечение туберкулеза. Показания к операции при туберкулезе
Туберкулез легких является общим инфекционным заболеванием и подробно описывается в специальном курсе. В этом разделе мы касаемся только одного, но весьма важного раздела фтизиатрии — хирургического лечения этого заболевания.
Лечение туберкулеза проводят комплексно. Основой его является химиотерапия туберкулостатическими препаратами на фоне общеукрепляющей терапии. Свежие формы туберкулеза легких относительно хорошо поддаются консервативному лечению. Полный клинический эффект удается получить у 75—80% больных. Значительно хуже результаты лечения фиброзно-кавернозного туберкулеза, при котором эффективность консервативных методой резко падает. У этой категории больных решающее значение часто приобретают хирургические вмешательства.
Успехи грудной хирургии, анестезиологии, реаниматологии и химиотерапии значительно расширили возможность применения и диапазон хирургических вмешательств при туберкулезе легких. Возросла эффективность операций, снизился операционный риск. Многочисленные oперативные вмешательства, применяемые при легочном туберкулезе, можно классифицировать следующим образом: 1) резекции легкого; 2) коллапсотерапевтические операции; а) торакопластика, б) экстра плевральный пневмолиз; 3) операции на каверне: а) дренирование каверны, б) кавернотомия; 4) удаление казеозных лимфатических узлов; 5) операции на бронхах: а) перевязка бронха, прошивание и рассечение бронха, б) резекция и пластика бронха.
Из перечисленных операции некоторые производятся часто (резекция легкого, торакопластика), другие — гораздо реже. Ряд операций, которые широко применялись при туберкулезе легких 10—20 лет назад, вышли из употребления и теперь имеют только историческое значение (пережигание и пересечение плевральных сращений у больных с искусственным пневмотораксом, перевязка легочных артерий и вен, операции на диафрагмальном нерве).
При всех хирургических вмешательствах по поводу туберкулеза легхих в дооперационном и послеоперационном периодах проводят комплексное лечение в виде гигиено-диетического режима и применения туберкулостатических препаратов. В случаях соответствующих показании применяют также стимулирующую, десенсибилизирующую и гормональную терапию. Если в предоперационном периоде диагностируют туберкулезное поражение бронхов, проводят эндобронхиальное лечение (лечебные бронхоскопии, интратрахеальные вливания лекарственных препаратов, ингаляции).
Резекция пораженных участков легкого является основной, наиболее распространенной операцией при туберкулезе легких. Показания к резекции бывают абсолютными и относительными. При абсолютных показаниях другие методы лечения туберкулеза легких представляются неэффективными и только резекция легкого позволяет рассчитывать на успех. При относительных показаниях возможно и консервативное лечение. В клинической практике наиболее часто приходится оперировать больных с туберкуломами легких, кавернозным и фиброзно-кавернозным туберкулезом.
Туберкулома — это, как правило, округлый, покрытый фиброзной капсулой фокус казеозного некроза диаметром не менее 1,5—2 см. Фиброзная капсула туберкуломы практически непроницаема для циркулирующих и крови туберкулостатичсских препаратов. В тубсркуломе среди казеозных масс могут быть остатки элементов легочной паренхимы, эластических волокон, стенок сосудов или бронхов. Иногда в туберкуломах наблюдаются известковые включения. У многих больных с туберкуломамн легких имеются различные признаки активности туберкулезного процесса и отмечается его прогрессировать. Более часто прогрессировать наблюдается в тех случаях, когда в туберкуломе имеется pacпад, а также при наличии в одной доле легкого нескольких туберкулом.
Операция по поводу туберкуломы показана во всех случаях, когда течение туберкулезного процесса осложняется периодическими обострениями, которые проявляются субфебрнльной температурой и симптомами интоксикации, при бацилловыделении, увеличении размеров туберкуломы или появлении в ней полости распада, множественных туберкуломах в одной доле легкого, туберкуломах диаметром более 2—3 см, специфическом поражении бронхов. Прямым показанием к операции является также трудность дифференциальной диагностики между туберкуломой и периферическим раком легкого. В некоторых случаях показанием к оперативному лечению может быть препятствие к работе по специальности (педагоги, врачи-педиатры, работники пищеблоков и др.).
Больным кавернозным туберкулезом резекция легкого показана, если консервативное лечение не приводит к ликвидации полости распада в легком, а также в случаях, когда имеется один или несколько следующих осложняющих факторов: бронхостеноз, сочетание каверны и туберкуломы, множественные каверны в одной доле, продолжающееся бацилловыделение.
При фиброзно-кавернозном туберкулезе в легочной ткани развиваются необратимые морфологические изменения. Излечение, как правило, может быть достигнуто только в результате хирургического вмешательства — резекции легкого, которая обеспечивает достаточно радикальное удаление необратимо измененных участков легочной ткани и бронхиального дерева. Резекция легкого абсолютно показана при поликавернозном поражении легкого или его доли, гигантских кавернах, ателектазах, фиброзно-склеротических изменениях, бронхоэктазах и бронхостенозе.
При решении вопроса о возможности резекции легкого по поводу туберкулеза важно оценить степень активности туберкулезного процесса (фазу), его распространенность, состояние бронхиального дерева, функциональные возможности аппарата внешнего дыхания, сердца, печени, почек. Степень активности туберкулезного процесса имеет решающее значение для определения целесообразного срока оперативного вмешательства. При операциях в фазе вспышки часто возникают обострения и рецидивы туберкулезного процесса в послеоперационном периоде, поэтому в процессе предоперационного лечения важно добиться максимальной стабилизации туберкулезного процесса.
Распространенность патологических изменений в легких и функциональные возможности аппарата внешнего дыхания имеют чрезвычайно большое значение при решении вопроса о возможности резекции и ее допустимом объеме. Резекцию легкого по поводу туберкулеза хорошо переносят дети и подростки, вполне удовлетворительно — взрослые и значительно хуже—люди пожилого возраста. Прн установлении противопоказаний к резекции возрастному фактору необходимо уделять должное внимание.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Меш небулайзеры - самые совершенные приборы для ингаляции. Виды небулайзеров
На сегодняшний день заболевания дыхательных путей считаются одним из самых распространенных в мире. Бронхиальная астма, обструктивный бронхит, пневмония, трахеит, ларингит и это далеко не полный перечень болезней, которыми страдают не только дети, но и взрослые. Те, кто не понаслышке знает, как часто может повторяться обструктивный бронхит у ребенка, как трудно избавиться от одышки и изнуряющего кашля, уже давно оценили пользу небулайзеров - приборов для проведения ингаляций при лечении заболеваний дыхательных путей.
Ингаляция - самый эффективный и безопасный способ доставки лекарственных препаратов в легкие и бронхи. Для проведения этой процедуры обычно используют ингаляторы и небулайзеры, которые, несмотря на то, что имеют одинаковое функциональное назначение, все же отличаются друг от друга. Ингаляторы- это приборы для вдыхания лекарственного препарата. С помощью них можно делать паровые, масляные и сухие ингаляции.
Нейбулайзером называют специальный прибор, который жидкость с лекарством превращает в аэрозоль - мельчайшие частицы размером 3-5 мкм. Ингаляция небулайзером оказывает наибольший лечебный эффект на легкие, так как до нижних дыхательных путей могут дойти только частицы размером меньше 5 мкм. Среди всех существующих видов небулайзеров самыми совершенными являются последние разработки в сфере ингаляционной терапии - меш небулайзеры, которые еще называют электронно-счетными небулайзерами. Чтобы понять, почему для ингаляции лучше применять меш небулайзеры, давайте вкратце ознакомимся - какие виды небулайзеров имеются?

Сегодня в продаже можно встретить три разновидности небулайзеров: компрессорные, ультразвуковые и меш-небулайзеры. Компрессорный небулайзер превращает жидкость с лекарством в аэрозольное облако путем сжатия воздуха. Происходит этот процесс в специальной камере, в которую заливается лекарственное средство. Компрессорный небулайзер дает возможность распылять практически все виды лекарств, он имеет хорошую мощность и доступную цену. Единственным недостатком прибора является его шумность и большие размеры компрессора.
Ультразвуковой небулайзер образует аэрозоль и распыляет его с помощью ультразвуковых колебаний, генерируемых компактным элементом. Он маленький по габариту и работает без шума. Питание этого вида небулайзера может быть от сети и аккумуляторных батареек. Недостатком ультразвуковых небулайзеров является то, что ими можно делать ингаляцию только определенными лекарственными препаратами. Например, они непригодны для вдыхания антибиотиков, гормонов и масляных растворов. Высокие ультразвуковые волны способны разрушить структуру лекарств и растворов.
Меш небулайзеры работают без шума также как и ультразвуковой небулайзер. Они могут распылять все виды лекарственных препаратов, подобно компрессорным небулайзерам. Поэтому можно по праву утверждать, что меш небулайзер является самым совершенным прибором, который объединил в себе все плюсы компрессорного и ультразвукового небулайзера. По габаритам меш небулайзер очень компактный, с его помощью можно делать ингаляцию в любом положении, что очень актуально для лечения лежащих больных и маленьких детей.

В меш небулайзерах аэрозоль образуется от вибрации пленки-мембраны с нано-отверстиями, проходя через которые жидкость с лекарством превращается в аэрозольное облако, которое способно проникать в самые глубокие части легких и бронхов. Вибрация мембраны в небулайзерах также достигается за счет колебаний ультразвука, но с частотой намного меньше, чем у ультразвуковых приборов. Благодаря этому меш небулайзерами можно делать ингаляцию любыми лекарствами и растворами, в том числе препаратами инсулина, антибиотиков и гормонов.
Меш небулайзер - это прибор, покупая который не стоит стараться сэкономить. У дорогих моделей небулайзеров практически нет конкурентов и недостатков. Они могут работать от сети или обеспечить бесперебойное питание в течение 4 часов от двух пальчиковых батареек. У этих моделей есть возможность использования разных режимов подачи аэрозоля для разных отделов дыхательной пути. Кроме того, у качественных небулайзеров мембрану можно заменить по истечении срока эксплуатации.
Покупая меш небулайзер, вы поможете себе и близким избавиться от приступов сухого кашля, одышки, затрудненного дыхания и постоянного насморка. С помощью современных меш небулайзеров можно быстро вернуться к обычной жизни и надолго забыть о болезни, которая не дает вам возможности дышать полной грудью.
Туберкулез представляет собой заболевание, вызванное микобактериями, наиболее часто поражающее легкие в виде инфильтративных или деструктивных изменений паренхимы или бронхов; встречаются и внелегочные формы туберкулеза – туберкулез костей, кишечника и др. Заболевание это крайне распространено и остается одной из главных причин смерти в мире. По оценкам Всемирной Организации Здравоохранения в 2012 году отмечено 8,6 миллионов новых случаев заражения туберкулезом и 1,3 миллиона смертей. обусловленных этим заболеванием. При этом у 450 000 больных выявлены микобактерии туберкулеза, характеризующиеся мультирезистентностью, то есть устойчивостью к двум и более медикаментам, применяющихся в лечении этой патологии; чаще это изониазид и рифампицин. Появляются формы, устойчивые и к фторхинолонам и второй линии терапии. Несмотря на то, что в прошлые десятилетия отмечался значительный прогресс в диагностике туберкулеза и появлении новых средств для его лечения, многие медикаменты не прошли последние стадии клинических испытаний, а создание заявленной как важнейшее средство профилактики новой вакцины потерпело неудачу.
В начале 2014 года в журнале Lancet Respiratory Medicine прозвучало предложение о лечении больных с резистентными формами туберкулеза собственными стволовыми клетками пациента в дополнение к антибиотикотерапии. R. J.Wilkinson et al. из Императорского Колледжа Лондона, Великобритания, совместно с A. Skrahin et al. из Республиканского исследовательского центра пульмонологии и туберкулеза, Минск, Беларусь представили результаты первой фазы клинических испытаний стволовых клеток в лечении туберкулеза, согласно которым исходы заболевания улучшались.
В открытом исследовании указанная группа ученых в течение 4 недель проводила инфузии 30 пациентам в возрасте от 21 до 65 лет, страдающим мультирезистентным туберкулезом легких, примерно 10 миллионов их собственных мезенхимальных стволовых клеток, забранных из костного мозга и размноженных in vitro. Пациенты с сопутствующим гепатитом В или С, а также с ВИЧ-инфекцией исключались из исследования.
Сначала у больных наблюдалось ухудшение течения туберкулеза. Данное явление отмечалось в пределах первых шести месяцев. Затем иммунная система демонстрировала улучшенный ответ на инфекцию. В итоге, среди всех участников, 16 больных из 30 продемонстрировали отсутствие клинических и лабораторных следов туберкулезной инфекции через 18 месяцев от начала терапии стволовыми клетками. В сравнение, лишь у 5 из 30 больных, получавших стандартное лечение, то есть лишь антибиотикотерапии, обнаруживался такой же результат. Побочными эффектами добавления к обычной терапии стволовых клеток были повышение уровня холестерина сыворотки крови (14 из 30 больных), тошнота (11 больных), лимфопения (10 больных) и диарея (10 больных). Снижение иммунной функции у них не отмечалось.
Robert J. Wilkinson et al. Host-directed therapies against tuberculosis. The Lancet Respiratory Medicine. S2213-2600(13)
Читайте также:

