Расчет инфузионной терапии у детей при кишечной инфекции у
Обновлено: 05.05.2024
В статье рассматривается проблема синдрома дегидратации, развивающегося при острых инфекционных диареях у детей. Приведены подходы к коррекции обезвоживания с помощью пероральной регидратации. Продемонстрирована эффективность гипоосмолярных растворов.
- КЛЮЧЕВЫЕ СЛОВА: инфекционные диареи, дети, острые кишечные инфекции, синдром дегидратации, регидратация, лечение, Регидрон Био
В статье рассматривается проблема синдрома дегидратации, развивающегося при острых инфекционных диареях у детей. Приведены подходы к коррекции обезвоживания с помощью пероральной регидратации. Продемонстрирована эффективность гипоосмолярных растворов.
Таблица 5. Расчет необходимого количества жидкости для пероральной регидратации при эксикозах у детей
Таблица 8. Сравнительный состав Регидрона Био и раствора для пероральной регидратации согласно критериям ESPGHAN
Острые кишечные инфекции (ОКИ) по-прежнему занимают второе место в структуре инфекционной заболеваемости у детей. В Европе ежегодно регистрируется от 0,5 до 1,9 эпизода инфекционной диареи у детей младше трех лет [1, 2].
При инфекционной диарее тяжесть состояния больного определяется наличием и выраженностью ряда патологических симптомов. Речь, в частности, идет об общеинфекционном синдроме (лихорадке, интоксикации, вялости), синдроме дегидратации (токсикозе с эксикозом), синдроме метаболического ацидоза, синдроме местных изменений (диарее, рвоте, метеоризме, парезе кишечника).
Причиной частой дегидратации (эксикоза) у детей принято считать анатомо-физиологические особенности, обусловливающие быстрый срыв адаптационных механизмов и развитие декомпенсации функций органов и систем в условиях инфекционной патологии, сопровождаемых потерей воды и электролитов.
Синдром дегидратации у детей, пациентов со среднетяжелыми и тяжелыми формами острых вирусных гастроэнтеритов связан со значительными некомпенсированными потерями жидкости с рвотой и патологическим стулом. Как следствие – ухудшение центральной и периферической гемодинамики, развитие патологических изменений всех видов обмена веществ, накопление в клетках и межклеточном пространстве токсических метаболитов и их вторичное воздействие на органы и ткани. Доказано, что основной причиной развития синдрома дегидратации является ротавирусный гастроэнтерит [3–5].
Алгоритм терапии ОКИ у детей предполагает воздействие прежде всего на макроорганизм, направленное на коррекцию водно-электролитных расстройств и элиминацию возбудителя. Основополагающей считается патогенетическая терапия: регидратация, диетотерапия, энтеросорбция и использование пробиотиков [6]. При водянистой диарее эксперты Всемирной организации здравоохранения (ВОЗ) (2006) признают абсолютно доказанной эффективность только двух терапевтических мероприятий – регидратации и адекватного питания [1, 6]. Бытует мнение, что для любого специалиста, а не только педиатра лечение ОКИ не представляет сложностей.
Как показал наш опыт (преподавательский и экспертный), к сожалению, именно при проведении регидратационной терапии допускают самое большое количество ошибок. Даже при парентеральном введении жидкости для купирования дегидратации в большинстве историй болезни расчет необходимой жидкости либо отсутствует, либо выполнен некорректно. При пероральной регидратации расчет не проводится совсем. Однако больше всего впечатляет тот факт, что даже при наличии солидного стажа практической работы врачи разных специальностей не понимают, зачем регидратирующую соль растворять в строго определенном объеме жидкости, почему нельзя смешивать глюкозо-солевые и бессолевые растворы. Не секрет, что нередки случаи необоснованной инфузионной терапии, поскольку законные представители ребенка или медицинский персонал не хотят затруднять себя проведением пероральной регидратации или не имеют для этого эффективных средств.
Прежде чем приступать к коррекции дефицита жидкости при ОКИ, необходимо определить степень дефицита жидкости и объем патологических потерь. Мы попытались проанализировать различные подходы к оценке степени синдрома дегидратации: традиционный подход российских педиатров-инфекционистов и анестезиологов-реаниматологов и широко вошедшие в повседневную практику критерии ВОЗ и ESPGHAN/ESPID (European Society for Paediatric Gastroenterology, Hepatology, and Nutrition – Европейская ассоциация детских гастроэнтерологов, гепатологов и диетологов / European Society for Paediatric Infectious Diseases – Европейская ассоциация детских инфекционистов) (2008, 2014). Тяжесть синдрома дегидратации оценивается в первую очередь по проценту потери массы тела (табл. 1). Используя критерии ВОЗ, оценивая степень дегидратации, можно сразу определить дефицит жидкости (табл. 2).
Универсальных лабораторных тестов, способных оценить тяжесть дегидратации, не существует. Целью определения тяжести дегидратации является объем дефицита (в мл) для последующего восполнения. Оценка тяжести дегидратации по клиническим данным, естественно, субъективна. Для этих целей ESPGHAN рекомендует использовать клиническую шкалу дегидратации CDS (Clinical Dehydration Scale): 0 баллов – дегидратация отсутствует, от 1 до 4 баллов – легкая дегидратация, 5–8 баллов соответствуют дегидратации средней и тяжелой степени (табл. 3) [7].
Перед началом лечения ребенка с инфекционной диареей необходимо тщательно собрать и проанализировать анамнез заболевания, оценить тяжесть состояния. Особое внимание обращают на частоту, консистенцию, ориентировочный объем фекалий, наличие и кратность рвоты, возможность приема жидкости (объем и состав), частоту и темп диуреза, наличие или отсутствие лихорадки. Обязательно определяют массу тела до начала лечения. В ходе терапии ведут строгий учет объема полученной и выделенной жидкости (взвешивание подгузников и памперсов, измерение объема рвотных масс, установка урологического катетера и т.д.).
Комплексный подход к диагностике синдрома дегидратации В.В. Курека и А.Е. Кулагина (2012) (табл. 4) легко выполним, позволяет избежать ошибок при оценке степени дегидратации, а также провести регидратационную терапию без угрозы развития осложнений [8].
Синдром дегидратации возникает при потере воды и электролитов, причем количественная потеря может быть разной. В зависимости от этого дегидратацию подразделяют на гипертоническую, гипотоническую и изотоническую. Повышение уровней белка крови, гемоглобина, гематокрита и эритроцитов характерно для всех видов, но при изотонической дегидратации эти показатели иногда могут быть в норме.
Гипотоническая (соледефицитная, внеклеточная) дегидратация возникает при значительной потере электролитов (натрия, калия), наблюдается в случае преобладания рвоты над диареей. Потеря солей приводит к снижению осмолярности плазмы и перемещению жидкости из сосудистого русла в клетки (внутриклеточный отек). Жажда умеренная. Внешние признаки дегидратации выражены слабо: кожа холодная, бледная, влажная, слизистые не столь сухие, большой родничок западает. Характерно снижение уровня натрия плазмы 9 КОЕ. Диоксид кремния оказывает сорбирующее, регенерирующее действие в просвете кишечника, то есть обеспечивает дополнительный детоксицирующий эффект. Мальтодекстрин обеспечивает более низкую осмолярность раствора и обладает бифидогенным действием. Добавление в регидратирующий раствор Lactobacillus rhamnosus GG гарантирует получение высокоэффективного и безопасного пробиотического штамма, рекомендованного (с высоким уровнем доказательности) ESPGHAN для лечения инфекционных диарей у детей [7]. Как известно, штамм Lactobacillus rhamnosus GG устойчив к воздействию кислой среды желудка, обладает высокой адгезивной способностью к эпителиальным клеткам, выраженной антагонистической активностью в отношении патогенных и условно патогенных микроорганизмов, влияет на продукцию противовоспалительных цитокинов и характеризуется высоким профилем безопасности [16, 17].
Результаты исследований, проведенных В.Ф. Учайкиным, подтвердили высокую эффективность Регидрона био при инфекционных диареях, как водянистых, так и осмотических. Использование Регидрона био приводит к более быстрому купированию симптомов дегидратации, интоксикации, абдоминальных болей, явлений метеоризма и нормализации характера стула [18]. Кроме того, Lactobacillus rhamnosus GG способствует нормализации количества в кишечнике лактобактерий и энтерококков, но не влияет на уровень анаэробов и кишечной палочки (табл. 8).
Наш собственный опыт использования Регидрона био у 40 детей с вирусным гастроэнтеритом показал более быстрое купирование диареи, а самое главное – высокую приверженность терапии. 90% пациентов, получавших Регидрон био, использовали весь назначенный на сутки раствор. Среди пациентов (30 человек), получавших раствор с нормальной осмолярностью, только 40% могли выпить весь рассчитанный объем глюкозо-солевого раствора. К преимуществам Регидрона био относятся хорошие органолептические свойства.
Таким образом, пероральная регидратация является основным методом лечения инфекционной диареи у детей. Важно правильно оценивать степень дегидратации и использовать регидратирующие растворы со сниженной осмолярностью.
При лечении гастроэнтеритов у детей энтеральная регидратация эффективна в большинстве случаев. Эффективность такой терапии по некоторым показателям превосходит парентеральную регидратационную терапию [19, 20].
Этапы регидратационной терапии. Расчет регидратационной терапии
Водно-электролитная терапия, проводимая внутривенно вводимыми полиионными кристаллоидными растворами, как и оральная, осуществляется в два этапа: I — восстановление потерь жидкости и солей, отмечавшихся до начала инфузионной терапии; II — коррекция продолжающихся водно-электролитных потерь.
Приступая к I этапу регидратационной терапии, прежде всего следует определить объем жидкости, который целесообразно ввести больному. С этой целью выявляется степень обезвоживания. При I степени обезвоживания потеря жидкости не превышает 3 % массы тела, при II — потеря жидкости составляет 4—6 %, при III — 7—9 %, при IV (декомпенсированное обезвоживание) — ю % и более. Определив степень обезвоживания по клиническим и лабораторным показателям с помощью таблицы и выяснив массу тела больного (со слов пациента или путем взвешивания в отделении) можно вычислить величину потери жидкости. Важность правильной оценки степени обезвоживания заключается в том, что она определяет метод и темпы регидратационной терапии — ключевого звена в лечении больных с острыми кишечными инфекциями.
Примеры расчетов: 1) у больного обезвоживание III степени, масса тела — 80 кг. При данной степени обезвоживания потеря жидкости в среднем составляет 8 % массы тела, или 6400 мл. Это значит, что объем внутривенно вводимых жидкостей на I этапе лечения будет равен 6400 мл; 2) у больного обезвоживание IV степени, масса тела 90 кг. При данной степени обезвоживания потери жидкости составляют не менее 10 % массы тела, или 9 л. Объем вводимых внутривенно растворов на I этапе лечения срставит 9 л.
В целом при холере и нехолерных острых кишечных инфекциях сходство клинических проявлений обусловлено общими патофизиологическими механизмами — остро развивающимся изотоническим обезвоживанием, дефицитом электролитов, гемоконцентрацией, метаболическим ацидозом, гемодинамической недостаточностью с функциональной перегрузкой правых отделов сердца и легочной гипертензией, тромбогеморрагическим синдромом, гипоксией, недостаточностью внешнего дыхания и функции почек. Такое сходство определяет целесообразность синдромального подхода при проведении регидратационной терапии.
Водно-солевая терапия при холере с обезвоживанием II—IV степени должна обязательно включать I этап регидратации, при котором оптимальная скорость внутривенной инфузии составляет 70—120 мл в минуту, а объем вводимой жидкости определяется дефицитом массы тела в соответствии с указанной степенью обезвоживания.
Водно-солевая терапия при острых кишечных инфекциях нехолерной этиологии должна проводиться при тяжелом течении болезни со скоростью 70—90 мл/мин в объеме 60—120 мл/кг, а при среднетяжелом течении — со скоростью 60—80 мл/мин, в объеме 55—75 мл/кг.
Опыт показывает, что регидратация больных с острыми кишечными инфекциями, проведенная в объеме менее 60 мл/кг и со скоростью менее 50 мл/мин, наряду с более длительным сохранением симптомов обезвоживания и интоксикации не способствует восстановлению возникших изменений и у больных развиваются вторичные нарушения гомеостаза. Указанные нарушения являются фактором повторного прогрессирования обезвоживания, гемодинамических нарушений, микроциркуляторных расстройств, изменений гемостаза, развития осложнений, в том числе острой почечной и коронарной недостаточности, тромбоза мезентериальных сосудов.
Завершение I этапа регидратационной терапии происходит при восстановлении гемодинамики, прекращении рвоты и нормализации диуреза. У значительной части больных возникает необходимость в проведении II этапа регидратации. Лечение осуществляется с помощью тех же полиионных кристаллоидных растворов с учетом продолжающихся потерь жидкости с испражнениями, рвотными массами и мочой за определенный период (при больших потерях их объем определяют каждые 2 ч, при малых — каждые 4—6 ч). Скорость введения жидкости на II этапе лечения может колебаться в зависимости от объема продолжающихся потерь и обычно составляет 40—60 мл/мин. Баланс потерь и количество выделяемой жидкости каждые 2 ч фиксируются в истории болезни. Такой учет потерь жидкости (с рвотой, калом, мочой) и объема вводимых растворов является принципиально важным в лечении больных с острыми кишечными инфекциями, если проводится регидратационная терапия.
Внутривенное введение жидкости прекращается после исчезновения рвоты, отчетливой стабилизации гемодинамики и восстановления выделительной функции почек. Важным критерием для решения вопроса о прекращении внутривенных инфузий является значительное преобладание количества выделенной мочи над количеством испражнений в течение последних 4 ч.
Общий объем внутривенно вводимой жидкости в тяжелых и затяжных случаях может достигать несколько десятков литров.
Часто после I этапа лечения с помощью внутривенной инфузий II этап осуществляется методом оральной регидратации. При этом принципы лечения и объем вводимой жидкости остаются неизменными.
Безусловно, необходима коррекция метаболического ацидоза, который у части больных бывает декомпенсированным.
Коррекция метаболического ацидоза у большинства больных осуществляется полиионными кристаллоидными растворами. Наиболее эффективны растворы "Трисоль" и "Квартасоль". Когда же это не удается осуществить коррекция метаболического ацидоза проводится с помощью 4 % раствора натрия гидрокарбоната или раствора трисамина.
Принципы и задачи поддерживающей инфузионной терапии. Расчет энергозатрат
Принципы поддерживающей терапии лежат в основе всех видов инфузионной терапии у детей. В целом они заключаются в том, что правильно проведенная поддерживающая терапия должна в точности компенсировать потери жидкости и воды (в состоянии покоя и нормотермии), тем самым сохраняя нормоволемию.
Объем вводимой жидкости рассчитывается таким образом, чтобы получить мочу с осмолярностью 280—310 мосм/л (то есть изотоничную) и удельным весом 1,010, не перенапрягая при этом почечные компенсаторные механизмы. Поддерживающая терапия подбирается исходя из уровня энергозатрат. Холидей и Сигар обнаружили, что суточные энергозатраты у детей можно приблизительно рассчитать по формуле: 100 ккал/кг для первых 10 кг + 50 ккал/кг для следующих 10 кг (до 20 кг) + 20 ккал/кг для следующих 60 кг (до 80 кг).
Потребность в воде составляет 100 мл на 100 ккал (помимо метаболической и поступающей с пищей воды), поэтому по этой же формуле можно рассчитать и объем поддерживающей инфузионной терапии. Например, для ребенка весом 14 кг объем поддерживающей терапии составляет 1000 мл (для первых 10 кг) + 50 мл/кг (для следующих 4 кг), что составляет 1200 мл/сут и соответствует энергозатратам 1200 ккал/сут. Аналогично рассчитывается и почасовая скорость введения жидкости: 40 мл/ч для первых 10 кг + 2 мл/кг/ч для следующих 4 кг, итого — 48 мл/ч.
У больных весом более 80 кг соотношение между весом и потребностями в воде отличается и применение данной формулы может дать завышенные результаты.
Стандартная поддерживающая инфузионная терапия возмещает только потери жидкости при испарении через легкие и кожу (так называемые скрытые потери), атакже через почки и ЖКТ. Однако в патологии возможны и другие пути потери воды и электролитов, называемые выходом в третье пространство. В таких случаях объем поддерживающей терапии увеличивают.

Потери воды с испарением через кожу и легкие называют скрытыми потерями, так как их объем сложно оценить. Около 2/3 скрытых потерь составляют потери через кожу, а 1/3 — через легкие. Испарение через легкие и дыхательные пути является одним из механизмов теплоотдачи и увлажнения вдыхаемого воздуха. Испарение с поверхности кожи также служит важнейшим механизмом теплоотдачи (надо отметить, что вода выделяется на поверхность кожи не только путем потоотделения). В обычных условиях на восполнение скрытых потерь приходится около трети объема поддерживающей инфузионной терапии.
Они выше у новорожденных (около 40%), ниже у подростков (около 25%) и существенно зависят от температуры и влажности окружающей среды. Скрытые потери увеличены при гипертермии, тахипноэ, нахождении вблизи источника тепла (в частности, обогревателя), а также в условиях сухой и жаркой окружающей среды. При температуре тела выше 38°С скрытые потери возрастают с каждым градусом на 12,5%. И, наоборот, при пониженной температуре тела или высокой влажности воздуха потери воды с испарением снижены.
Объем поддерживающей инфузионной терапии рассчитывают исходя из того, что моча должна быть изостенурической (с удельным весом 1,010) и изотоничной (с осмолярностью 280—310 мосм/л). На компенсацию почечных потерь приходится 2/3 объема поддерживающей инфузионной терапии. У детей младшего возраста диурез составляет примерно 2 мл/кг/ч. Когда нарушена концентрационная функция почек (например, при несахарном диабете, у недоношенных, больных серповидноклеточной анемией) или повышена почечная осмотическая нагрузка (например, при парентеральном питании), выделяется либо большое количество изотоничной мочи, либо гипотоничная моча; при этом следует соответственно увеличить объем вводимой жидкости.
При выделении концентрированной мочи (например, при гиперсекреции АДГ или сердечной недостаточности) объем вводимой жидкости снижают.
Состав инфузионных растворов подбирается таким образом, чтобы удовлетворялись энергетические потребности и потребность в электролитах (Na+, К+, Cl-). Эмпирическим путем выявлено, что на каждые 100 ккал или 100 мл жидкости требуется по 3 мэкв Na+ и Cl- и 2 мэкв К+. Такой состав способствует поддержанию гомеостаза и клеточного роста. Добавление 5 г глюкозы на каждые 100 мл жидкости позволяет восполнить дефицит энергии и предотвратить развитие кетоацидоза и распад белков.
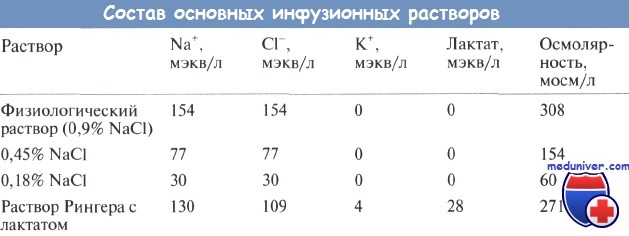
Таким образом, для поддерживающей инфузионной терапии рекомендуется использовать растворы, содержащие 30 мэкв/л натрия хлорида, 20 мэкв калия и 50 г/л глюкозы, например 0,18% NaCl с 5% глюкозы и 20 мэкв/л КО. Калий обычно добавляют в виде калия хлорида, из-за чего содержание хлора превышает расчетное, но не вызывает клинически значимой гиперхлоремии. Содержание натрия и хлора в различных растворах указано в таблице.
После введения рассчитанного количества жидкости следует оценить адекватность поддерживающей инфузионной терапии по изменению веса, сывороточной концентрации натрия и общему состоянию больного. Поддерживающая инфузионная терапия обеспечивает только 20% энергетических потребностей, поэтому больные, получающие только такую терапию, теряют в сутки от 0,5 до 1 % веса. Если количество вводимой жидкости меньше должного для поддерживающей терапии, а концентрация глюкозы в ней не увеличена, то потеря веса будет еще больше.
При правильном подборе поддерживающей инфузионной терапии сывороточная концентрация натрия составляет 130—140 мэкв/л. Повышение веса в сочетании со снижением сывороточной концентрации натрия или с появлением отеков указывает либо на введение избыточного количества жидкости, либо на нарушения выделения воды через легкие, кожу или почки, в том числе ятрогенного происхождения. Наоборот, быстрая потеря веса в сочетании с повышением сывороточной концентрации натрия и(или) постоянной тахикардией может быть обусловлена недостаточным введением или повышенным расходом жидкости; важно искать возможные причины такого повышенного расхода.
Таким образом, инфузионная терапия у детей требует непрерывного контроля за постоянно меняющимися клиническими и физиологическими показателями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В статье изложены современные подходы к регидратационной терапии при острых кишечных инфекциях у детей, в том числе с использованием комплексных методов, направленных на коррекцию не только синдрома обезвоживания, но и микроэкологических нарушений, ассоци
The article covers modern approaches to fluid therapy in acute intestinal infections in children, including use of complex methods directed not only to correction of dehydration syndrome, but also micro-ecological disorders associated with infectious affection of the intestine.
Дегидратационный синдром является ведущим патогенетическим фактором при ОКИ у детей, обуславливая тяжесть заболевания. Поэтому особую значимость для практического здравоохранения приобретает оперативность и правильность оценки степени дегидратации у ребенка, больного ОКИ [9]. Фундаментальные исследования Н. В. Воротынцевой, В. В. Малеева, В. И. Покровского по оценке выраженности обезвоживания на основе оценки острой потери массы тела пациента сохраняют свою актуальность до настоящего времени: эксикозу I степени соответствует потеря до 5% массы тела, что составляет до 50 мл/кг жидкости, эксикозу II степени — потеря 6–10% массы тела (60–100 мл/кг), эксикозу III степени — потеря более 10% массы тела (110–150 мл/кг). Обезвоживание с потерей массы тела более 20% не совместимо с жизнью [10]. Однако применительно к педиатрической практике определение дефицита массы тела ребенка на фоне болезни не всегда возможно ввиду интенсивного роста детей, поэтому оценка степени дегидратации проводится на основе клинических данных. В этой связи в настоящее время широкое распространение получили рекомендации Европейского общества педиатров, гастроэнтерологов и диетологов (European Society for Paediatric Gastroenterology Hepatology and Nutrition, ESPGHAN) от 2014 г. [11]. Однако в них предусмотрена клиническая оценка только внешнего вида, состояния глазных яблок и слизистых оболочек, а также наличие у ребенка слез. Более полная клиническая шкала M. H. Gorelick дополнительно включает определение времени капиллярной реперфузии (в норме не более 2 секунд), снижение диуреза, основные гемодинамические показатели (частота и наполнение пульса) и показатели нарушения дыхания [12]. Существуют и другие шкалы клинической оценки выраженности обезвоживания. Однако значимость каждого из симптомов обезвоживания в клинической практике может быть не всегда достаточно высокой, особенно при эксикозе I степени, что делает их наиболее применимыми при эксикозе II степени (табл. 1).
При ОКИ у детей преобладает изотонический тип обезвоживания, характеризующийся пропорциональной потерей жидкости и электролитов, в первую очередь натрия. При этом не отмечается изменения осмотического давления воды во внутриклеточном и внеклеточном пространствах, что затрудняет его определение лабораторными методами [15].
Объективизация диагностики степени выраженности обезвоживания у детей возможна с применением алгоритма, включающего клинические (увеличение времени капиллярной реперфузии, определяемая клинически сухость слизистых оболочек), анамнестические (выраженность диареи и рвоты), инструментальные (оценка влажности кожных покровов) и лабораторные (дефицит буферных оснований сыворотки крови) данные [16].
Также одним из важных аспектов патогенеза, являющегося закономерным для ОКИ любой этиологии, является развитие нарушений микрофлоры желудочно-кишечного тракта (ЖКТ). Ранее было показано, что при дизентерии Зонне у 67,8–85,1% пациентов, при сальмонеллезе — у 95,1%, иерсиниозе — у 94,9%, ротавирусной инфекции — у 37,2–62,8% нарушения со стороны микрофлоры ЖКТ носят выраженный характер [17–19].
Дестабилизация микробиоценоза ЖКТ на фоне течения инфекционного процесса приводит к снижению колонизационной резистентности микрофлоры, повышению выраженности воспалительных реакций со стороны слизистой оболочки кишки и снижению темпов репаративных процессов в кишечнике, что приводит к усугублению интоксикационного синдрома за счет высвобождения токсинов не только патогенных возбудителей, но и представителей условно-патогенной микрофлоры (УПФ), доля которых при ОКИ возрастает [20].
Основные патогенетические аспекты ОКИ обосновывают и терапевтические подходы — регидратационную и пробиотическую терапию, от своевременности и адекватности назначения которых зависят длительность заболевания и его исходы [10].
При развитии дегидратации основным принципом ведения таких больных является быстрое возмещение потерь жидкости и солей, а также увеличение буферной емкости крови. Общепризнано, что в педиатрической практике следует отдавать предпочтение оральной регидратации, как менее травматичной и более физиологичной для ребенка [21]. Международная практика применения оральной регидратации при ОКИ получила широкое применение с 70-х годов XX века, а ее включение в стандарты ведения больных позволило сократить число случаев госпитализации на 50–60% и значительно, на 40–50%, снизить летальность детей [22]. Однако первые рекомендации, которые можно отнести к регидратационной терапии и включающие в себя назначение рисового отвара, кокосового сока и морковного супа, относятся к периоду более 2500 лет назад и принадлежат древнеиндийскому врачу Sushruta [23]. В 1874 г. во Франции доктором Luton было обосновано назначение дополнительной воды для лечения детей, больных ОКИ. Впервые раствор, в состав которого вошли глюкоза, натрий и хлор, предложил использовать доктор Robert A. Phillips, после открытия механизма потенцирования глюкозой всасывания в кишечнике ионов натрия и калия [23]. В нашей стране в 30–50-х годах XX века проводилась разработка методов регидратационной терапии ОКИ М. С. Масловым (1928, 1945, 1955), В. И. Моревым (1937), В. Е. Балабан (1937). Основные принципы оральной регидратации, состав растворов и методы организации помощи больным ОКИ в нашей стране были разработаны Центральным научно-исследовательским институтом эпидемиологии под руководством В. И. Покровского [10].
Общий терапевтический подход к оральной регидратации предусматривает раннее назначение регидратационных растворов и проводится в два этапа:
- 1-й этап — восполнение потерь, произошедших до момента обращения за медицинской помощью. Назначается суммарное количество жидкости 50–80 мл/кг в течение 6 ч;
- 2-й этап — поддерживающая регидратация, задачей которой является восполнение текущих потерь жидкости при ОКИ. В сутки назначается 80–100 мл/кг жидкости. Длительность второго этапа оральной регидратации продолжается до момента выздоровления или появления показаний для парентеральной коррекции обезвоживания [24].
Согласно действующим современным подходам, для проведения оральной регидратации рекомендовано использование готовых форм растворов, сбалансированных по электролитному составу и осмолярности (75 мэкв/л натрия и 75 мэкв/л глюкозы и осмолярностью 245 мосм/л), при этом значению осмолярности растворов, рекомендуемых для педиатрического применения, уделяется огромное значение.
Также было показано, что данный тип растворов уменьшает потребность в инфузионной терапии, снижает выраженность диарейного синдрома и рвоты и позволяет уменьшить объемы растворов при проводимой оральной регидратации, что является важным преимуществом для педиатрии [16].
Необходимо учитывать, что коррекция обезвоживания должна проводиться с использованием и бессолевых растворов, среди которых предпочтение следует отдать питьевой воде (не минеральной!), возможно использование пектинсодержащих отваров (яблочный компот без сахара, морковно-рисовый отвар). Соотношение глюкозосолевых растворов и питьевой воды должно быть 1:1 при водянистой диарее, 2:1 при выраженной рвоте, 1:2 при инвазивных диареях [24].
Тяжелые формы ОКИ, отсутствие эффекта от оральной регидратации или наличие обильной рвоты, отеков, развитие функциональной (острой) почечной недостаточности являются показаниями для проведения парентеральной регидратации, которая может быть осуществлена с использованием одного из современных отечественных растворов — 1,5% раствора меглюмина натрия сукцината, доказавшего свою эффективность в интенсивной терапии данных состояний [30].
Патогенетическое обоснование необходимости применения пробиотических лекарственных средств при ОКИ не вызывает сомнения как в отечественной, так и в зарубежной литературе. Пробиотическую терапию рекомендовано назначать в составе комплексной стартовой терапии вне зависимости от этиологии заболевания и в как можно более ранние сроки. Данные препараты показаны также всем пациентам в периоде реконвалесценции с целью восстановления параметров микробиоценоза. Их применение при ОКИ у детей является не только патогенетически обоснованным, но и относится к самому высокому уровню доказательности — А — в соответствии с принципами доказательной медицины [31]. Данный факт был подтвержден в 2010 г. результатами метаанализа, включившего в себя результаты 63 рандомизированных контролируемых клинических исследований. В нем было показано, что использование пробиотиков достоверно уменьшает продолжительность диареи в среднем на 24,76 часа и сокращает частоту стула, при этом данные препараты характеризуются высоким профилем безопасности [32].
Одним из патогенетических механизмов, позволяющих рекомендовать пробиотики при ОКИ, является их положительное влияние на муциновый слой слизистой оболочки ЖКТ. На фоне течения инфекционного процесса наблюдается изменение физических характеристик данного барьера — снижение вязкости за счет разрушения дисульфидных связей между цистеиновыми мостиками суперструктуры данного геля, что может приводить к транслокации микроорганизмов из просвета кишечника в ткани. Данные процессы развиваются под действием патогенных микроорганизмов, имеющих соответствующие факторы патогенности в виде ферментов, разрушающих слизь (нейраминидаза, гиалуронидаза, муциназа). Длительное, в том числе в постинфекционном периоде, изменение физических свойств муцинового слоя приводит к риску развития воспалительных заболеваний кишечника [33]. Микроорганизмы, относящиеся к компонентам нормальной микрофлоры ЖКТ человека, а также продукты их обмена оказывают потенцирующее действие на состояние муцинового слоя посредством целого ряда механизмов, в том числе генетических [34, 35].
Современный взгляд на терапию пробиотиками подразумевает штамм-специфичный подход, который включает в себя установление в клинических исследованиях терапевтических эффектов, характерных для определенных генетически сертифицированных штаммов и дальнейшее их использование с учетом штамм-специфичных свойств пробиотиков в различных клинических ситуациях [36, 37].
Применительно к острым кишечным инфекциям у детей рабочая группа ESPGHAN в 2014 г. на основе анализа опубликованных систематических обзоров и результатов рандомизированных клинических исследований, в том числе плацебо-контролируемых, опубликовала меморандум, в котором разделила все пробиотические штаммы на пробиотики с положительной рекомендацией, с отрицательной рекомендацией и пробиотики с недостаточными доказательствами их эффективности. К рекомендованным штаммам (несмотря на низкий уровень доказательной базы по мнению экспертов) для терапии ОКИ у детей были отнесены Lactobacillus GG, Saccharomyces boulardii, Lactobacillus reuteri штамм DSM 17938 (исходный штамм ATCC 55730), а также термически инактивированный штамм Lactobacillus acidophilus LB, который формально к пробиотикам как живым микроорганизмам с заданными полезными свойствами отнесен быть не может, однако он показал свою эффективность при острых инфекционных гастроэнтеритах [38].
Штамм Lactobacillus reuteri DSM 17938 устойчив к следующим антимикробным средствам (возможен совместный прием пробиотиков Lactobacillus reuteri Protectis с этими средствами): амоксициллин, ампициллин, Аугментин, диклоксациллин, оксациллин, пенициллин G, феноксиметилпенициллин, цефуроксим, цефалотин, ванкомицин, доксициклин, тетрациклин, фузидовая кислота, ципрофлоксацин, энрофлоксацин, налидиксовая кислота, метронидазол. Lactobacillus reuteri DSM 17938 чувствительны к цефотаксиму, неомицину, стрептомицину, кларитромицину, эритромицину, рокситромицину, клиндамицину, хлорамфениколу, рифампицину, имипенему, линезолиду, виргиниамицину.
При этом Lactobacillus reuteri DSM 17938 характеризуется хорошим профилем безопасности, что подтверждено Продовольственной и сельскохозяйственной организацией ООН (Food and Agriculture Оrganization of the United Nations, FAO) и ВОЗ в 2002 г.
Клиническая эффективность Lactobacillus reuteri DSM 17938 показана при функциональных коликах у детей первого года жизни, в составе комплексной эрадикационной терапии H. рylori-инфекции, профилактики антибиотик-ассоциированной диареи, при метаболическом синдроме, в терапии аллергических заболеваний. Эффективность данного штамма подтверждена в 163 клинических исследованиях у 14 000 пациентов, из которых 114 — рандомизированные, двойные/слепые или слепые плацебо-контролируемые исследования, 47 — открытые исследования, 56 исследований проводились среди 7300 детей 0–3 лет жизни.
Однако наиболее хорошо изучены клинические эффекты данного штамма при ОКИ, что послужило причиной включения его в рекомендации ESPGHAN. Так, в многоцентровом рандомизированном простом слепом клиническом исследовании, проведенном среди госпитализированных с острым гастроэнтеритом детей, получавших традиционную терапию с или без 1 × 10 8 КОЕ Lactobacillus reuteri DSM 17938 на протяжении 5 дней, было показано, что назначение данного пробиотического штамма сокращает продолжительность диареи через 24 и 48 ч (50% в основной группе против 5% в группе сравнения, p < 0,001) и 72 ч (69% против 11%, р < 0,001), позволяет уменьшить сроки госпитализации (4,31 ± 1,3 дня против 5,46 ± 1,77 дня, р < 0,001) и снизить вероятность развития затяжного характера диареи (17% в группе сравнения и ни одного пациента в основной группе) [40]. Аналогичные данные были получены и в других исследованиях [41, 42].
Учитывая вышеизложенное, можно заключить, что в настоящее время в РФ единственным низкоосмолярным глюкозосолевым регидратационным раствором, содержащим Lactobacillus reuteri DSM 17938, является БиоГая ОРС (биологически активная добавка). Данный раствор оказывает терапевтическое действие по двум основным патогенетическим направлениям — корригировать и обезвоживание, и нарушения микробиоценоза при ОКИ у детей. Важно подчеркнуть, что, помимо глюкозы, солей и пробиотика, БиоГая ОРС содержит цинк, оказывающий положительное влияние на всасывание воды, который также потенцирует процессы иммунологической защиты и участвует в процессах регенерации.
По составу и осмолярности комбинация солей БиоГая ОРС соответствует рекомендациям Европейского общества педиатров, гастроэнтерологов и диетологов, а также ВОЗ и ЮНИСЕФ по оральной регидратации при легкой и средней степенях обезвоживания (табл. 2).
Эффективность данной комбинации — Lactobacillus reuteri DSM 17938 и растворов для оральной регидратации — была подтверждена в проспективном плацебо-контролируемом исследовании, где было показано снижение на 84% доли детей с обезвоживанием на вторые сутки приема данной комбинации [43].
Таким образом, комбинированная терапия пробиотиком и низкоосмолярным раствором для оральной регидратации (БиоГая ОРС) у детей без возрастных ограничений является не только патогенетически обоснованной, доказавшей свою несомненную эффективность и безопасность в контролируемых клинических исследованиях, но и наиболее перспективным направлением в лечении острых диарей любой этиологии, значительно уменьшающим полипрагмазию.
Литература
А. А. Плоскирева 1 , кандидат медицинских наук
А. В. Горелов, доктор медицинских наук, профессор, член-корреспондент РАН
Для построения рациональной этиотропной и патогенетически обоснованной терапии острых кишечных инфекций (ОКИ) в начальном периоде заболевания (до получения результатов лабораторных исследований) следует, в первую очередь, определить тяжесть заболевания (л
Больные острыми кишечными инфекциями, независимо от этиологии и типа диареи, могут лечиться как в стационаре, так и на дому. Обязательной срочной госпитализации подлежат больные среднетяжелыми и тяжелыми формами ОКИ при наличии синдромов, угрожающих жизни ребенка (гипертермический, судорожный синдром, синдром нейротоксикоза, гиповолемического шока и др.). Основными направлениями лечения ОКИ как в стационаре, так и на дому являются: рациональная диета, оральная или инфузионная регидратация, ферментотерапия, симптоматическая, посиндромная и этиотропная терапия.
Рациональная диета. Независимо от тяжести заболевания и типа диареи назначается разгрузка в питании. При легких формах суточный объем питания уменьшается на 15–20% от физиологической потребности, среднетяжелых — на 20–30%, а при тяжелых — на 30–50%. Объем разового кормления определяется не только возрастом ребенка, но и тяжестью состояния, наличием аппетита и частотой рвоты. Ночной перерыв в кормлении детей обязателен. Начиная со вторых суток объем разового питания может быть увеличен на 20–30 мл и соответственно удлиняется интервал между кормлениями. Разгрузка в питании детей старше трех лет в первый день обычно проводится кефиром по 100–150–200 мл через 3–4 часа в зависимости от возраста ребенка.
В острый период, независимо от тяжести заболевания и типа диареи, не рекомендуются продукты питания, усиливающие перистальтику кишечника, бродильный процесс и содержащие грубую клетчатку. Ограничения в диете назначаются до стойкой нормализации частоты и характера стула, затем набор запрещенных продуктов постепенно расширяется (табл. 1).
При выборе детских смесей независимо от типа диареи предпочтение следует отдать лечебно-профилактическим пробиотическим продуктам питания и детским смесям с нуклеотидами. Бифидо- и лактобактерии, входящие в их состав, обладают выраженной антагонистической активностью в отношении патогенов, возбудителей ОКИ, оказывают нормализующее действие на микробиоценоз кишечника и препятствуют дальнейшему прогрессированию дисбактериоза, активно участвуют в пищеварении, оказывают иммуномодулирующее действие и др. и, тем самым, существенно повышают клиническую эффективность проводимой терапии. Нуклеотиды являются исходным компонентом для построения РНК и ДНК, им принадлежит важная роль в развитии иммунного ответа, стимуляции роста и дифференцировки энтероцитов. При осмотическом и инвазивно-осмотическом типе диареи в первые дни заболевания назначаются низколактозные или безлактозные детские смеси или продукты питания (рисовая каша на воде без сахара, отмытый творог и др.).
Регидратационная терапия. Основой рационального лечения больных ОКИ, независимо от типа диареи, наряду с правильным питанием, является возмещение патологических потерь воды и электролитов — регидратационная терапия. Показаниями для проведения пероральной регидратации являются — начальные проявления диареи, умеренное (1–2 степени) обезвоживание, нетяжелое общее состояние ребенка. Для борьбы с обезвоживанием рекомендуется использовать глюкозосолевой раствор Регидрон или морковно-рисовый отвар ORS-200. Эффективность пероральной регидратации оценивается по исчезновению и уменьшению симптомов обезвоживания, прекращению водянистой диареи, прибавке массы тела. Показаниями для проведения инфузионной регидратационной терапии являются — токсикоз с эксикозом 2–3-й степени, гиповолемический шок, неукротимая рвота, сочетание эксикоза (любой степени) с тяжелой интоксикацией, неэффективность пероральной регидратации в течение суток.
В остром периоде заболевания независимо от типа диареи не следует назначать препараты на основе панкреатина с компонентами бычьей желчи (Фестал, Дигестал, Панолез, Энзистал и др.), так как они могут усилить диарейный синдром. Компоненты бычьей желчи (желчные кислоты и др.) стимулируют моторику кишечника и желчного пузыря, усиливают осмотическое давление химуса, оказывают повреждающее действие на слизистую, а при микробной деконъюгации — способствуют активации цАМФ энтероцитов с последующим развитием или усилением гиперсекреции или осмотического компонента диареи. Не следует также использовать ферментные препараты с высокой протеолитической активностью (Абомин, Панзинорм форте и др.), так как в большинстве случаев протеолитическая активность химуса в остром периоде ОКИ повышена. Кроме того, назначение протеолитических ферментов при ротавирусной инфекции может стимулировать репродукцию вируса, усилить диарейный синдром и тяжесть заболевания.
Купирование абдоминальных болей (табл. 2). Причиной абдоминальных болей при кишечных инфекциях может быть воспалительный процесс, усиленная перистальтика кишечника или спазм гладкой мускулатуры, а также повышенное газообразование. Для купирования болевого синдрома при метеоризме используются ветрогонные лекарственные средства (ЛС) (Метеоспазмил, диметикон, симетикон), ферментные препараты (Зимоплекс, Панкреофлат (панкреатин + диметикон)) и энтеросорбенты (Неосмектин, Смекта (смектит диоктаэдрический), Фильтрум-СТИ (лигнин гидролизный) и др.), при усиленной перистальтике кишечника — лоперамид и его аналоги (Имодиум, Лопедиум и др.). При спазмах гладкой мускулатуры кишечника эффективными являются миотропные спазмолитики или блокаторы М-холинорецепторов. При выборе препаратов спазмолитического действия предпочтение следует отдать ЛС, которые избирательно действуют на мускулатуру ЖКТ (Спазмомен 40 (отилония бромид), Бускопан (гиосцина бутилбромид), Дюспаталин (мебеверин)), — они лишены общего гипотензивного действия, как дротаверин и папаверин. При болях, связанных с воспалительным процессом в нижних отделах толстого кишечника, и гемоколите используются суппозитории альгината натрия (Альгинатол, Натальсид).
Противорвотные мероприятия. При наличии частой рвоты эффективным является разгрузка в питании, дробное дозированное кормление и промывание желудка, особенно при пищевом пути инфицирования, а при отсутствии эффекта назначаются противорвотные препараты (табл. 3).
Купирование явлений метеоризма (табл. 4). Лечебные мероприятия должны включать низколактозную или безлактозную диету и ферментные препараты с высокой амилолитической активностью. В качестве симптоматической терапии назначаются ветрогонные лекарственные средства. Они затрудняют образование и способствуют разрушению газовых пузырьков.
Этиотропная терапия. Выбор средства этиотропной терапии осуществляется с учетом предполагаемой этиологии ОКИ (шигеллез, сальмонеллез, ротавирусная инфекция и др.) и типа диареи (инвазивный, секреторный и др.), а также — с учетом возраста ребенка, периода болезни и сопутствующей патологии.
Энтеросорбенты обладают не только этиотропным (сорбция и элиминация патогенов из кишечника), но и патогенетическим действием (дезинтоксикационным, антидиарейным, оказывают нормализующее действие на микробиоценоз кишечника, в том числе и на фоне антибактериальной терапии и др.). Комбинированное использование в лечении среднетяжелых и тяжелых форм ОКИ пробиотиков и энтеросорбентов, независимо от типа диареи, существенно повышает клиническую и санирующую эффективность проводимой терапии (рис. 4).
Антибактериальная этиотропная терапия проводится, как правило, 5–7-дневным курсом. Повторные курсы, даже с учетом чувствительности выделенного штамма бактерий к антибиотикам и химиопрепаратам, нецелесообразны. Длительные или повторные курсы антибактериальной терапии лишь способствуют прогрессированию дисбактериоза кишечника и даже могут привести к развитию эндогенной инфекции за счет роста представителей условно-патогенной флоры, не чувствительных к данному антибиотику. Лечение антибиотиками должно сопровождаться назначением энтеросорбентов, и/или антибиотико-резистентных пробиотиков (Аципол, Энтерол и др.), и/или препаратов иммуномодулирующего действия (Циклоферон (меглумина акридонацетат), Гепон и др.) — они существенно повышают клиническую, санирующую эффективность проводимой терапии и предупреждают прогрессирование дисбактериоза кишечника.
Для стартовой терапии ОКИ вирусной (осмотического) и вирусно-бактериальной этиологии (инвазивно-осмотического типа диареи), в том числе и при тяжелых формах заболевания, целесообразнее использовать, помимо пробиотиков и энтеросорбентов, специфические иммуноглобулины (КИП), препараты иммуномодулирующего и противовирусного действия, как монотерапию или в комбинациях (табл. 9, см. рис. 6 и 7 на стр. 45).
При повторном высеве патогенных или условно-патогенных бактерий, по окончании 5–7-дневного курса, следует использовать специфические бактериофаги (сальмонеллезный, клебсиеллезный и др.), специфические иммуноглобулины (КИП, Кипферон), препараты, обладающие иммуномодулирующим действием (Циклоферон, Гепон и др.) или лактоглобулины (колипротейный лактоглобулин, лактоглобулин против сальмонелл и условно-патогенных бактерий) (табл. 10).
При наличии неустойчивого характера стула по окончании антибактериальной терапии, как правило, связанного с дисбактериозом кишечника, назначаются пробиотики (Пробифор, Полибактерин, Бифистим, Энтерол и др.) курсом не менее 7–10 дней или лечебно-профилактические продукты питания, обогащенные бифидо- или лактобактериями (например, детский кефир Бифидок и др.).
Литература
Учайкин В. Ф., Новокшонов А. А., Соколова Н. В., Корнюшин М. А. Современные подходы к лечению ОКИ у детей // Педиатрия. 1996. № 3. С. 49–54.
Абрамов Н. А. и др. Применение продукта Бифидок для профилактики и лечения дисбактериоза кишечника у детей // Методические рекомендации для врачей. 1997. 15 с.
Учайкин В. Ф. и др. Пробиотики в комплексной терапии кишечных инфекций у детей // Биопрепараты. 2001. № 1. С. 2–4.
Новокшонов А. А. и др. Лечение ОКИ у детей препаратами бифидумбактерин форте и пробифор // Методическое пособие для врачей. 2001. 12 с.
Новокшонов А. А., Мазанкова Л. Н., Соколова Н. В. Патогенетическое обоснование оптимальной терапии ОКИ у детей // Детские инфекции. 2002. № 1. С. 32–37.
Учайкин В. Ф., Новокшонов А. А., Мазанкова Л. В., Соколова Н. В. Острые кишечные инфекции у детей (диагностика, классификация, лечение) // Пособие для врачей. 2003. 34 с.
Новокшонов А. А. и др. Роль иммуномодулятора гепон в комплексной терапии ОКИ у детей // Лечащий Врач. 2003. № 6.С. 76–77.
Новокшонов А. А. и др. Пробиотик Бифиформ — альтернатива этиотропной антибиотико- и химиотерапии ОКИ у детей // Детские инфекции. 2003. № 3. С. 36–40.
Новокшонов А. А. и др. Биоценоз-сберегающая терапия инфекционных заболеваний кишечника у детей // Фарматека. 2004. 13 (90). С. 85–88.
Новокшонов А. А.,Тихонова О. Н.,Соколова Н. В. Сравнительная эффективность этиотропной терапии острых кишечных инфекций у детей 5-нитрофуранами//Детские инфекции. 2005. Т. 4. №1. С. 49–53.
Учайкин В. Ф. и др. Энтеросорбция — эффективный метод этиопатогенетической терапии ОКИ у детей // Детские инфекции. 2005. Т. 4. № 3. С. 39–43.
Учайкин В. Ф. и др. Место и значение энтеросорбции в этиопатогенетической терапии ОКИ у детей // Педиатрия. 2007. Т. 86. № 2. С. 44–50.
Рациональная фармакотерапия детских заболеваний. Рук-во для практикующих врачей. Под общей ред. А.А. Баранова, Н.Н. Володина, Г.А.Самсыгиной. М.: Литтера. 2007. Т. XV. Книга 2. С. 64–148.
Новокшонов А. А., Соколова Н. В., Тихонова О. Н., Ларина Т. С. Рациональная этиотропная терапия ОКИ бактериальной и вирусной этиологии у детей на современном этапе // Доктор РУ. 2007. № 2.С. 5–12.
Врачебный контроль за здоровьем ребенка на первом году жизни. Настольная книга врача-педиатра. Под ред. М. А. Курцера, А. Г. Румянцева. Департамент здравоохранения г. Москвы. 2007. С. 90–143.
Учайкин В. Ф., Новокшонов А. А., Соколова Н. В., Бережкова Т. В. Энтеросорбция. Роль энтеросорбентов в комплексной терапии острой и хронической гастроэнтерологической патологии. Пособие для врачей. 2008. 24 с.
Новокшонов А. А., Учайкин В. Ф. Дисбактериоз и кишечные инфекции у детей. Принципы микробиоценозсберегающей этиотропной терапии // Медицинская газета. № 20 от 19.03. 2008. С. 8–9.
Новокшонов А. А.,Тихонова О. Н.,Соколова Н. В.,Калмыков А. А. Эффективная этиотропная терапия среднетяжелых форм ОКИ у детей//Consilium medicum. Гастроэнтерология. 2008. № 1.С. 68–70.
Новокшонов А. А., Соколова Н. В., Ларина Т. С., Бережкова Т. В. Роль энтеросорбентов в составе комплексной терапии ОКИ у детей // Практика педиатра. 2008. 05. С. 20–26.
А. А. Новокшонов, кандидат медицинских наук, профессор
В. Ф. Учайкин, доктор медицинских наук, профессор, академик РАМН
Н. В. Соколова, кандидат медицинских наук
РГМУ, Москва
Читайте также:

