Реферат по теме геморрагическая лихорадка с почечным синдромом
Обновлено: 25.04.2024
1. Валишин Д.А., Мурзабаева Р.Т., Мамон А.П., Кутуев О.И., Рожкова Е.В., Кутдусова А.М. Геморрагическая лихорадка с почечным синдромом: клиника, диагностика и лечение: уч. пособие для врачей. Уфа: Изд-во ГБОУ ВПО БГМУ Минздравсоцразвития России, 2012. С. 19-21.
2. Покровский В.И., Пак С.Г., Брико Н.И., Данилкин Б.К. Инфекционные болезни и эпидемиология. М.: ГЭОТАР-Медиа, 2013. С. 826.
3. Учайкин В.Ф. Инфекционные болезни у детей / В.Ф. Учайкин, О.В. Шамшева. М.: ГЭОТАР-Медиа, 2015. С. 790.
Геморрагическая лихорадка с почечным синдромом – зоонозная хантавирусная инфекция, характеризующаяся тромбогеморрагическим синдромом и преимущественным поражением почек. Клинические проявления включают острую лихорадку, геморрагическую сыпь, кровотечения, интерстициальный нефрит, в тяжелых случаях – острую почечную недостаточность. По данным Роспотребнадзора отмечается тенденция к росту ГЛПС, поэтому данное заболевание требует повышенного внимания и является для служб общественного здравоохранения значимым.
Геморрагические лихорадки (код по МКБ-10: А90-А99) – группа природно-очаговых вирусных заболеваний с симптомами геморрагического диатеза, лихорадкой, интоксикацией и весьма частым поражением внутренних органов, особенно почек. Группа геморрагических лихорадок насчитывает 11 нозологических форм (желтая лихорадка, геморрагическая лихорадка Крым-Конго -Хозер, омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом, боливийская, аргентинская геморрагическая лихорадки, лихорадка Ласса, лихорадка Марбург и Эбола и др.), различаемых по этиологии, механизму возникновения и клиническим проявлениям. Среди всех известных клинических форм наибольшее значение для нашей страны имеют геморрагическая лихорадка с почечным синдромом, омская и крымская геморрагические лихорадки. Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острое природно-очаговое зоонозное инфекционное заболевание, вызываемое хантавирусами с циклическим течением и характеризующееся выраженным симптомом интоксикации, поражением почек по типу нефрозо-нефрита с возможным развитием ОПН, геморрагическими проявлениями, длительной утратой трудоспособности. Определение ГЛПС как вирусной болезни было предложено советским бактериологом, вирусологом и иммунологом А.А. Смородинцевым в 1944 году. Сам вирус был выделен у животных южно-корейским учёным Н.W. Lee в 1976 году, у человека – в 1978 году.
Возбудитель болезни относится к семейству Bunyaviridae, рода Hantavirus, включающий около 30 серотипов, 4 из которых (Hantaan, Puumala, Seul и Dobrava/Belgrad) вызывают заболевание. Вирусы имеют диаметр 80-120 нм. Они имеют липидную оболочку с выступами (гликопротеиновыми шипами), содержат одноцепочечную РНК [4]. В зависимости от вида вируса имеется различное количество открытых рамок считывания, – это последовательность нуклеотидов в составе ДНК или РНК, потенциально способная кодировать белок. Проникновение вируса в клетку хозяина осуществляется путём прикрепления к её поверхности с помощью специфических белков G. Мутации хантавирусов при репликации проходят параллельно с эволюционными изменениями их природных носителей (грызунов). Устойчивость вирусов во внешней среде небольшая и зависит от сочетания влажности и температуры: при 56 °C они погибают за 15-30 минут, от 0 °С до 4 °С – за 12 часов, в пробирке с кровью при 4 °С сохраняются около 4-7 дней. При комнатной температуре хантавирусы остаются в помещении около 5-9 дней. В естественных условиях леса или луга при средней дневной температуре 20 °C и влажности 40-60 % вирус в подстилке сохраняется до 2-х недель. Вирусы не выдерживают повышенную кислотность, быстро инактивируются при воздействии ацетона, бензола и хлороформа, погибают от ультрафиолета.
ГЛПС – типичная зоонозная инфекция. Природные очаги заболевания находятся на Дальнем Востоке, в Забайкалье, Восточной Сибири, Казахстане и в европейской части страны. Резервуаром инфекции являются мышевидные грызуны: полевые и лесные мыши, крысы, полевки и др. От грызуна грызуну инфекцию передают гамазовые клещи и блохи. Мышевидные грызуны переносят инфекцию в латентной, реже в клинически выраженной форме, при этом они выделяют вирус во внешнюю среду с мочой и фекалиями. Человеку инфекция передается аспирационным путем – при вдыхании пыли со взвешенными инфицированными выделениями грызунов, контактным путем – при попадании инфицированного материала на царапины, порезы, скарификации или при втирании в неповрежденную кожу; алиментарным путем – при употреблении инфицированных выделениями грызунов пищевых продуктов (хлеб, овощи, фрукты и др.). Трансмиссивный путь передачи, считавшийся раньше ведущим, в настоящее время оспаривается. Непосредственная передача инфекции от человека человеку маловероятна [3].
ГЛПС встречается в виде спорадических случаев, но возможны локальные эпидемические вспышки.
Дети, особенно моложе 7 лет, болеют редко из-за ограниченного контакта с природой. Описаны вспышки ГЛПС в пионерских лагерях, детских садах, детских санаториях, расположенных близко к лесному массиву. Наибольшее число заболеваний регистрируется с мая по ноябрь. На Дальнем Востоке заболеваемость имеет подъемы: в мае-июле и особенно в октябре-декабре, что в целом совпадает с миграцией грызунов в жилые и хозяйственные помещения, а также с расширением контактов человека с природой и проведением сельскохозяйственных работ.
Вирус проникает в организм человека через поврежденные кожные покровы и слизистые оболочки респираторного или желудочно-кишечного тракта и размножается в ретикулогистиоцитарных клетках, далее проникая в кровь. Возникающая вирусемия обуславливает синдром интоксикации. Обладая вазотропностью, вирус повреждает стенки кровеносных сосудов, в результате чего усиливается сосудистая проницаемость, возникают плазморея, сгущение крови. Синдром внутрисосудистого свертывания крови, что клинически проявляется сухостью во рту, жаждой и повышением количества эритроцитов и гемоглобина в крови, и нарушение целостности капилляров приводят к геморрагическим проявлениям. Микроциркуляторные расстройства и серозно-геморрагический отек ведут к развитию нефроза без воспалительного процесса в почках и нарушением канальцевой реабсорбции. Возможно развитие острой почечной недостаточности со 2-4 дня болезни, чему в значительной степени способствуют нейроэндокринные нарушения и аутоиммунные процессы: образование клеточных белков с антигенной активностью, выработка антител к ним, формирование иммунных комплексов, повреждающих почечную ткань. Нарушение выделительной функции почек связано с непосредственным действием вируса на сосуды почек, приводящим к серозно-геморрагическому отеку, что ведет к развитию олигурии. В случаях освобождения организма от возбудителя и выздоровления, патологические процессы в почках регрессируют, что сопровождается полиурией, уменьшением азотемии. В этот период снижается способность канальцевого эпителия к реабсорбции провизорной мочи на фоне падения клубочковой инфильтрации. Почечная функция восстанавливается медленно, в течение многих месяцев.
Геморрагическая лихорадка с почечным синдромом характеризуется циклическим течением с последовательной сменой нескольких периодов:
1) инкубационного (от 2-5 дней до 50 суток – в среднем 2-3 недели);
2) лихорадочного (3-6 дней);
4) полиурического (с 9-13 дня ГЛПС);
5) реконвалесцентного (раннего – от 3-х недель до 2 месяцев, позднего – до 2-3-х лет) [6].
В зависимости от выраженности симптомов, тяжести инфекционно-токсического, геморрагического и почечного синдромов различают типичные, стертые и субклинические варианты; легкие, среднетяжелые и тяжелые формы геморрагической лихорадки с почечным синдромом.
Заболеванию свойственна выраженная цикличность.
I. Инкубационный период составляет от 4 дней до 2 месяцев. Продромальные явления встречаются редко, это недомогание, чувство разбитости, субфебрилитет.
III. Развитие олигурического периода сопровождается уменьшением количества выделяемой мочи вплоть до анурии. Появляется боль в пояснице. Температура тела снижается до нормального или субфебрильного уровня. Возникают признаки уремии: тошнота, рвота, икота, гиперемия лица сменяется серовато-бледным цветом и сухостью кожи. При тяжелом течении нарастают проявления геморрагического синдрома. Артериальное давление снижается с относительной брадикардией. Язык сухой, живот болезненный во всех отделах. Патология нервной системы проявляется нарастанием головной боли, бессонницей, психомоторным возбуждением с возможным развитием делириозного состояния. В связи с нарушением микроциркуляции в сетчатке часто снижается острота зрения. В лабораторных показателях: протеинурия, гипоизостенурия, гематурия, цилиндрурия и слепки канальцевого эпителия. Длительность олигоурического периода около 1 недели.
IV. При благоприятном течении заболевания в дальнейшем возникает полиурический период. Повышение диуреза, доходящей до 5 литров в сутки, рассматривается как хороший прогностический признак. Сохраняется длительная гипоизостенурия. Заметно улучшается самочувствие больных: прекращаются тошнота, рвота, боли в животе, уменьшаются боли в пояснице, но остаются слабость, одышка и сердцебиение даже при незначительной физической нагрузке. Показатели мочевины и креатинина, высокие в олигурическом периоде, снижаются. Жажда, сухость во рту сохраняются.
V. В период реконвалесценции количество выделяемой мочи постепенно приближается к норме. У больных долго сохраняется постинфекционная астения, характеризующаяся общей слабостью, снижением работоспособности, быстрой утомляемостью, эмоциональной лабильностью. Синдром вегетативной дистонии выражается гипотонией, инсомнией, одышкой при минимальной нагрузке, повышенной потливостью [2].
Специфическими осложнениями тяжелых клинических вариантов ГЛПС могут являться инфекционно-токсический шок, кровоизлияния в паренхиматозные органы, отек легких и головного мозга, кровотечения, миокардит, менингоэнцефалит, уремия и др. Предотвратить летальный исход при этом грозном осложнении может только применение экстракорпорального гемодиализа. Возможен разрыв почки или надрыв коркового вещества и почечной капсулы с кровоизлиянием в околопочечную клетчатку. Тяжелыми осложнениями являются желудочно-кишечное кровотечение, кровоизлияние в миокард, мозг, гипофиз и надпочечники. При присоединении бактериальной инфекции возможно развитие пневмонии, пиелонефрита, гнойных отитов, абсцессов, флегмон, сепсиса.
К группе повышенного риска по заболеваемости геморрагической лихорадкой с почечным синдромом относятся сельскохозяйственные и промышленные рабочие, трактористы, водители, непосредственно активно контактирующие с объектами внешней среды. Заболеваемость человека напрямую зависит от численности инфицированных грызунов на данной территории. ГЛПС регистрируется преимущественно в виде спорадических случаев; реже – в виде локальных эпидемических вспышек. После перенесенной инфекции остается стойкий пожизненный иммунитет; случаи повторной заболеваемости единичны.
Патогенетическую сущность геморрагической лихорадки с почечным синдромом составляют некротизирующий панваскулит, ДВС-синдром и острая почечная недостаточность. После заражения первичная репликация вируса происходит в эндотелии сосудов и эпителиальных клетках внутренних органов. Вслед за накоплением вирусов наступает вирусемия и генерализация инфекции, которые клинически проявляются общетоксическими симптомами. В патогенезе геморрагической лихорадки с почечным синдромом большую роль играют образующиеся аутоантитела, аутоантигены, ЦИК, оказывающие капилляротоксическое действие, вызывающие повреждение стенок сосудов, нарушение свертываемости крови, развитие тромбогеморрагического синдрома с повреждением почек и других паренхиматозных органов (печени, поджелудочной железы, надпочечников, миокарда), ЦНС. Почечный синдром характеризуется массивной протеинурией, олигоанурией, азотемией, нарушением КОС.
Критерии определения случая геморрагической лихорадки с почечным синдромом
Остро возникающая системная воспалительная реакция с незначительными катаральными явлениями и с признаками поражения почек (потрясающий озноб, высокая лихорадка, слабость, головная боль, головокружение, сухость во рту, боли в пояснице, снижение диуреза) у лиц, находившихся в природном очаге заболевания в пределах максимального инкубационного периода (40 дней).
В гемограмме: лейкопения, тромбоцитопения, повышение СОЭ
Все выше перечисленные клинические критерии + геморрагические проявления – гиперемия конъюктив, инъекции склеральных сосудов, гиперемия слизистой оболочки мягкого неба, кровотечения различной локализации, петехиальная сыпь, кровоизлияния в кожу и слизистые оболочки. Снижение остроты зрения.
Все вышеперечисленные клинические критерии подозрительного и вероятного случая + четкая цикличность заболевания с формированием начального (лихорадочного), олигоурического, полиурического периодов, с нарастанием геморрагического синдрома, наличием всех вышеперечисленных синдромов.
ГЛПС распространена по всему миру. Около 97 % от общего количества ежегодно регистрируемых случаев ГЛПС приходится на Европейскую и 3 % – на Азиатскую часть России. Наиболее активными очагами заболевания являются регионы между Волгой и Уралом (Башкирия, Татария, Удмуртия, Самарская и Ульяновские области). Самые активные очаги находятся в липовых лесах, 30 % которых в России приходится на Республику Башкортостан (РБ). Обильное плодоношение липы обеспечивает рыжих полевок кормом, способствует поддержанию их высокой численности. Ежегодная заболеваемость ГЛПС на Дальнем Востоке РФ составляет в среднем 2 на 100 тыс. населения и регистрируется, в основном, среди жителей Приморского и Хабаровского краев, Еврейской автономной и Амурской областей.
Исследование эпидемиологии, этиологии, патогенеза, морфологии геморрагической лихорадки с почечным синдромом - вирус-индуцированного заболевания почек, характеризующегося нарастающей почечной недостаточностью и гематурией. Методы диагностики и лечения.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 19.09.2010 |
| Размер файла | 23,4 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерство образования Российской Федерации
Пензенский Государственный Университет
Медицинский Институт
Кафедра Терапии
Реферат на тему:
Пенза 2010
ПЛАН
5. Клиническая картина
8. Прогноз и перспективы
9. Неотложные мероприятия
ВВЕДЕНИЕ
Геморрагическая лихорадка с почечным синдромом (ГЛПС) -- вирус-индуцированное заболевание почек, характеризующееся нарастающей почечной недостаточностью, гематурией и возможными системными геморрагическими проявлениями, такими, как кожная пурпура, носовые, желудочно-кишечные, маточные кровотечения, ДВС-синдром.
1. ЭПИДЕМИОЛОГИЯ
На территории Российской Федерации ГЛПС длительно оставалась природно-очаговым заболеванием, особенно часто встречавшимся в Омской, Оренбургской областях, Хабаровском крае, Башкирии, а также в Поволжье и некоторых южных областях (Белгородской, Курской, Орловской). Однако в настоящее время в нашей стране четко прослеживается общемировая тенденция к утрате ГЛПС эндемичности. Изменение климата и влажности в 1990-х годах привели к массовым миграциям грызунов-носителей, в связи, с чем вспышки и спорадические случаи этого заболевания в настоящее время наблюдают почти повсеместно в европейской части Российской Федерации, в том числе в Тульской, Калужской и Московской областях.
В связи с нередкими сегодня абортивными вариантами течения ГЛПС, отличающимися отсутствием или минимальной выраженностью системного геморрагического синдрома, умеренным ухудшением функции почек, не сопровождающимся изменением диуреза, а также возможностью спонтанного излечения, многие ее случаи, особенно единичные, остаются нераспознанными, что затрудняет достоверную эпидемиологическую характеристику этой болезни.
Одна из первых вспышек ГЛПС была отмечена во время американо-корейской войны в 1951 году в бассейне реки НаNааn (именно поэтому возбудитель ГЛПС получил потом название хантавирусов): более чем у 3000 американских военнослужащих развились фебрильная лихорадка, острая почечная недостаточность, у части -- геморрагический шок, 7% заболевших погибли. В настоящее время в мире регистрируют более 200 000 случаев хантавирусной ГЛПС ежегодно. В эндемических очагах заболеваемость достигает 200 случаев на 100 000 человек, а серопозитивными оказываются до 40% проживающих в них людей. Типичны два пика заболеваемости ГЛПС - весенний и осенний.
Путь заражения ГЛПС -- фекально-оральный, и в связи с этим увеличение заболеваемости отмечают во время массовых миграций населения, в том числе во время локальных военных конфликтов, когда не соблюдаются общепринятые гигиенические нормы. Так, в Боснии и Герцеговине с 1994 по 1995 год число заболевших ГЛПС возросло почти в 50 раз.
Наибольшему риску заражения ГЛПС подвержены лица, работающие в сельской местности (сельскохозяйственные рабочие, охотники, особенно на пушных зверей и крупных грызунов, солдаты, задействованные на сезонной уборке урожая). Спорадические случаи ГЛПС нередко возникают и у городских жителей, выезжающих за город и во время пребывания в сельских домах и подсобных строениях контактирующих с грызунами-переносчиками (рыжей полевкой) и/или употребляющих пищевые продукты или воду, контаминированную их экскрементами. Существуют несколько возможных эпидемических источников ГЛПС:
· дикие животные (например, красная береговая полевка -- резервуар вируса Риита1а в Центральной Европе), контакт с которыми человека относительно редок и всегда происходит в естественной среде их обитания;
· животные, обитающие в сельской местности, в том числе в населенных пунктах (например, желтошейная мышь Ароdетus flavicollis -- разносчик вируса Dobrava, распространенного на Балканах и в южной Европе);
· животные, обитающие в непосредственном контакте с человеком, в том числе в городах, и распространяющие вирус через контаминированные мочу и фекалии (например, крыса Rattus norvegicus, распространяющая вирус Sеои1, особенно часто встречающийся в Азии).
2. ЭТИОЛОГИЯ
Хантавирусы относятся к РНК-содержащему семейству Bunyaviridae, но, в отличие от других его представителей, не передаются от человека к человеку. Хантавирусы реплицируются в цитоплазме клетки-хозяина. Вирусная частица состоит из сферической липидной оболочки, 4 вирусных белков и 3 одноцепочечных ДНК-сегментов, кодирующих белок нуклеокапсида, поверхностные гликопротеиды G1 и G2, а также РНК-зависимую РНК-полимеразу.
Хантавирусы условно подразделяют на вирусы Старого и Нового Света. В зависимости от вида конкретного вируса клиническая картина заболевания может различаться, но в целом она представлена тремя основными вариантами -- геморрагической лихорадкой с почечным синдромом, относительно доброкачественной по течению эпидемической нефропатией (ЭН) и хантавирусным легочным синдромом (ХЛС).
Группа хантавирусов Старого Света представлена вирусами Напtаап, Sеои1, Атиr, Ти1а и Dobravа, вызывающими преимущественно ГЛПС, а также одним из наиболее распространенных в Европе вирусом Риита1а, обусловливающим развитие ЭН. С начала 1990-х годов, вслед за первым идентифицированным вирусом Sin Nотbrе, было открыто несколько хантавирусов Нового Света, большинство из которых вызывают ХЛС.
Различные хантавирусы имеют разные ареалы распространения и переносятся разными видами животных.
3. ПАТОГЕНЕЗ
Имеются указания на то, что к ГЛПС, ЭН и ХЛС, индуцированным хантавирусами, имеется наследственная предрасположенность, маркерами которой могут служить носительство НLА-В8, DRB 1*0301 и НLА-DQ2 аллелей главного комплекса гистосовместимости. Показано также, что наличие аллеля НLА-В35 обусловливает более тяжелое течение ГЛПС. Тем не менее, генетические детерминанты, очевидно, не играют решающей роли в развитии органного поражения при хантавирусной инфекции, клинические проявления которой часто формируются и у тех, у кого соответствующие маркеры отсутствуют.
Хантавирусы проникают преимущественно в макрофаги и эндотелиоциты преимущественно почечных и легочных сосудов. Проникновение хантавируса в клетку-мишень осуществляется путем взаимодействия с расположенным на клеточной мембране интегрином бvв3 с последующим эндоцитозом. В цитоплазме активация вирусной РНК-зависимой РНК-полимеразы обусловливает транскрипцию фрагментов вирусной РНК. Белки вирусного нуклеокапсида и м-РНК РНК-полимеразы транслируются на свободных рибосомах, а м-РНК гликопротеидов -- в эндоплазматических ретикулумах. Окончательная подготовка гликопротеидов G1 и G2 завершается их гликозилированием в аппарате Гольджи. В цитоплазме формируются крупные тельца-включения, состоящие из нуклеокапсида, а сборка вирусных частиц происходит на мембранах аппарата Гольджи. Цитопатическим действием на клетки-мишени (эндотелиоциты, макрофаги) хантавирусы не обладают. Тем не менее, установлена возможность индукции ими клеточного апоптоза (в том числе апоптоза эмбриональных почечных клеток), играющего, по-видимому, не последнюю роль в дальнейшем тканевом повреждении.
Макрофаги, инфицированные хантавирусами, начинают увеличивать продукцию интерферонов, однако темпы роста их секреции меньше, чем у интактных клеток макрофагального ряда. В ткани, где присутствуют хантавирусы, также быстро мигрируют МК-клетки (естественные киллеры). Кроме того, хантавирусная инфекция всегда приводит к тканевой активации мембранатакующего комплекса комплемента (С5Б-С9).
Инфицирование хантавирусами всегда сопровождается продукцией специфических IgА, IgМ и IgG; титры последних нарастают в дальнейшем в фазу реконвалесценции. Наряду с этим уже в начале острой фазы хантавирусной инфекции увеличивается продукция специфических IgЕ, приводящая к увеличению экспрессии и секреции интерлейкина-1в и трансформирующего фактора роста-в, обусловливающих неконтролируемый рост проницаемости эндотелиоцитов.
Острая фаза хантавирусной инфекции сопровождается гиперпродукцией ряда тканьдеструктивных цитокинов и хемокинов, в том числе б-фактора некроза опухолей, концентрация которого коррелирует с тяжестью клинических проявлений. Некоторые воспалительные цитокины могут определяться в моче. Воспалительные цитокины, хемокины, а также маркеры острофазового ответа, очевидно, играют центральную роль в развитии эндотелиальной дисфункции, следствием которой является формирование органного повреждения, реализуемого при резком увеличении объема внутриклеточной жидкости за счет проникновения в нее жидкой части плазмы, а также нарастающих расстройств системного и тканевого гемостаза.
Таким образом, формирование и прогрессирование органных поражений определяется в первую очередь нарастающей дисфункцией эндотелиоцитов с резким увеличением проницаемости эндотелия и расстройством систем гемостаза, нередко достигающим степени ДВС-синдрома. Пропотевание жидкой части плазмы в ткани-мишени и расстройство органной гемодинамики с образованием тромбов в микроциркуляторном русле и одновременным формированием очагов кровоизлияний определяют формирование недостаточности функций соответствующих органов -- почек и легких.
4. МОРФОЛОГИЯ
При ГЛПС почки увеличены, под капсулой и в корковом веществе обнаруживают кровоизлияния. Легкие отечны, в них также обнаруживаются очаги кровоизлияний. Из-за отечной жидкости масса легких может в два раза превышать нормальные значения. При развитии ДВС-синдрома кровоизлияния могут также быть обнаружены в коже и подкожно-жировой клетчатке, надпочечниках, головном мозге.
При микроскопическом исследовании ткани почек выявляют признаки тубуло-интерстициального нефрита -- инфильтраты из иммунокомпетентных клеток, очаги кровоизлияний в интерстиций. Канальцевые эпителиоциты и эндотелиоциты капилляров отечны, многие интерстициальные капилляры спавшиеся, в их просвете могут обнаруживаться тромбы. Изменения клубочков носят вторичный характер.
5. КЛИНИЧЕСКАЯ КАРТИНА
В зависимости от типа хантавируса заболевание может развиваться по трем клиническим вариантам. ЭН нередко своевременно не распознают; ГЛПС и ХЛС нередко становятся неотложным состоянием и могут быстро приводить к смерти.
При ГЛПС инкубационный период составляет от 7 до 36 часов. В клиническом течении выделяют 5 фаз, в каждой из которых ведущее значение приобретают разные симптомы:
· фебрильная (3-4-й дни болезни);
· гипотензивная (на 3--6-й день с момента начала лихорадки);
· фаза восстановления диуреза (начиная с 11-го дня болезни);
· фаза реконвалесценции (3--6 месяцев с момента начала заболевания).
ЭН начинается внезапно, однако нередко может быть практически бессимптомной, характеризуясь преимущественно лабораторными проявлениями. Полиурию нередко отмечают уже на 3-й день болезни.
При ХЛС в течение 2--14 суток развиваются артериальная гипотензия и некардиогенный отек легких. У выживших регресс органных поражений с восстановлением функции происходит на 5--7-й день.
6. ДИАГНОСТИКА
7. ЛЕЧЕНИЕ
В большинстве случаев лечение ГЛПС ограничивается только симптоматическими и патогенетическими методами.
При развитии ДВС-синдрома используют свежезамороженную плазму: при выраженной тромбоцитопении возможна трансфузия тромбоцитарной массы. При развитии артериальной гипотензии целесообразна инфузия физиологического раствора, инфузия коллоидных и кристаллоидных растворов -- для коррекции гиповолемии, электролитных нарушений и артериальной гипотензии.
При ГЛПС риск геморрагических осложнений и острой сердечной недостаточности, сопряженный с проведением острого гемодиализа, очень велик. Кроме того, гемодиализ малоэффективен для устранения проявлений энцефалопатии и некардиогенного отека легких, в патогенезе которых ведущее значение имеет практически неустранимое с помощью аферезных и диализных методов лечения расстройство органного кровообращения, связанное, в том числе с интенсивным тромбогенезом в микроциркуляторном русле. При выраженной острой почечной недостаточности с установленной гипергидратацией и кардиогенным отеком легкого возможно проведение артериовенозной ультрафильтрации.
При хантавирусных инфекциях уточняют показания и режимы применения противовирусных препаратов. Накоплен определенный опыт клинического применения рибавирина, назначение которого оправдано, по-видимому, только в острую фазу заболевания, характеризующуюся активной репликацией вируса. Эффективность влияния рибавирина на основные клинические проявления почечного поражения удалось подтвердить не во всех клинических исследованиях. К тому же следует иметь в виду, что применение рибавирина может приводить к мутациям хантавируса, в результате которых эффективность этого препарата может быть утрачена, а вирус может приобрести способность ускользать от иммунного ответа хозяина.
Интерфероны при хантавирусной инфекции не эффективны. Эффективными могут оказаться некоторые биологические препараты, в частности рекомбинантный интерлейкин-2, позволяющий добиться достоверно более выраженного регресса креатининемии, чем это наблюдается у пациентов, не получающих данного препарата.
Таким образом, при ГЛПС, ЭН и ХЛС общие принципы лечения должны быть аналогичны используемым при других вирусных инфекциях, для которых противовирусные препараты отсутствуют или малоэффективны. Более обоснованными можно считать только симптоматические меры, направленные на коррекцию метаболических и электролитных нарушений, гемодинамических расстройств, а также ДВС-синдрома.
8. ПРОГНОЗ И ПЕРСПЕКТИВЫ
При ЭН острая почечная недостаточность и летальный исход наблюдаются не более чем у 1% пациентов. ХЛС приводит к смерти более чем у 50% больных. Смертность при ГЛПС, как правило, не превышает 15%.
Опыт длительного наблюдения за реконвалесцентами ГЛПС позволяет утверждать, что у части этих пациентов формируются признаки хронической болезни почек. Результаты сравнения переболевших с пациентами контрольной группы показало, что у лиц, перенесших ГЛПС, обнаруживают более высокие значения альбуминурии и систолического АД, СКФ у них чаще оказывается выше или ниже нормального диапазона, и почти у 15% переболевших выявляют признаки канальцевой дисфункции. Следовательно, ГЛПС может играть роль одной из эпидемически значимых причин формирования хронической болезни почек в первую очередь в очагах хантавируснои инфекции.
Перспективы в лечении хантавируснои инфекции определяются разработкой вакцин, в том числе получаемых из трансгенных животных и растений - продуцентов соответствующих антител. Так, в настоящее время в Южной Корее доступна инактивированная формалином вакцина против вируса Напtaап -- коммерческое название Наntavах. Наряду с новыми противовирусными препаратами для лечения хантавируснои инфекции могут быть использованы и рекомбинантные нейтрализующие антитела. Кроме того, для ГЛПС и ХЛС прогноз может быть улучшен в случае внедрения новых патогенетических препаратов, разработанных для лечения ДВС-синдрома и респираторного дистресс-синдрома (например, рекомбинантного легочного сурфактанта). Необходимо также совершенствование противоэпидемических мероприятий, в частности своевременной дератизации.
9. НЕОТЛОЖНЫЕ МЕРОПРИЯТИЯ
1. Оценивать в динамике креатининемию, СКФ, калиемию и натриемию.
2. Периодически выполнять общий анализ мочи и количественную оценку гематурии.
3. Периодически выполнять общий анализ крови с подсчетом количества тромбоцитов.
4. Проводить мониторинг АД, ЧСС и ЭКГ.
5. Определить показатели коагулограммы и вести их мониторинг; исследовать плазменную концентрацию В-димера.
6. Проводить ультразвуковое исследование почек с целью обнаружения их спонтанного разрыва.
7. Проводить инфузию физиологического раствора, кристаллоидных и коллоидных растворов с целью коррекции гиповолемии.
8. При появлении признаков ДВС-синдрома -- осуществлять трансфузии свежезамороженной плазмы.
ЛИТЕРАТУРА
1. Нефрология: неотложные состояния/ Под.ред. Н.А. Мухина. - М.: ЭКСМО, 2010 г.
Подобные документы
Этиология и патогенез геморрагической лихорадки с почечным синдромом. Характеристика основных периодов в клиническом течении заболевания: инкубационного, доолигурического, олигурического, полиурии и реконвалесценции. Меры лечения и профилактики болезни.
презентация [406,5 K], добавлен 06.03.2012
Возбудители геморрагической лихорадки с почечным синдромом - острой вирусной природно-очаговой болезни. Пути передачи вируса. Клинические проявления и инкубационный период заболевания. Лечение и профилактика ГЛПС. Санитарно-эпидемиологический надзор.
презентация [999,7 K], добавлен 08.10.2015
Возбудитель геморрагической лихорадки с почечным синдромом, источник и резервуар вируса, заражение, диагноз и неотложная помощь. Арбовирус - возбудитель омской геморрагической лихорадки. Клиническая картина чумы, ее формы и противоэпидемические меры.
реферат [21,1 K], добавлен 03.08.2009
Вирусная природа геморрагической лихорадки с почечным синдромом (ГЛПС). Этиологии и эпидемиология распространения ГЛПС. Анализ динамики заболеваемости ГЛПС в Оренбургской области, задачи по улучшению ситуации и противоэпидемические мероприятия.
реферат [24,5 K], добавлен 01.10.2011
Общие сведения о геморрагической лихорадке - остром вирусном антропозоонозе, проявляющемся интоксикационным и геморрагическим синдромами. Этиология, возбудители и патогенез конго-крымской лихорадки, лихорадки с почечным синдромом и клещевого энцефалита.
контрольная работа [21,6 K], добавлен 22.01.2013
Виды геморрагической лихорадки с почечным синдромом - острого инфекционного зоонозного заболевания. Способы передачи инфекции. Симптомы и процесс протекания болезни. Степени тяжести ГЛПС, возможные осложнения. Диагностика, профилактика и лечение.
презентация [3,6 M], добавлен 07.12.2012
Геморрагическая лихорадка с почечным синдромом - острая вирусная природно-очаговая болезнь. Возбудители болезни и источники заражения. Патогенез, симптомы и периоды протекания заболевания, возможные осложнения. Диагностика, профилактика и лечение ГЛПС.
* Данная работа не является научным трудом, не является выпускной квалификационной работой и представляет собой результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала при самостоятельной подготовки учебных работ.
Таврический национальный университет
кафедра медицинской подготовки
1. Общая характеристика группы заболеваний 3
3. Первичная патология 3
4. Причины геморрагического синдрома, этиология 4
1. Общая характеристика группы заболеваний
Группа геморрагических лихорадок включает острые лихорадочные заболевания вирусной этиологии, в патогенезе и клинических проявлениях которых ведущую роль играет поражение сосудов, приводящее к развитию тромбогеморрагического синдрома.
Впервые в качестве самостоятельной нозологической формы геморрагическую лихорадку (геморрагический нефрозонефрит) описал в 1941 г. А. В. Чурилов (профессор кафедры инфекционных болезней Военно-медицинской академии). В последующие годы был описан целый ряд геморрагических лихорадок в различных странах мира. В группу геморрагических лихорадок были включены некоторые болезни, которые были описаны раньше (денге, желтая лихорадка).
2. Патогенез
Патогенез геморрагических состояний при геморрагических лихорадках. Тромбогеморрагический синдром (синдром М. С. Мачабели) является важным звеном патогенеза многих инфекционных болезней. Тромбогеморрагический синдром (ТГС) - это симптомокомплекс, обусловленный универсальным и неспецифическим свойством крови, лимфы, тканевой жидкости, клеточных и межклеточных структур обратимо и необратимо сгущаться вследствие активации их способности к коагуляции и в результате ретракции расслаиваться на компоненты различного агрегатного состояния [М. С. Мачабели, В. Г. Бочоришвили, 1989]. ТГС в своем развитии проходит 4 стадии.
Стадия гиперкоагуляции начинается в клетках тканей поврежденного органа, что приводит к высвобождению коагуляционно-активных веществ, реакция активации коагуляции распространяется на кровь. Эта стадия обычно кратковременная.
Стадия нарастающей коагулопатии потребления, непостоянной фибринолитической активности. Она характеризуется падением числа тромбоцитов и уровня фибриногена, а также расходом других плазменных факторов коагуляционнолитической системы организма. Это - стадия начинающегося и нарастающего ДВС (неполный синдром ДВС).
Стадия дефибриногенации и тотального, но не постоянного фибринолиза (дефибриногенационно-фибринолитическая). Синоним этой стадии - полный синдром ДВС.
Восстановительная стадия или стадия остаточных тромбозов и окклюзий. При благоприятном течении синдрома отмечается возвращение к физиологическим нормам всех факторов коагуляционнолитической системы организма.
По клиническим проявлениям различают различные формы ТГС (молниеносный, острый, хронический, латентный, геморрагический, гиперергический и др.). ТГС наблюдается при травмах, хирургических заболеваниях, в онкологии, при акушерской патологии, при сепсисе и многих инфекционных болезнях. В настоящей работе мы рассматриваем только особенности патогенеза геморрагического синдрома при геморрагических лихорадках.
3. Первичная патология
При геморрагических лихорадках первичная патология страдания развивается на клеточно-молекулярном уровне с обязательным вовлечением в инфекционный процесс эндотелиальных клеток кровеносной системы и стволовых полипотентных клеток костного мозга. Скорость развития процесса обусловлена агрессивностью патогена и его тропностью и к другим чувствительным клеткам, например, макрофагам-моноцитам, а также степенью зрелости иммунной системы пораженного конкретным возбудителем индивидуума. В итоге нормальный физиологический уровень функционирования эндотелия и кроветворных органов динамически меняется. В разгар инфекции происходит тотальное изменение анатомо-морфологической целостности и, соответственно, функций системы микроциркуляции крови. Оно сопровождается ухудшением трофики всех органов и тканей, развивается гипоксия и их функциональная недостаточность. Процесс сопровождается нарушением деятельности терморегулирующего и координирующего центров ЦНС, сердечно-сосудистой и выделительной систем, развивается легочная или иная органная патология и нередко больные погибают в коматозном состоянии. Угрожающая жизни объемная потеря крови редка, хотя повышенная кровоточивость, как признак изменения сосудистой проницаемости, выступает в качестве одного из ведущих симптомов геморрагических вирусных лихорадок.
4. Причины геморрагического синдрома, этиология
Среди причин геморрагического синдрома, развивающегося достаточно быстро и часто заканчивающегося смертью больных, известны вирусы пяти семейств: Arena-, Bunya-, Filo-, Flavi- и Togaviridae. Они включают вирусы Ласса, Хунин, Мачупо, Гуанарито, Сэбия (семейство аренавирусов) - возбудители, соответственно, лихорадок Ласса, Аргентинской, Боливийской, Венесуэльской и Бразильской; лихорадки долины рифт и Крым Конго (семейство буньявирусов); желтой лихорадки (семейство флавивирусов); лихорадок Марбург и Эбола (семейство филовирусов), лихорадки денге, къясанурской лесной болезни и геморрагической лихорадки с почечным синдромом (семейства тогавирусов). Возбудители клещевых риккетсиозов, эрлихиозов и группы сыпного тифа, напротив, причастны к геморрагическому синдрому с более медленным и большей частью доброкачественным течением. Следовательно, по привязанности к возбудителю инфекционной болезни геморрагический синдром полиэтиологичен.
Широкий спектр возбудителей, вызывающих единый по клинике комплекс симптомов, обусловлен однотипным механизмом его формирования. Из данных морфологического и иммуногистологического изучения вышеуказанных заболеваний известно, что основная патология развертывается в эндотелиальных клетках микроциркуляторной системы, клетках костного мозга и для некоторых инфекций (лихорадки Марбург, денге) в процесс вовлекаются мононуклеарные фагоциты, как циркулирующие в русле крови, так и тканевые. Это находит отражение в клеточном, белковом и пептидном (кинины, лейкотриены) составе крови и балансе ее биологически активных компонентов. Затрагивается деятельность систем комплемента, кининовой, коагуляции и антикоагуляции. Последние регулируют тонус сосудов, их проницаемость, секреторную деятельность эндотелия, реологические свойства крови и ответственны за субъективные ощущения боли, усталости и другую симптоматику болезней.
Несмотря на этиологическое разнообразие патогенов, ассоциируемых с развитием геморрагического синдрома, их объединяет идентичный или весьма близкий механизм доставки возбудителя к клеткам-мишеням на начальной стадии инфекционного процесса. Возбудители лихорадок, передающиеся с участием кровососущих переносчиков, контактно через расчесы кожи или аэрогенно через альвеолярно-капиллярные мембраны легких, по существу механически переносятся к чувствительным к патогену клеткам эндотелия и тканевым оседлым макрофагам в местах микротравм, вызванных колюще-сосущим аппаратом переносчиков или повреждением эпителия. Именно в этих точках или же в альвеолярно-капиллярных мембранах, на которых произошла задержка частиц инфекционного аэрозоля, формируется первичный локальный процесс. Защитная реакция у места входных ворот сопровождается и одновременной генерализацией инфекционного процесса вследствие диссеминации возбудителя с крово-лимфооттоком с дальнейшим последовательно нарастающим поражением клеток-мишеней в органах и тканях, удаленных от места входных ворот инфекции. При этом часть частичек возбудителя поглощается макрофагами и другими клетками крови, например, эритроцитами при риккетсиозах и бартонеллезах, но не инактивируется вследствие недостаточной концентрации цитокинов, таких как интерферон-гамма (ИНФ-g), фактора некроза опухоли-альфа (ФНО-a), других монокинов и отсутствия специфических нейтрализующих антител в плазме крови на момент заражения и в начальный период болезни.
Локальное повреждение физиологически высокоактивных, регулирующих гемостаз клеток в области входных ворот патогена и одновременная генерализация инфекции с трансмиссивным механизмом передачи предопределены особенностями кровососания клещей и комаров, переносчиков возбудителей большинства геморрагических лихорадок, и особенностями анатомического строения тканевых и альвеолярных капилляров. Синхронность формирования локального и генерализованного процессов объясняется тем, что кровососание у переносчиков длится долго и прерывисто, особенно у клещей (до нескольких суток). Периодический отсос крови сопровождается периодическим же вспрыскиванием в капилляр слюны, а в некоторых случаях и коксальной жидкости, содержащих патоген, антикоагулянты и ферменты кровососа.
Инфекционный процесс на уровне клетка-возбудитель начинается по обычной для внутриклеточных паразитов схеме: прикрепление к поверхностной мембране и ее разрыхление, проникновение в цитоплазму, размножение или гибель (в случае абортивной инфекции), выход в окружающее межклеточное пространство или русло крови, с инфицированием прилегающих и отдаленных интактных клеток. Последняя стадия взаимодействия клетка-патоген сопровождается либо разрушением и некролизом первой, либо усилением внутриклеточных физиологических процессов с повышенной продукцией цитокинов и других метаболитов их нормального функционирования.
Процесс преодоления клеточной стенки патогеном небезразличен для макроорганизма: липополисахариды мембраны расщепляются фосфолипазами переносчика и возбудителя. Как следствие, освобождается арахидоновая кислота - субстрат-предшественник биологически наиболее активных эйкозаноидов (простагландин Е2(ПГЕ2), тромбооксаны, фактор активации тромбоцитов (ФАТ), интерлейкин-I (ИЛ-I) и другие), ответственные в макроорганизме за тонус и проницаемость малых артериол и прекапилляров, хемотаксилс лейкоцитов, терморегуляцию, чувство боли и другие реакции организма, объединяемые общим названием "эндогенный токсикоз".
Репродукция возбудителя в эндотелиальных клетках по электронномикроскопическим наблюдениям сопровождается их набуханием и вакуолизацией, а затем и явной патологией - отслоением от базальной мембраны на участках капилляры-венулы или от нижележащих клеток в более крупных сосудах и появлением части клеток эндотелия в русле крови. На стыке капилляровенулы возникают анатомические дефекты с оголением части базальной мембраны. Слабость сосудистых стенок в этих локусах при прогрессирующем избытке ПГЕ2, ФАТ и других цитокинов обусловливает стойкое расширение просвета венул с увеличением их кровенаполнения; кровоток замедляется, формируются лейкоцитарно-тромбоцитарный стаз, гипотензия по периферическому типу, а затем отеки и геморрагии вследствие экссудации плазмы и миграции клеток крови в периваскулярное пространство из посткапиллярных венул. Первоначально процесс экссудации компенсируется, но нарастание инфекционного процесса в целом с расширением деструктивно-воспалительных изменений в сосудистой и макрофагальной системах преодолевает "порог" компенсаторных защитных реакций организма. Последний очевидно определяется особенностями конституционального иммунитета заболевшего, возрастной степенью зрелости его иммунной системы и вирулентностью патогена. Время преодоления порога компенсаторного ответа скорее всего определяется (совпадает?) с окончанием очередного цикла репродукции возбудителя, проявляется нарастанием структурно-функциональных клеточных изменений негативного характера и появлением возбудителя в крови и в экссудатах на поверхности слизистых оболочек и коже. В клетках возрастает количество пероксидов, а в плазме - эйкозаноидов. По мере диссеминации возбудителя выраженность локальных процессов и множественность заражения макроорганизма прогрессивно возрастают, сопровождаясь появлением и развитием у инфицированного неопределенных симптомов болезни, создающих общее ощущение дискомфорта. В этот начальный период болезни, помимо количественных изменений медиаторов и цитокинов, начинает проявляться дисбаланс в системе коагуляции-антикоагуляции крови, в состоянии больного наступает резкое ухудшение, что обычно ощущается им как начало болезни. С этого времени и в разгар болезни в тканях и крови больного происходят кардинальные изменения. Отток плазмы в межклеточные пространства декомпенсируется, периваскулярная лейкоцитарная инфильтрация, диапедез эритроцитов и сгущение крови возрастают, формируются симптомы "сладжа".
Повышенная агрегация тромбоцитов и миграция лейкоцитов-нейтрофилов в стенки сосудов и околососудистые щели активизируют фактор Хагемана (фактор XII), "пусковой" компонент каскада свертывания. На фоне тромбоцитопении и лейкопении развиваются симптомы гиперкоагуляции, свойственные I стадии ДВС-синдрома.
Геморрагические лихорадки – вирусные инфекции с природно-очаговым распространением, протекающие с геморрагическим и острым лихорадочным синдромом. Симптоматика геморрагических лихорадок включает выраженную интоксикацию, высокую температуру тела, геморрагическую сыпь, кровотечения различной локализации, полиорганные нарушения. Форма геморрагической лихорадки определяется с учетом клинико-эпидемиологических и лабораторных данных (ПЦР, ИФА, РИФ). При геморрагических лихорадках проводится дезинтоксикационная, противовирусная, гемостатическая терапия, введение специфических иммуноглобулинов, борьба с осложнениями.
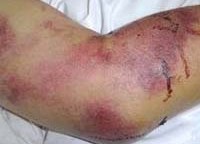
Общие сведения
Геморрагические лихорадки – группа инфекционных заболеваний вирусной природы, вызывающих токсическое поражение сосудистых стенок, способствуя развитию геморрагического синдрома. Протекают на фоне общей интоксикации, провоцируют полиорганные патологии. Геморрагические лихорадки распространены в определенных регионах планеты, в ареалах обитания переносчиков заболевания. Вызывают геморрагические лихорадки вирусы следующих семейств: Togaviridae, Bunyaviridae, Arenaviridae и Filoviridae. Характерной особенностью, объединяющей эти вирусы, является сродство к клеткам эндотелия сосудов человека.
Резервуаром и источником этих вирусов является человек и животные (различные виды грызунов, обезьяны, белки, летучие мыши и др.), переносчиком – комары и клещи. Некоторые геморрагические лихорадки могут передаваться контактно-бытовым, пищевым, водным и другими путями. По способу заражения эти инфекции подразделяются на группы: клещевые инфекции (Омская, Крымская-Конго и лихорадка Кьясанурского леса), комариные (желтая, лихорадка денге, Чукунгунья, долины Рифт) и контагиозные (лихорадки Лаоса, Аргентинская, Боливийская, Эбола, Марбург и др.).
Восприимчивость к геморрагическим лихорадкам у человека довольно высока, заболевают преимущественно лица, чья профессиональная деятельность связана с дикой природой. Заболеваемость в городах чаще отмечается у граждан, не имеющих постоянного места жительства и сотрудников бытовых служб, контактирующих с грызунами.

Симптомы геморрагической лихорадки
Геморрагические лихорадки в большинстве случаев объединяет характерное течение с последовательной сменой периодов: инкубации (как правило, 1-3 недели), начальный (2-7 дней), разгара (1-2 недели) и реконвалесценции (несколько недель). Начальный период проявляется общеинтоксикационной симптоматикой, обычно весьма интенсивной. Лихорадка при тяжелом течении может достигать критических цифр, интоксикация – способствовать расстройству сознания, бреду, галлюцинациям.
Перед наступлением периода разгара нередко отмечается кратковременная нормализация температуры и улучшение общего состояния, после чего токсикоз нарастает, интенсивность общей клиники увеличивается, развиваются полиорганные патологии, нарушения гемодинамики. В период реконвалесценции происходит постепенный регресс клинических проявлений и восстановление функционального состояния органов и систем.
Геморрагический дальневосточный нефрозонефрит нередко называют геморрагической лихорадкой с почечным синдромом, поскольку для этого заболевания характерно преимущественное поражение сосудов почек. Инкубация геморрагического дальневосточного нефрозонефрита составляет 2 недели, но может сокращаться до 11 и удлиняться до 23 дней. Впервые дни заболевания возможны продромальные явления (слабость, недомогание). Затем развивается тяжелая интоксикация, температура тела поднимается до 39,5 и более градусов и сохраняется на протяжении 2-6 дней. Спустя 2-4 дня от начала лихорадки появляется геморрагическая симптоматика на фоне прогрессирующей интоксикации. Иногда могут отмечаться менингеальные симптомы (Кернига, Брудзинского, ригидность затылочных мышц). Ввиду токсического поражения головного мозга, сознание нередко спутано, появляются галлюцинации, бред.
Крымская геморрагическая лихорадка характеризуется острым началом: отмечается рвота, боль в животе натощак, озноб. Температура тела резко повышается. Внешний вид больных характерный для геморрагических лихорадок: гиперемированное отечное лицо и инъецированные конъюнктивы, веки, склеры. Геморрагическая симптоматика выражена: петехиальные высыпания, кровоточивость десен, кровотечения из носа, примесь крови в кале и рвотных массах, маточные кровотечения у женщин. Селезенка чаще остается нормального размера, у некоторых больных может отмечаться ее увеличение. Тяжелое течение заболевания проявляется интенсивной болью в животе, частой рвотой, меленой. Пульс лабильный, артериальное давление снижено, сердечные тоны – глухие.
Омская геморрагическая лихорадка протекает более легко и доброкачественно, геморрагический синдром выражен слабее (хотя летальность имеет место и при этой инфекции). В первые дни лихорадка достигает 39 с небольшим градусов, в половине случаев лихорадочный период протекает волнообразно, с периодами повышения и нормализации температуры тела. Продолжительность лихорадки – 3-10 дней.
Геморрагическая лихорадка денге характеризуется инкубационным периодом от 5 до 15 дней, доброкачественным течением, симптоматикой общей интоксикации, усиливающейся к 3-4 дню и пятнисто-папулезной сыпью геморрагического происхождения, проходящей через 2-3 дня после появления (обычно возникает в разгар заболевания) и не оставляющей после себя пигментаций или шелушения. Температурная кривая может быть двухволновой: лихорадка прерывается 2-3-дневным периодом нормальной температуры, после чего возникает вторая волна. Такая форма характерна для европейцев, у жителей Юго-Восточной Азии лихорадка Денге развивается по геморрагическому варианту и имеет более тяжелое течение.
Геморрагические лихорадки могут способствовать развитию тяжелых, угрожающих жизни состояний: инфекционно-токсического шока, острой почечной недостаточности, комы.
Диагностика геморрагических лихорадок
Диагностику геморрагических лихорадок производят на основании клинической картины и данных эпидемиологического анамнеза, подтверждая предварительный диагноз лабораторно. Специфическая диагностика производится с помощью серологических исследования (РСК, РНИФ и др.), иммуноферментного анализа (ИФА), выявления вирусных антигенов (ПЦР), вирусологического метода.
Геморрагические лихорадки обычно характеризуются тромбоцитопенией в общем анализе крови, выявлением эритроцитов в моче и кале. При выраженной геморрагии появляются симптомы анемии. Положительный анализ кала на скрытую кровь говорит о кровотечении по ходу желудочно-кишечного тракта.
Лихорадка с почечным синдромом также проявляется при лабораторной диагностике в виде лейкопении, анэозинофилии, увеличением количества палочкоядерных нейтрофилов. Значительны патологические изменения в общем анализе мочи – удельный вес снижен, отмечается белок, (нередко повышение достигает 20-40%), цилиндры. В крови повышен остаточный азот. Крымская лихорадка отличается лимфоцитозом на фоне общего нормоцитоза, сдвигом лейкоформулы влево и нормальной СОЭ.
Лечение геморрагической лихорадки
Больные с любой геморрагической лихорадкой подлежат госпитализации. Прописан постельный режим, полужидкая калорийная легкоусвояемая диета, максимально насыщенная витаминами (в особенности С и В) – овощные отвары, фруктовые и ягодные соки, настой шиповника, морсы). Кроме того, назначают витаминотерапию: витамины С, Р. Ежедневно в течение четырех дней принимается викасол (витамин К).
Внутривенно капельно назначают раствор глюкозы, в период лихорадки могут производиться переливания крови небольшими порциями, а также введение препаратов железа, препаратов на основе водного экстракта из печени крупного рогатого скота. В комплексную терапию включают противогистаминные средства. Выписка из стационара производится после полного клинического выздоровления. По выписке больные некоторое время наблюдаются амбулаторно.
Прогноз и профилактика геморрагической лихорадки
Прогноз зависит от тяжести течения заболевания. Геморрагические лихорадки могут варьироваться по течению в весьма широких пределах, в некоторых случаях вызывая развитие терминальных состояний и заканчиваясь летально, однако в большинстве случаев при своевременной медицинской помощи прогноз благоприятен – инфекция заканчивается выздоровлением.
Профилактика геморрагических лихорадок в первую очередь подразумевает меры, направленные на уничтожение переносчиков инфекции и предупреждение укусов. В ареале распространения инфекции производят тщательную очистку мест, подготовленных под поселение, от кровососущих насекомых (комары, клещи), в эпидемически опасных регионах рекомендовано в лесных массивах носить плотную одежду, сапоги, перчатки, специальные противокомариные комбинезоны и маски, использовать репелленты. Для омской геморрагической лихорадки существует методика специфической профилактики, плановая вакцинация населения с помощью убитой вакцины вируса.
Читайте также:

