С дизентерией и конъюнктивитом
Обновлено: 25.04.2024
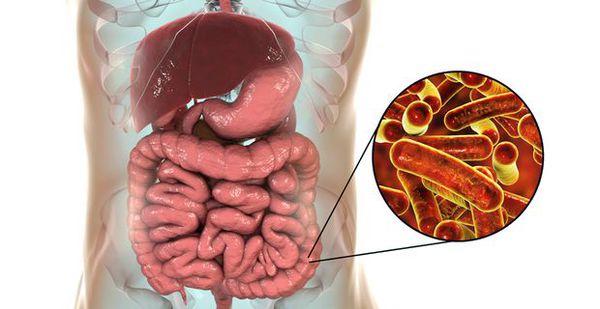
Дизентерия представляет собой острую кишечную инфекцию, вызываемую бактериями рода Shigella, характеризующуюся преимущественной локализацией патологического процесса в слизистой оболочке толстого кишечника. Дизентерия передается фекально-оральным путем (пищевым или водным). Клинически у больного дизентерией наблюдается диарея, боли в животе, тенезмы, интоксикационный синдром (слабость, разбитость, тошнота). Диагноз дизентерии устанавливают при выделении возбудителя из испражнений пациента, при дизентерии Григорьева-Шиги – из крови. Лечение проводится преимущественно амбулаторно и заключается в регидратации, антибактериальной и дезинтоксикационной терапии.
Общие сведения
Дизентерия представляет собой острую кишечную инфекцию, вызываемую бактериями рода Shigella, характеризующуюся преимущественной локализацией патологического процесса в слизистой оболочке толстого кишечника.
Характеристика возбудителя
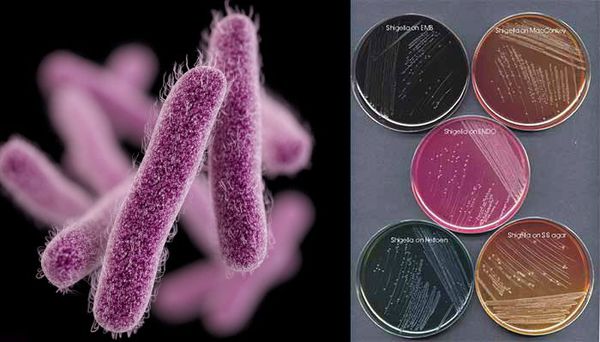
Возбудители дизентерии – шигеллы, в настоящее время представлены четырьмя видами (S. dysenteriae, S.flexneri, S. boydii, S. Sonnei), каждый из которых (за исключением шигеллы Зонне) в свою очередь подразделяется на серовары, которых в настоящее время насчитывается более пятидесяти. Популяция S. Sonnei однородна по антигенному составу, но различается по способности продуцировать различные ферменты. Шигеллы – неподвижные грамотрицательные палочки, спор не образуют, хорошо размножатся на питательных средах, во внешней среде обычно малоустойчивы.
Оптимальная температурная среда для шигелл - 37 °С, палочки Зонне способны к размножению при температуре 10-15 °С, могут образовывать колонии в молоке и молочных продуктах, могут длительно сохранять жизнеспособность в воде (как и шигеллы Флекснера), устойчивы к действию антибактериальных средств. Шигеллы быстро погибают при нагревании: мгновенно - при кипячении, через 10 минут - при температуре более 60 градусов.
Резервуаром и источником дизентерии является человек - больной или бессимптомный носитель. Наибольшее эпидемиологическое значение имеют больные с легкой или стертой формой дизентерии, в особенности, имеющие отношение к пищевой промышленности и учреждениям общественного питания. Шигеллы выделяются из организма зараженного человека, начиная с первых дней клинической симптоматики, заразность сохраняется в течение 7-10 дней, после чего следует период реконвалесценции, в который, однако, также не исключено выделение бактерий (иногда может продолжаться несколько недель и месяцев).
Дизентерия Флекснера наиболее склонна к переходу в хроническую форму, наименьшая тенденция к хронизации отмечается при инфекции, вызванной бактериями Зонне. Дизентерия передается с помощью фекально-орального механизма преимущественно пищевым (дизентерия Зонне) или водным (дизентерия Флекснера) путем. При передаче дизентерии Григорьева-Шиги реализуется преимущественно контактно-бытовой путь передачи.
Люди обладают высокой естественной восприимчивостью к инфекции, после перенесения дизентерии формируется нестойкий типоспецифический иммунитет. Переболевшие дизентерией Флекснера могут сохранять постинфекционный иммунитет, предохраняющий от повторного заболевания в течение нескольких лет.
Патогенез дизентерии
Шигеллы попадают с пищей или водой в пищеварительную систему (частично погибая под воздействием кислого содержимого желудка и нормального биоценоза кишечника) и достигают толстой кишки, частично внедряясь в её слизистую оболочку и вызывая воспалительною реакцию. Пораженная шигеллами слизистая склонна к образованию участков эрозий, язв, кровоизлияний. Выделяемые бактериями токсины нарушают пищеварение, а также присутствие шигелл разрушает естественный биобаланс кишечной флоры.
Классификация
В настоящее время применяется клиническая классификация дизентерии. Выделяют ее острую форму (различается по преимущественной симптоматике на типичную колитическую и атипичную гатроэнтеритическую), хроническую дизентерию (рецидивирующую и непрерывную) и бактериовыделение (реконвалесцентное или субклиническое).
Симптомы дизентерии
Острая дизентерия в гастроэнтеритическом варианте характеризуется коротким инкубационным периодом (6-8 часов) и преимущественно энтеральными признаками на фоне общеинтоксикационного синдрома: тошнотой, многократной рвотой. Течение напоминает таковое при сальмонеллезе или токсикоинфекции. Боль при этой форме дизентерии локализуется в эпигастральной области и вокруг пупка, имеет схваткообразный характер, стул жидкий и обильный, патологические примеси отсутствуют, при интенсивной потере жидкости может отмечаться дегидратационный синдром. Симптоматика гастроэнтеритической формы бурная, но кратковременная.
Первоначально гастроэнтероколитическая дизентерия также напоминает по своему течению пищевую токсикоинфекцию, в последующем начинает присоединяться колитическая симптоматика: слизь и кровянистые прожилки в каловых массах. Тяжесть течения гастроэнтероколитической формы определяется выраженностью дегидратации.
Дизентерия стертого течения на сегодняшний день возникает довольно часто. Отмечается дискомфорт, умеренная болезненность в животе, кашицеобразный стул 1-2 раза в день, в основном без примесей, гипертермия и интоксикация отсутствуют (либо крайне незначительна). Дизентерия, продолжающаяся более трех месяцев, признается хронической. В настоящее время случаи хронической дизентерии в развитых странах кране редки. Рецидивирующий вариант представляет собой периодические эпизоды клинической картины острой дизентерии, перемежающиеся периодами ремиссии, когда больные чувствуют себя относительно благополучно.
Непрерывная хроническая дизентерия ведет к развитию тяжелых нарушений пищеварения, органических изменений слизистой оболочки кишечной стенки. Интоксикационная симптоматика при непрерывной хронической дизентерии обычно отсутствует, имеет место постоянная ежедневная диарея, испражнения кашицеобразные, могут иметь зеленоватый оттенок. Хронические нарушения всасывания ведут к снижению массы тела, гиповитаминозам, развитию синдрома мальабсорбции. Реконвалесцентное бактериовыделение обычно наблюдается после перенесения острой инфекции, субклиническое - бывает при перенесении дизентерии в стертой форме.
Осложнения
Осложнения при современном уровне медицинской помощи встречаются крайне редко, преимущественно в случае тяжело протекающей дизентерии Григорьева-Шиги. Эта форма инфекции может осложниться инфекционно-токсическим шоком, перфорацией кишечника, перитонитом. Кроме того, вероятно развитие парезов кишечника.
Дизентерия с интенсивной длительной диареей может осложниться геморроем, анальной трещиной, выпадением прямой кишки. Во многих случаях дизентерия способствует развитию дисбактериоза.
Диагностика
Максимально специфична бактериологическая диагностика. Выделение возбудителя обычно производят из испражнений, а в случае дизентерии Григорьева-Шиги – из крови. Поскольку нарастание титра специфических антител происходит довольно медленно, методы серологической диагностики (РНГА) имеют ретроспективное значение. Все больше в лабораторную практику диагностирования дизентерии входит выявление антигенов шигелл в испражнениях (обычно производят с помощью РКА, РЛА, ИФА и РНГА с антительным диагностикумом), реакция связывания комплимента и агрегатгемаглютинации.
В качестве общих диагностических мер применяют различные лабораторные методики для определения степени тяжести и распространенности процесса, выявления метаболических нарушений. Проводят анализ кала на дисбактериоз и копрограмму. Эндоскопическое исследование (ректороманоскопия) нередко может дать необходимую информацию для дифференциального диагноза в сомнительных случаях. С этой же целью пациентам с дизентерией, в зависимости от ее клинической формы, может понадобиться консультация гастроэнтеролога или проктолога.
Лечение дизентерии
Легкие формы дизентерии лечатся амбулаторно, стационарное лечение показано лицам с тяжело протекающей инфекцией, осложненными формами. Также госпитализируют больных по эпидемиологическим показаниям, в старческом возрасте, имеющих сопутствующие хронические заболевания, и детей первого года жизни. Пациентам назначают постельный режим при лихорадке и интоксикации, диетическое питание (в острый период – диета №4, при стихании диареи – стол №13).
Этиотропная терапия острой дизентерии заключается в назначении 5-7-дневного курса антибактериальных средств (антибиотики фторхинолонового, тетрациклинового ряда, ампициллина, котримоксазола, цефалоспоринов). Антибиотики назначают при тяжелых и среднетяжелых формах. С учетом способности антибактериальных препаратов усугублять дисбактериоз, в комплексе применяют эубиотики курсом в течение 3-4 недель.
При необходимости производится дезинтоксикационная терапия (в зависимости от тяжести дезинтоксикации препараты назначают орально или парентерально). Коррекцию нарушений всасывания производят с помощью ферментных препаратов (панкреатин, липаза, амилаза, протеаза). По показаниям назначают иммуномодуляторы, спазмолитики, вяжущие средства, энтеросорбенты.
Для ускорения регенеративных процессов и улучшения состояния слизистой в период реконвалесценции рекомендованы микроклизмы с настоем эвкалипта и ромашки, маслом шиповника и облепихи, винилина. Хроническая форма дизентерии лечится так же, как и острая, но антибиотикотерапия обычно менее эффективна. Рекомендовано назначение лечебных клизм, физиотерапевтическое лечение, бактериальные средства для восстановления нормальной микрофлоры кишечника.
Прогноз и профилактика
Прогноз преимущественно благоприятный, при своевременном комплексном лечении острых форм дизентерии хронизация процесса крайне редка. В некоторых случаях после перенесения инфекции могут сохраниться остаточные функциональные нарушения работы толстого кишечника (постдизентерийный колит).
Общие меры профилактики дизентерии подразумевают соблюдение санитарно-гигиенических норм в быту, в пищевом производстве и на предприятиях общественного питания, контроль за состоянием водных источников, очистку канализационных отходов (в особенности дезинфекция сточных вод лечебных учреждений).
Больных дизентерией выписывают из стационара не ранее, чем спустя три дня после клинического выздоровления при отрицательном однократном бактериологическом тесте (забор материала для бактериологического исследования производится не ранее 2 дня после окончания лечения). Работники пищевой промышленности и другие лица, приравненные к ним, подлежат выписке после двукратного отрицательного результата бактериологического анализа.
Что такое дизентерия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Шигеллёзы, или дизентерия — это группа острых/хронических заболеваний, вызываемых бактериями рода Шигелла, которые поражают желудочно-кишечный тракт (преимущественно дистальный отдел толстой кишки). Манифестные формы (клиническая картина) дизентерии: синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (дистальный колит), синдром обезвоживания. При отсутствии адекватного лечения приводит к серьёзным осложнениям и хронизации.
Возбудитель дизентерии
семейство — кишечные бактерии (Enterobacteriaceae)
род — Шигелла (Shigella)
виды — 4 основных:
- Dysenteriae (серовары — шигелла Григорьева-Шига, Штутцера-Шмитца, Ларджа-Сакса);
- Flexneri (Флекснера);
- Boydii (Боудии);
- Sonnei (Зонне).
Являются факультативно-анаэробными (способны существовать как при наличии, так и при отсутствии кислорода), граммотрицательными, неподвижными палочками. Хорошо растут на обычных питательных средах.
Имеют О-антиген (серологическая специфичность) и К-антиген (оболочечная структура). Клеточная стенка частично состоит из эндотоксина (липополисахарида), высвобождающегося при гибели микроорганизма. Бактерии вида Shigella Dysenteriae серовара Григорьева-Шига продуцируют высокоактивный цитотоксин, который нарушает синтез белка рибосомами клеток кишечного эпителия. Цитотоксин в совокупности с энтеротоксином (усиливающим секрецию жидкости и солей в просвет кишки) и нейротоксином (оказывающим нейротоксическое действие на сплетения Ауэрбаха) образует экзотоксином — токсин, выделяемый в процессе жизнедеятельности шигелл (Цитотоксин + энтеротоксин + нейротоксин = экзотоксин). Также у данной группы микроорганизмов происходит выделение гемолизинов — веществ, разрушающих эндотелий капилляров и вызывающий ишемию в тканях кишечника).
Факторы патогенности шигелл (механизм приспособления бактерий):
- адгезия (прикрепление к слизистой оболочке кишечника);
- инвазия (проникновение в эпителиальные клетки слизистой оболочки толстого кишечника);
- токсинообразование;
- внутриклеточное размножение.
Тинкториальные свойства (особенности микроорганизмов при окрашивании): быстро изменяют чувствительность к антибактериальным препаратам. Характерна высокая выживаемость во внешней среде (в воде, почве и пище при комнатной температуре сохраняются до 14 дней, в канализационных стоках — до 30 дней, при благоприятных условиях могут быть жизнеспособны до 4 месяцев). Способны к размножению в пищевых продуктах. При воздействии УФО (ультрафиолетового облучения) погибают за 10 минут, в 1% феноле — за 30 минут, при кипячении — мгновенно.
Интересная особенность: чем выше ферментативная активность возбудителя дизентерии, тем ниже вирулентность (минимальная доза возбудителя, способная заразить человека) и наоборот. [3] [6]
Эпидемиология
Антропоноз (повсеместное распространение).
Источник инфекции — человек (больной, носитель и лица с субклинической формой заболевания).
Минимальная инфицирующая доза для бактерии Григорьева-Шига — 10 микробных тел в 1 грамме вещества, для Флекснера — 10 2 бактерий, для Зонне — от 10 7 .
Длительное время в РФ превалировали случаи заражения, вызванные шигеллой Флекснера 2а, однако в настоящее время ввиду широкого развития туризма длительного преобладания какой-либо формы нет.
Механизм передачи — фекально-оральный (пищевой, водный, контактно-бытовой), из них преимущественно:
- Григорьева-Шига (контактно-бытовой путь);
- Зонне (с молоком и молочными продуктами);
- Флекснера (водный путь);
- Дизентериа (пищевой путь).
Наибольшую опасность представляют работники питания и водоснабжения. Больные заразны с начала болезни (конца инкубационного периода) и до трёх недель болезни.
Иммунитет непродолжителен и моноспецифичен (вырабатывается только к одному серотипу, который вызвал заболевание). [1] [4] [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дизентерии
Инкубационный период — от 1 до 7 дней.
Начало заболевания острое (развитие основных синдромов наблюдается в первые сутки заболевания), характерна лихорадка постоянного типа.
Причины и возбудитель дизентерии. Механизмы развития дизентерийной инфекции
При разрушении в организме человека все шигеллы образуют эндотоксин: палочка Григорьева-Шига, в отличие от других шигелл, способна выделять экзотоксин (нейротоксин), обладающий выраженной энтеротоксической активностью. Бактерии Григорьева-Шига отличаются самой высокой вирулентностью и вызывают тяжелые эпидемии дизентерии с большой летальностью (до 30-40%). Шигелла Зонне способна размножаться и накапливаться в пищевых продуктах (салаты, мясной фарш, компоты и др.), особенно в молоке при температуре +25°С и выше Все шигеллы хорошо сохраняются на продуктах растительного происхождения (зелень, фрукты, ягоды, овощи и др.) от нескольких дней до 1-2 мес; в воде-до 2 мес; в испражнениях- 10-15 суток; переносят замораживание до 40 дней. Обычные дезинфицирующие средства (например 5% раствор Лизола) убивает их через минуту. Наиболее устойчивы во внешней среде шигеллы Зонне.
Механизмы развития дизентерийной инфекции
В развитии болезни имеют значение вид шигелл, доза возбудителя, фактор заражения (пища или вода), состояние организма человека до начала заболевания. Механизм развития патологического процесса при дизентерии сложен и, несмотря на многочисленные исследования отечественных и зарубежных ученых, еще полностью не изучен. Из существующих теорий патогенеза (токсикоинфекционная, аллергическая, инвазивная, связанная с внутриклеточным паразитированием возбудителя, иммуногенетическая и др.) ни одна в полной мере не объясняет сложного механизма развития патологического процесса при шигеллезной инфекции Бесспорным является факт, что после попадания шигелл через рот происходят гибель их в желудке и кишках, высвобождение и проникновение эндотоксина (а при шигеллезе Григорьева-Шига и экзотоксина) в кровь.
Это ведет к развитию общей интоксикации и сенсибилизации организма к шигеллезным токсинам, а позднее и к продуктам повреждения стенки кишечника, что облегчает внедрение возбудителя в слизистую оболочку толстой кишки. Бактериемии, как правило, не наблюдается. В эксперименте на людях - добровольцах показано, что размножение возбудителя в слизистой оболочке кишечника и ее повреждение (чаще дистальных отрезков толстой кишки) возможно только после предварительной специфической сенсибилизации организма к шигеллам. Опыты заражения дизентерией человека путем введения живой культуры возбудителя в прямую кишку не приводят к развитию болезни, что свидетельствует о решающей роли в ее патогенезе токсико-аллергического механизма. После инвазии с помощью имеющихся ферментов (гидролазы, муциназы и др.), шигеллы разрушают слизистую оболочку кишечника, преодолевают клеточные мембраны, проникают внутрь энтероцитов и размножаются в них.
Внутриклеточное паразитирование шигелл ведет к дегенеративным изменениям эпителия кишечника, слущиванию, частичному или полному его разрушению. Благодаря инвазивным свойствам шигеллы паразитируют в стенке кишечника. Под влиянием аутоантигенов тканевого происхождения возникают дополнительная аутосенсибилизация и усиление воспалительной реакции в кишке.
При дизентерии патологические изменения дистрофического характера обнаруживаются во всех отделах желудочно-кишечного канала, органах пищеварения, нервном аппарате кишечника и связанных с ним анатомически и функционально нервных сплетениях (мейснеровском и аурбаховском), солнечном сплетении, в шейных симпатических узлах, других отделах симпатической нервной системы, узловатом ганглии блуждающего нерва. В печени, поджелудочной железе, миокарде, почках вследствие интоксикации также происходят дистрофические изменения. В тяжелых случаях, наблюдавшихся в прежние годы, находили циркуляторные расстройства в мозговых оболочках и тканях мозга, кровоизлияния и некрозы в надпочечниках.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекционные конъюнктивиты и другие поражения глаз
Аденовирусные конъюнктивиты — довольно частые заболевания глаз. Они протекают в форме кератоконъюнктивальной лихорадки, когда, помимо катарального воспаления конъюнктивы, имеется разлитой эритематозный фарингит с болями при глотании и хрипотой, повышением температуры. Фолликулярный аденовирусный конъюнктивит протекает у взрослых обычно с нормальной температурой. В случаях весьма контагиозного эпидемического (вероятно, энтеровирусного ECHO или Коксаки) кератоконъюнктивита возможны фебрильные и афебрильные формы.
Иногда они протекают с пленчатым экссудатом, требующим дифференциальной диагностики с дифтерией.
У больных с тяжелой менингококковой индукцией, помимо кровоизлияний в слизистые оболочки и кожу, развиваются гнойные конъюнктивиты, кератиты, флегмоны глазницы. В тяжелых случаях лептоспирозов могут возникать конъюнктивиты, иридоциклит, ретробульбарный неврит.
При дизентерии отмечаются конъюнктивиты, ирит, иридоциклит. Поражение глаз иногда одновременно сочетается с безмикробным уретритом и артритами, чаще коленным моноартритом (триада Рейтера), патогенетической основой которых являются, вероятнее всего, аутоиммунные реакции. В редких случаях сальмонеллеза и других бактериальных поражений кишечника также возможно развитие синдрома Рейтера. При бруцеллезе сравнительно редко наблюдаются кератоконъюнктивиты, ири-доциклит, ретинит, хориоидит.
Активное изучение распространения и клинических проявлений лайм-боррелиоза привело к установлению факта поражения при нем глаз; описаны двусторонний кератит, диффузный хориоидит, дисковидный отек и экссудативная отслойка сетчатки. В этих случаях у больных значительно повышается уровень специфических иммуноглобулинов к Borrelia burdgorferi (IgG до титра 1:320).

Коревой катаральный конъюнктивит может осложниться вторичными гнойными инфекциями, вызываемыми стафилококком, стрептококком, пневмококком и др. При ветряной оспе специфическое поражение глаз относится к числу редких. Оно протекает в виде кератита с развитием эктропиона. В прошлом при натуральной оспе часто развивались специфические вирусный кератит, иридохориоидит, ретинит, воспаление зрительного нерва, приводившие к слепоте.
При многообразии клинических форм инфекционного мононуклеоза с соответствующими гематологическими показателями (лимфомоноцитоз с положительными серологическими реакциями на мононуклеоз) наблюдаются формы заболевания с поражениями кожи и слизистых оболочек: конъюнктивиты, стоматит, катары верхних дыхательных путей, различные кожные высыпания.
Помимо катаральных конъюнктивитов, кератита, ирита и иридоциклита, при эпидемическом паротите возможна изолированная форма дакриоаденита паротитной природы, которая проявляется сильной двусторонней болью в глазницах.
При глазном опоясывающем лишае больных беспокоят сильные боли по типу невралгии тройничного нерва. Они обычно предшествуют высыпанию. Иногда боли продолжаются в течение нескольких недель или месяцев. Пузырьковая сыпь сопровождается гиперемией и отеком кожи лба и верхних век, при этом больной по виду напоминает больного рожей. Герпетический кератит может привести к потере зрения. Реже поражаются сосудистые оболочки глаза, зрительный или глазодвигательный нервы. В поздних стадиях вследствие поражения тройничного нерва может возникнуть нейропаралитический кератит.
Поражение глаз встречается при врожденном токсоплазмозе. В части случаев оно является главным симптомом заболевания. Развиваются одно- или двухсторонняя микроофтальмия с расстройством глазодвигательных функций, косоглазие и нистагм. Возможна отслойка сетчатки как следствие хориоретинита. При приобретенном токсоплазмозе также часто поражается орган зрения в виде хориоидита, хориоретинита, которые могут быть единственными признаками этого заболевания [Казанцев А. П., Васильев В. В.].
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Причины конъюнктивита у новорожденных и его профилактика, лечение
Неонатальный конъюнктивит является воспалением или инфекцией конъюнктивы, которые развиваются в первые месяцы жизни. Выделяют три вида этого заболевания: химический, бактериальный и вирусный. Многие формы неонатального конъюнктивита разрешаются самостоятельно и не угрожают зрению, однако некоторые разновидности сочетаются с серьезными системными нарушениями или могут приводить к слепоте.
Конъюнктивальная инъекция, хемоз, выделения и отек век могут наблюдаться при всех разновидностях неонатального конъюнктивита. На специфические причины конъюнктивита указывают дополнительные клинические признаки, такие как латерализация, тяжесть инъекции и хемоза, характер выделений, наличие конъюнктивальных псевдомембран или кожных везикул.
История болезни, в том числе пренатальный анамнез матери, помогает назначить соответствующие лабораторные исследования.
Неонатальный конъюнктивит — самая распространенная инфекция в первый месяц жизни, ее частота составляет от 1% до 24%.
Crede впервые сообщил о профилактике офтальмии новорожденных: применение нитрата серебра снижало частоту офтальмии новорожденных с 7,8% до 0,17%. До широкого применения профилактических мер офтальмия новорожденных была распространенным диагнозом в школах для слепых детей. Рубцевание роговицы, в том числе вызванной офтальмией новорожденных, остается основной причиной детской слепоты в Африке.
К средствам профилактики относятся: нитрат серебра 1%, повидон-йод 2,5%, мазь с эритромицином 0,5% и мазь с тетрациклином 1%. Эти препараты применяются на нижний свод конъюнктивы обоих глаз в течение часа после рождения ребенка. Нитрат серебра среди профилактических средств обладает наибольшей вероятностью вызвать химический конъюнктивит. Нитрат серебра и тетрациклин обладают равной эффективностью (83-93%) в профилактике гонококковой офтальмии новорожденных.
В контролируемом исследовании 3117 новорожденных в Кении повидон-йод 2,5% оказался более эффективным, чем эритромицин и нитрат серебра в профилактике инфекционного конъюнктивита. Однако в рандомизированном контролируемом исследовании 410 новорожденных в Израиле повидон-йод был чуть менее эффективным в профилактике инфекционного конъюнктивита, но с большей вероятностью вызывал химический конъюнктивит по сравнению с тетрациклином.
В США в качестве местного профилактического средства применяется эритромицин 0,5%. Другие препараты в торговой сети здесь отсутствуют. Во время нехватки эритромицина в 2009 году Центр контроля и профилактики заболеваний США рекомендовал применение местного раствора азитромицина 1% или, при его отсутствии, местную мазь гентамицина 0,3% или мазь тобрамицина 0,3%. Азитромицин стоит в 10 раз дороже чем повидон-йод, приготовлен ный в больничной аптеке. Местный гентамицин может вызвать периокулярный язвенный дерматит.
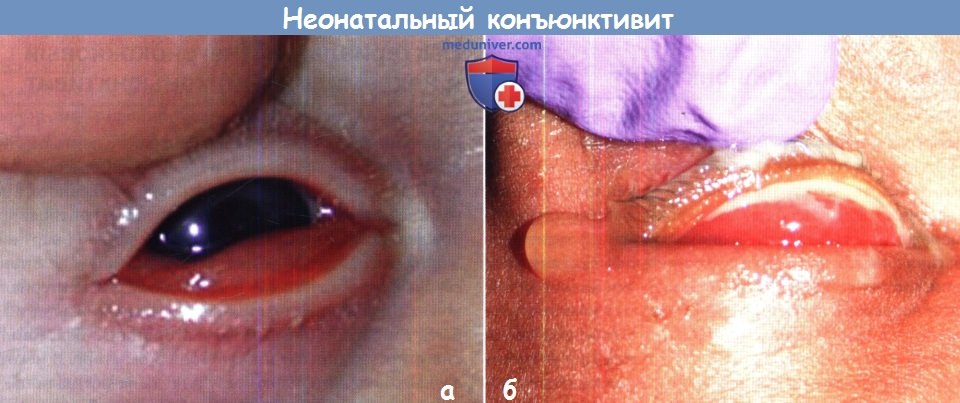
(А) Пальпебральная конъюнктивальная инъекция и хемоз вследствие инфекции Chlamydia trachomatis. Фотография представлена Irene Anteby.
(Б) Выраженный пальпебральный конъюнктивит с гнойными выделениями вследствие инфекции Neisseria gonorrhoeae и ко-инфекции Chlamydia trachomatis у четырехдневного младенца.
а) Химический конъюнктивит у новорожденных. Химический конъюнктивит возникает в течение 1-2 дней после назначения местного препарата и развивается билатерально. Окрашивание по Граму показывает лейкоцитоз и отсутствие бактерий. Отмена виновного препарата приводит к разрешению симптомов в течение двух дней.
б) Хламидийный конъюнктивит у новорожденных. Распространенность Chlamydia trachomatis среди беременных женщин составляет от 2% до 20%, более высокий процент отмечается у молодых женщин, а также у женщин, не находившихся во время беременности под контролем врача. Вероятность развития симптоматического конъюнктивита у ребенка, рожденного от матери с нелеченой инфекцией С. trachomatis составляет от 20% до 50%.
Хламидийный конъюнктивит обычно развивается в течение 5-14 дней после родов. Хотя он чаще встречается у детей после вагинальных родов, но может встречаться и после кесарева сечения.
Конъюнктивит бывает односторонним или двусторонним, а выделения слизисто-гнойными. Возможно образование псевдомембран. При отсутствии лечения конъюнктивит разрешается в течение недель и месяцев, но может приводить к рубцеванию конъюнктивы и роговицы. Диагноз устанавливается при выделении Chlamydia в культуре клеток эпителия, полученных при соскобах пальпебральной конъюнктивы. Внутриклеточные включения обнаруживаются при окрашивании по Гимзе. Эквивалентным культуральному методу определения С. trachomatis в материале, взятом с конъюнктивы, является метод ПЦР. Хламидийный конъюнктивит ассоциируется с заложенностью носа, отитом среднего уха и пневмонией, развивающейся на 4-12 неделе жизни.
При хламидийном конъюнктивите назначают внутрь эритромицин (50 кг/день, разделенных на 4 дозы) в течение 14 дней. Бессимптомным младенцам, родившимся у матерей с нелеченой инфекцией С. trachomatis, профилактическая терапия не назначается, отчасти потому, что эритромицин может вызвать у новорожденных гипертрофический стеноз привратника. У детей с конъюнктивитом при отсутствии системных признаков пневмонии прием эритромицина можно отложить в ожидании результата диагностических тестов, подтверждающих наличие Chlamydia. Альтернативной терапией является прием азитромицина внутрь (20 мг/кг ежедневно в течение 3 дней), хотя опыт его применения у новорожденных ограничен.
Мать и ее половой партнер должны получить однократную дозу азитромицина (1 г) внутрь и пройти обследование на другие заболевания, передаваемые половым путем.
в) Гонококковый конъюнктивит у новорожденных детей. Распространенность цервикальной гонококковой инфекции у женщин в развитых странах, как правило, менее 1%; однако в некоторых странах распространенность инфекции достигает 22%. Вероятность развития конъюнктивита у новорожденных от матерей с гонококковой инфекцией после вагинальных родов при отсутствии профилактического лечения составляет 30-47%. Передача гонококковой инфекции возрастает до 68%, если у материи имеется также хламидийная инфекция. Гонококковый конъюнктивит возможен также у детей, родившихся в результате кесарева сечения. Симптомы у младенцев обычно проявляются через 2-5 дней после родов.
Конъюнктивит протекает агрессивно, с обильными гнойными выделениями, тяжелой конъюнктивальной инъекцией, хемозом и отеком век. Гонококки могут проникать в роговицу через интактный эпителий. Поражение роговицы начинается с плотных белых периферических инфильтратов. На второй неделе инфекции может развиться изъязвление. Серьезной проблемой является рубцевание роговицы в результате неоваскуляризации и перфорации роговицы. В одном исследовании у 4 из 25 пациентов (16%) с гонококковым конъюнктивитом развилось поражение роговицы.
Дети, рожденные от матерей, инфицированных N. gonorrhoeae, независимо от наличия или отсутствия конъюнктивита, должны получить внутримышечно или внутривенно профилактическую однократную дозу цефтриаксона (25-50 мг/кг до максимально 125 мг) или цефотаксима (100 мг/кг внутримышечно или внутривенно), если у ребенка отмечается гипербилирубинемия.9 При подозрении на гонококковый конъюнктивит детям, до назначения антибиотиков, проводится культуральный анализ с окрашиванием по Граму и применением модифицированной среды Тайера-Мартина.
Чувствительность грамотрицательных диплококков при окрашивании по Граму на наличие гонококкового конъюнктивита составляет 86%, а специфичность 90%. Культуральное исследование крови и спинномозговой жидкости проводится для обследования на бактериемию и менингит, проводится клинический контроль ребенка на наличие септического артрита. Поскольку у матери часто имеется сопутствующая хламидийная инфекция, проводится окрашивание по Гимзе и культуральный анализ на Chlamydia. При наличии системной инфекции курс цефалоспорина продлевается до 7-14 дней. В местных антибиотиках необходимости нет, однако рекомендуется частое промывание гнойных выделений физиологическим раствором.
Мать и ее половой партнер должны получить лечение по поводу гонококковой и предположительной хламидийной инфекции, а также пройти обследование на наличие других заболеваний, передающихся половым путем.
г) Бактериальный (негонококковый и нехламидийный) конъюнктивит. В большинстве случаев бактериального конъюнктивита, вызванного не Chlamydia и не Gonococcus, имеет место микробная колонизация носоглотки новорожденного, а не влагалища матери. По сравнению с группой контроля у новорожденных с конъюнктивитом чаще всего обнаруживают Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus viridans, Enterococcus и Haemophilus. Бактериальный конъюнктивит начинается на 5-14-й день жизни и может быть односторонним или двухсторонним. Бактерии культивируют на шоколадном и кровяном агаре. В некоторых случаях положительный результат означает наличие колонизации, но не вызывающих заболевание бактерий.
До получения результатов культурального анализа можно применять местный антибиотик широкого спектра действия, но многие случаи разрешаются без терапии.
д) Герпетический конъюнктивит. В редких случаях неонатальный конъюнктивит может вызываться вирусом простого герпеса (ВПГ). Новорожденные инфицируются во время вагинальных родов или в результате восходящей внутриматочной инфекции, если у матери имеется генитальная инфекция ВПГ. Риск инфекции намного выше, если у матери первичная герпетическая инфекция, а не случай реактивации генитальной инфекции ВПГ: 25-60% по сравнению с 2%. Новорожденные могут заразиться при прямом контакте с ухаживающим персоналом, имеющим лабиальный герпес или герпетический панариций.
Офтальмологические проявления неонатального ВПГ включают эритему и везикулы на веках, конъюнктивит, кератит и передний увеит. Кератит может захватывать все слои роговицы и протекает по-другому, чем у взрослых. Глазные симптомы обычно появляются через 5-14 дней после контакта с вирусом. Неонатальный герпетический кератоконъюнктивит обычно протекает на фоне системного заболевания, которое может быть диссеминированной инфекцией (пневмонит, гепатит), менингоэнцефалитом или заболеванием кожи, глаз и слизистых оболочек. Начало системного заболевания может запаздывать до шестой недели жизни.
При подозрении на герпетический кератоконъюнктивит у новорожденных проводятся культуральный анализ на ВПГ (соскобы конъюнктив, эпителия роговицы или кожных везикул), анализ спинномозговой жидкости, в том числе ПЦР (полимеразно-цепная реакция) на ВПГ, а также функциональные пробы печени. К ускоренным диагностическим методам относятся прямое иммунофлюоресцентное окрашивание антител или обнаружение методом иммуноферментного анализа антигенов ВПГ в соскобах. ПЦР на определение ВПГ может также проводиться на материале мазков и соскобов. Тестирование на антитела ВПГ у новорожденных бесполезно.
Бессимптомные младенцы профилактически получают ацикловир внутривенно, если они рождены от матерей с первичной инфекцией генитального ВПГ на момент вагинальных родов, или если в материале поверхностных соскобов растет ВПГ. Для лечения неонатальной инфекции назначают ацикловир внутривенно (60 мг/ кг в день в 3 приема) в течение 14 дней или в течение 21 дня при наличии диссеминированной инфекции или поражения ЦНС. Рекомендуется вспомогательная терапия местным трифлуридином 1%, йоддезоксиуридином 0,1% или видарабином 3%. В случае поражения стромы и эндотелия можно добавить местный стероид, в случае увеита — местный стероид и циклоплегию. У детей с неонатальной инфекций ВПГ высок риск смертности, их госпитализируют на период внутривенной терапии.
У таких детей высок также риск реактивации ВПГ, поэтому профилактический прием ацикловира следует продолжать как минимум шесть месяцев после выписки из больницы.
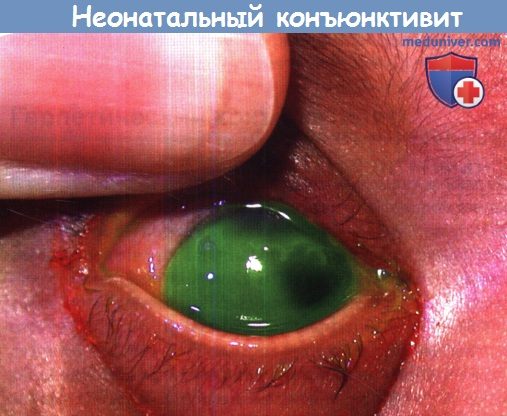
Неонатальный конъюнктивит и кератит вследствие инфекции ВПГ-1 у пятидневного новорожденного.
Дендрит роговицы в верхне-назальном направлении соседствует с географическим дефектом эпителия по направлению к центру и к виску.
Несмотря на внутривенное введение ацикловира у пациента развился герпетический энцефалит.
е) Госпитальный неонатальный конъюнктивит. Госпитализированные новорожденные приобретают конъюнктивит от больничного персонала и инструментов, а также при искусственной вспомогательной вентиляции легких, которая, как считается, повышает контакт флоры носоглотки с глазами. Кроме того, большинство таких младенцев недоношенные или имеют множество сопутствующих заболеваний. В проведенном в США исследовании у 200 новорожденных, находившихся в отделении неонатальной интенсивной терапии, чаще всего обнаруживали коагулазонегативные стафилококки, а также Staphylococcus aureus и Klebsiella. Вспышки конъюнктивита в отделениях интенсивной терапии новорожденных вызывал метициллин-резистентный Staphylococcus aureus частота которого возрастает.
ж) Лабораторные тесты при конъюнктивите новорожденных детей. Назначение соответствующих лабораторных тестов зависит от истории заболевания. Если в дифференциальный диагноз включены несколько инфекционных причин, следующие тесты помогают исключить наименее вероятные причины:
- Окрашивание по Граму.
- Окрашивание по Гимзе.
- Культуральное исследование на хламидии или ПЦР.
- Культуральное исследование на гонококки на среде Тайера-Мартина.
- Бактериологические исследования на шоколадном и кровяном агаре.
- Культуральное исследование на ВПГ, ПЦР, прямое иммунофлюоресцентное окрашивание антител или обнаружение антигенов методом иммуноферментного анализа.
Примерно в половине клинически выраженных случаев неонатальных конъюнктивитов результаты культуральных исследований отрицательные.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

