Сепсис у детей этиология патогенез клиника
Обновлено: 12.05.2024
Наблюдаемый в последние годы рост удельного веса гнойно-септических заболеваний (ГСЗ) в патологии детского возраста и тяжесть течения нозокомиальных инфекций можно объяснить рядом факторов. Прежде всего это изменения микробного пейзажа: на смену грамположительной флоре, выделяемой в монокультуре в 3060-х годах, пришли микробные ассоциации грамположительных и грамотрицательных аэробных и анаэробных бактерий [3, 5, 7]. Кроме того, нерациональное применение антибиотиков неизбежно приводит к появлению приобретенной резистентности, что в свою очередь сопровождается отсутствием эффекта от стандартной антибактериальной терапии.
Так, в 5060-е годы по всему миру прокатилась волна тяжелейшей стафилококковой инфекции (стафилококковая легочная чума), поразившей преимущественно детей младшего возраста и сопровождавшейся высокой летальностью до 70% у новорожденных. Отметим, что география распространения этой волны точно следовала бессистемному и неоправданно широкому применению пенициллина.
Увы, история нас ничему не учит, и мы вновь стараемся во что бы то ни стало наступить на те же грабли свободная продажа любых антибиотиков в наших аптеках приводит к неоправданному, бездумному их применению, а отсутствие стандартных протоколов терапии влечет нерациональное назначение мощных антибиотиков в амбулаторной практике. Все это рано или поздно может завершиться новой волной тяжелейших ГСЗ непредсказуемой этиологии.
Таким образом, серьезность и актуальность обсуждаемой проблемы бесспорны и требуют безотлагательных поисков путей ее решения.
Мы определяем сепсис как угрожающее жизни состояние организма, связанное с бурным размножением микроорганизмов и характеризующееся синдромом полиорганной недостаточности различной степени выраженности; ведущим, как правило, является нарушение функции дыхания.
Клинические проявления сепсиса многообразны и во многом зависят от локализации основного очага инфекции, особенностей микрофлоры, реактивности организма и т.д. Наиболее типичными общими симптомами сепсиса у детей являются: лихорадка (с иногда гектической температурной кривой), тахикардия и тахипное, прогрессирующая интоксикация, иктеричность кожных покровов, раннее присоединение септической пневмонии, появление других вторичных очагов инфекции.
Наряду с понятием сепсис мы выделяем группу ГСЗ, понимая под этим клиническим определением запущенные формы тяжелых гнойных процессов, требующие проведения интенсивной терапии.
К этой группе мы относим декомпенсированный разлитой гнойный перитонит, гнойный медиастинит, бактериальную деструктивную пневмонию (исключая буллезную форму), гнойный перикардит, септический эндокардит, тяжелые формы острого гематогенного остеомиелита.
Общие принципы интенсивной терапии ГСЗ у детей
1. Интенсивная терапия должна начинаться непосредственно с момента поступления больного с ГСЗ в стационар и осуществляться в полном объеме. Этот принцип нарушается довольно часто, так как дежурный врач, как правило, ограничивается минимумом назначений.
2. Интенсивная терапия должна проводиться параллельно с неотложным обследованием ребенка, превращаясь, по мере уточнения диагноза, из симптоматической в патогенетическую, а затем в этиотропную.
3. Дети с ГСЗ должны быть госпитализированы в отделения (палаты) реанимации и интенсивной терапии (ОРИТ).
4. В составлении программы интенсивной терапии должны принимать участие три специалиста: анестезиолог-реаниматолог, педиатр и детский хирург (при его отсутствии хирург общего профиля).
5. Интенсивная терапия должна осуществляться одновременно в трех направлениях: воздействие на очаг инфекции, воздействие на организм пациента, воздействие на микрофлору.
Рассмотрим каждое из этих направлений, уделив основное внимание принципам антибактериальной терапии.
Воздействие на очаг инфекции требует ранней и полноценной его санации, способы которой определяются характером и особенностями основного процесса.
Воздействие на организм ребенка должно исходить из патогенеза полиорганной недостаточности: необходимо обеспечить детоксикацию, восполнение ОЦК, дыхательную поддержку, нормализацию деятельности сердечно-сосудистой системы, посиндромную терапию.
Проведение длительной инфузионной терапии обуславливает необходимость катетеризации магистральных вен. Возможность развития осложнений, связанных с этой манипуляцией, требует соблюдения следующих правил:
Показания к катетеризации магистральных вен должны определяться заведующим отделением или, в ночное время, ответственным дежурным. Показания должны быть зафиксированы в истории болезни.
Катетеризацию магистральных вен могут проводить только специально подготовленные врачи.
Катетеризация и уход за катетером должны осуществляться при строжайшем соблюдении правил асептики и антисептики обученным персоналом.
В историю болезни заносятся фамилия врача, проводившего катетеризацию, с какой попытки и на какую глубину проведен катетер, метод фиксации катетера, осложнения во время манипуляции.
Все осложнения, связанные с катетеризацией магистральных вен, должны обсуждаться на больничной конференции.
Антибактериальная терапия может быть эмпирической или направленной (этиотропной). Под эмпирической антибактериальной терапией понимают назначение антибиотиков непосредственно при поступлении ребенка в стационар до получения результатов микробиологического исследования. К сожалению, эмпирическая антибиотикотерапия часто назначается вслепую. Подобная тактика недопустима, особенно при ГСЗ, так как адекватность эмпирической терапии может определить судьбу ребенка. Таким образом, эмпирическая терапия должна быть ориентированной.
Первичными ориентирами для эмпирической терапии могут служить бактериоскопия окрашенного по Граму мазка клинического материала, полученного из очага поражения, и информация о возможных возбудителях, характерных для определенного ГСЗ.
Методика окраски мазка по Граму: мазок исследуемого материала подсушивается на воздухе и фиксируется путем трехкратного быстрого проведения стекла над пламенем. Окраска включает в себя 4 этапа:
1. На препарат наносится 10 капель раствора генцианвиолета и через 1-2 минуты смывается струёй воды.
2. После этого препарат обрабатывается 10 каплями раствора Люголя (1-2 минуты) и снова промывается под струёй воды.
3. Обесцвечивание препарата проводится 96% спиртом до прекращения отхождения краски, раствор спирта тщательно смывается водой.
4. Препарат окрашивается 10 каплями фуксина или сафранина в течение 1 минуты, промывается водой и помещается под микроскоп.
Метод позволяет быстро определить наличие и соотношение в материале грамположительных бактерий, окрашенных в темно-фиолетовый цвет, и грамотрицательных микроорганизмов, окрашенных в темно-красный цвет.
На основании данных исследований отечественных и зарубежных авторов и собственных наблюдений, можно выделить следующих наиболее типичных возбудителей ГСЗ у детей (табл. 1).
Особое место в обсуждаемой проблеме занимает нозокомиальная инфекция, в первую очередь, пневмония, частота которой у больных, находившихся на искусственной вентиляции легких (ИВЛ) в ОРИТ достигает 768%. Пневмония составляет 45% всех случаев нозокомиальной инфекции. Наиболее частыми возбудителями нозокомиальной пневмонии являются Enterobacteriaceae (35%), S.aureus (30%), P.aeruginosa (29%). Необходимо подчеркнуть значительные колебания частоты выделения возбудителей нозокомиальной инфекции в различных регионах, стационарах и отделениях. Достаточно привести данные исследования, проведенного в 9 городах России в 19961997 годах, выявившего частоту выделения P.aeruginosa в ОРИТ стационаров Москвы от 2 до 36,4%, отсутствие в ОРИТ стационаров Казани Acinetobacter spp., но выделение его в стационарах Екатеринбурга в 27,3%.
При исследовании особенностей антибиотикорезистентности госпитальных штаммов в ОРИТ Детского медицинского Центра Минздрава Татарстана была выявлена множественная устойчивость к таким популярным антибиотикам, как ампициллин, амоксициллин/клавуланат, цефотаксим, цефтазидим, гентамицин. Эти данные заставили нас пересмотреть тактику антибактериальной терапии у таких больных, обратив основное внимание на возможность стартовой монотерапии карбапенемными антибиотиками. На наш взгляд, в крупных многопрофильных детских больницах на базе бактериологических лабораторий должна быть организована служба клинической микробиологии, обеспечивающая постоянное информирование клиницистов о состоянии резистентности госпитальной флоры и способствующая адекватному выбору антибактериальных препаратов.
По мнению R. Resse и R. Betts [8], для проведения адекватной эмпирической антибиотикотерапии врачу надо ответить на 10 вопросов:
1. Являются ли клинические проявления у данного пациента основанием для назначения антибиотиков?
Ориентация на лихорадку может быть ошибочной, так как сепсис, вызванный грамотрицательной флорой, может протекать с нормо- или гипотермией. В то же время лихорадка может быть обусловлена вирусной инфекцией, при которой назначение антибиотиков бессмысленно.
2. Какова возможность идентификации микрофлоры у данного пациента?
Необходимо получить адекватный материал, не контаминированный нормальной микрофлорой, для проведения бактериоскопии, выделения и идентификации возбудителя (гной, плевральный или интраабдоминальный выпот, мокрота и т.д.).
3. Какие возбудители наиболее характерны для данного заболевания и локализации патологического процесса?
4. Какой антибиотик или комбинация антибактериальных препаратов оптимальны для данного пациента?
Необходимо учитывать фармакокинетику, нежелательные реакции препарата, лекарственную совместимость, стоимость курса терапии и многое другое.
5. Показана ли в данном случае монотерапия или комбинация антибиотиков?
Несмотря на учащение случаев полимикробной этиологии ГСЗ, необходимо стремиться к монотерапии при условии сопоставимой ее эффективности в сравнении с комбинированной. Отсутствие проблемы совместимости антибиотиков, снижение риска нежелательных реакций, более низкая стоимость курса терапии вот основные преимущества монотерапии.
6. Имеются ли какие-либо особенности состояния организма ребенка, влияющие на выбор антибиотика и тактику антибактериальной терапии?
Необходимо принимать во внимание следующие факторы: генетические, например, возможность развития гемолиза при применении сульфаниламидов или нитрофуранов у людей с недостаточностью глюкозо-6-фосфат-дегидрогеназы; возрастные особенности функции печени, почек, желудочно-кишечного тракта.
7. Какой путь введения антибиотиков предпочтителен?
У детей с ГСЗ оптимальным является внутривенное введение антибиотиков.
8. Каковы оптимальные дозы препарата?
При сепсисе следует применять максимально допустимые возрастные дозы антибиотиков.
9. Какие изменения программы антибактериальной терапии необходимо сделать после получения данных микробиологических исследований, то есть при переходе от эмпирической к этиотропной антибиотикотерапии?
Необходимость коррекции терапии в соответствии с результатами бактериологических исследований должна быть обязательно обоснована изменениями клинической симптоматики. При неэффективности 3-дневного эмпирического применения антибиотиков, проводимого на фоне интенсивной терапии и полноценной санации очага инфекции, независимо от результатов бактериологического исследования должна проводиться коррекция антибактериальной терапии. В ситуациях, когда имеется положительная клиническая динамика, выбранная терапия может продолжаться.
10. Каковы длительность антибиотикотерапии и изменения ее программы при присоединении нозокомиальной инфекции?
Длительность применения антибиотиков зависит от характера патологического процесса, тяжести течения, осложнений и других факторов. Присоединение нозокомиальной инфекции требует изменения антимикробной терапии.
Наметившаяся в последние годы тенденция к более широкому применению монотерапии при лечении тяжелых инфекций выдвинула задачу поиска антимикробных препаратов, обладающих максимально широким спектром активности и сохраняющих активность в отношении наиболее частых возбудителей. Сегодня этим требованиям наиболее полно отвечают антибиотики группы карбапенемов и, прежде всего, имипенем. Класс карбапенемов в настоящее время включает также меропенем, биапенем и другие. Однако наиболее популярным является именно имипенем, пятнадцатилетний опыт применения которого позволяет по достоинству оценить его эффективность в серьезных клинических ситуациях [2].
С точки зрения клинициста, наибольшую важность представляют следующие свойства карбапенемов: способность проникать внутрь микробной клетки, обеспечивая бактерицидный эффект; устойчивость к действию b-лактамаз; способность препарата ограничивать выброс в кровь бактериальных токсинов и тем самым снижать риск развития токсического шока.
Широкий спектр активности, включающий госпитальные штаммы грамположительных, грамотрицательных, аэробных и анаэробных бактерий, достаточно низкая токсичность и высокая клиническая эффективность при лечении ГСЗ обеспечивают популярность карбапенемов среди клиницистов.
Таким образом, вопрос о включении карбапенемов в список жизнеспасающих препаратов при тяжелых формах ГСЗ сегодня сомнений не вызывает. Вопрос в другом: являются ли карбапенемы антибиотиками первой линии или это препараты глубокого резерва?
По нашим данным, в условиях крупной многопрофильной детской больницы из 190 детей (включая 87 новорожденных) 75% пациентов с ГСЗ получали имипенем как препарат резерва в связи с тяжестью состояния и неэффективностью предшествующей комбинированной антибиотикотерапии. Однако в 25% наблюдений имипенем был применен в качестве стартовой монотерапии с хорошей клинической эффективностью. При клиническом применении имипенема в течение 15 лет приобретенная резистентность основных возбудителей гнойно-септических заболеваний (за исключением штаммов P.aeruginosa) к карбапенемам не выявлена. Мы считаем, что карбапенемы следует отнести к группе суперантибиотиков, имеющих свои особые показания.
Анализ данных литературы, отражающих результаты изучения сравнительных характеристик имипенема и меропенема, свидетельствует об аналогичной широте бактерицидного спектра и клинической эффективности обоих препаратов [1, 2]. В то же время при менингите и других инфекциях ЦНС предпочтительнее использовать меропенем, так как имипенем у таких больных может повышать судорожную готовность.
Дискутабельным остается вопрос о допустимости и рациональности применения имипенема у новорожденных в связи с отсутствием в научной литературе достаточных данных, за исключением рекомендации о снижении дозы и кратности введения у детей в возрасте до 7 дней (50 мг/кг через каждые 12 часов). В нашем исследовании выраженный клинический эффект монотерапии имипенемом у детей грудного возраста и отсутствие каких-либо нежелательных реакций послужили основанием для его применения у новорожденных с сепсисом. Одна группа детей получала имипенем при неэффективности предшествующей терапии, другая в качестве стартовой монотерапии. В дальнейшем использовались препараты более узкого спектра действия с ориентацией на результаты мик робиологического исследования.
В последние годы все большее число клиницистов, к которым относимся и мы, отдают предпочтение стартовой монотерапии карбапенемами. В клиническую практику внедряется и ступенчатая терапия имипенемом: после трехдневного внутривенного введения препарат используется внутримышечно. Суточная доза имипенема при внутримышечном введении ниже, тем самым при ступенчатой терапии снижается стоимость лечения.
Тяжесть течения генерализованной хирургической инфекции у детей, реальная опасность новой вспышки ГСЗ непредсказуемой этиологии, связанная с нерациональным использованием антибиотиков, диктуют необходимость проведения ряда безотлагательных мер:
категорически запретить безрецептурную свободную продажу антибиотиков;
создать в крупных многопрофильных детских больницах службу антибиотикотерапии или выделить врача, ответственного за контроль резистентности госпитальной флоры, особенно в ОРИТ данного лечебного учреждения;
разработать и внедрить в клиническую практику стандартные протоколы рациональной антибиотикотерапии сепсиса и ГСЗ у детей, включающие современные режимы монотерапии карбапенемами.
Появление новых антибактериальных препаратов, дальнейшие изменения микробного пейзажа будут выдвигать все новые и новые проблемы. Бесспорно, что антибиотикотерапия не должна быть стихийной или, тем более, ориентированной на пристрастия врача к той или иной группе препаратов или к той или иной фармацевтической компании. Решение вопроса о показаниях к антибиотикотерапии и выборе препарата должно опираться на конкретные данные о предшествовавшей антимикробной терапии, характере патологического процесса, возможных возбудителях, состоянии пациента. Самое пристальное внимание должно быть уделено нозокомиальным инфекциям, в первую очередь, госпитальной пневмонии в ОРИТ, и динамическому контролю за приобретенной антибиотикорезистентностью госпитальной микрофлоры. Все эти проблемы могут быть успешно решены только при постоянном тесном контакте бактериологов и клиницистов педиатров, детских хирургов, анестезиологов-реаниматологов.
1. Белобородов В.Б. Проблема нозокомиальных инфекций в отделениях реанимации и интенсивной терапии и роль карбапенемов. Клиническая фармакология и терапия, 1998; 7: 1316.
2. Зайцев А.А., Карпов О.И. Итоги 15-летнего опыта применения карбапенемов. Клиническая фармакология и терапия, 1999; 8: 14.
3. Семина Н.А. Страчунский Л.С. Козлов Р.С. и др. Состояние антибиотикорезистентности грамотрицательных возбудителей нозокомиальных инфекций в отделениях интенсивной терапии. Информационное письмо. Смоленск: Амипресс, 1997.
4. Todd J.K. Toxic Shock Syndromes. In: Long S.S., Pickering L.K., Prober C.G., editors. Principles and practice of pediatric infection diseases. New York: Charchill Livingstone, 1997.
5. Kaplan S.L. Bacteriemia and Septic Shock. In: Feigin R.D., Cherry J.D., editors, Textbook of Pediatric Infectious Diseases. V. 1. Philadelphia: W.B. Saunders, 1998.
6. Mandell L., Campbell D. Nosocomial pneumonia guidelines. Chest. 1998; 113: 188193.
7. Steinhaff M., Kinney J. Neonatal sepsis and infections: In: Reese R.E., Betts R.F., editors, A practical approach to infectious diseases. New York: Lippincott-Raven Publishers, 1991.
8. Reese R.E., Betts R.F. A practical approach to infectious diseases. New York: Lippincott-Raven Publishers, 1991.
Адрес для переписки:
420015, Казань, Оренбургский тракт, д. 140 Детский медицинский Центр, клиника детской хирургии Михаил Рафаилович Рокицкий
Стартовая эмпирическая антибактериальная терапия
Сепсис новорожденных: пенициллины расширенного
спектра с ингибиторами b-лактамаз или цефалоспорины II-III поколений в комбинации с аминогликозидами. В особо тяжелых случаях – карбапенемы
Уросепсис: цефалоспорины III поколения + аминогликозиды, имипенем, меропенем
Интраабдоминальный сепсис, разлитой гнойный перитонит: цефалоспорины III поколения + аминогликозиды + метронидазол, имипенем, меропенем
Посткатетеризационный сепсис: ванкомицин, оксациллин или цефалоспорины I-II поколений + аминогликозиды, имипенем, меропенем
Септический эндокардит: цефалоспорины III поколения + аминогликозиды; ванкомицин; имипенем, меропенем
Бактериальная деструкция легких, нозокомиальная пневмония с тяжелым течением: цефалоспорины II-III поколений + аминогликозиды; имипенем, меропенем
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
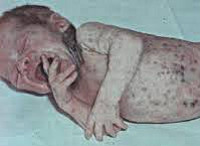
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Неонатальный сепсис – системное инфекционное заболевание у ребенка первых 28 дней жизни, проявляющееся характерными клиническими симптомами и подтвержденное одной или несколькими положительными культурами крови (ЕРБ ВОЗ, 2002 г.).
Р 36.3 Сепсис новорожденного, обусловленный другими и неуточненными стафилококками
Р 36.4 Сепсис новорожденного, обусловленный кишечной палочкой (Escherichia coli)
Классификация
Этиология и патогенез
Факторы и группы риска
Диагностика
Физикальное обследование:
- нестабильность температуры;
- изменения в поведении / мышечном тонусе;
- бледность кожных покровов;
- плохо сосет, теряет в массе;
- рвота / диарея;
- тахикардия.
- лейкоцитарный индекс (ЛИ - сумма молодых форм нейтрофильных лейкоцитов, деленная на общую сумму молодых и зрелых нейтрофильных лейкоцитов) > 0,2-0,3;
Инструментальные исследования
Рентгенография органов грудной клетки и люмбальная пункция (ЛП) при наличии показаний (цитоз > 20/3, белок > 1 г/л):
1. Показания к ЛП: симптомы сепсиса + любой из симптомов менингита (выбухание родничка, любые неврологические симптомы и рвота) + лейкоцитов < 5 тыс. или >30 тыс. в 1-е сутки жизни или > 20 тыс. со 2-х суток жизни, или ЛИ > 0,4, или СРБ > 10 мг/100 мл, или ≥ 2 лабораторных показателя с явным отклонением от нормы.
2. У новорожденных с массой тела при рождении менее 1500 г с наличием симптомов сепсиса – люмбальная пункция рекомендуется в комплексном обследовании на сепсис.
Лечение
Цели лечения: улучшить диагностику и исходы, а также проведение своевременной адекватной терапии сепсиса.
3. Настоящая беременность с положительным результатом на СГБ (за исключением планового кесарева сечения при отсутствии родовой деятельности).
Алгоритм оказания помощи младенцам, рожденным матерями с вышеперечисленными факторами:
АБП* ≥ 4 час после введения АБ роженице.
** Факторы риска: СГВ+, хориоамнионит, длительность безводного периода > 18 час., температура у матери в родах ≥ 38ºС, гестационный возраст < 37 недель.
– цефалоспорины третьей генерации дополнительно используются при подозрении или при подтвержденном диагнозе менингита.
Общие принципы организации помощи новорожденному с сепсисом:
3. Проводить мониторинг жизненно важных функций (ЧД и тяжесть ДР, ЧСС, температура тела младенца; диурез; по возможности – SpO2, АД).
9. При наличии признаков улучшения в течение 3-х дней – продолжить антибактериальную терапию до конца 10 дня.
10. При отсутствии признаков улучшения или при ухудшении состояния новорожденного после 3-го дня лечения:
- при их отсутствии – назначить цефотаксим вместо ампициллина и продолжить лечение (цефотаксим + аминогликозид), в течение 7 дней после появления симптомов улучшения;
- решить вопрос о переводе ребенка в стационар третьего уровня или в отделение патологии новорожденных детской больницы.
11. После 12 часов лечения антибиотиками или как только состояние ребенка начнет улучшаться – попробовать приложить его к груди матери или использовать альтернативный метод кормления сцеженным материнским молоком.
13. После прекращения антибактериальной терапии наблюдать за ребенком в течение как минимум 24 часов. Если в течение этого времени состояние ребенка удовлетворительное и у него нет других проблем – выписать домой.
- учесть результаты бактериологического исследования крови и, в случае несоответствия, внести изменения в проводимую терапию.
Дальнейшее ведение: нет.
Индикаторы эффективности лечения: улучшение качества жизни.
Генерилизованное инфекционное заболевание с ациклическим течением, вызванное условно патогенной флоров, в основе которого лежит дисфункция иммунной системы с развитием очагов гнойного воспаления, бактереимии,СВР, шока, ДВС и полиорганной недостаточности у детей 1 мес жизни.
Причинами дисбаланса являются как особенности становления иммунитета в первые дни и недели жизни, так и иммунодефицитные состояния (ИДС), развивающиеся у части детей вследствие неблагоприятно протекавших беременности и родов
- 1 и более очаги инфекции
- Сист. вост. ответ.
- результаты микро исследований
Классификация: ранний неонатальный - первые трое суток, септицемия
поздний неонатальный с 4-7 суток, септициямия и септикопиемия
Клиника: тахипноэ, колебания T, лейкоцитоз или лейкопения, сдвиг влево, пов соэ, лимфопения, белки острой фазы. СВО -> сепсис -> тяж сепсис -> шок -> полиорг н-ть.
Диагностика: оценка риска, ищем очаги, ищем н-ть 2 и более органов и систем, диагностика СВО.
Ф-ры риска: лихорадка матери в родах, безводный промежуток более 12, острые и хронич инфекции, эндометрит.
этиологию, входные ворота инфекции; форму - септицемия, септикопиемия; течение - молниеносное, острое, подострое;
период болезни - начало, разгара, восстановительный, реабилитация;
Острый период сепсиса клинически может проявляться как септицемия или как септикопиемия. При септицемии у больного резко выражены признаки нарастающего бактериального инфекционного токсикоза при отсутствии метастатических очагов гнойного воспаления. Обычно у таких больных микробы, попавшие в кровь в обход естественных барьеров, интенсивно размножаются гематогенно, задерживаются в тканях и вызывают множество клинически не выявляемых мелких гнойных очагов. Такое течение типично для больных с выраженной нейтропенией, агранулоцитозом, но, по мере исчезновения нейтропении, выхода из агранулоцитоза, у больного начинают появляться более крупные локальные рнойные очаги.
Септикопиемическая форма сепсиса характеризуется фебрильной гектической лихорадкой, резко выраженной интоксикацией и почти одновременно развивающимися множественными гнойными очагами (остеомиелит, гнойный отит, абсцессы, флегмоны, флебиты, деструкция легких и др.), геморрагическим синдромом, анемией, падением массы тела, иногда высыпаниями на коже (не только геморрагическими).
Для подостоого течения сепсиса характерны умеренная интоксикация при нерезко выраженной или стертой симптоматике первичного очага инфекции, т.е. на месте входных ворот. При этом подъемы температуры тела могут быть кратковременными. Типичны анемия, постепенное нарастание дефицита массы тела и появление одного за другим очагов инфекции на месте "выхода микробов из крови": отит, пиелонефрит, пневмония, энтерит и энтероколит. У большинства недоношенных детей отмечается подострое (вялое, затяжное) течение сепсиса, проявляющееся в первые дни и недели как СДР, незрелость: одышка с периодами брадипноэ и апноэ, брадикардия, отсутствие сосательного рефлекса и прибавки массы тела, мышечная гипотония идистония, вялость, быстрая охлаждаемость, срыгивания, рвота, неустойчивый стул, отечный синдром, склерема и др. На фоне активной терапии состояние больного на некоторое время может улучшаться, однако при окончании интенсивной терапии состояние вновь ухудшается и могут выявляться поражения кишечника - некротизирующий энтероколит, пневмония, геморрагический синдром и др. Для стафилококкового сепсиса типичны локальные гнойные поражения кожи и подкожной клетчатки, лупка (пемфигус, некротическая флегмона, омфалит и др.), легких (деструктивная пневмония), остеомиелит, гнойный отит с доминированием признаков острого токсикоза, гипертермии и возбуждения. Для грамотрииательного сепсиса характерны: признаки токсикоза с угнетением деятельности ЦНС - вялость, адинамия, анорексия, неэмоциональный крик и безучастный взгляд, мышечная гипотония, кома, прострация; - раннее развитие расстройств микроциркуляции - бледность кожи, быстрая охлаждаемость ребенка, склерема, тахикардия с нитевидным пульсом, коллапс, шок; - нормо- или гипотермия, реже субфебрилитет; - высокая частота поражения легких (пневмонии); - склонность к геморрагическим расстройствам, развитию ДВС-синдрома; часты осложнения: желтуха, менингит, геморрагический синдром, некротизирующий энтероколит и др. Молниеносный сепсис (септический шок) - развивается чаще при грамположительных инфекциях, имеющих суперантигены (стафило-, стрепто-, менингококки) еще в септицеми-ческую стадию с лихорадкой, ознобом и признаками гипервозбудимости ЦНС. В первой фазе септического шока превалирует избыток в крови цитокинов, катехолами-нов и других биогенных аминов, микробных токсинов; во второй - отмечается прогрессирующее ухудшение периферической гемодинамики. Результат: развернутая клиника тяжелой общей интоксикации с выраженным поражением многих органов и систем, подавлением иммунитета и развитием ДВС-синдрома. I. Срочная госпитализация в отдельный бокс специализированного отделения. Антибиотики. Симптоматич. терапия, инфузионная терапия, парентеральное или энтеральное питание, иммунотерапия - патогенетическая(пентаглобин всегда - 5мл/кг/сут 3 дня) До получения результатов антибиотикограммы используют .комбинации ампициллина (300-400 мг/кг/сут на 4-6 приемов) с аминогликозидами РМИЦИН, сизомицин или тобрамицин по 7,5-10 мг/кг/сут, или амикацин по 22,5-30,5 мг/ гна 3 введения), или цефалоспорины (200 мг/кг/сут на 4 введения) с карбенициллином, аминогликозидами.
Глубоконедоношенным начинают вливать 5% раствор глюкозы (детям с массой более 1,5 кг и доношенным вливают 10% раствор); через 12-24 часа вводят электролитные добавки, на 3-й день жизни - растворы аминокислот, в конце первой недели жизни - жировые эмульсии. Затем постепенно выходят на состав полного суточного парентерального питания: углеводы 12,0 г/ кг, белки 2,5-3,0 г/кг и жировые нагрузки 3 г/кг при условии к установленной толерантности новорожденного, что обычно бывает на 6-12-й день от начала введения пищевой нагрузки.
После выписки из стационара - наблюдение в поликлинике в течение трех лет педиатром, невропатологом и другими специалистами, в зависимости от характера течения болезни.
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.

Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Читайте также:

