Серологические методы в диагностике холеры
Обновлено: 26.04.2024
Диагностические критерии холеры. Принципы современного лечения холеры
Диагноз холеры при ее типичном течении с выраженным обезвоживанием и характерным видом больного не представляет большого затруднения, особенно когда уже были случаи с ее бактериологическим подтверждением. Наиболее ответственной является диагностика первых случаев холеры, которые требуют обязательного бактериологического подтверждения диагноза - выделения культуры холерного вибриона из кишечного содержимого или рвотных масс с точной ее идентификацией. Легкие формы холеры даже при начавшейся эпидемической вспышке должны иметь бактериологическое подтверждение диагноза, который занимает обычно 36-48 ч (при круглосуточной работе лаборатории). В части случаев возникает необходимость бактериологического исследования на холеру трупного материала (отрезка тонкой кишки).
Существуют серологические методы диагностики холеры (РА, РНА, определение вибриоцидных антител в сыворотке крови и др., включая экспресс-методы), но решающего значения в установлении диагноза холеры они не имеют. Они могут быть использованы только для решения частных задач эпидемиологического анализа.
Принципы современного лечения холеры
Все больные холерой, подозрительные на нее и вибриононосители подлежат обязательной госпитализации. Для этой цели в период эпидемической ситуации создают госпитальную базу с дифференцированным профилем стационаров. Главное значение имеют госпитали для больных с клинически выраженной холерой, которые должны быть обеспечены современными возможностями для диагностики и лечения больных. В них должен работать персонал наиболее профессионально подготовленный. Лечение холеры должно начинаться немедленно и быть направлено на восстановление водно-электролитных потерь и кислотно-щелочного состояния (первичная регидратация) и на коррекцию продолжающихся потерь воды и солей (корригирующая регидратация).
Время перехода со струйного на капельное введение раствора зависит от улучшения клинической симптоматики, ее динамики и определения параметров гомеостаза до начала и во время лечения (удельный вес плазмы крови, Ht, pH, BE, количество калия, хлора, натрия). В.И. Покровский (1996 г.) подчеркивает необходимость слежения за динамикой болезни в целом, чтобы избежать двух крайностей: недостаточной регидратации и гипергидратации. Об этом свидетельствует и наш опыт во время лечения больных холерой в Астрахани в 1970 г. Регидратационная корригирующая терапия после выведения больного из гиповолемического шока должна быть адекватной продолжающимся потерям жидкости и солей, что достигается точным измерением объема испражнений и рвотных масс за 4-6-часовые интервалы, регистрируемым в специальной реанимационной карте больного, куда вносят сведения об объеме выделяемой мочи и основных параметрах гомеостаза, а также показатели АД, ЧСС, ЧДД. С учетом этих данных планируется объем вводимой жидкости на следующие 4-6 ч.
В лечении больных холерой антибиотики не имеют решающего значения, но они существенно повышают его эффективность, уменьшают объем водно-солевых потерь, длительность диареи и реконвалесцентного вибрионовыделения. Наибольшая эффективность признана за тетрациклинами и левомицетином.
Перед выпиской из стационара после выздоровления проводят посевы кала в течение трех дней подряд и однократный посев желчи (порций В и С) в связи с возможным сохранением возбудителя в желчевыделительной системе.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика холеры
1. РАЗРАБОТАНЫ: Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Ю.М.Федоров, Н.Я.Жилина); Федеральным государственным учреждением здравоохранения "Ростовский-на-Дону научно-исследовательский противочумный институт" (Ю.М.Ломов, Б.Н.Мишанькин, Л.С.Подосинникова, Л.Г.Воронежская, И.Я.Черепахина, Т.А.Кудрякова, Б.Л.Мазрухо, Л.М.Смоликова, И.В.Рыжко, Р.И.Цураева, Э.А.Москвитина, Б.П.Голубев, С.О.Водопьянов, Е.В.Монахова, В.Д.Кругликов, Н.Р.Телесманич, А.Б.Мазрухо, В.В.Агафонова); Федеральным государственным учреждением здравоохранения "Противочумный Центр" (А.А.Кюрегян, С.М.Иванова, Ю.С.Королев); Федеральным государственным учреждением здравоохранения "Российский научно-исследовательский противочумный институт "Микроб" (А.К.Адамов, З.В.Малыхина, Т.В.Бугоркова, Н.И.Смирнова, Л.Ф.Ливанова; А.В.Топорков, С.И.Заднова, Н.А.Осина, Е.С.Казакова, Н.Б.Челдышева, А.В.Осин); Федеральным государственным учреждением здравоохранения "Иркутский научно-исследовательский противочумный институт" (А.С.Марамович, В.С.Ганин, Л.Я.Урбанович, В.И.Погорелов, Л.В.Миронова, Е.С.Куликалова); Федеральным государственным учреждением здравоохранения "Ставропольский научно-исследовательский противочумный институт" (В.Н.Савельев); Федеральным государственным учреждением здравоохранения "Причерноморская противочумная станция" (Г.В.Гальцева); Государственным Центром по антибиотикам (С.В.Сидоренко); Российской медицинской академией последипломного образования (Е.А.Ведьмина); ГИСК им. Л.А.Тарасевича (Т.И.Анисимова, Л.В.Саяпина).
2. УТВЕРЖДЕНЫ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 31 мая 2007 г.
3. ВВЕДЕНЫ ВЗАМЕН Методических указаний "Лабораторная диагностика холеры" МУ 4.2.1097-02.
1. Область применения
1.1. Методические указания "Лабораторная диагностика холеры" разработаны для внедрения и применения действующих нормативных документов, определяющих требования к эпидемиологическому надзору за холерой в части, касающейся организации и проведения лабораторной диагностики холеры.
1.2. Настоящие методические указания предназначены для специалистов бактериологических лабораторий учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, лечебно-профилактических и противочумных учреждений.
2. Нормативные ссылки
2.3. Санитарные правила "Порядок учета, хранения, передачи и транспортирования микроорганизмов I-IV групп патогенности. СП 1.2.036-95".
2.4. Санитарные правила "Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами. СП 1.2.731-99".
2.6. Методические указания "Организация работ при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности. МУ 1.3.1794-03".
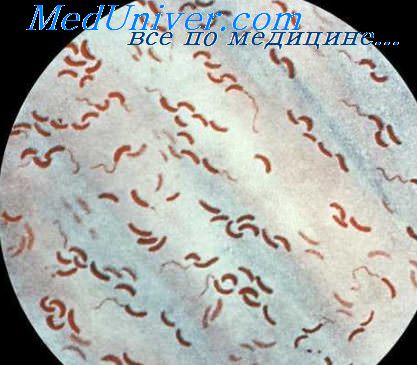
3. Характеристика возбудителя холеры
Холера - острая инфекционная болезнь с диарейным синдромом, фекально-оральным механизмом заражения, пищевым, водным и контактно-бытовым путями распространения возбудителя. Относится к группе инфекций, борьба с которыми регламентируется Международными медико-санитарными правилами (2005).
Возбудителями холеры являются холерные вибрионы О1 (классического и эльтор биоваров) и О139 серогрупп.
Токсигенные () холерные вибрионы обеих серогрупп вызывают заболевание холерой, склонное к эпидемическому и пандемическому распространению (эпидемически значимые штаммы), нетоксигенные () - единичные или групповые заболевания холерой при общем источнике заражения.
У нетоксигенных () штаммов холерных вибрионов возможно присутствие отдельных генов патогенности, среди которых определенную значимость имеет ген , участвующий в реализации процесса адгезии.
Характеристика генома выделенных холерных вибрионов биологическими методами широко используется для эпидемиологического анализа и оценки эпидемической значимости выделенных штаммов.
4. Организация лабораторных исследований
Диагностические исследования на холеру в регламентированном объеме могут проводить:
- бактериологические лаборатории учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, лечебно-профилактических и противочумных учреждений, имеющие разрешение на работу с микроорганизмами III группы патогенности;
- лаборатории особо опасных инфекций центров гигиены и эпидемиологии Роспотребнадзора и ведомств, имеющие разрешение на проведение диагностических исследований на холеру;
- лаборатории противочумных учреждений, имеющие разрешение на проведение диагностических исследований на холеру и на работу с возбудителем холеры.
Организация и выполнение диагностических исследований на холеру в лабораториях должны осуществляться в соответствии с требованиями, регламентирующими:
- безопасность работы с микроорганизмами III-IV групп патогенности - для бактериологических лабораторий учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и лечебно-профилактических учреждений;
- безопасность работы с микроорганизмами I-II групп патогенности - для лабораторий (отделов) особо опасных инфекций центров гигиены и эпидемиологии Роспотребнадзора, ведомств и противочумных учреждений;
- порядок учета, хранения, передачи и транспортирования микроорганизмов IV группы патогенности.
Порядок получения лабораториями разрешения на диагностические исследования на холеру определяется действующими нормативными документами о порядке выдачи разрешений на эти виды работ.
В условиях осложнения эпидемиологической обстановки временное разрешение на проведение диагностических исследований на холеру бактериологическим лабораториям учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и другим, функционирующим в составе лабораторной службы очага, в случае расширения их функциональных обязанностей представляется решением медицинского штаба очага.
4.1. При осуществлении эпидемиологического надзора
4.1.1. Бактериологические лаборатории учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и лечебно-профилактические учреждения проводят плановые диагностические исследования на холеру материала от больных острыми кишечными инфекциями, определенного контингента здоровых лиц и проб из объектов окружающей среды в объеме, предусмотренном действующими нормативными документами по эпидемиологическому надзору за холерой.
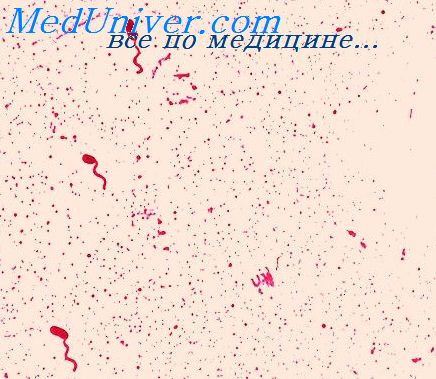
Исследования ведут до установления отрицательного результата анализа или до выделения культуры с характерным для вибрионов ростом на агаровой и полиуглеводной средах и положительной реакцией на оксидазу. Культуры проверяют на чистоту в мазке, окрашенном по Граму, на подвижность и в реакции агглютинации на стекле (далее слайд-агглютинации) с холерными сыворотками О1, Огава, Инаба, РО и О139.
При положительном результате слайд-агглютинации немедленно сообщают в органы Роспотребнадзора в субъекте Российской Федерации, культуру для окончательной идентификации немедленно доставляют в специализированную лабораторию в установленном порядке.
При отрицательном результате слайд-агглютинации:
- неагглютинирующиеся холерными сыворотками О1 и О139 культуры, выделенные от людей, направляют для дальнейшей идентификации в специализированную лабораторию;
- неагглютинирующиеся холерными сыворотками О1 и О139 культуры, выделенные из объектов окружающей среды, идентифицируют на месте или по согласованию передают в учреждение Роспотребнадзора.
- 4.1.2. Лаборатории особо опасных инфекций центров гигиены и эпидемиологии Роспотребнадзора и ведомств:
- выполняют диагностическое исследование материала от больных и умерших с подозрением на холеру и проб из объектов окружающей среды;
- идентифицируют культуры вибрионов, выделенных в территориальных и ведомственных лабораториях, определяя их таксономическую принадлежность, а также определяют эпидемическую значимость (токсигенность) и антибиотикочувствительность холерных вибрионов О1 и О139 серогрупп по регламентированным для этих лабораторий тестам;
- осуществляют (или организуют) бактериологический контроль качества питательных сред и других диагностических препаратов, используемых в территориальных лабораториях;
- представляют оперативную информацию о выделении культур холерных вибрионов О1 и О139 серогрупп;
- в установленном порядке немедленно передают в территориальное противочумное учреждение культуры холерных вибрионов, таксономическая принадлежность или токсигенность которых имеющимися средствами диагностики не определяется;
- в течение 5 дней после окончания идентификации передают в территориальное противочумное учреждение или в головной по проблеме "Холера" Ростовский-на-Дону научно-исследовательский противочумный институт все культуры холерных вибрионов О1, О139, независимо от объекта обследования, и других серогрупп при выделении от больных;
- контролируют деятельность территориальных лабораторий, оказывают им методическую помощь по всем вопросам лабораторного обеспечения эпидемиологического надзора за холерой.
4.1.3. Лаборатории противочумных учреждений:
- проводят исследования материала от больных и умерших с подозрением на заболевание холерой, а также проб из объектов окружающей среды;
- подтверждают таксономическую принадлежность культур холерных вибрионов, выделенных на курируемой территории;
- идентифицируют все атипичные культуры холерных вибрионов с использованием дополнительных методов серологической, биохимической и других видов идентификации с целью уточнения таксономической принадлежности;
- определяют эпидемическую значимость (токсигенность) и антибиотикочувствительность культур;
- осуществляют методическое руководство по всем вопросам лабораторного обеспечения эпидемиологического надзора за холерой на курируемой территории;
- в установленном порядке выделенные культуры холерных вибрионов с паспортами передают в территориальный противочумный институт, головной по проблеме "Холера" Ростовский-на-Дону научно-исследовательский противочумный институт, одновременно паспорта на эти же культуры направляют в противочумный центр Роспотребнадзора.
Лабораторное обеспечение эпидемиологического надзора за холерой осуществляют в соответствии с действующими нормативными и методическими документами. Профилактические исследования на холеру проводят в течение рабочего дня с использованием соответствующих питательных сред, диагностические исследования материала от подозрительных на холеру больных (трупов) - в условиях круглосуточного режима работы лаборатории.
4.2. При проведении противоэпидемических мероприятий
Организация и регламентирование деятельности лабораторий, а также формирование лабораторной службы в очаге холеры осуществляются в соответствии с действующими нормативными документами по организации и проведению противохолерных мероприятий.
5. Бактериологическое исследование
В системе противохолерных мероприятий значительное место занимает бактериологический анализ, от правильности и своевременности проведения которого зависит характер и объем профилактических и противоэпидемических мероприятий.
Исследования проводят с целью:
- выявления больных холерой и вибриононосителей;
- установления окончательного диагноза при вскрытии трупов лиц, умерших от подозрительного на холеру заболевания;
- обоснования выбора средств этиотропной терапии холеры;
- бактериологического контроля эффективности лечения больных холерой и вибриононосителей;
- бактериологического контроля объектов окружающей среды, в том числе поверхностных водоемов;
- бактериологического контроля эффективности обеззараживания в очаге инфекции.
5.1. Отбор и доставка материала на исследование
Материалом для бактериологического анализа могут служить испражнения, рвотные массы, желчь, трупный материал (отрезки тонкого кишечника и желчный пузырь); предметы, загрязненные испражнениями (постельное и нательное белье и др.); вода, ил, гидробионты, сточные воды, содержимое выгребных туалетов; смывы с объектов окружающей среды, пищевые продукты, мухи и др.
Материал от больного забирает медицинский персонал лечебного учреждения, немедленно после выявления больного и до начала лечения антибиотиками. Руководитель является ответственным за правильность отбора, хранения и своевременность доставки проб в лабораторию.
Необходимо учитывать высокую чувствительность холерных вибрионов к дезинфицирующим средствам и кислотам, возможность антагонистического действия сопутствующей микрофлоры и предполагаемую концентрацию возбудителя в исследуемом материале. Если в материале от больных алгидной формой холеры концентрация возбудителя достигает 10-10 м.к./мл, то в испражнениях больных легкой формой и леченных антибиотиками, реконвалесцентов и носителей количество холерных вибрионов обычно не превышает 10-10 м.к./г.
Для отбора проб используют чистую стерильную посуду, не содержащую следов дезинфицирующих растворов. Стерилизацию посуды и других средств забора материала проводят автоклавированием, сухим жаром или кипячением в 2%-м растворе пищевой соды.
Материал для исследования должен быть доставлен не позже, чем через 2 ч после его взятия. В случае удлинения сроков доставки используют транспортные среды. Наиболее удобной и достаточно эффективной является 1%-я пептонная вода (рН 8,4±0,1).
В пептонную воду в качестве ингибитора сопутствующей флоры может быть добавлен теллурит калия из расчета 1:100000-1:200000 или моющее средство "Прогресс" в концентрации 0,1-0,2%. В отдельных случаях для транспортирования материала могут быть использованы солевые консерванты (см. раздел 7).

Серологические методы исследования, как правило, имеют дополнительное значение, и лишь в отдельных случаях при проведении оперативного и ретроспективного эпидемиологического анализа их результаты могут быть решающими.
Для серологической диагностики холеры используют иммунологические реакции, выявляющие в сыворотке крови больных, переболевших и вибриононосителей, а также вакцинированных специфические антитела: агглютинины, антитоксины и вибриоцидные антитела.
У больных холерой на 5 - 7-й день от начала заболевания появляются агглютинины, вибриоцидные антитела и антитоксины.
Целесообразно исследовать парные сыворотки с интервалом в 7 - 10 дней. Первая проба должна быть взята на 5 - 7-й день для оперативной диагностики и вторая - через 7 - 10 дней и более - для ретроспективной.
Кровь для серологических исследований берут из вены, а при отсутствии такой возможности - из пальца. Из вены берут 1 - 5 мл крови, после свертывания сгусток отслаивают от стенки пробирки стерильной стеклянной палочкой или платиновой петлей. Пробирки сохраняют в холодильнике и транспортируют в лабораторию охлажденными (в термосе, сумке-холодильнике и др.). В лаборатории сыворотку инактивируют при температуре (56,0 +/- 0,5) °С 30 мин.
Если кровь забирают в день постановки реакции, пробирки со свернувшейся кровью необходимо центрифугировать 10 - 15 мин. при 3000 об./мин. При отсутствии возможности исследовать сыворотку немедленно ее сохраняют в ампулах при температуре (4,0 +/- 0,5) °С. Кровь из пальца берут в объеме 0,4 мл и вносят в стерильный пенициллиновый флакон или пробирку с 1,6 мл 0,9%-го раствора хлорида натрия (1:5).
А. Обнаружение противохолерных антител методом развернутой реакции агглютинации
Исследуемую сыворотку разводят 1%-й пептонной водой рН 7,5 +/- 0,1 в объеме 1 мл от 1:10 до 1:640. В качестве антигена используют 3-часовую бульонную культуру, выделенную в данном очаге, или исследуют в 3-х рядах с культурами холерных вибрионов (сероваров Огава, Инаба и О139 серогруппы). В пробирку с раститрованной сывороткой вносят по 1 капле культуры-антигена и ставят на 1 ч в термостат, затем до утра в холодильник при температуре (4,0 +/- 0,5) °С, после чего отмечают результаты. Реакция сопровождается контролями антигена и сыворотки.
При определении титра реакции учитывают разведения с агглютинацией на 3 - 4 креста.
Результат исследования сыворотки больного при реакции агглютинации в разведении 1:40 и выше считается ориентировочно положительным.
Диагностическое значение имеет не менее чем 4-кратное нарастание титров антител.
Б. Реакция непрямой гемагглютинации (РНГА) с диагностикумом эритроцитарным холерным антигенным
Для выявления полных антител в сыворотке крови предназначена РНГА. Это достаточно специфичная и чувствительная двухкомпонентная реакция. По чувствительности значительно превосходит реакцию агглютинации. Необходимые ингредиенты, методика постановки в макро- и микрообъемах изложены в наставлении к диагностикуму эритроцитарному холерному антигенному.
Результат исследования сыворотки больного в разведении 1:40 и выше считается ориентировочно положительным.
Диагностическое значение имеет не менее чем 4-кратное нарастание титров антител.
В. Реакция нейтрализации антигена (РНАг)
Для выявления антител в сыворотке крови с использованием диагностикума эритроцитарного холерного иммуноглобулинового служит РНАг. Реакция нейтрализации антигена - высокоспецифическая трехкомпонентная реакция. Ее принцип заключается в специфической нейтрализации добавляемого антигена как полными, так и неполными антителами, которые появляются ранее других. Необходимые ингредиенты, методика постановки в макро- и микрообъемах изложены в инструкциях по применению к диагностикуму эритроцитарному холерному иммуноглобулиновому.
При использовании системы реакций РНГА и РНАг отпадает необходимость в постановке контроля специфичности с каждой исследуемой сывороткой, т.к. эти две реакции взаимно контролируют полученные результаты.
Результат исследования сыворотки больного в РНАг в разведении 1:50 (1:80) и выше считается ориентировочно положительным.
Диагностическое значение имеет не менее чем 4-кратное нарастание титров антител при исследовании парных сывороток в РНГА и РНАг.
Вибриоцидные антитела в крови больных обнаруживаются и достигают максимальных значений 10(-4) - 10(-8) к 10 - 12 дню. Принцип метода во всех его вариантах заключается в том, что в присутствии вибриоцидных антител не происходит размножение холерных вибрионов.
При проведении серологических исследований в очаге, обусловленном возбудителем холеры определенного серовара, в реакции используют один штамм соответствующего серовара, при отсутствии этих данных - два штамма обоих сероваров.
Материалы и оборудование:
- исследуемые сыворотки, инактивированные прогреванием 30 мин. при температуре (56,0 +/- 0,5) °С;
- сухой комплемент или свежеполученная сыворотка морской свинки в разведении 1:20;
- 0,9%-й раствор хлорида натрия рН 7,2 +/- 0,1;
- штаммы холерных вибрионов сероваров Огава и Инаба, типичные в S-форме, не чувствительные к комплементу;
- чашки Петри со щелочным агаром;
- термостат на (37,0 +/- 1,0) °С.
Методика постановки реакции
Комплемент, разведенный 0,9%-м раствором хлорида натрия 1:20, разливают в два ряда пробирок по 0,9 мл. В первую пробирку вносят 0,1 мл исследуемой сыворотки и после тщательного перемешивания последовательно переносят по 0,1 мл до разведения 10(-10), получая десятикратные разведения сыворотки в объеме 0,9 мл. Титрацию сыворотки проводят на льду, который помещают в любую емкость.
Из односуточной агаровой культуры холерного вибриона готовят взвесь в 0,9%-м растворе хлорида натрия, содержащего в 1 мл 1 - 2 х 10(4) м.к. Стерильной градуированной пипеткой полученную взвесь по 0,1 мл вносят в опытные пробирки с раститрованной сывороткой.
Необходимы следующие контроли: а) контроль комплемента (0,9 мл комплемента и 0,1 мл культуры); б) контроль сыворотки (0,8 мл 0,9%-го раствора хлорида натрия, 0,1 мл сыворотки и 0,1 мл культуры); в) контроль культуры (0,9 мл 0,9%-го раствора хлорида натрия и 0,1 мл культуры).
Штатив с пробирками на 1 ч помещают в водяную баню или термостат при температуре (37,0 +/- 0,5) °С, сделав предварительно высев из пробирки контроля культуры на 2 пластинки щелочного агара для определения фактической концентрации живых вибрионов в опытной суспензии (контроль разведения).
Через 1 ч штатив вновь ставят на лед и из каждой пробирки отдельной стерильной пипеткой 0,1 мл культуры высевают на чашку с щелочным агаром рН 7,0 +/- 0,1. Посев равномерно распределяют по поверхности чашки покачиванием или шпателем. Чашки помещают на 18 - 24 ч в термостат при температуре (37,0 +/- 0,5) °С, после чего подсчитывают количество выросших колоний.
В посевах из контрольных пробирок с культурой должно вырастать количество колоний, близкое к контролю разведения.
Вибриоцидным титром считают максимальное разведение сыворотки, которое вызывает гибель не менее чем 50% клеток холерного вибриона, что выявляется при посеве на агаровые пластинки в чашки Петри по сравнению с количеством выросших колоний из пробирки контроля комплемента.
Пример вычисления: при посеве из опытных пробирок с разведением сыворотки 10(-1); 10(-2); 10(-3); 10(-4); 10(-5); 10(-6); 10(-7) и т.д. на чашках соответственно выросло 0; 0; 5; 10; 15; 30; 38 и т.д. колоний. При высеве из пробирки контроля комплемента также после часовой инкубации при температуре (37,0 +/- 0,5) °С выросло 36 колоний, 50% от этого числа будет составлять 18. Из 5-й пробирки выросло 15 колоний, т.е. меньше 50% от количества колоний в контроле (18), в следующей - 30, т.е. более 50% этого же показателя. Разведение сыворотки в 5-й пробирке составляет 10(-5), следовательно, вибриоцидный титр в данном примере будет составлять 10(-5).
Определение вибриоцидных антител (ВА) в сыворотке крови на основе ферментации углеводов
Об отсутствии или наличии ВА судят по ферментации сахарозы, регистрируемой с помощью индикатора.
Материалы и оборудование:
- инактивированная сыворотка крови;
- штаммы холерного вибриона серовара Огава и Инаба;
- комплемент, разведенный 1:20 1%-й пептонной водой, содержащей 1% сахарозы и 1% индикатора Андреде;
- термостат на (37,0 +/- 1) °С.
Методика постановки реакции
Комплемент, разведенный 1:20 1%-й пептонной водой с сахарозой и индикатором Андреде разливают в пробирки по 0,45 мл. В первую пробирку добавляют 0,05 мл исследуемой сыворотки и после тщательного перемешивания переносят 0,05 мл смеси во вторую пробирку, из второй в третью и т.д. (до разведения 10(-5) - 10(-9)). Готовят суспензию 18 - 20-часовой агаровой культуры холерного вибриона и разводят 1%-й пептонной водой до концентрации 10(3) м.к./мл. Во все пробирки вносят по 0,45 мл суспензии и помещают в термостат.
Постановку реакции сопровождают следующими контролями:
- 0,45 мл 1%-й пептонной воды, содержащей 1% сахарозы и 1% индикатора Андреде + 0,05 мл исследуемой сыворотки + 0,45 мл взвеси культуры - контроль сыворотки;
- 0,45 мл комплемента с сахарозой и индикатором + 0,45 мл культуры - контроль комплемента;
- 0,45 мл 1%-й пептонной воды с сахарозой и индикатором + 0,45 мл культуры - контроль культуры;
- 0,45 мл 1%-й пептонной воды с сахарозой и индикатором + 0,05 мл исследуемой сыворотки - контроль стерильности сыворотки.
Через 5 - 6 ч проводят учет реакции. При этом в контроле (кроме контроля стерильности сыворотки) цвет содержимого пробирок должен перейти в красный или розовый. Изменение цвета индикатора в пробирках рабочего ряда, связанное с ферментацией сахарозы размножившимися вибрионами, свидетельствует об отсутствии вибриоцидных антител в исследуемой сыворотке. За вибриоцидный титр принимают то наибольшее разведение сыворотки, при котором цвет содержимого пробирок остается неизмененным или интенсивность его значительно отличается от окраски контрольных проб. Результат выражают в виде десятичного логарифма разведения сыворотки, взятого с обратным знаком.
Примечание. Для постановки РВА при холере, обусловленной холерным вибрионом О139 серогруппы, не может быть использован выделенный в очаге штамм в связи с возможной чувствительностью его к комплементу. В этих случаях рекомендуется предложенный специалистами Ростовского НИПЧИ, ctx- клон холерного вибриона О139, направленный на депонирование в Государственную коллекцию патогенных бактерий "Микроб" (РосНИПЧИ "Микроб").
Для выявления токсиннейтрализующих антител в сыворотке крови больных холерой и вибриононосителей предназначена РНГА с эритроцитарным холерным энтеротоксическим диагностикумом (ЭХЭД), у которых инфицирование обусловлено холерными вибрионами О1 и О139 серогрупп. Токсиннейтрализующие антитела появляются на 5 - 7-й день болезни, достигая максимума на 14 - 21-й день, затем их титр постепенно снижается, но сохраняется дольше других антител. Иммуноглобулины к холерному токсину в сравнении с вибриоцидными и другими специфическими холерными антителами дольше циркулируют в сыворотке крови после перенесенной инфекции (до 8 - 10 и более месяцев). Условно положительным титром РНГА с ЭХЭД следует считать 1:160 и выше. Целесообразно исследовать парные сыворотки.
Результат РНГА с ЭХЭД позволяет сделать заключение о токсигенности (эпидемичности) циркулирующего в очаге штамма холерного вибриона, в том числе и без выделения культуры.
Диагностика холеры. Микробиологическая диагностика холеры. Выявление холеры. Лечение холеры. Профилактика холеры.
Основу диагностики холеры составляют выделение и идентификация возбудителя. Цели исследований на холеру — выявление больных и вибрионосителей; установление причины смерти при исследовании трупов; контроль над эффективностью лечения больных и санации носителей, контроль над объектами внешней среды и эффективностью дезинфекционных мероприятий. Материал для исследований — испражнения, рвотные массы, жёлчь, секционный материал (фрагменты тонкой кишки и жёлчного пузыря), постельное и нательное бельё, вода, ил, сточные воды, гидробионты, смывы с объектов окружающей среды, пищевые продукты, мухи и др.
При проведении исследований на холеру необходимо соблюдать следующие правила:
• Материал исследований на холеру следует доставлять в лабораторию не позже 2 ч после забора (так как возбудитель быстро погибает, особенно в испражнениях). При невозможности срочной доставки образцы помещают в транспортные среды (1% пептоннан вода с рН 8,2-8,6).
• Ёмкости для материала нельзя обеззараживать химическими веществами, так как возбудитель чувствителен даже к их следовым количествам. Все образцы помещают в герметически закрываемую транспортную тару.
Посев холеры проводят на жидкие среды обогащения, щелочной МПА, элективные и дифференциально-диагностические среды (например, TCBS-arap). Изучают рост на первой среде накопления и выполняют высев на щелочной агар и вторую среду накопления (что повышает высевае-мость возбудителя). Если на первом этапе при исследовании нативного материала ускоренными методами получают положительные результаты, пересев на вторую среду накопления не проводят. Подозрительные колонии пересевают для выделения чистых культур.

Затем определяют морфологические, биохимические свойства и антигенную структуру холеры с помощью агглютинирующих О-, OR-, Инаба- и Огава-антисывороток. Важное диагностическое значение имеет типирование с помощью холерных диагностических бактериофагов. Все V. cholerae лизируются бактериофагом IV группы, а вибрионы биовара Эль-Тор — фагами группы V.
• Для ускоренной биохимической идентификации возбудителя холеры предложен набор СИБ из 13 тестов (оксида-за, индол, лактоза, глюкоза, сахароза, манноза, арабиноза, маннит, инозит, аргинин, орнитин, лизин), дифференцирующий от представителей семейства Enterobacteriaceae, бактерий родов Plesiomonas, Aeromunas и др.
• При выделении Vibrio cholerae группы, отличной от 01, возбудитель необходимо типировать с помощью других антисывороток. При выделении таких бактерий от больного с диареей обязательным считают проведение всего объёма исследований дли диагностики холеры.
• Определение AT в крови больных холерой носит вспомогательный характер. Их выявляют в РА, а также путём обнаружения вибриоцидных AT и антитоксинов.
Лечение холеры. Профилактика холеры.
Восполняют потерю жидкости и электролитов, проводят антибактериальную терапию холеры препаратами тетрациклинового ряда. Альтернативные антибактериальные препараты — левомицетин, ко-тримоксазол и фуразолидон.
Профилактика холеры включает организацию санитарно-гигиенических мероприятий, предупреждающих занос заболевания; проведение санитарно-просветительной работы среди населения; раннее выявление больных и носителей; массовое профилактическое назначение тетрациклинов в районах эпидемической опасности.
Для специфической иммунопрофилактики холеры разработаны убитая вакцина из штаммов Огава и Инаба, холероген-анатоксин для подкожного введения и бивалентная вакцина из анатоксина и О-Аг Огава и Инаба. Эффективность их использования не превышает 60-70%, невосприимчивость сохраняется в течение 3-6 мес, поэтому вакцин опрофилактику применяют по эпидемиологическим показаниям.
В очагах холеры хороший эффект даёт профилактический приём тетрациклина.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

