Stenotrophomonas maltophilia это что за инфекция
Обновлено: 10.05.2024
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Staphylococcus aureus делится на две группы – мецитиллинчувствительные (MSSA) и мецитиллинрезистентные (MRSA):
1. MSSA вырабатывают беталактамазы – пенициллиназы, которые разрушают незащищенные пенициллины, но сохраняют высокую чувствительность к оксациллину и цефазолину. Кроме того они обладают лейкоцидином Пантона-Валентайна, который вызывает распад тканей практически в любом очаге, что служит косвенным подтверждением стафилококковой инфекции еще до получения микробиологического анализа.
2. MRSA в свою очередь подразделяются на госпитальные, которые характеризуются тем, что:
- являются полирезистентными, т.е. нечувствительные ко всему классу бета-лактамов, включая карбапенемы;
- у них отсутствует лейкоцидин Пантона-Валентайна, поэтому реже возникают деструктивные процессы (пациенты просто тихо и долго гниют, в отличие от инфекций, вызванных дикими штаммами)
- вызывают нозокомиальные пневмонии, инфекции кожи, ран, сепсис, бак эндокардит протезированных клапанов, инфекции имплантов.
и внебольничные MRSA, характеризующиеся:
- полирезистентностью;
- наличием лейкоцидина Пантона-Валентайна, благодаря которому они более агрессивны и вызывают некротизирующие заболевания кожи, сосудов и легких (особенно четко роль лейкоцидина Пантона-Валентайна видна в развитии некротизирующей пневмонии);
- в основном характерны для наркоманов и лиц без определенного места жительства.
Факторами риска MRSA инфекций являются
- назофарингеальная колонизация MRSA;
- лечение бета-лактамами (выбивается чувствительная флора и ее место занимает MRSA;
- нахождение в ОРИТ;
- повреждение кожи при длительной госпитализации более 2-х недель (п/о раны, ожоги, язвы);
- внутрисосудистые катетеры и импланты;
- мед. работники и члены их семей (соседи – реаниматологи или хирурги, если семьи между собой общаются)
Для чего мы все это вспоминаем? Дело в том, что основные проблемы, связанные со стафилококковой инфекцией, это:
- Широкое распространение в медицине и как следствие недооценка проблемы.
- Назначение эмпирической терапии без учета риска MRSA, и как следствие – отсрочка адекватной терапии, что в случае золотистого стафилококка в прямом смысле смерти подобно.
- Клиническая эффективность антибиотика in vitro не всегда тоже самое что in vivo (мы все таки отличаемся от чашки Петри).
- Неадекватное дозирование и длительность терапии (недостаточные дозы и короткие курсы) – отсюда осложнения и рецидивы.
- Высокая летальность при неадекватной терапии
Проводить антистафилококковую терапию меньше 3-х, а то и 4-х недель нельзя, так как для этого возбудителя характерно развитие метастатических очагов и весь процесс пойдет по новому, только с учетом еще и того, что возбудитель окажется резистентным к ранее проводимой терапии.
Когда можно лечить 2 недели стафилококковую инфекцию?
- В/в катетер или другой источник инфекции удален (хорошо если катетер, а если речь об импланте – его же не удалишь).
- Инфекционный эндокардит исключен по данным чрезпищеводной ЭХО-КГ.
- Отсутствуют импланты (протезированный клапан, кардиостимулятор, А-В фистула).
- Нормализация температуры и отрицательная гемокультура в течение 72 ч после удаления источника инфекции.
- Нет признаков метастатических очагов на других органах и тканях.
Во всех остальных случаях лечим 21-28 дней. А что происходит у нас? Максимум 10-14 дней пролечили и отпустили.
Антистафилококковые препараты мы обязаны назначить сразу как только получили положительную гемокультуру на стафилококк однократно! И только потом проводим повторную проверку, так как максимально раннее начало антибактериальной терапии в 2-3 раза снижает летальность.
Итак, как уже стало понятно, основную проблему представляют устойчивые формы S.aureus. Для их эрадикации были синтезированы и предлагаются к использованию следующие препараты
- Гликопептиды – Ванкомицин (1958 год) – категория доказательств IА
- Стрептогранины – Синерцид (в РФ отсут)
- Оксазолиндиноны – Линезолид – категория доказательств IА
- Липопептиды – Даптомицин – категория доказательств IА – Тигециклин – категория доказательств IIВ
1. Ванкомицин
Внедрен в практику в 1958 году, а первый устойчивый штамм стафилококка поймали только в 1996 году. Проблема с ванкомицинустойчивыми штамма стафилококка в том, что до сих пор нет отработанных схем преодоления этой самой устойчивости. Помимо прочего у возбудителей непрерывно нарастает МПК (минимальная подавляющая концентрация) к ванкомицину и сейчас при МПК 2 мы говорим о резистентном штамме.
Еще одна проблема – это плохо очищенные формы препарата. Если ванкомицин плохо очищен, то риск токсических нефропатий достигает 20%. К сожалению надо констатировать тот факт, что Ванкомицин отечественного разлива относится к плохо очищенным формам.
Основным и самым грозным осложнением является развитие острой почечной недостаточности, а она развивается у 40% пациентов, если дозировка препарата составляет более 4 гр/сут. А потому вводить данный препарат можно только под контролем клиренса креатинина (КК). То есть первый анализ мы проводим до введения препарата, второй через 2-3 дня и смотрим, если имеет место падение КК: если он падает на 25% – это говорит о нефротоксичном действии препарата, если на 50%, то препарат следует немедленно отменить.
Ванкомицин является бактериостатическим антибиотиком, эффективность действия мы оцениваем не ранее чем через 72 часа, а то и на 5-е сутки от начала терапии. Доза должна подбираться в соответствии с МПК возбудителя и под постоянным контролем клиренса креатинина. То есть для использования этого препарата нам необходимы хорошая клиническая и микробиологическая лаборатории.
Современные рекомендации по дозированию препарата выглядят следующим образом:
У Вас есть возможность это делать? У меня такой возможности не было и нет до сих пор, а потому мы до сих пор используем этот препарат как саперы на минном поле, где ошибиться можно только один раз.
Активность против MSSA у Ванкомицина сопоставима с плацебо, а значит применять его можно только при верифицированной MRSA, либо комбинировать с препаратами, активными против MSSA (цефазолином, например)
Следует так же помнить о том, что Ванкомицин, в виду строения его молекулы, а особенно ее размера, плохо проникает в ткани и проблемными его локализациями будут дыхательные пути, ЦНС, клапаны сердца и кости. А потому быстрого действия там не дождешься и терапия требуется очень и очень длительная.
В заключении хотелось бы сказать, что препарат хорош, но будет лучше, если вы его не будете назначать в самостоятельном режиме, а вызовете врача – клинического фармаколога, ибо назначение и дозировка таких вот препаратов входит в его непосредственные обязанности.
Что делать если клин. фарма нет, а пациент есть. И что надо соблюсти, чтобы безопасно применять ванкомицин?
- Использовать хроматографически очищенные препараты – Ванкоцин, Эдицин (в настоящих условиях это практически невозможно, торги они не выигрывают)
- Требуется коррекция гиповолемии, сердечной недостаточности (перфузия почек должна быть нормальное, иначе усугубим нефротоксический эффект)
- Избегать комбинаций с нефро- или ототоксичными препаратами (аминогликозидами, НПВС и т.д.)
- Коррекция режима дозирования по клиренсу креатинина. Если в течение 2-3-х дней он снизился вдвое от изначального, а данных за то, что он мог рухнуть не только от Ванко нет – это проявление нефротоксичности препарата.
2. Линезолид
Является чистым бактериостатиком. Производителем неоднократно заявлялось, что препарат эффективнее Ванкомицина, однако проведенные независимые метаанализы клинических исследований хорошего качества рандомизированных и с двойным слепым контролем показали, что единственное, где Линезолид имеет преимущество – это вентилятор-ассоциированный пневмонии, вызванные MRSA. В других случаях, в т.ч. и стафилококковой пневмонии, преимуществ нет никаких. Зато стоимость лечения повышается в разы.
Еще один момент, о котором умалчивается – это безопасность применения Линезолида. Да, нефротоксичности нет, но по данным того же метаанализа частота возникновения тромбоцитопений при его использовании в 11,72 раза выше чем в группе плацебо.
Таким образом, Линезолид является препаратом выбора при нозокомиальной вентилятор-ассоциированной MRSA пневмонии, где при его использовании летальность ощутимо ниже, чем при использовании ванкомицина.
3. Тигециклин (или тайгециклин)
Давайте разберемся и с ним, тем более к вам будут часто приходить и рассказывать про него как про самый препаратистый антибиотик в мире.
- Препарат позиционируется как новый класс антибиотиков, на деле это производный тетерациклина со всеми исходящими отсюда последствиями.
- Он является бактериостатиком, как все тетрациклины
- Имеет хорошую тканевую фармакокинетику, но при этом крайне низкие концентрации в плазме крови (ангиогенные инфекции из его показаний выпадают сразу)
А теперь о том, куда его следует применять:
- В качестве средства целенаправленной этиотропной терапии НИ, вызванных полирезистентными бактериями:
- БРЛС: альтернатива карбопенемам
- Ацинетобактер – альтернатива сульбактаму
- Клебсиела и E.coli – устойчивые к карбопенемам
- Stenotrophomonas maltophilia
Повторюсь еще раз, место его применения это ЦЕЛЕНАПРАВЛЕННАЯ ЭТИОТРОПНАЯ ТЕРАПИЯ, т.е. когда микроб четко установлен в результате бактериологического исследования вместе с чувствительностью к антибиотикам.
Повторюсь еще раз – место этого препарата в лечении грам-отрицательной инфекции, но никак не стафилококков. Да и вообще это препарат крайне глубокого резерва, как по характеристикам, так и по цене, т.к. в ближайшие 10 лет не будет ни одного нового препарата с Гр(-) активностью, так как их просто нет даже в проекте (медицина традиционно не успевает за возбудителями, а только пытается их догонять, о чем мы в самом начале и говорили, прослеживая эволюцию возбудителей)
4. Даптомицин.
Препарат появился у нас недавно, хотя во всем мире применяется уже очень давно (в Штатах с 2003 года)
Препарат относится к классу липопептидов и от всех имеющихся на данный момент антиMRSA препаратов отличается тем, что является бактерицидным. И этот самый эффект развивается у него очень быстро и нам не надо ждать нескольких дней. То есть антибактериальный эффект мы можем оценивать как и у всех бактерицидных препаратов через 48 часов от начала применения, а это очень важно у больных в тяжелом состоянии. Еще одним несомненным плюсом является то, что не происходит лизиса клеток и не увеличивается интоксикация.
Основными показаниями к применению являются:
- Эндокардит,
- Менингит,
- Остеомиелит,
- Инфекции у больных с нейтропенией,
- Сепсис стафилококковой этиологии
Также препарат может использоваться в эмпирической терапии (кстати, единственный из всех имеющихся на данный момент) Гр(+)инфекций, так как активность против MSSA и MRSA одинаковая.
Кроме того, препарат проявляет активность против MRSA в биопленках, а значит нет необходимости в удалении протезов и имплантов. А значит Даптомицин показан при ангиогенных инфекциях (бактериемиях), остеомиелите, бактериальном эндокардите.
- Препарат откровенно дорог
- В связи с крупным размером молекулы имеются проблемы с тканевой кинетикой, а потому пневмонии и инфекции ЦНС на данный момент мы им не лечим.
- Побочные эффекты – миалгии, производитель говорит о необходимости следить за КФК и обращать пристальное внимание на пациентов уже имеющих подобные проблемы.
- Описано несколько случаев эозинофильных пневмоний, а потому и на это следует обращать внимание, так как при своевременной диагностике и вовремя назначенной терапии, данный вид пневмонии проходит без следа.
Итак, сводя все к общему знаменателю:
Ванкомицин мы используем тогда, когда у нас верифицирован MRSA стафилококк, имеется хорошая микробиологическая лаборатория, которая нам даст его МПК и это МПК не будет больше 2 (иначе он уже резистентен), в наличие есть клинический фармаколог, который посчитает дозу, будет ее контролировать и корригировать согласно изменениям клиренса креатинина. Но при этом мы помним о том, что препарат не работает на MSSA. И конечно же мы продолжаем помнить о его высокой нефротоксичности, если не имеем возможности пользоваться высокоочищенными формами.
Тигециклину нечего делать антистафилококковой терапии, этот препарат предназначен только для этиотропной терапии Гр(-)инфекции.
В связи с высокой активностью против MRSA и MSSA, быстрым бактерицидным эффектом является препаратом выбора при ангиогенных инфекциях, сепсисе и инфекционном эндокардите, а также препаратом выбора при эмпирической терапии MRSA+MSSA. Не использовать при лечении нозокомиальных пневмоний и инфекций ЦНС.
Инфекции вызванные Burkholderia cepacia, Burkholderia pseudomallei, Stenotrophomonas maltophilia, Acinetobacter
Burkholderia cepacia. Возбудитель хронических заболеваний лёгких у пациентов с муковисцидозом. Инфекция характеризуется нарушениями функции лёгких и молниеносной септицемией. В лечебных учреждениях происходит её передача от одного пациента с муковисцидозом к другому. Возбудитель обладает природной устойчивостью к большинству антибиотиков.
Антимикробную терапию назначают только после проведения тестов на чувствительность микроорганизма к антибактериальным препаратам (обычно применяют цефалоспорины широкого спектра действия, карбапенемы или уреидопенициллины).
Burkholderia pseudomallei. Сапрофит, обитающий в почве и водоёмах тропической зоны. Вызывает мелиоидоз (ложный сап), характеризующийся туберкулёзоподобными симптомами и развитием острой септицемии или множественных абсцессов. Септицемия часто приводит к летальному исходу. Диагностические мероприятия включают бактериологическое исследование крови и тканей больного. Для лечения используют цефтазидим.
Другой вид рода Burkholderia — Burkholderia mallei — вызывает похожую инфекцию у лошадей (сап), которая может перейти к человеку.
Возбудитель инфекции - бактерия Burkholderia cepacia
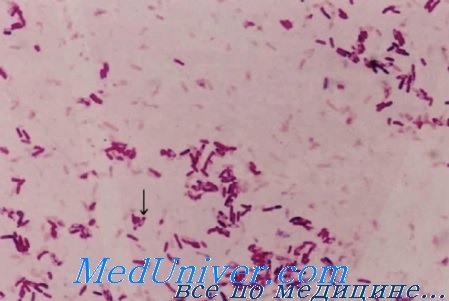
Stenotrophomonas maltophilia — грамотрицательная палочка, обитающая в почве и воде. Охотно колонизирует влажные поверхности и благодаря природной устойчивости к большинству антибиотиков представляет серьёзную угрозу для пациентов, помещённых в отделение интенсивной терапии, и для лиц со сниженным иммунитетом. Инфекция распространяется через предметы общего пользования и медицинские принадлежности (например, ингаляторы, катетеры идр.). Возбудитель вызывает септицемию и пневмонию.
Большинство штаммов устойчивы к действию аминогликозидов и карбапенемов, однако чувствительны к ко-тримоксазолу, тетрациклинам и иногда к цефалоспоринам широкого спектра действия.
Acinetobacter — мелкие грамотрицательные коккобациллы, обитающие в окружающей среде и обладающие природной устойчивостью к большинству антибиотиков. Обычно инфекция возникает у пациентов, находящихся на стационарном лечении (особенно в отделении интенсивной терапии). Возбудитель колонизирует различные предметы в местах с высокой влажностью (например, увлажнители воздуха) и вызывает вспышки мультирезистентных инфекций. При генерализированном течении развивается пневмония, септицемия, менингит и инфекции мочевыводящих путей.
В группу риска входят пациенты, принимающие антибиотики, с множеством установленных катетеров, после интубации трахеи. Антибактериальное лечение назначают после проведения тестов на чувствительность к антибиотикам.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции вызванные Pseudomonas aeruginosa: диагностика, лечение, профилактика
К роду Pseudomonas относят возбудителей, обитающих в окружающей среде и при определённых условиях вызывающих инфекционный процесс у человека (оппортунистические инфекции). Наиболее патогенной бактерией считают Pseudomonas aeruginosa.
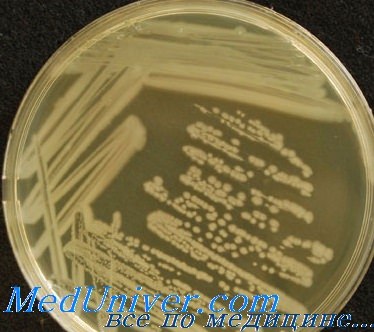
Pseudomonas aeruginosa - аэробная грамотрицательная подвижная палочка, широко распространена в окружающей среде. В микрофлоре у здоровых людей её определяют достаточно редко. Вероятность носительства повышается у пациентов, находящихся на стационарном лечении. Источник P. aeruginosa —практически любые предметы (умывальные раковины, водопроводные краны, покрытые дезинфицирующими средствами поверхности) по истечении 24 ч после дезинфекции.
Патогенез инфекции вызванной Pseudomonas aeruginosa. Pseudomonas aeruginosa вырабатывает цитотоксины и протеазы (экзотоксины А и S, гемолизины и эластазу). Возбудитель, выделенный от пациентов с муковисцидозом, способен синтезировать полисахаридные альгинаты, что облегчает образование микроколоний, защищает их от опсонизации, фагоцитоза и воздействия антибиотиков. Факторы адгезии — альгинаты, пили и наружные мембранные белки.
Образование альгинатов сопровождается уменьшением подвижности возбудителя и снижением синтеза экзотоксинов, развитием реакций гиперчувствительности к антибиотикам, снижением синтеза липополисахарида.
Pseudomonas aeruginosa
Клинические признаки инфекции вызванной Pseudomonas aeruginosa. Быстрее всего прогрессируют инфекционные поражения роговицы и наружный отит. Воротами инфекции могут быть ожоговые и раневые поверхности, при этом возможно развитие вторичной септицемии. Последняя — наиболее частая причина смерти пациентов с нейтропенией.
Некоторые штаммы вызывают деструкцию кожных покровов и гангренозную эктиму. В дальнейшем может развиться остеомиелит, септический артрит и менингит (особенно после нейрохирургических операций). Хронический муковисцидоз приводит к прогрессирующему ухудшению функции лёгких.
Лабораторная диагностика инфекции вызванной Pseudomonas aeruginosa:
• Культивирование на простых и селективных питательных средах (с цетавлоном, иргазином и налидиксовой кислотой) при 42 °С.
• Изучение биохимических свойств возбудителя.
• Серотипирование по полисахаридному (О) и жгутиковому (Н) антигену.
• Фаготипирование.
• Бактериоцинотипирование.
• Молекулярное типирование [гель-электрофорез в пульсирующем электрическом поле (PFGE)].
Лечение инфекции вызванной Pseudomonas aeruginosa. Для лечения применяют аминогликозиды, кар-бапенемы, уреидопенициллины, цефалоспорины широкого спектра действия или фторхинолоны. Некоторым штаммам возбудителя свойственна мультирезистентность.
Профилактика и контроль инфекции вызванной Pseudomonas aeruginosa. В настоящее время вакцинацию не считают эффективным методом профилактики синегнойных инфекций. Для предотвращения распространения мультирезистентных штаммов необходима изоляция инфицированных пациентов и уменьшение количества влажных предметов (тампоны, бельё и др.), способных быть источниками инфекции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
S. maltophilia относится к грамотрицательным аэробам. Как и клостридии, S. maltophilia живет везде — в воде, на растениях, в почве, в Антарктиде с пингвинами. В общем, она так же вездесуща. При этом является неферментером, как синегнойная палочка и ацинетобактер. К слову, ранее она называлась Pseudomonas maltophilia, но потом ученые передумали и отнесли ее к семейству Xanthomonadaceae.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Начнем традиционно с микробиологических аспектов
S. maltophilia относится к грамотрицательным аэробам. Как и клостридии, S. maltophilia живет везде — в воде, на растениях, в почве, в Антарктиде с пингвинами. В общем, она так же вездесуща. При этом является неферментером, как синегнойная палочка и ацинетобактер. К слову, ранее она называлась Pseudomonas maltophilia, но потом ученые передумали и отнесли ее к семейству Xanthomonadaceae.
Единственное, что в S. maltophilia есть хоть немного хорошее — это то, что она не умеет образовывать споры, ибо только спорообразования, для полноты картины абсолютного убийцы тяжелых и крайне тяжелых пациентов, нам и не хватало.
Клинические аспекты
Здесь так же все сложно. И это еще одна причина настоятельно советовать, как только получен подобный результат, сразу звать клинического фармаколога, потому что:
это может быть контаминация или колонизация, что чаще всего, к слову, и бывает, так как S. maltophilia настоящим образом может, что называется, прибиться ко всей остальной микрофлоре, которая в действительности вызвала инфекционный процесс;
у вас пациент с муковисцидозом в непрофильном отделении (в профильном справляться так или иначе умеют);
у вас пациент с установленными катетерами, шунтами или протезами, то есть речь идет о доказанной инфекции, связанной с медицинским вмешательством.
Какие могут быть клинические варианты заболеваний, связанные с S. maltophilia?
Внутрибольничная пневмония, связанная с использованием диагностического оборудования (бронхоскопы), установкой трахеостомы, применением искусственной вентиляции легких и т. п. Крайне неприятная ситуация с очень высокой (до половины случаев) летальностью, особенно в случае иммунокомпрометированных больных.
Очень быстро растет число респираторных инфекций, связанных со S. maltophilia у пациентов, страдающих муковисцидозом. Здесь, скорее всего, основную роль играет частый прием большого количества антисинегнойных препаратов, то есть все тот же выигрыш за счет отрицательной селекции конкурентной микрофлоры.
Бактериемия и сепсис, чаще всего связанные с катетер-ассоциированными инфекциями — то есть при установке внутрисосудистых катетеров в результате нарушений правил асептики и антисептики, либо далее при уходе за оными. Для пациентов такие бактериемии в 70% случаев становятся летальными.
Перитониты, связанные с перитонеальным диализом, то есть снова нозокомиальные.
Инфекции кожи и мягких тканей — раневые и ожоговые, хотя здесь все очень сложно в плане выделения роли именно S. maltophilia, так как подобные поражения чаще всего носят полимикробный характер и S. maltophilia вполне может оказаться банальным колонистом. Кроме того, не нужно забывать об инфицированных кошачьих царапинах и укусах, в которых S. maltophilia играет особую роль.
Инфекции мочевыводящего тракта также чаще всего связаны с выполнением диагностических процедур или установкой катетеров, то есть снова чисто внутрибольничная история.
Офтальмологические инфекции — конъюнктивиты, кератиты, дакриоциститы, язвы роговицы у лиц, использующих контактные линзы, а так же в случаях, связанных с трансплантациями роговиц.
Инфекции костей после оперативных вмешательств также неоднократно зафиксированы и описаны.
Так что, по сути, с этим возбудителем, так или иначе, может столкнуться или уже столкнулся каждый врач, имеющий отношение к антибактериальной терапии в условиях стационарной помощи.
Диагностические аспекты
Вы не поверите, но и тут все очень сложно. Забор материала и сам процесс диагностики полностью совпадает с таковым у синегнойной палочки. Но лучше всего использовать метод масс-спектрометрии, а оборудование для оного стоит как крыло самолета. Но после детекции возбудителя необходимо провести исследование на антибиотикочувствительность, а диско-диффузионный метод в этом случае очень плохо воспроизводим, а потому совершенно неточен, если не сказать жестче. Так что в этом случае наилучшим вариантом будут методы аппаратной детекции, которые стоят как второе крыло самолета. А без всего этого мы даже не догадаемся, чем именно лечить, потому что надо помнить, что к бета-лактамам S. maltophilia природно устойчива, а данные по множественной лекарственной устойчивости говорят о том, что перестали работать фторхинолоны, тетрациклины и аминогликозиды, отсюда и такая ужасающая смертность.
Чем лечить?
Только индивидуальный подбор антибактериальных препаратов в соответствии со значениями MIC в антибиотикограмме и всегда помнить, что за S. maltophilia может прятаться любой другой патоген, который и может оказаться истинной причиной того же сепсиса.
И что же делать в этой, казалось бы, безнадежной ситуации?
Единственное, что спасает, это соблюдение принципов эпидемиологического надзора, которые в общем виде заключаются в следующем:
Всегда, а не только в случае S. maltophilia, максимально рационально подходить к назначению антибиотиков в рутинной практике, по возможности не допуская селекции и распространения внутрибольничных форм, как S. maltophilia, так и тех возбудителей, с которыми она активно дружит, — E. coli, P. aeruginosa и протей. Обо всех мы писали в соответствующих статьях нашей Азбуки.
Всегда мыть руки! И под перчатки тоже. И даже под стерильные перчатки. Они — не презерватив, и всегда имеют свойство рваться в самый неподходящий момент.
Использование барьерных методов защиты, таких как маски и одноразовые халаты (которые всем уже опостылели) — это особенно в случае появления S. maltophilia в стационаре.
Если все-таки произошла внутрибольничная вспышка, то необходимо исключить такие общие источники заражения, как воду и медицинское оборудование.
Всех пациентов с выявленной S. maltophilia подвергать изоляции до окончания процесса эрадикации возбудителя.
По окончании вспышки обязательно проведение заключительной дезинфекции.
Читайте также:

