Сыворотки для идентификации возбудителей инфекций
Обновлено: 25.04.2024
Современные препараты для лабораторной диагностики гриппа и ОРВИ
И. В. Амосова, к.б.н., ведущий научный сотрудник лаборатории биотехнологии диагностических препаратов ФГБУ НИИ гриппа МЗ РФ, “Научно-исследовательский институт гриппа” Минздрава России (ФГБУ “НИИ гриппа” МЗ РФ), ООО “Предприятие по производству диагностических препаратов” (ООО “ППДП”), Санкт-Петербург, Россия
На сегодняшний день грипп и другие острые респираторные вирусные инфекции (ОРВИ) остаются серьезной медицинской и социальной проблемой, о чём свидетельствуют высокие показатели заболеваемости и смертности, особенно среди детей, пожилых людей и пациентов с хроническими заболеваниями. Для организации эффективных процессов лечения, профилактики и надзора за гриппом необходимо своевременное проведение лабораторной диагностики, позволяющей выявить возбудителя инфекции. Всемирная организации здравоохранения (ВОЗ) рекомендует использовать для идентификации возбудителей ОРВИ методы иммунофлуоресценции (ИФ) и реакции торможения гемагглютинации (РТГА) наряду с выделением вирусов в культуре клеток или полимеразной цепной реакцией (ПЦР)1.
ООО “Предприятие по производству диагностических препаратов” (ООО “ППДП”) организовано в 2013 году с целью обеспечения учреждений здравоохранения препаратами для диагностики вирусов гриппа А, В и других ОРВИ: вирусов парагриппа 1, 2 и 3 типов, РС-вируса
и аденовирусов. Основной учредитель Предприятия – ФГБУ “НИИ гриппа” Минздрава России, выполняющий в качестве Федерального центра по гриппу одну из ключевых функций в системе надзора за заболеваемостью гриппом в России и являющийся признанным Национальным центром по гриппу ВОЗ в рамках глобального контроля этой инфекции.
В основе производства – научные разработки и многолетний опыт лаборатории биотехнологии диагностических препаратов НИИ гриппа, а также современные методы накопления, очистки и концентрации вирусов, иммунохроматографии, иммуноблоттинга, иммуноферментного и ИФ- анализа и методы гибридомной технологии, позволяющие создавать новые препараты моноклонального типа.
Предприятие выпускает и реализует следующие диагностические препараты:
Наименование препарата
Кол-во анализов
Иммуноглобулины диагностические флуоресцирующие гриппозные сухие (ИФ-Г):
грипп А (Н1N1)pdm 09
Ранняя диагностика ОРВИ по выявлению антигенов: вирусов гриппа А или В; адено- или РС-вирусов; вирусов парагриппа 1, 2 или 3 типа, вирусов герпеса 1 или 2 типов в клетках цилиндрического эпителия носа от больных с симптомами ОРВИ; обнаружение вирусных антигенов в препаратах клеточных культур, инфицированных материалами от больных.
Материалом для исследования служат мазки из носа, взятые от больных ОРВИ, содержащие клетки цилиндрического эпителия слизистой оболочки глубоких отделов носовой полости.
Иммуноглобулин диагностический флуоресцирующий аденовирусный антигексоновыйсухой (ИДФАГ)
Иммуноглобулины диагностические флуоресцирующие парагриппозные сухие (ИФ-ПГ):
парагрипп 1 типа
парагрипп 2 типа
парагрипп 3 типа
Иммуноглобулины диагностические флуоресцирующие
РС-вирусные сухие (ИФ-РС)
Иммуноглобулины диагностические флуоресцирующие герпетические сухие (ИФ-Герпес):
герпес 2 типа
Диагностикумы гриппозные для реакции торможения гемагглютинации сухие (ДИГ):
грипп А (Н1N1)pdm09
грипп В (Викторианская линия)
грипп В (Ямагатская линия)
Диагностика гриппозной инфекции по выявлению прироста антител в сыворотках реконвалесцентов, оценка коллективного иммунитета, оценка иммуногенности гриппозных вакцин, научные исследования.
Диагностикумы парагриппозные для реакции торможения гемагглютинации сухие (ДИ-ПГ):
парагрипп 1 типa
парагрипп 2 типа
парагрипп 3 типа
Наименование препарата
Кол-во анализов
Сыворотка диагностическая гриппозная для реакции торможения гемагглютинации сухая (СДГ):
грипп А(Н1N1)pdm 09
грипп В (Викторианская линия)
грипп В (Ямагатская линия)
Идентификация типов/ субтипов вирусов гриппа А и В, выделенных из материалов от больных, изучение антигенной структуры вирусного гемагглютинина, контроль специфичности штаммов вирусов гриппа.
Сыворотка диагностическая парагриппозная для реакции торможения гемагглютинации сухая (СД-ПГ):
парагрипп 1 типа
парагрипп 2 типа
парагрипп 3 типа
Иммуноферментная тест-система для определения антител класса IgG
к вирусу гриппа А (H1N1)pdm 09
к вирусу гриппа А (H3N2)
к вирусу гриппа B
к вирусу парагриппа 1 типа
к вирусу парагриппа 3 типа
Определение антител классов IgG в сыворотках людей, переболевших вирусными ОРВИ по приросту уровня специфических антител (IgG).
Материалом для исследования служат парные сыворотки крови от больных ОРВИ, взятые в первые 5 дней болезни и через 14-30 суток от начала заболевания.
Набор реагентов для культивирования клеток и выделения вирусов гриппа в культуре клеток
Выделение вирусов гриппа, надзор и быстрая расшифровки эпидемий гриппа.
Флуоресцирующие иммуноглобулины обеспечивают быструю (в течение 1,5-2-х часов) возможность непосредственной детекции вирусных антигенов в клинических материалах или в клеточных культурах, инфицированных материалами от больных.
Иммуноглобулины диагностические
флуоресцирующие гриппозные сухие
РУ № ФСР 2009/05255 от 09.07.2009 г.
Иммуноглобулин диагностический флуоресцирующий аденовирусный антигексоновый сухой
РУ № ФСР 2008/03940 от 26.12.2008 г.
Иммуноглобулины диагностические
флуоресцирующие парагриппозные сухие
РУ № ФСР 2009/05254 от 09.07.2009 г.
Иммуноглобулины диагностические
флуоресцирующие РС-вирусные сухие
РУ № ФСР 2009/05256 от 09.07.2009 г.
В лаборатории биотехнологии диагностических препаратов ФГБУ “НИИ гриппа” МЗ РФ разработаны и широко используются в практике здравоохранения Иммуноглобулины диагностические флуоресцирующие сухие, которые представляют собой коньюгат очищенных противовирусных антител с флуоресцеинизотиоцианатом (ФИТЦ). Препараты имеют красящий титр не ниже 1:16, содержат консервант – мертиолат 1:10000, лиофилизированы, выпускаются во флаконах по 0,5 или 1 мл. Флаконы упаковывают в коробки. Количество флаконов в коробке от 1 до 5.В коробку вкладывают Инструкцию по применению. Срок годности препаратов – 2 года.
Диагностикумы гриппозные/парагриппозные для реакции торможения гемагглютинации сухие
Гриппозные диагностикумы для реакции торможения гемагглютинации (РТГА) используют в качестве подтверждающего теста при поступлении больных в стационар на 6-10 сутки заболевания, когда другие тесты (ИФЛ, ПЦР, выделение вируса) оказываются уже мало чувствительными.
Диагностикумы предназначены для субтиповой серодиагностики гриппа (по 4-х кратному приросту титров антител в сыворотках реконвалесцентов); контроля популяционного иммунитета населения; оценки иммуногенности живых и инактивированных гриппозных вакцин.
Препараты готовятся по оригинальным технологиям из антигенно актуальных штаммов, в соответствии с рекомендациями ВОЗ, не содержат инфекционного вируса, включают наполнитель, препятствующий сорбции антигенов на полистироловых планшетах. 1 мл препарата достаточно для тестирования 100 сывороток микрометодом РТГА.
Диагностикумы выпускаются в лиофилизированном виде, во флаконах по 1 мл. Флаконы упаковывают в коробки. Количество флаконов в коробке от 1 до 5. В коробку вкладывают Инструкцию по применению. Срок годности препаратов – 2 года.
Диагностикумы гриппозные для реакции торможения гемагглютинации сухие РУ № ФСР 2009/05253 от 09.07.2009 г.
Специфические сыворотки для идентификации возбудителей ОРВИ
Высокоспецифичные диагностические сыворотки предназначены для идентификации вирусов гриппа А (субтипов H1, H2, H3, H5, Н7, H9) и В (обеих современных эволюционных ветвей), а также других возбудителей ОРВИ в ИФА, реакциях торможения гемагглютинации и микронейтрализации.
Сыворотки выпускаются в лиофилизированном виде, во флаконах по 1 мл. Флаконы упаковывают в коробки. Количество флаконов в коробке от 1 до 5. В коробку вкладывают Инструкцию по применению. Срок годности препаратов – 2 года.
Сыворотка диагностическая гриппозная для реакции торможения гемагглютинации сухая РУ № ФСР 2009/05257 от 09.07.2009 г.
Иммуноферментные тест-системы (ИФТС) для определения антител класса IgG к ОРВИ и гриппу
Современные методы иммунодиагностики с определением классов и субклассов IgG открывают новые возможности в исследовании структуры иммунитета и формирования иммунопатологических состояний.
Характерными особенностями разработанных ИФТС являются:
• высокая чувствительность анализа;
• возможность использования микроколичеств сывороток (0,5 – 1 мкл);
• снижение трудоемкости анализа за счет исключения операций титрования сывороток;
• возможность индикации класс-специфических противовирусных антител;
• сокращение сроков проведения анализов.
Иммуноферментные тест-системы представляет собой 13-компонентный набор, основными реагентами которого являются очищенные вирусные антигены, позитивные и негативные контрольные образцы сывороток, а также конъюгаты моноклональных антител к IgG человека.
Тест-системы предназначены для детекции антител классов IgG в сыворотках людей, переболевших вирусными ОРЗ, рассчитаны на проведение 96 анализов, включая контрольные пробы. Предназначены для серодиагностики инфекций по определению достоверного прироста уровня специфических IgG.
Материалом для исследования служат парные сыворотки крови от больных ОРВИ, взятыми в первые 5 дней болезни и через 14-30 суток от начала заболевания.
Парные сыворотки от одного больного исследуют одновременно, в одной постановке реакции. Постановку реакций осуществляют в соответствии с прилагаемыми Инструкциями по применению. Срок годности ИФТС – 6 месяцев.
ООО “ППДП” оказывает информационную поддержку и консультационные услуги по всему ассортименту своей продукции, а также принимает участие в организации и проведении конференций, семинаров, и других научно-практических мероприятий на базе ФГБУ “НИИ гриппа” Минздрава России.
Сыворотки иммунные (син. антисыворотки) — препараты крови животных или человека, содержащие антитела; используются для диагностики, лечения и профилактики различных заболеваний.
Изучение иммунных сывороток тесно связано с развитием гуморального направления в иммунологии, разрабатываемого с середины 80-х гг. 19 в. В 1890 г. Э. Беринг и С. Китасато обнаружили в сыворотке крови кроликов, иммунизированных столбнячным токсином, антитоксины, нейтрализующие этот яд. В 1891 г. П. Эрлих открыл антитела (см.) к токсинам растительного происхождения. Благодаря работам Э. Ру и Г. Н. Габричевского противодифтерийная сыворотка получила широкое применение при лечении дифтерии (см.). В 1894 г. Р. Пфейффер и В. И. Исаев описали лизис холерных вибрионов в организме животного под действием специфической иммунной сыворотки (см. Исаева — Пфейффера феномен).
Ж. Борде, изучая в лаборатории И. И. Мечникова действие противохолерной сыворотки, установил, что холерный вибрион под ее влиянием теряет свою подвижность. В 189(5 г. Грубер и Дархем (M. Gruber, H. E. Durham) показали, что в результате иммунизации животных сыворотки их крови приобретали свойства агглютинировать соответствующие микробы. Так были открыты антитела — агглютинины. В 1897 г. Краус (R. Kraus) установил, что сыворотки крови иммунизированных животных действуют на фильтраты соответствующих бульонных культур: в прозрачном фильтрате выпадает осадок (преципитат). В 1899 г. Ф. Я. Чистович первым получил преципитины к белкам животного происхождения.
В 1898 г. Ж. Борде открыл у морских свинок, иммунизированных кроличьими эритроцитами, антитела — гемолизины и гемагглютинины. В 1900 г. И. И. Мечников, впрыскивая морским свинкам эмульсию селезенки или брыжеечных лимфатических узлов кролика, получил специфические сыворотки — антилейкоцитарные сыворотки. Вскоре были выделены сыворотки против других клеток организма. Т. о., получение иммунных сывороток основано на свойстве антигенов (см.) вызывать в организме образование антител (см.).
Иммунные сыворотки получают от иммунизированных животных или человека, а также от реконвалесцентов, в крови к-рых содержатся антитела после перенесенной инфекционной болезни (сыворотки реконвалесцентов). Сыворотки могут содержать так наз. нормальные антитела, напр. аллоантитела, или изоантитела, образующиеся у человека или животного в течение жизни и не зависящие от искусственной иммунизации (см.). В результате многократной иммунизации получают С., содержащие антитела в высоких титрах — гипериммунные сыворотки. Различают диагностические и лечебно-профилактические сыворотки.
Содержание
Диагностические сыворотки
Диагностические сыворотки, как правило, содержат антитела в более высоком титре, чем лечебно-профилактические. Их получают как от мелких лаб. животных (кроликов, морских свинок), иммунизированных убитыми микроорганизмами, антигенами, анатоксинами, так и от крупных (коз, лошадей, баранов), если необходимо большое количество сыворотки. Диагностические С. применяют в различных иммунологических реакциях для установления вида, подвида или серотипа (серовара) возбудителя инфекционной болезни, определения различных антигенов в биол. жидкостях. При этом используют Сыворотки, содержащие антитела, называемые в зависимости от характера иммунол. реакции. Так, в реакции агглютинации — агглютинины, в реакции преципитации — преципитины, в реакции связывания комплемента — комплементе вязывающпе антитела, в иммунофлюоресценции — флюоресцирующие антитела, в иммунорадиомет-рическом методе (см. Радиоиммунологический метод) — антитела, меченные радиоактивным изотопом, в иммуноферментном методе (см. Энзим-иммунологический метод) — антитела, меченные ферментом, в электронно-микроскопической иммуногистохимии — антитела, меченные ферментом или ферритином, и т. д. Поэтому в зависимости от характера иммунол. реакции различают агглютинирующие, преципитирующие, флюоресцирующие, гемолитические, меченные изотопами, ферментами, и другие диагностические сыворотки.
Среди диагностических С. различают антимикробные, к к-рым относятся антибактериальные и антивирусные, а также антитоксические С.
Антибактериальные сыворотки обычно используют как агглютинирующие. По степени специфичности их разделяют на неадсорбированные (нативные) и адсорбированные (поливалентные, содержащие антитела к нескольким антигенам или нескольким детерминантным группам антигена, и монорецепторные). Неадсорбированные сыворотки содержат перекрестно реагирующие антитела, т. к. различные микробы могут иметь сходные антигены. К ним относятся сыворотки, предназначенные для обнаружения нек-рых сальмонелл (напр., S. typhi, S. paratyphi, S. typhimurium, S. enteritidis, S. anatum, S. newport, S. choleraesuis), шигелл и эшерихий. Неадсорбированные агглютинирующие сыворотки используют для постановки развернутой реакции агглютинации с целью идентификации микробов (см.). При этом для точной серологической идентификации возбудителя (см. Серологические исследования) важно учитывать, чтобы реакция шла до титра или половины титра сыворотки. Неадсорбированные сыворотки из-за своей относительно невысокой специфичности находят меньшее применение, чем адсорбированные.
Адсорбированные поливалентные сыворотки способны агглютинировать несколько родственных бактерий, имеющих общий антиген. Адсорбированные монорецепторные сыворотки содержат антитела только против определенного антигена, т. е. они обладают высокой специфичностью (диагностические типоспецифические сыворотки). Их получают избирательной адсорбцией антител (см. Кастеллани метод). Адсорбированные сыворотки используют в реакции агглютинации (см.) на предметном стекле, чаще для идентификации возбудителей, относящихся к сем. Enterobacteriaceae, напр, для идентификации энтеропатоген-ных эшерихий применяют поливалентные и типовые ОК-сыворотки, для определения принадлежности возбудителя к роду сальмонелл — агглютинирующую адсорбированную поливалентную сальмонеллезную О-сыворотку (групп А, В, С, Д, Е), для определения серол. группы и серотипа возбудителя — отдельные адсорбированные О-, а затем Н-сыворотки. Для определения в исследуемом материале антигенов, напр. ботулинических токсинов или
О-брюшнотифозного антигена, используют соответствующие антитела сыворотки, сорбированные на эритроцитах,— так наз. антительные эритроцитарные диагностикумы (см. О-агглютинация).
Антивирусные диагностические Сыворотки используют в различных реакциях иммунитета, напр, реакции торможения гемагглютинации (см. Гемагглютинация), реакции связывания комплемента (см.), реакции иммунофлюоресценции (см.) и др. К антивирусным сывороткам в зависимости от вида вируса предъявляются особые требования. Разнообразие источников антивирусных сывороток связано с наличием в них неспецифических ингибиторов, к-рые могут подавлять и маскировать рецепторы вирусов. Антивирусные сыворотки очищают от термолабильных ингибиторов прогреванием при t° 56° в течение 30 мин., а от термостабильных ингибиторов ферментированием, воздействием углекислотой и др. в зависимости от природы вируса. Кроме этого, определяют наличие неспецифических агглютининов. С целью подавления бактериофагов применяют антифаговые С. В лаб. практике их добавляют к питательным средам для освобождения бактерий от их бактериофагов.
Из антитоксических диагностических сывороток наиболее часто используют сыворотки для обнаружения ботулинических токсинов в реакции нейтрализации in vivo (см. Ботулизм, лабораторная диагностика) и идентификации токсина возбудителя дифтерии в реакции преципитации (см. Дифтерия).
Преципитирующие сыворотки используют в реакциях преципитации (см.) для определения растворимых антигенов микробного, растительного или животного происхождения, определения аутоантител, С-реактивного белка, для диагностики инф. болезней, выявления видовой принадлежности белка крови, обнаружения определенных веществ в продуктах при подозрении на фальсификацию.
Флюоресцирующие (люминесцирующие) сыворотки представляют собой глобулиновую фракцию иммунной сыворотки крови животных, меченную флюоресцирующими красителями — флюорохромами (см.). Их применяют для обнаружения микробов методом прямой иммунофлюоресценции (см.) в патологическом материале и при экспериментальных исследованиях. С аналогичной целью используют также меченные флюорохромами антиглобулиновые и антикомплементарные сыворотки при непрямой иммунофлюоресценции.
В клин, иммунологии широко применяют диагностические сыворотки для определения группы крови (см.), проведения тканевого типирования, для характеристики иммунол. статуса организма. Группы крови по системе AB0 определяют с помощью стандартных гемагглютинирующих сывороток, приготовленных из крови человека. Они специфичны, т. к. содержат определенные аллоантитела — альфа-, бета- или альфа + бета-антитела. Сыворотка крови группы АВ (IV) этих антител не содержит.
Для определения резус-принадлежности крови нек-рых больных, беременных и первично обследуемых доноров используют стандартную сыворотку анти- Bh0(D), а также сыворотку для пробы Кумбса (см. Кумбса реакция) ,приготовленную из крови животных (кроликов, коз, баранов), иммунизированных белком сыворотки крови человека. Для дополнительного исследования крови донора применяют сыворотки анти- rh'(C) и анти-гЬ"(Е), сыворотки, содержащие два антитела — анти-ВЬ0 (С -f- D) или анти-Rho (D -f- Е) или три антитела — анти-Rh^ (С + D + Е).
Для тканевого типирования при аллогенных трансплантациях и гемотрансфузиях (см. Иммунитет трансплантационный, антигены гистосовместимости) используют так наз. тестовые HLA- и NA-, NB-реактивы. HLA-реактив получают от лиц, сенсибилизированных соответствующим антигеном (напр., сыворотка крови женщин, сенсибилизированных в период беременности, или сыворотки крови иммунизированных доноров). Антитела определяют с помощью лимфоцитотоксической пробы (см. Лейкоцитарные тесты) или реакции лейкоагглютинации (см. Агглютинация).
В таблице 1 дан перечень основных диагностических иммунных сывороток, их получение, применение в клинической иммунологии, форма выпуска.
Лечебно-профилактические сыворотки
К ним относятся антитоксические, антибактериальные, антивирусные сыворотки, а также иммуноглобулины. Антитоксические сыворотки получают методом гипериммунизации крупных животных (обычно лошадей) путем парентерального введения нарастающих доз анатоксинов, затем соответствующих экзотоксинов (см. Антитоксины). Антитоксические сыворотки применяют для пассивной иммунизации (см.).
Антитоксические сыворотки используют для лечения и профилактики токсинемических инфекций, в основе к-рых лежит действие на организм экзотоксинов бактерий — возбудителей столбняка, ботулизма, дифтерии, газовой гангрены, стафилококковых инфекций. Антитоксическими сыворотками являются и сыворотки, содержащие антитела против ядов змей, пауков, ядов растительного происхождения. Антитела антитоксических сывороток нейтрализуют действие соответствующих токсинов, обеспечивая тем самым леч.-проф. эффект.
Антитоксические сыворотки, полученные от гипериммунизированных животных, очищают и концентрируют (с целью удаления неактивных балластных белков); контролируют их физические свойства, стерильность, апирогенность, безвредность, специфическую активность, количество белка, значение pH и наличие остаточного сульфата аммония. Специфическая активность антитоксических сывороток выражается в международных единицах (ME). За единицу принимают минимальное количество сыворотки, к-рое нейтрализует стандартную единицу токсина. Для сывороток, еще не имеющих международных стандартов, утверждены национальные стандарты — антитоксические единицы (АЕ).
Определение специфической активности антитоксических сывороток производят двухэтапным титрованием. На первом этапе устанавливают опытную дозу токсина с помощью стандартной антитоксической сыворотки. На втором этапе определяют активность испытуемой антитоксической сыворотки посредством опытной дозы токсина (см. Антитоксины).
Стандартные образцы антитоксических сывороток проходят контроль в Государственном НИИ стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича и рассылаются производственным предприятиям, выпускающим сыворотки. Стандартные сыворотки соответствуют принятым международным стандартам, что облегчает возможность сопоставления свойств сывороток, изготовленных в разных странах.
Антибактериальные сыворотки получают из крови лошадей или волов, гипериммунизированных соответствующими убитыми бактериями или их антигенами. Они не нашли широкого применения с лечебными или профилактическими целями из-за наличия более эффективных антимикробных средств. Из антибактериальных сывороток иногда применяют гетерогенные иммуноглобулины (противосибиреязвенный гамма-глобулин и противолептоспирозный гамма-глобулин).
Антивирусные сыворотки (гетерогенные иммуноглобулины) получают из крови животных, иммунизированных вакцинными штаммами вирусов или соответствующими вирусами. Их очищают методом спиртового осаждения при низкой температуре. Наиболее широкое применение получил гамма-глобулин против клещевого энцефалита, антирабический гамма-глобулин и др. (см. Иммуноглобулины).
Иммуноглобулины, полученные из крови человека (гомологичные иммуноглобулины), являются, за исключением нормального иммуноглобулина, иммуноглобулинами направленного действия. Преимуществом гомологичных иммуноглобулинов перед гетерологичными является слабая реактогенность и более длительное циркулирование антител в организме (в течение 30— 40 дней). Получают гомологичные иммуноглобулины путем фракционирования этиловым спиртом при температуре ниже нуля (по методу Кона). Наибольшее значение в клин, практике имеют иммуноглобулины с максимально сниженной анти комплементарной активностью, к-рые используют для внутривенного введения. Таким препаратом является иммуноглобулин нормальный человеческий для внутривенного введения. В иммуноглобулиновых препаратах для внутривенного введения стремятся удалить способность Fc-области молекул иммуноглобулинов активировать систему комплемента, а также предотвратить агрегацию молекул иммуноглобулинов. Применяется при различных формах иммунологической недостаточности (см.).
Среди различных иммуноглобулинов направленного действия, или гамма-глобулинов направленного действия, выделяют антирезусный иммуноглобулин — aHTn-Rh0(D), к-рый используют для иммунопрофилактики гемолитической болезни новорожденных (см.). Его вводят первородящим резус-отрицательным женщинам в послеродовой период или после аборта; при повторных беременностях у таких женщин рождаются здоровые резус-положительные дети. Источником получения препарата может быть гипериммунная плазма доноров, а также плазма женщин, сенсибилизированных резус-антигеном естественным путем во время повторных беременностей.
Иммуноглобулином направленного действия является также анти-лимфоцитарный (гетерогенный) иммуноглобулин, входящий в состав антилимфоцитарной сыворотки (см.), содержащей различные антитела к лимфоидным клеткам, преимущественно к лимфоцитам. Наибольшей иммунодепрессивной активностью обладает антилимфоцитарная сыворотка, полученная путем иммунизации животных клетками тимуса и лимфоцитами грудного лимфатического протока. Она широко используется при трансплантации жизненно важных органов, в первую очередь почки.
Антиретикулярную цитотоксическую сыворотку (сыворотку Богомольца) получают из сыворотки крови лошади, иммунизированной тканью селезенки или костного мозга человека. Она содержит антитела-цитотоксины, активные по отношению к клеткам этих органов. Применение антиретикулярной цитотоксической сыворотки особенно целесообразно при длительно не заживающих язвах и ранах, а также при наличии медленно рассасывающихся воспалительных очагов.
В табл. 2 дан перечень основных препаратов иммуноглобулинов и антитоксических сывороток, источник их получения, применение и способ введения.
Получение иммунных сывороток включает: подготовку соответствующего иммуногена, т. е. вещества, стимулирующего продукцию антител; иммунизацию животных; контроль полученных сывороток. Для получения сывороток против таких гаптенов, как фармакол. препараты или низкомолекулярные гормоны, применяют в качестве иммуногена, или иммунизирующего препарата, конъюгат гаптен-носитель. Степень чистоты белковых иммуногенов проверяют с помощью иммунохимических и физико-химических исследований. Иммунизация является одним из наиболее вариабельных процессов при получении сывороток, т. к. доза иммуногена может влиять на свойства (напр., специфичность) образующихся антител. Малые дозы вводимого антигена позволяют экономить расход иммуногенных препаратов, индуцируют появление авидных антител в высоком титре. При небольших дозах антигена в организм вводятся и небольшие количества посторонних примесей, в результате чего не образуются побочные антитела. Для стимуляции антителообразования иммуногены смешивают с адъювантами (см.), напр. адъювантом Фрейнда. Помимо стимулирующей функции, адъюванты выполняют и депонирующую функцию в отношении иммуногена. Кроме дозы антигена, важно также учитывать степень его чистоты, способ, сроки и последовательность введения. Выбор животного зависит от предполагаемого количества сыворотки. Получение сыворотки от кроликов, являющихся хорошими продуцентами антител, требует содержания большого количества таких животных. В большом количестве сыворотку можно получить от лошадей или других крупных животных.
Для определения в сыворотках количества антител и для характеристики активности диагностических сывороток, напр, агглютинирующих иммунных сывороток, производят их титрование. Титр агглютинирующих иммунных сывороток определяют как предельное разведение сыворотки крови, при к-ром обнаруживается реакция агглютинации. Обычно готовят разведения сыворотки, возрастающие в геометрической прогрессии (двукратные). Для характеристики активности сыворотки крови, как правило, учитывают результат реакции в каждом разведении или суммарно во всех разведениях по количеству условных положительных единиц.
Таблица 1. Перечень основных диагностических иммунных сывороток, их получение, применений в клинической иммунологии и форма выпуска
Получение сыворотки и иммунологическая реакция, в которой она используется
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
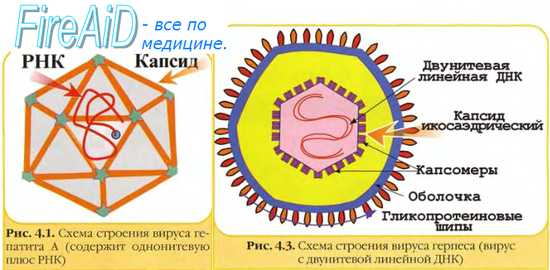
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Сывороточные иммунные препараты. Иммунные сыворотки. Гетерологичные сыворотки. Гомологичные сыворотки. Иммунные иммуноглобулины.
К сывороточным иммунным препаратам относят иммунные сыворотки и Ig. Эти препараты обеспечивают пассивную невосприимчивость к возбудителям инфекционных болезней. Действующее начало таких препаратов — специфические AT. Другими словами, в организм человека вводят готовые эффекторные молекулы. Поэтому их можно использовать для профилактики и лечения инфекций. Содержание AT в сывороточных иммунных препаратах (активность) выражают в титрах AT. По механизму действия AT сывороточных препаратов проявляют агглютинирующий, преципитирующий, комплементсвязывающий, нейтрализующий и другие эффекты. Обычно сывороточные препараты вводят парентерально; при этом состояние невосприимчивости развивается быстро, но длится недолго (в пределах 2-6 нед).
Иммунные сыворотки. Гетерологичные сыворотки. Гомологичные сыворотки
Иммунные сыворотки получают из крови искусственно иммунизированных животных и людей-доноров (в этих целях используют периферическую, плацентарную и абортную кровь). Для получения высоких титров AT лошадей и кроликов иммунизируют дробным введением соответствующих Аг в больших дозах. Препараты, изготовляемые из крови животных, содержат гетерологичные AT, поэтому человеку такие гетерологичные (чужеродные) сыворотки вводят при соблюдении мер предосторожности. Например, столбнячную антисыворотку (получаемую из крови иммунизированных лошадей) вводят после постановки кожных проб на чувствительность, дробно по Безрёдке на фоне приёма десенсибилизирующих средств.
Препараты, изготовляемые из крови иммунизированных доноров, содержат гомологичные AT; гомологичные сыворотки лишены многих побочных эффектов гетерологичных сывороток. Гомологичные сыворотки применяют для профилактики и лечения вирусных гепатитов, кори, столбняка, ботулизма и др. После введения гетерологичных сывороток состояние невосприимчивости длится 2-3 нед, эффект гомологичных AT сохраняется 4-6 нед.
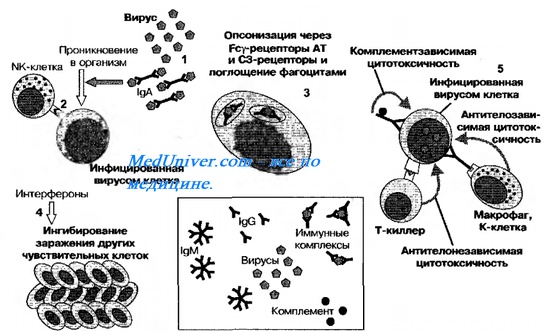
Иммуноглобулины
Иммуноглобулины получают осаждением из сыворотки крови, что освобождает их от балластных компонентов. Затем препараты очищают и концентрируют. Ig применяют для лечения и профилактики кори, клещевого энцефалита, стафилококковых инфекций, столбняка и других инфекций.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
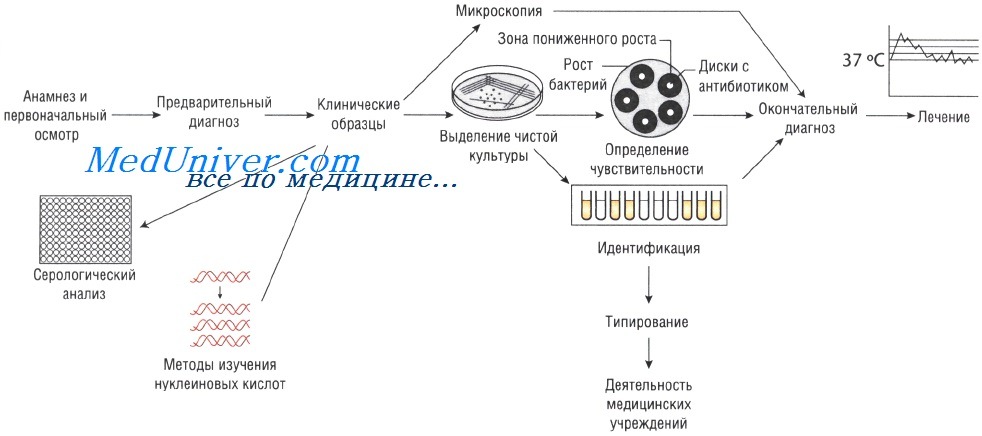
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

